牛蒡苷及苷元在制备抗肺纤维化药物中的应用的制作方法
本发明涉及两种中药单体成分的药理作用及其应用,尤其涉及以牛蒡苷和苷元为活性成分的药物及其在制备抗肺纤维化药物中的应用。
背景技术:
牛蒡子为菊科(Compositae)牛蒡属(Arctium)植物牛蒡(Arctium lappa)的干燥成熟果实。牛蒡子的主要药效成分为牛蒡苷,我们的研究结果(He Fan, Dou De-Qiang,Sun Yu,Zhu Lin,Xiao Hong-Bin, Kang Ting-Guo. Plasma pharmacokinetics and tissue distribution of arctiin and its main metabolite in rats by HPLC-UV and LC-MS. Planta Medica 2012, 78:800-806.),和国外报道均表明牛蒡苷是通过在胃肠道中代谢成牛蒡苷元而发挥其药效的。
肺维化是一种慢性、进行性、不可逆转也是最常见的一种致命性肺疾病,主要表现为成纤维细胞灶( fibroblastic foci) 的出现导致大量细胞外基质( extracellular matrix,ECM) 沉积,胶原积聚,肺泡结构破坏,最终导致正常肺组织结构的破坏(孔勤,陈民利. 特发性肺纤维化发病机制的研究进展[J]. 中国比较医学杂志,2012,08:74-80.)。目前治疗手段主要以西药,尤其是激素类药物为主,一般只能改善症状,不能控制其进程;并且长期应用,疗效减弱且毒性增大,总体来说目前临床上尚没有合适的治疗药物。
技术实现要素:
针对上述问题,本发明的目的在于提供一种牛蒡苷及苷元的新用途,即牛蒡苷或苷元单独或与其它药物合用,用于制备抗肺纤维化的药物。
所述牛蒡苷的制备方法:取牛蒡子(炒制品)粗粉(牛蒡苷含量5.2%),用水煎煮提取多次;合并提取液,减压浓缩后,加95%乙醇,4℃醇沉12小时,过滤,取上清液,减压浓缩至近干,得浸膏;浸膏用甲醇溶解,用浸膏等重量的100-120目硅胶拌样,用浸膏等重量的200-300目硅胶分离,用氯仿-甲醇洗脱,得到含有牛蒡苷的馏分,合并含有牛蒡苷的馏分,浓缩后加95%乙醇结晶,得牛蒡苷单体化合物(牛蒡苷含量大于95%)。
所述牛蒡苷元的制备方法,取牛蒡子(生品)粗粉(牛蒡苷含量5.2%),加3倍量水,40℃温孵4个小时,加95%乙醇和水调节成10倍量60%乙醇提取液,加热回流煎煮;继续用60%乙醇提取;合并提取液,浓缩近干;经硅胶柱分离,用100目硅胶按样品量1:1拌样,200-300目硅胶1:1进行柱层析,氯仿-甲醇洗脱,合并含有牛蒡苷元的流分,用乙醇重结晶,得牛蒡苷元单体化合物(牛蒡苷元含量大于95%)。
所述的制备牛蒡苷和牛蒡苷元单体化合物,纯度大于90%,符合中药一类新药的开发要求。
本发明的有益效果。
本发明公开了一种中药牛蒡子中活性成分牛蒡苷和苷元在制备抗肺纤维化药物方面的应用,牛蒡苷和牛蒡苷元为中药牛蒡子中的主要活性成分。我们曾对牛蒡苷和苷元的制备工艺进行研究,目前可以对牛蒡苷及其苷元单体进行大量制备(窦德强,侯墙,康廷国,李鸿福. 一种牛蒡子苷元的制备方法,专利号:ZL200910220575.3.),通过体内试验结果表明,我们发现牛蒡苷及其苷元具有较强的抗博来霉素引起的肺纤维化作用。我们的研究结果表明,牛蒡苷元为牛蒡苷的代谢产物和吸收入血的活性成分之一,因此牛蒡苷为牛蒡苷元的前体药物。研究结果证明,牛蒡苷和苷元均可应用于抗肺纤维化疾病的药物中。本发明中的牛蒡苷和苷元在抗肺纤维化方面有较强的活性,副作用小,价格便宜,具有较好的成药性。
附图说明
图1空白组和模型组肺的表观情况,其中A为空白组,B为模型组。
图2牛蒡苷及苷元对肺系数的影响。
图3牛蒡苷及苷元对肺通透系数的影响。
图4牛蒡苷及苷元对HYP含量的影响。
图5牛蒡苷及苷元对MPO活性的影响。
图6牛蒡苷及苷元对MDA含量的影响。
图7牛蒡苷及苷元对LDH活性的影响。
图8牛蒡苷及苷元对TGF-β含量的影响。
图9牛蒡苷及苷元对NF-κB含量的影响。
图10牛蒡苷及苷元对TNF-α含量的影响。
图11牛蒡苷及苷元对IL-6含量的影响。
图12肺组织病理学切片观察。
具体实施方式
下面结合具体实施例对本发明做进一步的说明。
实施例1。
(1)牛蒡苷的制备方法:取牛蒡子(抄制品)粗粉1.0kg(牛蒡苷含量5.2%),用水煎煮提取三次,每次加15倍量水,1小时;合并提取液,减压浓缩至药材的2倍量,加95%乙醇至乙醇浓度达到80%,4℃醇沉12小时,过滤,取上清液,减压浓缩至近干,得浸膏;浸膏用甲醇溶解,用浸膏等重量的100-120目硅胶拌样,用浸膏等重量的200-300目硅胶分离,用氯仿-甲醇洗脱,得到含有牛蒡苷的馏分,合并含有牛蒡苷的馏分,浓缩后加95%乙醇结晶,得牛蒡苷30g ,牛蒡苷含量大于97.1%。
(2)牛蒡苷元的制备方法,取牛蒡子(生品)粗粉1.0Kg(牛蒡苷含量5.2%),加3倍量水,40℃温孵4个小时,加95%乙醇和水调节成10倍量60%乙醇提取液,加热回流煎煮1小时;继续用60%乙醇提取两次,每次1小时;合并提取液,浓缩近干;经硅胶柱分离,用100目硅胶按样品量1:1拌样,200-300目硅胶1:1进行柱层析,氯仿-甲醇洗脱,合并含有牛蒡苷元的流分,用乙醇重结晶,得牛蒡苷元25g,牛蒡苷元含量大于96.2%。
一、牛蒡苷及苷元抗肺纤维化作用研究。
1材料与试剂。
1.1实验药物及仪器。
牛蒡苷和苷元来自于实施例1;注射用盐酸博莱霉素 (日本化药株式会社);醋酸泼尼松(天合药业有限公司);10%的水合氯醛(美伦生物科技有限公司);注射用聚乙二醇(天津大茂化学试剂厂);气管插管装置和大鼠开口器(本实验室自制);RT-2100C型多功能全自动酶标仪(深圳雷杜公司);ESJ220-4A型分析天平(沈阳龙腾电子公司)。
1.2实验中所用试剂盒。
羟脯氨酸测试盒 (南京建成生物工程研究所,生产批号20160701);丙二醛(MDA)测试盒(南京建成生物工程研究所,生产批号20160812);髓过氧化物酶(MPO)测试盒(南京建成生物工程研究所,生产批号20160814);乳酸脱氢酶(LDH)测试盒(南京建成生物工程研究所,生产批号20160815);总蛋白定量测试盒(南京建成生物工程研究所,生产批号20160820);TNF-α ELISA检测试剂盒(天和海生物科技有限公司,生产批号201608);IL-6 ELISA检测试剂盒(天和海生物科技有限公司,生产批号201608);TNF-βELISA检测试剂盒 (天和海生物科技有限公司,生产批号201608);NF-κB ELISA检测试剂盒(天和海生物科技有限公司,生产批号201608)。
2实验方法。
2.1纤维化模型建立方法。
大鼠腹腔注射10%的水合氯醛(3 mL/kg),麻醉后仰面固定于45-60 度倾斜的鼠板上,固定四肢,取一强光源直接照射于大鼠咽喉部皮肤表面,用木夹轻轻将大鼠舌头向外上拉起,用左手持压舌板伸入口腔向上顶起舌腹,此时可见大鼠口腔呈橙红色,口腔下方气管呈一白色亮点,可见气门随大鼠呼吸一张一合,将灭菌后的14号灌胃针管(外接2.0 mm橡胶灌胃管(已灭菌))缓慢插入气管中至针管标记处到达大鼠口腔处,使大鼠直立迅速推入注射用盐酸博莱霉素以保证药物喷入大鼠气管中(5 mg/kg,约0.2毫升),迅速取出针管并注入0.1-0.2 mL 空气,大鼠直立旋转3-4周使药物均匀分布于肺部中,若干秒后置于鼠笼中至它从麻醉中醒来;空白组给予等量的生理盐水。
2.2给药剂量。
牛蒡苷和苷元的低、高剂量组分别按照50mg/kg和100mg/kg给药,阳性药醋酸泼尼松按照5mg/kg给药,牛蒡苷和苷元以及阳性药均采用20%聚乙二醇进行混选配制给药液。
2.3动物分组与给药方法。
选取SD大鼠70只(由辽宁长生生物技术有限公司提供,合格证号:SCXK(辽)2010-0001),体重180-220g,动物级别SPF,将70只鼠分为空白组、模型组、阳性组(醋酸泼尼松组)、牛蒡苷低剂量组、牛蒡苷高剂量组、牛蒡苷元低和高剂量组,每组10只。
模型组:造模后第2天起,每天灌胃给予20%的聚乙二醇溶液(10 mL/kg),连续灌胃27天,第28天处死大鼠。
空白组:假造模组,同模型组给药方式。
阳性组:造模后第2天起,每天灌胃给予醋酸泼尼松(5 mg/kg),连续给药27天,第28天处死大鼠。
牛蒡苷低剂量组:造模后第2天起,每天灌胃给予牛蒡苷(50 mg/kg),连续给药27天,第28天处死大鼠。
牛蒡苷高剂量组:造模后第2天起,每天灌胃给予牛蒡苷(100 mg/kg),连续给药27天,第28天处死大鼠。
牛蒡苷元低剂量组:造模后第2天起,每天给予牛蒡苷元(50 mg/kg),连续给药27天,第28天处死大鼠。
牛蒡苷元高剂量组:造模后第2天起,每天给予牛蒡苷元(100 mg/kg),连续给药27天,第28天处死大鼠。
2.4表观指标观察。
给药后每天观察大鼠状况,包括皮毛,精神和食欲,营养状况,呼吸频率与方式,四肢颜色等。
2.5大鼠的处死、取材及切片分析。
腹主动脉取血:根据大鼠体重,于大鼠腹腔内注射10%的水合氯醛(3 mL/kg),麻醉后将其仰卧在大鼠手术板上;使用 75%的酒精消毒后,用手术剪沿腹正中线剪开腹腔,止血纱布擦去溢出的少量血液,用棉花轻轻拨开脂肪等组织以充分暴露腹主动脉,主动脉呈浅红色,具有有跳动感;取一次性真空采血针准确刺入腹主动脉,真空采血管收集腹主动脉血液至完全不出为止;将收集的血液用低温离心机进行4℃离心(10min、3000r/min),取上清液,将分装后的血清置入-80℃超低温冰箱中保存,用于测定血清中蛋白,TNF-α及IL-6的含量。
支气管肺泡灌洗液收集:用10%水合氯醛(3 mL/kg)腹腔注射麻醉动物,腹主动脉取血,然后打开胸腔,结扎下腔静脉,于气管分叉处下方,游离出右主支气管后结扎,再于颈部游离出气管,在气管喉软骨下0.5cm 处切一倒“T”形口,将2 mL注射器(内含4 ℃ 1 mL生理盐水)与直头的灌胃针接好后,置于气管腔内,达1 cm处,以0号缝合线固定,缓慢冲洗数次,每次间隔30 s左右,连续4次(回收率>80%),将回收的肺泡灌洗液,倒入事先灭菌的2 mLEP管中,再将EP管置于冰袋上保存,到一定数量后,进行4 ℃低温离心(15 min、3000 r/min),用移液器取上清保存,用于测定灌洗液中蛋白及LDH的含量。
肺组织分离:待收集完肺泡灌洗液后,分离出大鼠左右肺脏,生理盐水洗去部分血液后,吸水纸吸干水分,仔细分离掉多余的组织,分析天平称重,精确称量肺重,并记录。取右肺称重分成三部分,一部分匀浆分装后,取上清液用于ELISA及MDA等试剂盒测定,一部分取肺组织用于MPO含量的测定,一部分称定组织湿重用于HYP含量的测定;三部分均保存于-80℃冰箱中。
肺组织切片分析:取大鼠的右肺放入4%多聚甲醛中固定。按常规病理学方法包埋、切片。将病理切片进行HE染色,然后分析。
2.6体内指标测定。
2.6.1肺系数的测定。
肺系数=肺重(mg)/体重(g)×100%。
2.6.2总蛋白含量测定。
总蛋白的测定采用BCA法,具体按照试剂盒说明书进行;过程如下。
(1)组织样本前处理:准确称取组织重量。按重量(g):体积(mL)=1:9的比例,加入9倍体积的生理盐水,冰水浴条件下机械匀浆,2500 r/min,离心10 min,取上清液再用生理盐水稀释成1%组织匀浆,待测。
血清样本前处理:按血清:生理盐水=1:99的比例稀释,待测。
肺泡灌洗液样本前处理:取2个样本进行预实验,按比例稀释,测定范围为20-2000 μg/mL。
(2)空白管加入双蒸水20 μL,标准管加入标准品20 μL,测定管加入待测样本20 μL,分别向各管中加入工作液250 μL,漩涡混匀,37℃孵育30 min,取出加入终止应用液750μL,漩涡混匀,静置5分钟,波长562 nm,光径0.5 cm,双蒸水调零,测定各管吸光度值。
计算公式:总蛋白浓度(μg/ml)=(测定OD值-空白OD值)/(标准OD值-空白OD值)×标准品浓度(563μg/mL)×样本测定前浓度。
2.6.3 肺通透指数的测定。
本实验中总蛋白浓度的测定采用BCA法;肺通透指数=肺泡灌洗液中总蛋白浓度/血清中总蛋白浓度。
2.6.4肺组织羟脯氨酸(HYP)含量测定。
测定方法按照试剂盒说明书进行,具体方法为:将冷冻保存的小块肺组织放入试管内,准确加水解液 0.1 mL,混匀,加盖后95℃水浴水解 20 min,冷却后将各试管液体 PH 值调至 6.0-6.8左右,加双蒸水至10 mL,混匀,取3-4 mL稀释后的溶液加适量活性炭,混匀,3500r/min离心 10min,取上清1mL,依次加入三种试剂后,混匀,60℃水浴 15min,混匀,60℃水浴 15min,3500 r/min离心 10 min,取上清于波长 550 nm,1 cm 光径,双蒸水调零,测定各管的吸光度。
计算公式:HYP含量(μg/mL)=(测定OD值-空白OD值)/(标准OD值-空白OD值)×标准品浓度(5μg/mL)×水解液总体积(10ml)/组织湿重(mg)。
2.6.5肺组织中髓过氧化物酶(MPO)含量测定 。
以下按照试剂盒说明书进行测试,测试方法如下。
(1)先用生理盐水为匀浆介质按实验方法学制成浓缩一倍的匀浆,即10%的匀浆,不要离心,取出部分浓缩一倍匀浆按1:1比例加入浓缩一倍的试剂二溶液,混匀后再进行测定。
(2)取5%组织匀浆液,加3号试剂0.1 mL,充分混匀后37℃水浴15分钟,取出后待测,对照管依次加入蒸馏水3 mL、样本0.2 mL、试剂四0.2 mL,测定管依次加入样本0.2mL、试剂四0.2 mL、显色剂3 mL。
(3)将对照管和测定管分别于37℃水浴30分钟,取出后向各管中加入0.05 mL,试剂七,混匀,并放入60 °C水浴10分钟,取出后立即在波长460 nm处,1 cm光径,双蒸水调零,测各管吸光度值。计算公式:MPO活性(单位/组织)=(测定管OD值-对照管OD值)/(11.3×取样量(g))。
2.6.6肺组织中丙二醛(MDA)的含量测定。
(1)依次向空白管加入无水乙醇与试剂一各0.1 mL,向标准管加入标准品与试剂一各0.1 mL,向测定管与对照管中加入测试样品与试剂一各0.1 mL,混匀。向空白管、标准管与测定管中分别加入试剂二应用液3.0 mL、试剂三应用液1.0 mL,向对照管中加入试剂二应用液3.0 mL、50%冰醋酸各1.0 mL。
(2)旋涡混匀器混匀,试管口用保鲜膜扎紧,用针头刺一小孔,95℃水浴40分钟;取出后流水冷却,然后3500-4000r/min,离心10分钟。取上清,532 nm处,1 cm光径,双蒸水调零,测各管吸光度值。
计算公式:组织中MDA含量(nmol/mgprot)=(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度(10nmol/mL)/待测样本蛋白浓度(mgprot/mL)。
2.6.7肺泡灌洗液中乳酸脱氢酶(LDH)的含量测定。
(1)将收集的肺泡灌洗液离心,抽取上清液,取10μL-50μL上清液进行检测。
(2)向标准空白管中依次加入蒸馏水0.25mL、基质缓冲液0.25 mL、标准管中依次加入蒸馏水0.05 mL、0.2 mM丙酮酸标准液0.2 mL、基质缓冲液0.25 mL、测定管中依次加入待测样本0.2 mL、基质缓冲液0.25 mL、辅酶10.05 mL,测定空白管中依次加入双蒸水0.05 mL、待测样本0.2 mL、基质缓冲液0.25 mL。
(3)分别将各检测试管中的试剂混匀,放入37℃水浴锅中水浴15分钟,取出后向各管中加入2,4-二硝基苯肼0.25 mL,混匀,再次置于37℃水浴锅中水浴15分钟,取出后向各管中加入0.4MNaOH溶液2.5 mL,混匀后室温静置5分钟,于波长440 nm处,1 cm光径,蒸馏水调零,检测各管吸光度(OD)值。
计算公式:LDH活性(U/gprot)= (测定管OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度(2 mmol/L)/匀浆蛋白浓度(gprot/mL)。
2.6.8 ELISA法测定TNF-α、NF-κB、IL-6、TGF-β的含量。
这些指标的测定按照试剂盒操作说明书进行,大致操作过程如下。
(1)从室温平衡 20min 后的铝箔袋中取出所需板条,剩余板条用自封袋密封放回4℃。
(2)设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50μL。
(3)样本孔先加待测样本10μL,再加样本稀释液40μL;空白孔不加。
(4)除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,用封板膜封住反应孔,37℃水浴锅或恒温箱温育60min。
(5)弃去液体,吸水纸上拍干,每孔加满洗涤液,静置1 min,甩去洗涤液,吸水纸上拍干,如此重复洗板 5 次(也可用洗板机洗板)。
(6)每孔加入底物A、B各50 μL,37℃避光孵育15min。
(7)每孔加入终止液50 μL,15min内,在450nm波长处测定各孔。
3.实验结果。
3.1大鼠表观指标观察。
造模后的大鼠,3天时出现不同程度的精神萎靡,饮食与饮水量下降,之后食欲逐渐恢复正常;7天大鼠出现呼吸急促,腹式呼吸作用明显,喜闭眼蜷缩;14天部分大鼠出现腹部胀大,被毛散乱,大鼠普遍体型消瘦;25天时大鼠后肢出现紫绀,呼吸非常急促,精神不振,运动量减少。
3.2肺组织观察。
空白组肺呈粉红色,无水肿,表面光滑,饱满,质地柔软,有弹性,肺泡灌洗较容易,见图1中的图A。
模型组肺呈暗红色,部分肺叶有不同程度的发白,表面有纤维状纹络,质地较硬,有一定量的出血点,有白色的结块,弹性较差,见图1中的图B。
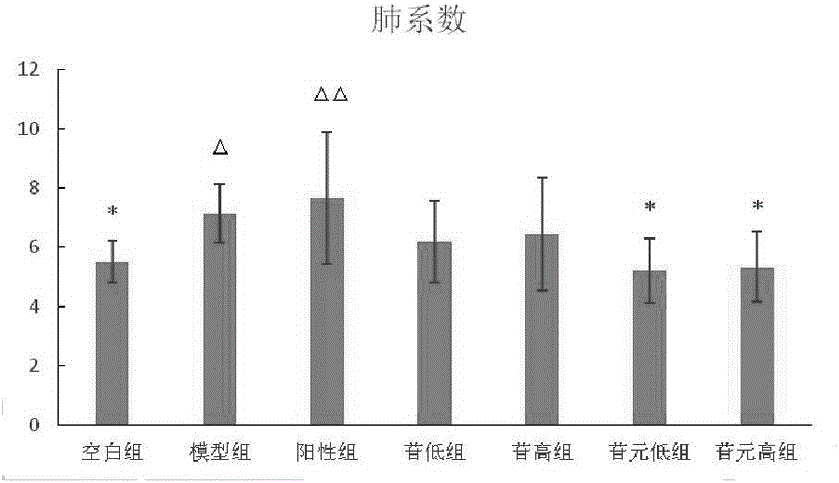
3.3肺系数。
模型组早期炎症细胞大量渗出,晚期成纤维细胞大量增生,胶原过度沉积都可导致肺系数增加,因此,肺系数这一指标可间接反应肺纤维化大鼠炎症和纤维化的程度;肺系数升高可间接反应纤维细胞增生程度大。
见图2,与空白组比较,模型组的肺系数明显升高(P<0.05),阳性组肺系数显著升高(P<0.01)。与模型组比较,牛蒡苷的低、高剂量组均有明显的下降,但无统计学差异。牛蒡苷元两个剂量组均有明显的降低肺系数作用(P<0.05)。
注:数据采用单因素方差分析LSD检验,与模型组比较,*P<0.05,**P<0.01;与空白组比较,△P<0.05,△△P<0.01。
3.4对肺通透系数的影响。
肺部广泛损伤后,炎性细胞浸润消耗大量氧可以引起氧相对不足,为适应组织代谢的需要,通过缺氧诱导因子刺激释放血管生成因子,引起毛细血管代偿性增生并导致血管异常过度生成和重构。同时,血管生成在炎症损害过程中能促进黏附和增加血管通透性而加剧炎症反应。肺通透系数大小可间接反映血管通透性的大小。
见图3,与空白组比较,模型组,阳性组,牛蒡苷元低、高剂量组的肺通透系数均有显著性差异(P<0.01),与模型组比较,牛蒡苷低、高剂量组均对肺通透指数均具有明显降低作用(P<0.05)。注:数据采用单因素方差分析LSD检验,与模型组比较,*P<0.05,**P<0.01;与空白组比较,△P<0.05,△△P<0.01。
3.5对组织中羟脯氨酸(HYP)含量的影响。
HYP 是机体胶原蛋白的主要成分之一,约占其氨基酸总量的 13%,其他除弹性蛋白含少量 HYP(约 1%)外,均不含 HYP,因此 HYP 可做为衡量胶原含量的重要指标。因纤维化形成原因是肺的胶原蛋白自我修复,故HYP升高。
见图4,与空白组比较,牛蒡苷高剂量组和牛蒡苷元高剂量组的HYP含量明显升高(P<0.05),模型组与阳性组的HYP含量显著升高(P<0.01)。与模型组比较,牛蒡苷高剂量组,牛蒡苷元高剂量组明显降低(P<0.05),牛蒡苷低剂量组和牛蒡苷元低剂量组显著降低(P<0.01)。注:数据采用单因素方差分析LSD检验,与模型组比较,*P<0.05,**P<0.01;与空白组比较,△P<0.05,△△P<0.01。
3.6对组织中髓过氧化物酶(MPO)活性的影响。
MPO活性检测的原理及意义:髓过氧化物酶是血红素过氧化物酶超家族成员之一,主要存在于中性粒细胞的嗜苯胺蓝颗粒中。其水平及活性的变化代表着中性粒细胞的功能和活性状态。该酶具有使过氧化氢还原的能力,利用这一特点能够分析酶的活力并间接定量中性粒细胞的数目。MPO活性越大,说明炎症反应越严重。
见图5,与空白组比较,模型组的MPO活性显著升高(P<0.01),与模型组比较,阳性组,牛蒡苷高剂量组MPO活性明显降低(P<0.05),牛蒡苷低剂量组、牛蒡苷元低剂量组与牛蒡苷元高剂量组显著降低(P<0.01)。注:数据采用单因素方差分析LSD检验,与模型组比较,*P<0.05,**P<0.01;与空白组比较,△P<0.05,△△P<0.01。
3.7对组织中丙二醛(MDA)含量的影响。
超氧化物歧化酶(superoxide dismutase,SOD)对机体的氧化与抗氧化平衡起着至关重要的作用,此酶能清除超氧阴离子自由基保护细胞免受损伤。机体通过酶系统与非酶系统产生氧自由基,后者能攻击生物膜中的多不饱和脂肪酸(polyunaturatedfatty acid,PUFA),引发脂质过氧化作用,并形成脂质过氧化物。因此MDA的量可反映机体内脂质过氧化的程度,间接反映出细胞损伤的程度。MDA升高反映细胞受氧化损伤程度越大。
见图6,与空白组比较,模型组的MDA含量有升高趋势,与模型组比较牛蒡苷元低剂量组明显降低(P<0.05),具有统计学意义。注:数据采用单因素方差分析LSD检验,与模型组比较,*P<0.05,**P<0.01;与空白组比较,△P<0.05,△△P<0.01。
3.8对肺泡灌洗液中乳酸脱氢酶(LDH)的影响。
LDH活性检测的原理及意义:LDH是存在于细胞内的一种催化酶,参与丙酮酸和乳酸之间的相互转化。在机体组织细胞受到损伤时会漏出至细胞外而至细胞外LDH含量和活性增加。因此LDH含量或活性的测定可间接反映组织细胞受损的程度,有时可用来诊断某些疾病或进行药物疗效的评价。通过比色法于波长440 nm处测定两酮酸的含量,能够推算出LDH的活性而间接反映组织细胞受到损伤的程度。LDH活性越大,细胞受损伤程度越大。
见图7,与空白组比较,模型组,阳性组的LDH活性显著升高(P<0.01),与模型组比较,牛蒡苷的两个剂量组与牛蒡苷元组的两个剂量组LDH活性均显著降低(P<0.01)。注:数据采用单因素方差分析LSD检验,与模型组比较,*P<0.05,**P<0.01;与空白组比较,△P<0.05,△△P<0.01。
3.9对肺组织中转化生长因子β(TGF-β)的影响。
在修复阶段,纤维化病灶附近转化生长因子β(transforming growth factor beta, TGF-β)表达升高,TGF-β是重要的致纤维化生长因子,能刺激成纤维细胞增生和胶原合成,促进胶原蛋白、纤维连接蛋白、透明质酸、蛋白聚糖等在肺间质沉积,减少 ECM 的降解。
见图8,与空白组比较,模型组的TGF-β含量显著升高(P<0.01),牛蒡苷元高剂量组TGF-β含量明显升高(P<0.05)。与模型组比较,阳性组、牛蒡苷低剂量组TGF-β含量显著降低(P<0.01),牛蒡苷高剂量组、牛蒡苷元低、高剂量组含量明显降低(P<0.05)。注:数据采用单因素方差分析LSD检验,与模型组比较,*P<0.05,**P<0.01;与空白组比较,△P<0.05,△△P<0.01。
3.10对肺组织中核因子-κB(NF-κB)的影响。
TNF-α本身能刺激NF-κB 活化,活化的 NF-κB反过来又增加TNF-α 的形成,二者相互促进。肺组织 TNF-α及NF-κB的表达升高,共同参与致肺纤维化的病理过程。NF-κB的表达滞后于 TNF-α 的表达,表明 TNF-α可能是NF-κB 活化的始动因素之一。
见图9,与空白组比较,模型组和阳性组的NF-κB含量显著升高(P<0.01),牛蒡苷元低剂量组含量明显升高(P<0.05),与模型组比较,牛蒡苷低剂量组与牛蒡苷元高剂量组NF-κB含量明显降低(P<0.05),牛蒡苷高剂量组NF-κB含量显著降低(P<0.01)。注:数据采用单因素方差分析LSD检验,与模型组比较,*P<0.05,**P<0.01;与空白组比较,△P<0.05,△△P<0.01。
3.11对组织中肿瘤坏死因子-α(TNF-α)的影响。
见图10,与空白组比较,牛蒡苷元低剂量组的TNF-α含量明显升高(P<0.05),模型组的TNF-α含量显著升高(P<0.01),牛蒡苷元高剂量组明显降低(P<0.05)。与模型组比较,牛蒡苷高剂量组的TNF-α含量明显降低(P<0.05),阳性组、牛蒡苷低剂量组和牛蒡苷元高剂量组的TNF-α含量显著降低(P<0.01)。注:数据采用单因素方差分析LSD检验,与模型组比较,*P<0.05,**P<0.01;与空白组比较,△P<0.05,△△P<0.01。
3.12对组织中白介素-6(IL-6)的影响。
见图11,与空白组比较,阳性组和牛蒡苷低剂量组的IL-6含量明显升高(P<0.05),模型组与牛蒡苷元低剂量组的IL-6含量显著升高(P<0.01)。与模型组比较,牛蒡苷高剂量组和牛蒡苷元高剂量组IL-6含量明显降低(P<0.05)。注:数据采用单因素方差分析LSD检验,与模型组比较,*P<0.05,**P<0.01;与空白组比较,△P<0.05,△△P<0.01。
3.13肺组织病理学切片观察。
本部分结果见图12,肺组织病理学切片观察(10×40);注:CON代表空白组,MOD代表模型组,POS代表阳性药组,ACL代表牛蒡苷低剂量组,ACH代表牛蒡苷高剂量组,AGL代表牛蒡苷元低剂量组,AGH代表牛蒡苷元高剂量组;图中标尺大小为20μm。
正常组肺组织的大鼠支气管、肺泡上皮细胞及肺泡间隔组织结构正常,细胞间连接紧密,血管内皮细胞及基膜完好,无充血、水肿及急慢性炎症等改变。
模型组大鼠肺毛细血管充血,支气管及血管周围均有炎性细胞聚集,肺泡腔萎缩,消失,肺泡壁断裂,肺泡间隔明显增宽且充血水肿,血管壁增厚,肺间质中可见大量中性粒细胞和单核巨噬细胞浸润,胶原纤维和纤维细胞增生并伴有淋巴细胞浸润,成纤维细胞增多,并有大量不规则、排列紊乱胶原纤维沉积。
阳性药醋酸泼尼松组偶见间质轻度水肿,炎性细胞浸润减少,胶原纤维沉积较模型组有一定的减轻,可观察到部分较明显的肺泡结构。
牛蒡苷及苷元组部分肺毛细血管充血,少部分肺泡细胞出现轻微水肿,炎性细胞浸润较少,有极少的胶原纤维沉积,肺泡结构较明显清晰。
以上结果表明,牛蒡苷和牛蒡苷元可从抗炎、抗氧化和免疫增强等方面对肺纤维化起到治疗作用,均可应用于抗肺纤维化疾病的药物中。
- 还没有人留言评论。精彩留言会获得点赞!