miR‑665‑3p抑制物在制备防治缺血再灌注损伤药物中的应用的制作方法
本发明涉及miR-665-3p抑制物的新用途,尤其是miR-665-3p抑制物在制备防治缺血再灌注损伤药物中的应用。
背景技术:
缺血再灌注损伤是指组织缺血缺氧到达一定时间及程度后引起细胞发生病理变化,在恢复血液供应后,损伤的组织非但没有恢复功能,反而出现进一步加重的病理现象。众多文献资料表明缺血再灌注损伤可能与以下若干因素有关:1. 氧自由基的生成;2. 钙超载;3. 中性粒细胞(PMN)激活;4. 过度的细胞凋亡;5. 大量细胞因子和炎性介质的释放。总之,缺血再灌注损伤是由各种机制相互影响,综合作用的结果。
自噬是广泛存在于真核生物中的一种溶酶体依赖的降解途径,是细胞存活、生长和细胞内稳态平衡不可缺少的机制。自噬可以通过降解衰老、损伤细胞器和长半衰期蛋白维持细胞稳态,在应激环境下,适度激活自噬则可以通过再生代谢前体和清除亚细胞碎片维持细胞完整性,减轻细胞氧化应激损伤、细胞凋亡,减少炎症因子释放,增强细胞抵抗外界刺激的能力。
微小RNA(microRNA, miRNA)是一类真核生物中RNA聚合酶转录的、具有帽子结构和多聚腺苷酸尾巴的非编码型RNA,一般长度为22-24个核苷酸。成熟的miRNA可以和特定靶基因mRNA的3’UTR区域互补结合,从而诱导沉默复合体降解靶标mRNA或阻滞其翻译过程,最终调控靶基因的表达。miRNA可调控生物体生长发育过程中的多个病理生理过程:细胞增殖、氧化应激、细胞凋亡等。虽然最近的研究表明miRNA在细胞自噬的多个不同阶段起着精细的调控作用,但是,迄今为止还没有关于miR-665-3p抑制物在制备预防或治疗缺血再灌注损伤药物中应用的相关报道。
技术实现要素:
本发明是发现了miR-665-3p抑制物具有预防和治疗缺血再灌注损伤的作用,从而发明了miR-665-3p抑制物在制备防治缺血再灌注损伤药物中的应用。
本发明的技术解决方案是:一种miR-665-3p抑制物在制备防治缺血再灌注损伤药物中的应用。
所述miR-665-3p抑制物在制备防治肠道缺血再灌注损伤药物中的应用。
所述miR-665-3p抑制物的DNA序列如SEQ ID NO:1或SEQ ID NO:3所示。
本发明证实了miR-665-3p抑制物可显著提高肠道细胞对于缺血再灌注损伤的耐受性,减轻肠道缺血再灌注损伤的严重程度,表现为有效缓解了发病小鼠小肠绒毛的倒伏及脱落、毛细血管的扩张及裸露等现象; miR-665-3p抑制物可显著抑制肠道损伤标记物肠型脂肪酸结合蛋白(I-FABP)及炎性细胞因子TNF-α和IL-6的过度释放,同时miR-665-3p抑制物对于小鼠II/R损伤后24h生存率显著高于对照组,可应用于制备防治缺血再灌注损伤药物。
附图说明
图1是LNA-miR-665-3p治疗后肠道组织病理图。
图2是LNA-miR-665-3p治疗后血清相关细胞因子的变化。
图3是LNA-miR-665-3p对小鼠II/R损伤后LC3蛋白表达的影响。
图4是LNA-miR-665-3p对小鼠II/R后小肠细胞原位凋亡的影响。
图5是LNA-miR-665-3p治疗对于小鼠II/R损伤24h生存率的影响。
图6是Antagomir-665-3p处理对于Caco-2细胞H/R损伤生存率的影响。
图7是Antagomir-665-3p处理对于Caco-2细胞H/R损伤后自噬流的影响。
图8是Antagomir-665-3p处理对于Caco-2细胞H/R损伤后凋亡的影响。
图9是Antagomir-665-3p处理对于Caco-2细胞H/R损伤后炎性因子释放的影响。
具体实施方式
下述实施例中所使用的试验方法如无特殊说明,均为常规方法。
下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径获得。
本实验中采用的miR-665-3p抑制物主要分为两种:
1. 基于新型锁核酸技术修饰的人工合成寡核苷酸序列(LNA),主要用于动物实验。
LNA-665-3p序列如SEQ ID NO:1所示;
LNA-NC对照序列如SEQ ID NO:2所示;
LNA-miR-665-3p序列和LNA-NC对照序列均委托丹麦Exiqon生物公司合成。
2. 经过特殊标记与化学修饰的miRNA高效阻断剂(Antagomir),主要用于细胞实验。
Antagomir-665-3p序列如SEQ ID NO:3所示;
Antagomir-NC对照序列如SEQ ID NO:4所示:
Antagomir-665-3p序列和Antagomir-NC对照序列均委托上海吉玛制药技术有限公司合成。
实验例1.LNA-miR-665-3p能够有效治疗缺血再灌注导致的小肠损伤
将24只健康的C57BL/6J小鼠分为4组:
A.正常对照组:假手术组;
B.正常给药组:假手术+LNA-miR-665-3p(2 mg/kg);
C.模型组:小肠缺血再灌注组(II/R组);
D.模型给药组:II/R+LNA-miR-665-3p(2 mg/kg)。
本实验采用Megision法构建小肠I/R动物模型,简要步骤如下:小鼠常规麻醉,待麻醉生效后,仰卧位固定于小动物手术台上,备皮后取上腹正中切口逐层入腹,轻柔分离肠系膜上动脉(SMA),于SMA根部使用微型无创血管夹夹闭。此时观察到SMA远端搏动消失,小肠壁由粉红色迅速转变为苍白色,确认SMA缺血构建成功,将小肠还纳腹腔,逐层关腹。待缺血时间达到45 min,沿用原切口入腹,取下微型无创血管夹,开始进行再灌注。再灌注4 h结束后,行腹主动脉取血处死动物。正常对照组小鼠平行进行麻醉,开腹和SMA分离等步骤,但不进行SMA夹闭。各组小鼠在再灌注开始时后肢皮下注射生理盐水12 ml/kg以补液。
使用无菌TE buffer溶解LNA-miR-665-3p,配制成10 mg/ml贮存液。术前12 h使用灭菌生理盐水配制注射液,正常给药组及模型给药组通过鼠尾静脉给药(2 mg/kg),给药负荷为0.1 ml。
1.1 小肠组织病理学
取小肠组织进行HE染色,于400倍光镜下观察。如图1所示,正常对照组(A)及正常给药组(B):小肠黏膜绒毛排列整齐,形态完整,上皮下间隙无扩张;模型组(C):小肠绒毛排列紊乱,顶端可见大量断裂及脱落,上皮下间隙增宽,毛细血管淤血;模型给药组(D):小肠绒毛脱落程度减轻,上皮与固有层轻度分离。实验结果表明,LNA-miR-665-3p可显著减轻缺血再灌注导致的小鼠小肠组织的损伤。
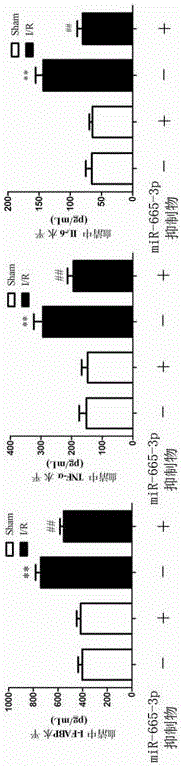
1.2 血清细胞因子的变化
采用酶联免疫法(ELISA)分别测定血清中肠型脂肪酸结合蛋白(I-FABP)、肿瘤坏死因子(TNF-α)、白细胞介素6(IL-6)的含量,ELISA试剂盒购自上海朗顿公司,结果见图2,** vs. Sham p<0.01,## vs. I/R p<0.01,n=6。
实验结果表明,LNA-miR-665-3p可显著减轻缺血再灌注导致的小肠细胞损伤及炎性因子的释放。
1.3 小肠组织LC3蛋白表达的变化
采用Western Blot法测定小肠组织中LC3蛋白的表达水平,结果如图3所示,** vs. Sham p<0.01,## vs. I/R p<0.01,n=6。与正常对照组相比,模型组中LC3-II/β-actin的比例显著下调,而给予LNA-miR-665-3p后,该比例显著上升,标志着自噬水平的恢复。实验结果表明,LNA-miR-665-3p可显著上调小肠组织自噬水平。
1.4 小肠组织细胞凋亡的变化
采用TUNEL法检测组织细胞的早期凋亡情况,结果见图4。模型组较正常对照组TUNEL阳性细胞数显著增多,断裂的绒毛顶端可见显著增强的绿色荧光信号;模型给药组较模型组TUNEL阳性细胞数显著减少,仅在绒毛顶端见少量绿色荧光信号。实验结果表明LNA-miR-665-3p可显著抑制小肠组织的细胞凋亡水平。
实验例2. LNA-miR-665-3p显著提高小鼠II/R损伤的生存率
将30只健康的C57BL/6J小鼠分为2组:
A. miRNA对照组:II/R+LNA-NC(2 mg/kg);
B. LNA-miR-665-3p给药组:II/R+LNA-miR-665-3p(2 mg/kg);
模型构建及给药方法如例1中所述,再灌注24 h后结果见图5,* vs. miRNA对照组 p<0.01,n=15。实验结果表明miR-665-3p给药组动物24小时生存率显著高于miRNA对照组。
实验例3.Antagomir-miR-665-3p显著减轻缺氧复氧诱导的细胞损伤
缺氧复氧(Hypoxia/Reoxygenation,H/R)为体外常用细胞损伤模型,用于模拟体内I/R损伤。利用Caco-2细胞构建H/R损伤模型,分为4组:
A. 正常对照组:Control+Antagomir-NC(30nM);
B. 模型对照组:H/R+Antagomir-NC(30nM);
C. 正常给药组:Control+Antagomir-665-3p(30nM);
D. 模型给药组:H/R+Antagomir-665-3p(30nM)。
3.1 Antagomir-miR-665-3p显著提高Caco-2细胞H/R损伤后的生存率
本实验采用缺氧12h复氧6h构建模型,模型构建成功后,应用CCK-8法检测各组细胞存活率,结果见图6,** vs. Control组 p<0.01,## vs. H/R p<0.01,n=6。实验结果表明,miR-665-3p抑制物可显著提高细胞对H/R损伤的耐受性。
3.2 Antagomir-miR-665-3p显著上调Caco-2细胞H/R损伤后的自噬流水平
采用mRFP-GFP-LC3自噬双标腺病毒法检测细胞中的自噬流水平,结果如图7所示,与正常对照组相比,H/R组中自噬小体和自噬溶酶体的数目显著下调,而给予Antagomir-miR-665-3p后,该数目均显著上升,标志着自噬流的激活。实验结果表明,miR-665-3p抑制物可显著激活Caco-2细胞H/R损伤后的自噬流水平。
3.3 Antagomir-miR-665-3p显著减轻Caco-2细胞H/R损伤后的细胞凋亡
采用TUNEL法检测细胞中的细胞凋亡水平,结果如图8所示,与正常对照组相比,H/R组中TUNEL阳性细胞数目显著上升,而给予Antagomir-miR-665-3p后,该数目显著下调,标志着细胞凋亡的减少。实验结果表明,miR-665-3p抑制物可显著抑制Caco-2细胞H/R损伤后的细胞凋亡水平。
3.4 Antagomir-miR-665-3p显著减轻Caco-2细胞H/R损伤后的炎性因子释放
采用酶联免疫法(ELISA)分别测定细胞上清液中肿瘤坏死因子(TNF-α)、白细胞介素6(IL-6)的含量,ELISA试剂盒购自上海朗顿公司,结果见图9。实验结果表明,miR-665-3p抑制物可显著减轻H/R导致的炎性因子释放。
序列表
<110>大连医科大学附属第二医院
<120> miR-665-3p抑制物在制备防治缺血再灌注损伤药物中的应用
<130>
<160>4
<210>1
<211>16
<212>DNA
<213>人工序列,LNA-665-3p
<400>1
GACCTCAGCCTCCTGG
<210>2
<211>15
<212>DNA
<213>人工序列,LNA-NC
<400> 2
ACGTCTATACGCCCA 15
<210>3
<211>20
<212>DNA
<213>人工序列,Antagomir-665-3p
<400> 3
AGGGGCCUCAGCCUCCUGGU 20
<210>4
<211>21
<212>DNA
<213>人工序列,Antagomir-NC
<400> 4
CAGUACUUUUGUGUAGUACAA 21
- 还没有人留言评论。精彩留言会获得点赞!