一种能进行MR‑荧光双模态成像的可降解纳米胶束及其制备方法和应用与流程
本发明涉及纳米医学与生物医学工程领域,具体地,涉及纳米胶束技术领域,更具体地,涉及一种能进行MR-荧光双模态成像的可降解纳米胶束及其制备方法和应用。
背景技术:
急性缺血性脑梗塞(Acute Ischemic Stroke,AIS),是由于脑动脉的闭塞导致的脑组织的梗死,不可避免的伴有神经元、星形胶质细胞、少突胶质细胞死亡以及神经通路的破坏。目前,临床治疗上主要通过超早期溶栓、脑神经保护及后期康复锻炼等措施,虽然部分患者神经功能恢复较好,然而仍有50%~70%的存活者遗留瘫痪、失语等严重残疾。虽然研究证明脑梗死发生后,位于室管膜下区或海马齿状回颗粒细胞下层的内源性神经干细胞(neural stem cells,NSCs)可激活、增殖、迁移、分化为新生的神经元,但是由于内源性NSCs数目、自我更新及转化为神经元的速度缓慢,脑梗塞后大脑的自我修复能力是非常有限的。移植的研究为脑梗死治疗开辟了一条新的途径。多项研究成果已经表明移植NSCs通过分泌神经营养因子或者直接的脑组织细胞替代等作用,能有效地促进神经功能修复作用。干细胞移植后需要对体内的存活、分布、迁徙、增殖及分化进行连续监测,从而评估其疗效和安全性,然而如何监测其在宿主体内的情况一直是NSCs移植中的一项关键技术难题。
传统的示踪方法主要有荧光染料标记、核酸标记、转基因、染色体等方法,而这些方法均需在体外状态下进行组织学分析和鉴定,然而对于干细胞移植进入临床应用还远远不够。干细胞体内示踪技术是以非侵入性方式在活体内示踪干细胞的存活、分布和功能等。目前最为常用的分子影像学技术有光学成像、超声成像、核医学、磁共振成像(MRI)等,不同的成像技术敏感性、分辨率、组织特异性不同,各成优势、互相补充。例如荧光成像信号强,可直接探测发出的信号,操作简单,但其组织分辨率差;MRI因其具有极佳的分辨率(可对深部组织进行精确定位和定量分析)、无创伤、可重复性强等优点,但其对设备及成像条件要求较高。多模态成像综合2种及以上成像技术,例如光学成像和MRI,联合各成像技术的优势,更准确有效地实现干细胞活体示踪,推动干细胞研究的临床转化。
然而,干细胞本身在常用的分子成像技术上均不具有特异性信号,给临床检测带来了相当程度的困难。为了提高干细胞的分辨和对比度,临床上需要对干细胞进行特异性的造影剂标记,使得干细胞出现特异性信号改变而被识别。高分子聚合物载体因其具有输送效率高、生物安全性及组织相容性高、细胞毒副作用低,易进行化学修饰、结构稳定性好、具有主动及被动靶向效应等优点,在干细胞示踪领域显示出独特的优势。尽管已经有多篇关于纳米载体用于干细胞多模态示踪的报道,甚至出现了能对干细胞同时进行MRI、荧光成像和PET三种成像模式的纳米载体的报道。然而这些纳米载体多数基于二氧化硅或钆剂,生物相容性或可降解性差,对干细胞及人体存在潜在毒性,难以真正运用于临床;或者仅通过对磁性纳米颗粒(SPIO)进行表面修饰后,链接荧光分子或放射性核素造影剂,造影剂负载量低,难以实现对干细胞的有效标记;或者通过对干细胞进行基因修饰插入报告基因而到达干细胞光学成像示踪的目的,而非真正的多模态纳米载体,并且报告基因操作复杂。报告基因会导致NSCs内基因产物的蓄积,可能对其增殖、分化等能力产生影响。如何实现安全、有效的干细胞示踪,仍然是干细胞治疗向临床转化的重要难题。
技术实现要素:
本发明为了克服现有技术的上述不足,提供一种能自组装、且能同时负载SPIO和尼罗红的可降解两亲性嵌段聚合物。
本发明的另一个目的是提供上述两亲性嵌段聚合物的制备方法。
本发明的另一个目的是提供上述两亲性嵌段聚合物在制备能进行MR-光学双模态成像的纳米胶束中的应用。
本发明的另一个目的是提供一种能进行MR-荧光双模态成像的可降解纳米胶束。
本发明的另一个目的是提供一种能进行MR-荧光双模态成像的可降解纳米胶束的制备方法。本发明的另一个目的是提供上述纳米胶束在对神经性干细胞进行高效、安全标记中的应用。所述纳米胶束能对干细胞进行高效标记,且易水解,水解产物可用于临床使用,安全无毒副作用。
本发明的另一个目的是提供上述纳米胶束在对神经性干细胞进行MR-荧光双模态成像中的应用。所述纳米胶束能负载高敏磁造影剂及荧光染料,就干细胞治疗中对其迁移及分布进行有效的、实时的定位监测。
为了实现上述目的,本发明是通过以下技术方案予以实现的:
一种能共同负载SPIO和尼罗红的两亲性嵌段聚合物,所述聚合物由聚天冬酰二甲基乙二胺亲水段和胆酸疏水支链段两嵌段共聚物构成;所述聚天冬酰二甲基乙二胺亲水段分子量为900~3600Da,再引入赖氨酸连接2个、4个或8个胆酸。
本发明为了实现体外培养时对NSCs的高效标记,选取带有正电荷的聚天冬酰二甲基乙二胺为亲水段;选取胆酸为疏水段,能够同时负载疏水性SPIO和尼罗红,同时使SPIO在细胞内的再聚集,可满足高灵敏度MR-荧光双模态造影剂的要求。
本发明为了实现对药物的可控性负载,可以通过控制聚天冬酰二甲基乙二胺上连接的胆酸数目,实现对有效的提高药物负载效率。
本发明为了实现体外培养时对NSCs的安全标记,将及易得到且生物安全的改性天冬氨酸聚合物和胆酸通过及易水解的酰胺键链接,水解产物均对干细胞毒性极小,能够保留干细胞干性,对人体安全无毒副作用。
如上所述能同时负载SPIO和尼罗红的两亲性嵌段聚合物的制备方法,由以下方法制备得到:
S1.苯甲醇和L-天冬氨酸合成β-天冬氨酸苄脂;再加入双(三氯甲基)碳酸酯合成苄氧羰基天冬氨酸酐(BLA-NCA);
S2.由正丁胺引发,苄氧羰基天冬氨酸酐(BLA-NCA)开环聚合成正丁胺-聚苄基天冬氨酸(BA-PBLA);
S3.将双(叔丁氧羰基)-L-赖氨酸(Boc-Lys(Boc)-OH)对接于正丁胺-聚苄基天冬氨酸(BA-PBLA)氨基末端,合成聚苄基天冬氨酸-双(叔丁氧羰基)L-赖氨酸(PBLA-Lys-BOC2);用三氟乙酸除去聚苄基天冬氨酸-双(叔丁氧羰基)L-赖氨酸(PBLA-Lys-BOC2)末端的BOC基团,得到聚苄基天冬氨酸-赖氨酸(PBLA-Lys);
S4.将胆酸对接于聚苄基天冬氨酸-赖氨酸(PBLA-Lys)的氨基端,得到聚苄基天冬氨酸苄脂-赖氨酸-胆酸(PBLA-Lys-CA2);
S5.聚苄基天冬氨酸苄脂-赖氨酸-胆酸(PBLA-Lys-CA2)经无水二甲基甲酰胺(DMA)氨解得到聚天冬酰二甲基乙二胺-赖氨酸-胆酸(PAsp(DMA)-Lys-CA2)。
如上所述的可降解两亲性嵌段聚合物在制备能进行MR-荧光双模态成像的纳米胶束中的应用。
一种能进行MR-荧光双模态成像的纳米胶束,所述纳米胶束由如上所述的可降解的两亲性嵌段聚合物自组装后,将疏水性的SPIO及尼罗红负载于其疏水内核,得到能够进行MR-荧光双模态成像的纳米胶束。
本发明所述的可降解的两亲性嵌段聚合物自组装后能形成一种纳米尺寸的正电荷纳米胶束,将疏水性的SPIO及尼罗红负载于其疏水内核,得到同时负载MRI造影剂及荧光造影剂的纳米胶束,将这种纳米胶束与神经干细胞在体外共同培养,实现了对神经干细胞高效率双模态标记,同时,由于该两亲性嵌段聚合物易水解,水解产物可用于临床使用,纳米胶束对神经干细胞显示了极小的细胞毒性,保留干细胞干性,对人体安全无毒副作用。
优选地,所述能进行MR-荧光双模态成像的纳米胶束的具体制备方法为:2mg SPIO、0.2mg尼罗红和20mg PAsp(DMA)-Lys-CA2同时溶于2mL的DMSO和氯仿混合溶剂中(v:v=1:3)。超声乳化作用下加入溶有20mL的PBS溶液,乳化均匀后旋蒸除去氯仿,经针筒滤过器(0.45μm)除去大颗粒,Millipore离心过滤装置((标称分子量(MW)临界值:100kDa)超滤除去DMSO和其他亲水性杂质,得到同时负载SPIO和尼罗红的纳米胶束。
如上所述的纳米胶束在对神经干细胞进行体外标记及体内MR-荧光双模态示中的应用。
与现有技术相比,本发明具有以下有益效果:
本发明提供了一种多功能纳米胶束的制备及应用方法,针对现有神经干细胞体外标记难度大、标记后细胞活力受损严重的问题,得到同时负载MRI造影剂及荧光造影剂的纳米胶束,将这种纳米胶束与神经干细胞在体外共同培养,能够对干细胞进行高效的SPIO、荧光双标记,在后续的干细胞体内移植治疗中,能实现对干细胞的迁移及分布进行有效的、实时的动态MR-荧光双模态定位监测。同时,由于该两亲性嵌段聚合物极易水解,水解产物可用于临床使用,该纳米胶束对神经干细胞显示了极小的细胞毒性,保留了神经细胞干性,对人体安全无毒副作用,有望真正实现纳米载体标记神经干细胞从基础研究向临床应用的转化。
附图说明
图1为纳米胶束的制备示意图。
图2为纳米胶束的粒径、TEM图。
图3为纳米胶束弛豫率的MRI检测。
图4为纳米胶束标记神经干细胞的荧光标记检测:流式细胞计数法。
图5为纳米胶束标记神经干细胞的铁标记检测:(A)MRI T2值测量法;(B)普鲁士蓝铁染色法。
图6为纳米胶束对神经干细胞细胞的毒性测试:(A)流失细胞仪凋亡检测法;(B)CCK8法。
具体实施方式
下面结合说明书附图和具体实施例,进一步阐述本发明。这些实施例仅用于说明本发明而不用于限制本发明的范围。下例实施例中未注明具体条件的实验方法,通常按照本领域常规条件或按照制造厂商建议的条件。本领域的技术人员在本发明的基础上所做的任何非实质性的变化及替换均属于本发明所要求保护的范围。
实施例1两亲性嵌段聚合物的合成
(1)苄氧羰基天冬氨酸酐(BLA-NCA)的合成,反应机理及过程如下:
苯甲醇和L-天冬氨酸合成β-天冬氨酸苄脂;再加入双(三氯甲基)碳酸酯合成苄氧羰基天冬氨酸酐(BLA-NCA)。具体步骤参照文献1。
(2)正丁胺-聚苄基天冬氨酸(BA-PBLA)的合成,反应机理及过程如下:
由十二醇引发,BLA-NCA开环聚合成正丁胺-聚苄基天冬氨酸(BA-PBLA)。称取73.14mg的正丁胺(1.0nmol,0.74g/mL)至50mL的反应瓶中,加入30mL的无水CH2Cl2充分溶解。称取2.49g BLA-NCA(10mmol)溶于20mL无水二甲基甲酰胺后,在氮气保护下,加入到正丁胺溶液中,在35℃下搅拌反应72h。反应结束后,反应液沉淀在大量无水乙醚中。分离沉淀并用无水乙醇洗涤,真空干燥后得到最终产物BA-PBLA。
(3)聚苄基天冬氨酸-赖氨酸(PBLA-Lys)的合成,反应机理及过程如下:
使用O-苯并三氮唑-四甲基脲六氟磷酸盐(HBTU)及1-羟基苯并三唑(HOBT)作为偶联试剂,将双(叔丁氧羰基)-L-赖氨酸(Boc-Lys(Boc)-OH)耦合至正丁胺-聚苄基天冬氨酸(BA-PBLA)的氨基末端,合成聚苄基天冬氨酸-双(叔丁氧羰基)L-赖氨酸(PBLA-Lys-BOC2)。称取双(叔丁氧羰基)-L-赖氨酸(Boc-Lys(Boc)-OH)(1.5mmol)于干燥的50mL反应瓶中,加入二甲基甲酰胺(DMF)溶解,再加入O-苯并三氮唑-四甲基脲六氟磷酸盐(HBTU)(1.5mmol)、1-羟基苯并三唑(HOBT)(1.5mmol)及正丁胺-聚苄基天冬氨酸(0.75mmol),很快有白色沉淀产生,室温搅拌反应24h。反应结束后,将反应液倒入过量无水乙醚中沉淀。分离沉淀并用无水乙醇洗涤,真空干燥后得到产物PBLA-Lys-BOC2。
用三氟乙酸除去PBLA-Lys-BOC2末端的BOC基团,得到PBLA-Lys。称取PBLA-Lys-BOC2至25mL反应瓶中,加入三氟乙酸(TFA)10mL搅拌溶解,成淡黄色溶液。反应1h后,将反应液倒入过量无水乙醚中沉淀。分离沉淀并用无水乙醇洗涤,真空干燥后得到产物PBLA-Lys。
(4)聚苄基天冬氨酸苄-赖氨酸-胆酸(PBLA-Lys-CA2)合成,反应机理及过程如下:
称取胆酸(CA)(3mmol)于干燥的50mL反应瓶中,加入N,N-二异丙基乙胺(DIPEA)溶解,再加HBTU(3mmol)、HOBT(3mmol)及PBLA-Lys(1.5mmol),室温搅拌反应24h。反应结束后,将反应液倒入过量无水乙醚中沉淀。分离沉淀并用无水乙醇洗涤,真空干燥后得到产物PBLA-Lys-CA2。
(5)聚天冬酰二甲基乙二胺-赖氨酸-胆酸(PAsp(DMA)-Lys-CA2)合成,反应机理及过程如下:
PBLA-Lys-CA2经无水二甲基甲酰胺(DMA)氨解得到聚天冬酰二甲基乙二胺-赖氨酸-胆酸(PAsp(DMA)-Lys-CA2)。于50mL反应瓶中用20mL无水二甲基亚砜(DMSO)溶解0.90g PBLA-Lys-CA2(0.3mmol)和2.6g DMA(30mmol,相当于苄基10eq.),在35℃下搅拌反应24h。将反应液逐滴加入100mL并用超声波分散,用透析袋(14kDa)在无氧水中透析3d,冷冻干燥得到终产物PAsp(DMA)-Lys-CA2。
实施例2两亲性嵌段聚合物的合成
参照实施例1合成两亲性嵌段聚合物,改变正丁胺-聚苄基天冬氨酸(BA-PBLA)的分子量,设计聚合度分别为5和20(实施例1为10),其余反应步骤均与实施例1一致,得到正电嵌段长度不同的嵌段聚合物PAsp(DMA)-Lys-CA2,聚天冬酰二甲基乙二胺(PAsp(DMA))的分子量分别为900Da和3600Da。
实施例3两亲性嵌段聚合物的合成
参照实施例1合成两亲性嵌段聚合物,得到聚苄基天冬氨酸-赖氨酸后(PBLA-Lys),其末端两个氨基经与双(叔丁氧羰基)-L-赖氨酸(Boc-Lys(Boc)-OH)耦合、脱保护后,可得到末端带四个氨基的PBLA-Lys3,PBLA-Lys3再接一次Boc-Lys(Boc)-OH并脱保护可得到末端带8个氨基的PBLA-Lys7。PBLA-Lys3和PBLA-Lys7按实施例1的方法接度胆酸并氨解,可得到末端接不同数目胆酸的两亲性聚合物,胆酸接枝数目分别是4个和8个。
实施例4纳米胶束的制备及表征
取实施例1制备得到的两亲性嵌段聚合物按纳米复合物制备方法准备同时负载SPIO和尼罗红的纳米胶束,制备思路如图1所示。
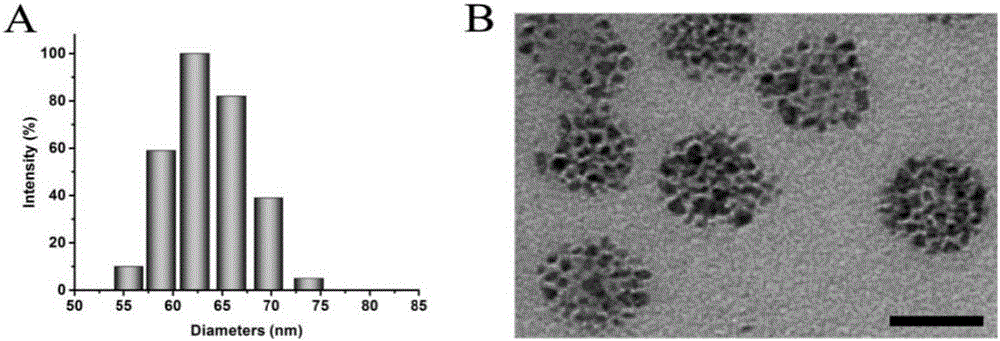
得到的纳米粒子溶液,用测定其水力学直径及形貌结构,结果如图2所示。(A)纳米胶束粒径为64.1±1.7nm。(B)电镜结果表明,纳米粒子呈均匀的球形结构。
实施例5纳米胶束弛豫率的MRI检测
将实施例4制备的PAsp(DMA)-CA2纳米胶束于96孔板内按浓度梯度逐级稀释,进行MRI(Philips Inter,3.0T)体外测试。MRI扫描参数如下:单次激发多次采集的自旋回波序列:重复时间(TR)/回波时间(TE)=2000/20-80ms,4次梯度回波采集,采集次数(NSA)=1,采集矩阵=160×266,视野(FOV)=80×80mm2,层厚=2mm。获取T2的弛豫时间。以铁浓度(mM)为横坐标,T的倒数(r2)为纵坐标,采用线性最小二乘回归分析,直线斜率即为T2的弛豫度。图3结果显示,负载于纳米胶束内的SPIO由于团簇效应,具有很高的T2弛豫率,能够实现对干细胞的有效标记。
实施例6纳米胶束标记神经干细胞的荧光标记检测
将实施例4制备的纳米胶束在铁浓度为10μg/mL的情况下标记神经干细胞4小时后,流式细胞仪、荧光显微镜纳米胶束对神经干细胞的荧光标记情况。图4结果显示:流式细胞仪示神经干细胞被载有荧光染料尼罗红的纳米胶束高效标记,标记高达97.55%。
实施例7纳米胶束对神经干细胞的铁标记检测
将实施例4制备的纳米胶束在铁浓度为10μg/mL的情况下标记神经干细胞4小时后,收集细胞PBS洗涤三次后重悬细胞于200μL 1%琼脂糖凝胶中(细胞密度为2.5×106/mL),MRI、普鲁士蓝检测纳米胶束对神经干细胞的SPIO标记情况,MRI参数同实施例5。图5结果显示:(A)MR示标记后细胞的T2值为35.70±8.95,明显低于对照组;(B)普鲁士蓝染色示标记后神经干细胞胞质内有较多蓝染铁颗粒。满足后续活体MR示踪的条件。
实施例8纳米胶束的细胞毒性检测
采用CCK8法检测实施例4制备的纳米胶束与NSCs孵育后细胞的存活率,用流式细胞计数仪定量检测了孵育后NSCs的凋亡情况,综合评价纳米胶束对细胞的毒性,结果如图6所示,纳米胶束显示了极小的细胞毒性,对人体安全无毒副作用,有望真正实现囊米载体标记神经干细胞从基础研究向临床应用的转化。
- 还没有人留言评论。精彩留言会获得点赞!