一种载药缓释的复合组织修复材料及其制备方法与流程
本发明属于复合组织修复材料及其制备领域,特别涉及一种载药缓释的复合组织修复材料及其制备方法。
背景技术:
通过载药增强材料的功能性是改良生物材料的可能途径之一。根据修复材料的用途针对性地添加功能性药物,在实现组织修复的同时提升疗效,维持有效药物浓度的同时减少药物使用剂量,降低毒性和副作用,减轻不良反应。此外,可缓释的载药修复材料还可以避免反复用药、换药的麻烦,并且适用于不便直接用药的部位。药物可选种类多样,可为不宜全身给药或需要提高局部、靶向释放的药物,如抑菌药物、抗凝血药物、免疫调节药物等。
基于生物材料的三维网状结构,具备一定的厚度、透湿性和孔隙率,可与药物形成膜控型和骨架型结构,减缓药物的释放。一方面,生物材料孔隙率高、具备一定的厚度,孔径不规则,可作为半透膜使用,以溶解、扩散作用减缓药物释放。将药物或载药介质结合后包裹至生物材料中,植入体内后体液或细胞间隙液浸润材料,药物分子经溶解、扩散穿过孔隙并在材料内部扩散,最终透过材料释放到体液中,药物的释放速率取决于材料内外的药物浓度差、材料厚度、孔隙性质等。另一方面,生物材料或介质的超微三维网状支架结构,富含粘滞成分,易于吸附各种药物分子,可作为药物释放的骨架材料,以溶解、溶蚀作用减缓药物释放。将药物或载药介质与材料结合植入体内后,药物溶解、扩散至材料内部并与材料或介质以分子间作用力或化学键结合,伴随骨架材料的降解,药物逐步释放,药物的释放速率取决于材料的降解时间、三维结构、孔隙性质等。
具备上述特性生物材料可以方便的植入特定药物,代表了改良组织修复材料的发展前景。在这方面,利用具有抗菌作用的生物酶类、壳聚糖衍生物或中国发明专利cn102014790a和cn101623518a分别公开的纳米银、银离子等抗菌金属粒子浸润脱细胞基质生物材料,均可提高生物材料的抗感染性。体外抗菌实验和动物实验结果表明可降低脱细胞基质生物材料感染率,提高污染创面修复成功率。这一改良生物补片抗感染效果令人满意,但由于抗菌成分仅为吸附至材料网状结构,结合较为松散,在植入后短时间内释放大量抗菌成分,致使修复区后期抗菌效果较差。中国发明专利cn103751844a公开了一种抗菌抗降解的猪小肠粘膜脱细胞基质制备方法及其应用。该发明以京尼平、多巴胺和纳米银处理的猪小肠粘膜脱细胞基质制备抗菌抗降解生物材料,多巴胺具有粘滞性,可通过化学键的作用将抗菌成分绑定至胶原纤维支架,实验证实其抗降解性能和抗菌性能均相对于天然的猪小肠粘膜脱细胞基质显著增强,且能够在高应力部位组织修复中应用。但交联材料较非交联材料应用于受污染的表面时,显著修复区感染率上升,这可能是由于交联会缩小材料的孔隙,过小的孔隙不利于细胞侵入实现早期血管化,且易于细菌定植,形成细菌生物膜。中国发明专利cn101810883a公开了一种高组织相容性、长效抗感染的生物衍生材料,其组分包括脱细胞基质和可吸收抗感染纳米微粒,可吸收抗感染纳米微粒植入体内后短期内突释药物,迅速达到有效浓度,且有效血液浓度持续2周~3月。中国发明专利cn102172418a公开了一种缓释生长因子的无细胞基质材料,其组分包括可降解疏水聚合物,血管再生的生长因子和无细胞基质,将纳米缓释系统复合至无细胞基质中,缓释出的生长因子仍有效保持生物学特性,缓释过程长且平稳。但这两项专利涉及的纳米粒子的制备过程复杂,且生物安全性未知,粒径较小的纳米粒子(<50nm)可能存在一定细胞毒性,缺乏临床应用前景。因此,生物材料的载药方法仍亟待改进。
技术实现要素:
本发明所要解决的技术问题是提供一种载药缓释的复合组织修复材料及其制备方法,涉及的材料的半透膜作用和三维结构可以实现所载药物的缓释,且释放曲线可控,不改变材料的组织相容性和宿主-材料免疫反应类型,具备生物相容、无毒无害的特点,有助于提升修复材料的生物学性能和特定功能,临床应用前景良好。
本发明的一种载药缓释的复合组织修复材料,所述修复材料包括具有三维结构、孔隙率和透过性的材料,药物或载药介质;其中药物或载药介质夹裹或涂布于材料层间或表面,通过具有三维结构、孔隙率和透过性材料的半透膜作用实现载药缓释。
药物或载药介质夹裹或涂布于材料层间或表面为:药物可单独夹裹或涂布于材料层间或表面,或药物与介质结合制备为载药介质后夹裹或涂布于材料层间或表面。
所述的具有三维结构、孔隙率和透过性的材料,其层数不限,具体层数应根据应用时所需力学强度和所载药物的释放曲线而定,药物、载药介质可分布或夹裹于任意层次材料间或表面。所述具有三维结构、孔隙率和透过性的材料为细胞外基质/脱细胞基质、胶原蛋白、纤维蛋白、壳聚糖、透明质酸、硫酸软骨素、胶原蛋白、明胶、聚合物水凝胶以及以静电纺丝、3d打印、发泡技术制备的生物材料或合成材料中的一种或多种。
具有三维结构、孔隙率和透过性的材料,其中孔隙率为0%-98%,透过性为材料对某些特定物质具备透过作用。
所述细胞外基质/脱细胞基质为来源于人或哺乳动物的空腔脏器粘膜下层、组织基底膜、真皮、心包、腹膜、胸膜或羊膜,材料交联度为0%~100%。
所述药物、载药介质中的药物为抗菌剂、抗生素类、促组织愈合类、抗凝血类、抗炎类、免疫调节类药物中的一种或几种以及包载上述成分的纳米颗粒、微球等。
所述抗菌剂为纳米银、银离子、三氯生、洗必泰、铋化合物中的一种或几种;抗生素类药物为万古霉素、庆大霉素、利福平、异烟肼中的一种或几种;促组织愈合类药物为生长因子、细胞因子、趋化因子、核酸、多肽中的一种或几种;抗凝血类药物为肝素和/或水蛭素;抗炎类药物为布洛芬、对乙酰氨基酚、cox-2受体拮抗剂中的一种或几种。
所述载药介质中的介质为水溶液、有机溶剂、壳聚糖、透明质酸、硫酸软骨素、胶原蛋白、明胶、聚合物水凝胶中的一种或几种。
药物添加量应根据修复材料的用途、已知常规用量及应用时所需药物释放曲线而定,如纳米银。
载药缓释的复合组织修复材料中药物释放根据临床治疗需要,其中药物的释放可以根据需要调节为1-48天。
修复材料可选择性地增加贯穿材料的孔洞或释放槽,直径1~5mm,间距0.5~5cm。
本发明的一种载药缓释的复合组织修复材料的制备方法:具有三维结构、孔隙率和透过性的材料与药物或药物/载药介质通过粘合剂粘合、医用可降解缝线捆扎、真空层压、恒温热压中或其他可以将多层材料固定为一体的物理、化学或生物方法中的一种或多种。
本发明具有三维结构、孔隙率和透过性的材料和药物或载药介质,制备方法为将药物/载药介质夹裹或涂布于材料层间或表面,借助粘合剂、缝线或真空层压形成整体结构。
有益效果
(1)缓释、控释所载药物:本发明主要通过基于生物材料的膜控型和骨架型结构实现所载药物的释缓。一方面,生物材料孔隙率高、具备一定的厚度,孔径不规则,可作为半透膜使用,以溶解、扩散作用减缓药物释放。将药物或载药介质结合后包裹至生物材料中,植入体内后体液或细胞间隙液浸润材料,药物分子经溶解、扩散穿过孔隙并在材料内部扩散,最终透过材料释放到体液中,药物的释放速率取决于材料内外的药物浓度差、材料厚度、孔隙性质等。另一方面,生物材料或介质的超微三维网状支架结构,富含粘滞成分,易于吸附各种药物分子,可作为药物释放的骨架材料,以溶解、溶蚀作用减缓药物释放。将药物或载药介质与材料结合植入体内后,药物溶解、扩散至材料内部并与材料或介质以分子间作用力或化学键结合,伴随骨架材料的降解,药物逐步释放,药物的释放速率取决于材料的降解时间、三维结构、孔隙性质等。以细胞外基质生物材料为例,其透过作用的强弱与组织来源、脱细胞处理方法及交联度密切相关;改变材料的加工工艺和孔隙率、增加材料的厚度/层数,调节药物的施加层次均可调控药物的释放。
另一方面,材料和介质作为药物的递送载体,具有二级膜控和骨架作用,辅助药物的缓释。本发明选择的材料或介质其组成单体均应具有一定的反应活性,如携带一定量的醛基、氨基、双键等基团。本发明涉及材料或介质应为完全或部分生物可降解,添加的生物相容性良好的药物可呈液态游离于网状结构的间隙,或与分子形成共价或非共价连接,如含有双键、醛基等结构的有益成分与带有氨基、醛基等活性基团的分子间均可形成化学键,黏附于网状结构表面,二种状态的药物可到达一定的动态平衡。植入生物体内后,材料或介质可以借助网孔的交联互通网状结构,在早期释放大量以液态游离于网状结构间隙的药物,中后期伴随宿主细胞和组织长入,介质缓慢降解,同时持续性释放剩余的药物。因此,可以通过改变介质浓度、材料和介质孔隙率、药物的添加量等调控药物的释放。
(2)组织相容性良好:材料和介质的包载保证了无大剂量药物直接暴露于机体组织,不改变材料的组织相容性和宿主-材料免疫反应类型,不引起过敏反应。且这种局部给药的方式,可以维持有效药物浓度的同时减少药物使用剂量,降低毒性和副作用,减轻不良反应。
(3)不易耐药性:针对不同缺损部位,按照一定比例联合使用多种功能性药物制备为个性化补片,从而达到减轻术后疼痛、降低感染风险、提高疗效、加快组织愈合等效果。
附图说明
图1实施例1扫描电子显微镜图;其中a图的放大倍数为50000倍,b图的放大倍数为100000倍;
图2实施例1抗菌剂体外释放曲线。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
制备猪小肠粘膜下层脱细胞基质(sis)和sis流体化组合物,后者添加10mm抗菌剂,为载药介质。sis以交错拼接的方式制备为面积为10×10cm2的片层,载药介质上下表面各覆盖2层sis片层,层间借助真空层压、-200mmhg压力压合为一体。扫描电子显微镜图可以观察到材料内部超微结构,抗菌剂已与sis胶原纤维结合。
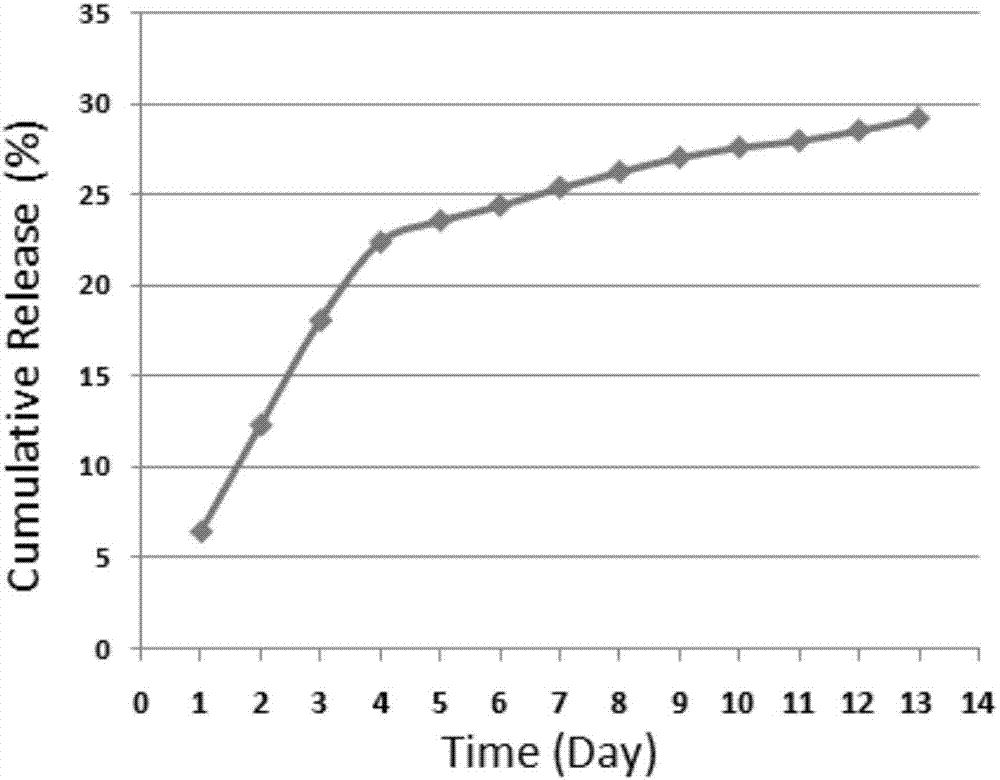
体外释放:将复合组织修复材料裁剪至1cm×1cm置于琼脂糖培养皿中,培养1-24天,提取琼脂糖、鉴定释放药物的浓度,结果表明复合组织修复材料可维持至少14天的稳定释放,释放量约为药物总含量的30%(图1)。
细胞毒性:将裁剪至1cm×1cm的复合组织修复材料固定至培养皿底部,其上加入1×105/mlnih3t3模式细胞,37℃、5%co2培养72h。mtt法测定细胞存活率为92.6%。材料的细胞毒性为0级。
血液相容性:接触组大鼠背部脱毛,涂抹浓度为50μg/ml的酶解产物,每天涂抹1次,连续涂抹20d;经口摄入组7d内隔天口服1ml浸提液,共摄入4次;肌肉注射组和静脉注射组7d内隔天注射浓度为0.15ml浸提液,各注射4次。分别于染毒第30天和90天两批处死动物,取静脉血用于测试。溶血率按下列公式计算:溶血率(%)=(样品吸光度-阴性吸光度)/(阳性吸光度-阴性吸光度)×100%。修复材料溶血率≤5%。
动物模型:构建腹壁缺损伴重度细菌感染犬模型,以修复材料修复。术后1、3、7、14、30天观察动物未发生重度腹腔感染,分泌物细菌数量受到抑制。
- 还没有人留言评论。精彩留言会获得点赞!