一种载布洛芬缓释纳米微球及其制备方法和应用与流程
本发明属于医药技术领域,尤其涉及一种载布洛芬缓释纳米微球及其制备方法和应用。
背景技术:
内脏痛是临床上常见的症状,常由机械性牵拉、痉挛、缺血和炎症等刺激所致。内脏痛的主要特点为定位不准确,腹痛病人一般不能说出疼痛发生的具体位置,主要原因是由于内脏的痛觉感受器分布要比躯体的稀疏得多,同时内脏感觉的传入途径也比较分散。内脏痛另外一个特点是常常伴有牵涉痛,即内脏器官的炎症疼痛常常有体表某一区域的疼痛。此外,内脏痛常引起不愉快的情绪活动,并伴有恶心、呕吐以及呼吸活动等改变。目前,内脏痛的具体发病机制仍然不清,临床上也没有有效的治疗手段。
目前,临床上常用布洛芬、阿司匹林、保泰松、罗非昔布、塞来昔布等止痛药来缓解内脏痛,其中,由于布洛芬的镇痛效果远比阿斯匹林、保泰松和扑热息强,而倍受消费者青睐。但布洛芬的半衰期比较短,镇痛效果不持久。
技术实现要素:
有鉴于此,本发明的目的在于提供一种载布洛芬缓释纳米微球及其制备方法和应用,本发明提供的载布洛芬缓释纳米微球具有良好的缓释效果。
本发明提供了一种载布洛芬缓释纳米微球,包括载体和负载在载体上的布洛芬;
所述载体为聚乳酸-羟基乙酸共聚物。
优选的,所述聚乳酸-羟基乙酸共聚物的重均分子量为40000~75000。
优选的,所述乳酸-羟基乙酸共聚物中具有乳酸结构的重复单元与具有羟基乙酸结构的重复单元的摩尔比为(50~80):(50~20)。
优选的,所述布洛芬在缓释纳米微球中的含量为5~20wt%。
优选的,所述缓释纳米微球的粒径为50~200nm。
本发明提供了一种上述技术方案所述载布洛芬缓释纳米微球的制备方法,包括以下步骤:
a)、将布洛芬、载体和有机溶剂混合,得到混合溶液;
b)、将所述混合溶液、乳化剂和水混合,得到乳状液;
c)、所述乳状液除去有机溶剂,得到载布洛芬缓释纳米微球。
优选的,所述有机溶剂包括二氯甲烷和/或氯仿;所述乳化剂包括聚乙烯醇和/或聚乙二醇。
本发明提供了一种治疗内脏痛的载布洛芬缓释制剂,包括上述技术方案所述的缓释纳米微球和药学上可接受的辅料。
优选的,所述缓释制剂为足底注射剂。
上述技术方案所述的载布洛芬缓释纳米微球在制备足底注射治疗内脏痛药物中的应用。
与现有技术相比,本发明提供了一种载布洛芬缓释纳米微球及其制备方法和应用。本发明提供的载布洛芬缓释纳米微球包括载体和负载在载体上的布洛芬;所述载体为聚乳酸-羟基乙酸共聚物。本发明提供的载布洛芬缓释纳米微球以聚乳酸-羟基乙酸共聚物作为载体,具有良好的缓释效果。本发明还提供了一种治疗内脏痛的载布洛芬缓释制剂,所述缓释制剂包括上述缓释纳米微球和药学上可接受的辅料。本发明提供的缓释制剂在治疗内脏痛时具有持久的阵痛效果。在本发明提供的优选技术方案中,所述缓释制剂为足底注射剂,本发明通过足底注射来治疗内脏痛可以避免口服布洛芬制剂带来的相关副作用。实验结果表明,本发明提供的载布洛芬缓释纳米微球可以明显缓解大鼠的内脏痛,并可以持续缓解疼痛达到3小时。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
图1是本发明实施例1提供的纳米微球粒径分布图;
图2是本发明实施例2提供的纳米微球粒径分布图;
图3是本发明实施例3提供的纳米微球粒径分布图;
图4是本发明实施例4提供的载布洛芬药物纳米微球的体外释放曲线图;
图5是本发明实施例5提供的载布洛芬药物纳米微球的体外释放曲线图;
图6是本发明实施例6提供的载布洛芬药物纳米微球的体外释放曲线图;
图7是本发明实施例7提供的背根神经节中荧光的分布图;
图8是本发明实施例8提供的足底注射不同剂量的载布洛芬纳米微球的生理盐水注射剂缓解大鼠内脏痛的效果图;
图9是本发明实施例8提供的足底注射载布洛芬纳米微球的生理盐水注射剂缓解大鼠内脏痛的时程效果图。
具体实施方式
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供了一种载布洛芬缓释纳米微球,包括载体和负载在载体上的布洛芬;
所述载体为聚乳酸-羟基乙酸共聚物。
本发明提供的载布洛芬缓释纳米微球包括载体和负载在载体上的布洛芬。其中,所述布洛芬又称为2-(-4-异丁基苯基)丙酸,CAS号为15687-27-1。
在本发明中,所述载体为聚乳酸-羟基乙酸共聚物(简称:PLGA),该共聚物为无规共聚物,由乳酸单体和羟基乙酸单体共聚而成,共聚物中包括无规排列的具有乳酸结构的重复单元和具有羟基乙酸结构的重复单元。在本发明提供的一个实施例中,所述聚乳酸-羟基乙酸共聚物的重均分子量(Mw)为40000~75000,具体可为45000、50000、55000、60000、65000或70000。在本发明提供的一个实施例中,所述乳酸-羟基乙酸共聚物中具有乳酸结构的重复单元与具有羟基乙酸结构的重复单元的摩尔比为(50~80):(50~20),优选为(65~70):(35~30)。
在本发明提供的一个实施例中,所述布洛芬在载布洛芬缓释纳米微球中的含量为5~20wt%,具体可为6wt%、7wt%、8wt%、9wt%、10wt%、11wt%、12wt%、13wt%、14wt%、15wt%、16wt%、17wt%、18wt%或19wt%。在本发明提供的一个实施例中,所述布洛芬在载布洛芬缓释纳米微球的粒径为50~200nm,具体可为90~130nm。
本发明提供的载布洛芬缓释纳米微球以聚乳酸-羟基乙酸共聚物作为载体,具有良好的缓释效果。实验结果表明,本发明提供的载布洛芬缓释纳米微球可以明显缓解大鼠的内脏痛,并可以持续缓解疼痛达到3小时。
本发明提供了一种上述技术方案所述载布洛芬缓释纳米微球的制备方法,包括以下步骤:
a)、将布洛芬、载体和有机溶剂混合,得到混合溶液;
b)、将所述混合溶液、乳化剂和水混合,得到乳状液;
c)、所述乳状液除去有机溶剂,得到载布洛芬缓释纳米微球。
在本发明提供的制备方法中,首先将布洛芬、载体和有机溶剂混合。其中,所述有机溶剂包括但不限于二氯甲烷和/或氯仿。在本发明中,所述布洛芬与载体的质量比优选为1:(5~20),更优选为1:(5~10),具体可选择为1:8;所述载体和有机溶剂的质量体积比优选为(50~100)mg:(1~10)mL。在本发明中,所述布洛芬、载体和有机溶剂混合的温度优选为室温;本发明对混合的时间没有特别限定,可是布洛芬和载体完全溶解在有机溶剂中即可;本发明对混合所用的设备没有特别限定,优选本领域技术人员熟知的摇床。混合完毕后,得到混合溶液。
得到混合溶液后,将所述混合溶液、乳化剂和水混合。其中,所述乳化剂包括但不限于聚乙烯醇(简称:PVA)和/或聚乙二醇。在本发明中所述聚乙烯醇的重均分子量优选为9000~2000000,聚乙二醇的重均分子量优选为5000~2000000。在本发明中,所述乳化剂与所述混合溶液中载体的质量比优选为(500~1000):(50~100),具体可选择为600:100、700:100、710:100、800:100或900:100;所述水与所述混合溶液中载体的体积质量比优选为(30~100)mL:(50~100)mg,具体可选择为40mL:100mg、50mL:100mg、53mL:100mg、60mL:100mg、70mL:100mg、80mL:100mg或90mL:100mg。在本发明中,所述混合溶液、乳化剂和水的混合优选在超声条件下进行;所述超声的功率优选为200~500W,具体可为300W或400W;所述超声的时间优选为1~10min,具体可为3min、4min、5min、6min、7min或8min。
在本发明提供的一个实施例中,所述混合溶液、乳化剂和水优选按照以下方式进行混合:先将乳化剂和水混合,得到乳化液;再将所述乳化液与所述混合溶液混合。其中,所述乳化液优选包括第一乳化液和第二乳化液;所述第一乳化液中乳化剂与水的质量体积比优选为(0.1~0.5)g:(1~10)mL,具体可为0.21g:3mL;所述第二乳化液中乳化剂与水的质量体积比优选为(0.1~1)g:(10~100)mL,具体可为0.5g:50mL。在本发明提供的一个包括第一乳化液和第二乳化液的实施例中,先将所述第二乳化液与混合溶液在超声条件下混合,之后再将混合物与第一乳化液在超声条件下混合。其中,第一次混合的时间优选为0.5~2min,具体可选择为1min;第二次混合的时间优选为2~5min,具体可选择为3min。
所述混合溶液、乳化剂和水混合完毕后,得到乳状液。得到乳状液后,将所述乳状液中的有机溶剂除去。在本发明中,除有机溶剂的方式优选为对所述乳状液进行搅拌,从而使乳状液中的有机溶剂挥发。乳状液中的有机溶剂除净后,得到载布洛芬缓释纳米微球。在本发明中,优选对得到的载布洛芬缓释纳米微球进行水洗,从而提高缓释纳米微球的纯净度。
本发明提供的方法能够制得粒径均一、分散性好的载布洛芬缓释纳米微球,该缓释纳米微球具有良好的缓释效果。实验结果表明,本发明提供的载布洛芬缓释纳米微球可以明显缓解大鼠的内脏痛,并可以持续缓解疼痛达到3小时。
本发明提供了一种治疗内脏痛的载布洛芬缓释制剂,包括上述技术方案所述的缓释纳米微球和药学上可接受的辅料。
本发明提供的缓释制剂包括所述缓释纳米微球和药学上可接受的辅料。在本发明提供的一个实施例中,所述缓释制剂为足底注射剂,所述足底注射剂包括所述缓释纳米微球和溶剂。在本发明提供的足底注射剂中,所述溶剂包括但不限于生理盐水或可用于生物体注射的缓冲液,所述缓冲液可选择磷酸盐缓冲液;所述缓释纳米微球在足底注射剂中的浓度优选为1~100mg/mL,具体可选择为1mg/mL、2mg/mL、3mg/mL、4mg/mL、5mg/mL、6mg/mL、7mg/mL、8mg/mL、9mg/mL、10mg/mL、11mg/mL、12mg/mL、13mg/mL、14mg/mL、15mg/mL、20mg/mL、25mg/mL、30mg/mL、35mg/mL、40mg/mL、45mg/mL、50mg/mL、55mg/mL、60mg/mL、65mg/mL、70mg/mL、75mg/mL、80mg/mL、85mg/mL、90mg/mL或95mg/mL。
本发明提供的缓释制剂在治疗内脏痛时具有持久的阵痛效果。在本发明提供的优选技术方案中,所述缓释制剂为足底注射剂,本发明通过足底注射来治疗内脏痛可以避免口服布洛芬制剂带来的相关副作用。实验结果表明,本发明提供的载布洛芬缓释制剂可以明显缓解大鼠的内脏痛,并可以持续缓解疼痛达到3小时。
本发明提供的上述技术方案具有如下优势之一:
1)、本发明使用PLGA为制备纳米粒子载体,PLGA是一种可降解的功能高分子有机化合物,无毒、具有良好的生物相容性、良好的成囊和成膜的性能,被广泛应用于制药、医用工程材料和现代化工业领域。在美国PLGA通过FDA认证,被正式作为药用辅料收录进美国药典。
2)、本发明载布洛芬药物纳米微球以PLGA作为载体,可以将药物布洛芬以缓释的方式释放。PLGA作为载体,能够有效延长药物布洛芬的半衰期。我们的研究显示载布洛芬药物纳米微球可以明显缓解大鼠的内脏痛,并可以持续缓解疼痛达到3小时;
3)、本发明载布洛芬药物纳米微球可避免药物布洛芬本身的高剂量,毒性导致的副作用;
4)、本发明载布洛芬药物纳米微球具有很好的生物相容性,无毒性,生物化学性质稳定;
5)、本发明制备方法制得的纳米粒子粒径较均一,分散性好。
6)、本发明独特的给药途径—足底注射药物,其方法简单,易操作;
7)、本发明通过将载布洛芬药物纳米微球作为止痛药剂注射足底来治疗内脏痛,可避免长期口服布洛芬带来的肾功能衰竭,消化不良等副作用。
为更清楚起见,下面通过以下实施例进行详细说明。
实施例1
载布洛芬缓释纳米微球的制备
步骤1)
称取100mg PLGA(lactide:glycolide=65:35(n:n),Mw=40000~75000)和15mg布洛芬,然后分别加入到1mL的二氯甲烷中,室温于摇床上溶解混合,得到含PLGA和布洛芬的混合溶液;称取0.5g,0.21gPVA(Mw=9000~2000000)分别加到50mL和3mL的双蒸水中,制备1g/100mL和7g/100mL的PVA水溶液。
步骤2)
将步骤1)制取的PLGA和布洛芬的混合溶液与7g/100mL的PVA水溶液混合并用超声破碎仪超声1分钟(功率300W)产生乳状液,然后将乳状液加入步骤1)制取的1g/100mL的PVA水溶液中继续超声3分钟(功率300W),然后在搅拌器上持续搅拌24小时充分去除二氯甲烷,最后用双蒸水洗涤两次(13000rpm离心),最后重悬到2mL双蒸水中,得到负载布洛芬的纳米微球。
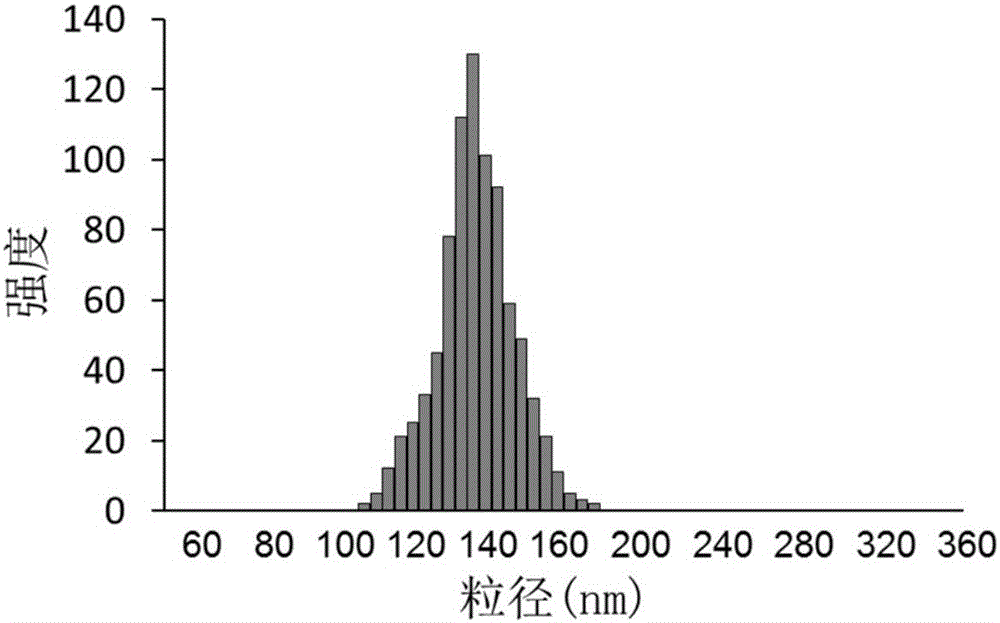
通过动态光散射测定上述纳米微球的粒径分布,结果如图1所示,图1是本发明实施例1提供的纳米微球粒径分布图,通过图1可以看出,纳米微球的粒径分布在92~185nm。
通过高效液相色谱测定上述纳米微球的载药量,结果为11wt%。
实施例2
载布洛芬缓释纳米微球的制备
步骤1)
称取100mg PLGA(lactide:glycolide=65:35(n:n),Mw=40000~75000)和10mg布洛芬,然后分别加入到1mL的二氯甲烷中,室温于摇床上溶解混合,得到含PLGA和布洛芬的混合溶液;称取0.5g,0.21g PVA(Mw=9000~2000000)分别加到50mL和3mL的双蒸水中,制备1g/100mL和7g/100mL的PVA水溶液。
步骤2)
将步骤1)制取的PLGA和布洛芬的混合溶液与7g/100mL的PVA水溶液混合并用超声破碎仪超声1分钟(功率300W)产生乳状液,然后将乳状液加入步骤1)制取的1g/100mL的PVA水溶液中继续超声3分钟(功率300W),然后在搅拌器上持续搅拌24小时充分去除二氯甲烷,最后用双蒸水洗涤两次(13000rpm离心),最后重悬到2mL双蒸水中,得到负载布洛芬的纳米微球。
通过动态光散射测定上述纳米微球的粒径分布,结果如图2所示,图2是本发明实施例2提供的纳米微球粒径分布图,通过图2可以看出,纳米微球的粒径分布在85~180nm。
通过高效液相色谱测定上述纳米微球的载药量,结果为8wt%。
实施例3
载布洛芬缓释纳米微球的制备
步骤1)
称取100mg PLGA(lactide:glycolide=65:35(n:n),Mw=40000~75000)和20mg布洛芬,然后分别加入到1mL的二氯甲烷中,室温于摇床上溶解混合,得到含PLGA和布洛芬的混合溶液;称取0.5g,0.21gPVA(Mw=9000~2000000)分别加到50mL和3mL的双蒸水中,制备1g/100mL和7g/100mL的PVA水溶液。
步骤2)
将步骤1)制取的PLGA和布洛芬的混合溶液与7g/100mL的PVA水溶液混合并用超声破碎仪超声1分钟(功率300W)产生乳状液,然后将乳状液加入步骤1)制取的1g/100mL的PVA水溶液中继续超声3分钟(功率300W),然后在搅拌器上持续搅拌24小时充分去除二氯甲烷,最后用双蒸水洗涤两次(13000rpm离心),最后重悬到2mL双蒸水中,得到负载布洛芬的纳米微球。
通过动态光散射测定上述纳米微球的粒径分布,结果如图3所示,图3是本发明实施例3提供的纳米微球粒径分布图,通过图3可以看出,纳米微球的粒径分布在90~185nm。
通过高效液相色谱测定上述纳米微球的载药量,结果为13wt%。
实施例4
缓释纳米微球的体外释放曲线的检测试验
在37℃下,分别将100mg实施例1制备的载布洛芬缓释纳米微球和10mg布洛芬加入到10mL的磷酸盐缓冲液中(0.01M,PH=7.4)透析,每隔2小时进行取样,利用高效液相色谱(HPLC,C-18柱,流动相为甲醇:乙腈:磷酸二氢钠溶液(0.02mol/L)=50:25:25,流动相用磷酸调节pH值至3.0±0.05,检测波长为263nm,流速为1.0mL/min)测定布洛芬的浓度,并绘制布洛芬释放曲线,如图4所示,图4是本发明实施例4提供的载布洛芬药物纳米微球的体外释放曲线图。通过图4可以看出,相比于布洛芬,实施例1提供的载布洛芬纳米微球具有良好的缓释效果。
实施例5
缓释纳米微球的体外释放曲线的检测试验
在37℃下,分别将100mg实施例2制备的载布洛芬缓释纳米微球和10mg布洛芬加入到10mL的磷酸盐缓冲液中(0.01M,PH=7.4)透析,每隔2小时进行取样,利用高效液相色谱(HPLC,C-18柱,流动相为甲醇:乙腈:磷酸二氢钠溶液(0.02mol/L)=50:25:25,流动相用磷酸调节pH值至3.0±0.05,检测波长为263nm,流速为1.0mL/min)测定布洛芬的浓度,并绘制布洛芬释放曲线,如图5所示,图5是本发明实施例5提供的载布洛芬药物纳米微球的体外释放曲线图。通过图5可以看出,相比于布洛芬,实施例2提供的载布洛芬纳米微球具有良好的缓释效果。
实施例6
缓释纳米微球的体外释放曲线的检测试验
在37℃下,分别将100mg实施例3制备的载布洛芬缓释纳米微球和10mg布洛芬加入到10mL的磷酸盐缓冲液中(0.01M,PH=7.4)透析,每隔2小时进行取样,利用高效液相色谱(HPLC,C-18柱,流动相为甲醇:乙腈:磷酸二氢钠溶液(0.02mol/L)=50:25:25,流动相用磷酸调节pH值至3.0±0.05,检测波长为263nm,流速为1.0mL/min)测定布洛芬的浓度,并绘制布洛芬释放曲线,如图6所示,图6是本发明实施例6提供的载布洛芬药物纳米微球的体外释放曲线图。通过图6可以看出,相比于布洛芬,实施例3提供的载布洛芬纳米微球具有良好的缓释效果。
实施例7
双荧光示踪剂标记特异性支配足底和结肠的背根神经节(DRG)神经元
以正常的雄性大鼠(体重180g左右)作为实验对象,首先用水合氯醛(360mg/kg)将大鼠麻醉,接着在无菌条件下将10μL荧光示踪剂DiI(1,19-dioleyl-3,3,39,3-tetramethylindocarbocyanine methanesulfonate;Invitrogen,Carlsbad,CA)分5个点注射到结肠肠壁上(每个点2μL),同时将10μL的荧光金(FG)分5个点注射大鼠后足底(每个点2μL),注射完毕待大鼠苏醒后于正常条件下(室温24℃,湿度50-60%,通风良好,人工昼夜(12h/12h),自由摄食摄水)喂养一周,然后麻醉大鼠,灌流取DRGs,由于支配足底的背根神经节主要分布在腰段L2-6,而支配结肠的背根神经节主要分布在胸段T13,腰段L1和L2,所以取材主要取T13-L6DRGs。然后,行冰冻切片观察荧光在背根神经节中的分布情况。观察结果如图7所示,图7是本发明实施例7提供的背根神经节中荧光的分布图,图7中,T13、L1、L2、L6表示不同背根神经节的编号,左栏为FG荧光的分布情况,中间栏为DiI荧光的分布情况,右栏为FG荧光和DiI荧光的叠加图。通过图7可知,在T13、L1、L2、L6均存在双色荧光标记的神经元,说明同时支配足底和结肠的神经元主要分布在T13、L1、L2、L6的背根神经节中。也就是说,支配内脏的神经纤维与支配足底的神经纤维可由背根神经节中同一个神经元发出,即在背根神经节中有些神经元可以同时支配内脏和足底。所以,可通过将药物注射足底,来降低同时支配内脏和足底的神经元兴奋性,达到治疗内脏痛的目的。
实施例8
鞘内注射载布洛芬缓释纳米微球的生理盐水注射剂缓解大鼠内脏痛试验
给予出生第10天SD大鼠足底注射完全弗氏佐剂CFA,可以诱发成年大鼠的AWR(腹壁撤回反射)评分显著升高,即表现为内脏痛觉过敏,且这种作用可以从第6周持续到第12周。
选取模型成功大鼠,后爪足底注射不同剂量的载布洛芬缓释纳米微球的生理盐水注射剂,检测其缓解内脏痛敏效果。检测成年大鼠内脏痛反应主要通过腹壁撤回反射(Abdominalwithdrawalreflex,AWR)评分来测量痛阈。首先将大鼠用乙醚适度麻醉,迅速将涂有石蜡油的乳胶扩张气囊小心地插入大鼠的结直肠,插入长度约8cm。用胶带把大鼠尾巴固定在木板上,固定好后让大鼠清醒并适应30分钟,以待测试。用水银检压计分别给以不同压力充气。结直肠扩张(CRD)可引起大鼠腹部肌肉的收缩,这称为内脏收缩反应(Visceral Motor Responses,VMR)。通过CRD扩张结直肠进行腹部撤回反射AWR评分方法检测内脏痛觉的反应性,CRD:用台式血压计将气球快速加压至恒压:20、40、60、80mmHg,2min一次,一次停留20s。
用AWR评分方法检测大鼠结肠痛阈:0,没有可察觉的异常表现;1,头部轻微僵直而身体没有明显异常;2,侧腹部收缩;3,下腹壁抬离桌面;4,下腹部拱起。根据大鼠在不同压力扩张情况下的反应给予相应的分数,相同压力下分值越高说明大鼠对疼痛越敏感。
将不同计量的实施例1制备的载布洛芬缓释纳米微球加入到生理盐水中,分别获得布洛芬含量为0.14mg/0.1mL、0.4mg/0.1mL、1.2mg/0.1mL的载布洛芬缓释纳米微球的生理盐水注射剂。分别足底注射1.2mg布洛芬,以及0.1mL上述载布洛芬缓释纳米微球的生理盐水注射剂,注射后进行结直肠扩张(20、40、60、80mmHg)刺激,用AWR评分方法观察大鼠的内脏痛反应变化和时程效应。结果如图8和图9所示,图8是本发明实施例8提供的足底注射不同剂量的载布洛芬纳米微球的生理盐水注射剂缓解大鼠内脏痛的效果图,图9是本发明实施例8提供的足底注射载布洛芬纳米微球的生理盐水注射剂缓解大鼠内脏痛的时程效果图。可见,注射0.1mL布洛芬含量1.2mg/0.1mL的载布洛芬缓释纳米微球的生理盐水注射剂可以明显翻转大鼠的内脏痛,并可以持续缓解疼痛达到3小时。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!