纳米钌复合材料及其制备方法和在载药和制备抗肿瘤药物中的应用与流程
本发明属于纳米钌抗肿瘤材料技术领域,特别涉及一种纳米钌复合材料及其制备方法和在载药和制备抗肿瘤药物中的应用,实现对肿瘤部位的精确定位和精准治疗。
背景技术:
癌症是威胁人类健康的头号杀手,目前主要有化疗、放疗和手术治疗等手段,但治愈率仍然很低,且存在很多并发症和毒副作用。近年研究表明,联合光热和光动力治疗成为非常有前途的治疗方式,且光声成像为精准治疗肿瘤和指导手术提供了重要的指导。其中,纳米材料的发展为肿瘤诊断和精准生物医药提供了革命性的新平台。
光学治疗,以光热治疗(ptt)和光动力学治疗(pdt)为主要代表,是一种比传统治疗更有前途的原位肿瘤治疗的策略,是因为它们都是在特定光激活下实现非介入性和定位治疗效果。ptt是一种新发展得肿瘤治疗途径,是在特定激发波长下利用光热转换试剂产生过高热(大于42℃)来杀死肿瘤细胞的。pdt是一种临床已经使用的技术,利用光敏剂在光激活下产生高毒性的活性氧(ros)来杀死肿瘤细胞。光声成像是一种新型的、非介入性的生物成像模态,基于组织对光学吸收效率具有深穿透作用和高空间分辨率的特点,这让其在体内预临床研究中愈有分量。而且,光声成像技术能够提供三维空间信息和直接测量肿瘤体积,这是目前其他生物成像(包括核磁、超声、ct)所无法相比的优势。纳米载药体系可以将多种功能结合在一个简单的诊断治疗平台上,在实现多模成像的同时具有治疗功能,能够实现高效、低毒、方便的肿瘤治疗。快速发展及其具有靶向给药、成像诊断、高效抗肿瘤等联合治疗的潜能,可以极大地提高治疗效率,使正常组织受损最小化的功能为实现高效诊断治疗肿瘤带来了新希望。在治疗肿瘤的过程中,所制备的纳米药物可以在肿瘤部位累积,实现准确的肿瘤定位和高效的联合ptt/pdt治疗。至今未发现有关功能化纳米钌负载钌配合物用于肿瘤诊断治疗功能的报道。
纳米钌材料多用于化学催化方面,现在还很少有研究者将纳米钌材料应用于生物方面。其具有很好的生物相容性和光热转换效率,并且具有表面易修饰性。
技术实现要素:
为了克服上述现有技术的缺点与不足,本发明的首要目的在于提供一种纳米钌复合材料。本发明复合材料不仅可精准识别肿瘤部位,还能实时监控药物分布,其结构外层的温敏性大分子聚(n-异丙基丙烯酰胺)(pnipam)更能实现控制释放,是一个新兴的诊断治疗平台,可以用于载药和制备抗肿瘤药物。
本发明另一目的在于提供一种上述纳米钌复合材料的制备方法。
本发明再一目的在于提供上述纳米钌复合材料在载药和制备抗肿瘤药物中的应用,实现对肿瘤部位的精确定位和精准治疗。
本发明的目的通过下述方案实现:
一种纳米钌复合材料的制备方法,先通过多元醇还原法和模板法合成钌纳米粒子(prunps);在其表面上修饰聚(n-异丙基丙烯酰胺)外壳(pru-pnipam);再负载多吡啶钌配合物,得到纳米钌复合材料(pru-pnipam@rbt)。
本发明先通过多元醇还原法和模板法合成钌纳米粒子(prunps),其呈绒球状(称为绒球状钌纳米粒子:prunps),具有相通的内部孔径,能够提高药物负载效率。
本发明纳米钌复合材料在激光照射下,外壳聚(n-异丙基丙烯酰胺)发生相变,从而释放出里面负载的多吡啶钌配合物,实现控制释放。
进一步地,所述通过多元醇还原法和模板法合成钌纳米粒子(prunps)具体包括以下步骤:mg/ml,将15~20质量份的三氯化钌(rucl3)和40~50质量份的聚乙烯吡咯烷酮(pvp)溶于10~14体积份的三羧酸聚乙二醇(teg)中,170~180℃加热40~80分钟,加入6~7.2质量份的十六烷基三甲基溴化铵(ctab)保温反应140~220分钟,洗涤,烘干,得到钌纳米粒子(prunps)。
更进一步地,所述通过多元醇还原法和模板法合成钌纳米粒子(prunps)具体包括以下步骤:mg/ml,将15质量份的三氯化钌(rucl3)和45质量份的聚乙烯吡咯烷酮(pvp)溶于10体积份的三羧酸聚乙二醇(teg)中,180℃加热60分钟,加入7.2质量份的十六烷基三甲基溴化铵(ctab)保温反应180分钟,洗涤,烘干,得到钌纳米粒子(prunps)。
进一步地,所述修饰聚(n-异丙基丙烯酰胺)外壳具体包括以下步骤:
将钌纳米粒子(prunps)与巯基修饰的聚乙二醇混合,搅拌反应,离心、洗涤后,水重悬,再加入n-异丙基丙烯酰胺单体、n,n’-亚甲基双丙烯酰胺、稳定剂和引发剂,加热反应,得到修饰聚(n-异丙基丙烯酰胺)外壳的钌纳米粒子(pru-pnipam)。
所用钌纳米粒子、巯基修饰的聚乙二醇、n-异丙基丙烯酰胺单体、n,n’-亚甲基双丙烯酰胺的摩尔比为1:(0.02~0.04):(8000~10000):(600~700)。
所述巯基修饰的聚乙二醇分子量可为2000~5000,优选为peg2000-sh。,
所述搅拌反应优选为室温下搅拌反应24~48h,更优选为24h。
所述n-异丙基丙烯酰胺单体、n,n’-亚甲基双丙烯酰胺可先配成溶液再加入体系中反应。
所述稳定剂可为十二烷基硫酸钠(sds)、n,n,n’,n’-四甲基乙二胺(tmeda)等,优选为十二烷基硫酸钠(sds)。所述稳定剂的用量为常规用量即可,优选为与钌纳米粒子的摩尔比为400:1~600:1。
所述的引发剂可为过硫酸钾(kps)、过硫酸铵(aps)等,优选为过硫酸钾(kps)。所述引发剂的用量为常规用量即可,优选为与钌纳米粒子的摩尔比为400:1~600:1。
所述加热反应优选为在65~75℃下加热3.5~4.5小时,更优选为在70℃下加热4小时。
所述加热反应优选在氮气氛围下进行。
进一步地,所述负载多吡啶钌配合物具体包括以下步骤:将多吡啶钌配合物与修饰聚(n-异丙基丙烯酰胺)外壳的钌纳米粒子于溶液体系中混合,搅拌反应,离心、洗涤、干燥后,得到纳米钌复合材料(pru-pnipam@rbt)。
所用多吡啶钌配合物与修饰聚(n-异丙基丙烯酰胺)外壳的钌纳米粒子的质量比为8:1~10:1。
所述搅拌反应优选为室温下搅拌10~24h,更优选为10h。
所述离心可通过高速离心机实现;所述洗涤可利用蒸馏水反复洗涤多次;所述干燥可通过冷冻干燥得到干燥后产物。
所述多吡啶钌配合物优选为[ru(bpy)2(tip)]2+(缩写为:rbt),结构式如下:
本发明方法首先制备得到新型绒球状纳米钌。绒球状纳米钌不仅具有生物相容性高、光热转换效率高,还有较高的药物负载能力,是一种理想的药物载体。再用温敏性大分子作为控制释放的开关,由于激光容易被操控,控制释放的准确度更高。相对于本领域现有技术中将其结合到光热材料中从而通过材料发热释放药物,其控制准确性低,容易提前释放,降低治疗效果。
本发明的纳米钌复合材料(pru-pnipam@rbt)不仅可精准识别肿瘤部位边缘,从而控制治疗面积,指导高效的联合光热治疗和光动力学治疗,还能实时监控药物分布,其结构外层的温敏性大分子聚(n-异丙基丙烯酰胺)(pnipam)更能实现控制释放,是一个新兴的诊断治疗平台,可以用于载药和制备抗肿瘤药物。
本发明相对于现有技术,具有如下的优点及有益效果:
(1)本发明的纳米钌复合材料(pru-pnipam@rbt)将多吡啶钌配合物完全包裹在温敏性大分子内部,不会泄露,在激光照射下,外壳聚(n-异丙基丙烯酰胺)发生相变,从而释放出里面负载的多吡啶钌配合物,实现控制准确释放。
(2)本发明的纳米钌复合材料(pru-pnipam@rbt)可精准识别肿瘤部位边缘,从而控制治疗面积,指导高效的联合光热治疗和光动力学治疗,将治疗区域与肿瘤体积相结合,达到光治疗只会杀伤肿瘤细胞而不损害周围的正常组织的效果。
附图说明
图1是多吡啶钌配合物[ru(bpy)2(tip)]2+结构式。
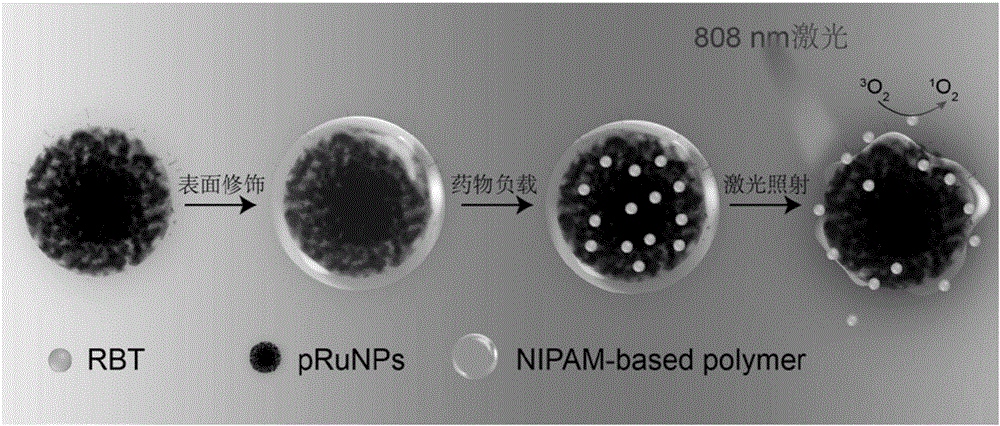
图2是本发明纳米材料pru-pnipam@rbt的合成流程图及药物释放机制。
图3是绒球状钌纳米粒子(prunps)的透射电镜图(左)和元素组成分析(右)。
图4是绒球状钌纳米粒子外面包裹上温敏性大分子(pru-pnipam)的透射电镜图(a)和扫描电镜图(b)。
图5是不同组分对4种不同细胞的细胞毒性图。
图6是本发明纳米材料pru-pnipam@rbt进入细胞的途径示意图(a)和激光共聚焦图(b)、激光共聚焦共定位分析曲线图(c)。
图7是近红外激光引起的药物释放共聚焦图片。
图8是小鼠的荧光成像图。
图9是小鼠的2d光声成像(a)和3d成像(b图)。
图10是小鼠激光照射后温度变化图(a)、温度定量图(b)和有效治疗面积图(c)。
图11是小鼠的治疗效果实体图(a)和剥离出来的肿瘤大小(b)。
具体实施方式
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。
下列实施例中涉及的物料均可从商业渠道获得。
其中,多吡啶钌配合物为[ru(bpy)2(tip)]2+(缩写为:rbt),其结构式见图1,参照文献(wangc,yuq,yangl,etal.ruthenium(ii)polypyridylcomplexesstabilizethebcl-2promoterquadruplexandinduceapoptosisofhelatumorcells[j].biometals,2013,26(3):387-402.)制备得到。
本发明纳米材料pru-pnipam@rbt的合成流程图及药物释放机制见图2。
实施例1:纳米钌复合材料pru-pnipam@rbt
(1)prunps的合成:将15mg的三氯化钌(rucl3)和45mg的聚乙烯吡咯烷酮(pvp)溶于10ml的三羧酸聚乙二醇(teg)中,油浴180℃加热1小时。然后加入7.2mg的十六烷基三甲基溴化铵(ctab)继续加热3小时。用蒸馏水和乙醇洗涤几次,在60℃烘干箱里获得粉末。纳米形貌和元素组成见图3。
(2)pru-pnipam的合成:将200μl的0.2mm巯基修饰的的聚乙二醇(peg2000-sh)和8ml的1nmprunps混合,在室温下低速搅拌24小时。离心洗涤将未反应完的底物除去,用5ml蒸馏水重悬。取其中1ml溶液到烧瓶中,然后再加入1ml的80mmn-异丙基丙烯酰胺单体(nipam)水溶液、0.2ml的25mmn,n’-亚甲基双丙烯酰胺(mba)水溶液、0.04ml的100mm十二烷基硫酸钠(sds)溶液、0.4ml的10mm过硫酸钾(kps)溶液,通氮气30分钟以除去瓶内的氧气,最后在70℃下加热4小时。纳米形貌见图4。
(3)pru-pnipam@rbt的合成:将1ml1.5mg/mlrbt溶液与2ml2.2mg/mlpru-pnipam混合,在常温下低速搅拌24小时。高速离心机(12000rpm/min)离心10分钟,用蒸馏水反复洗涤3次,最后冷冻干燥得到粉末样品。
实施例2:纳米钌复合材料pru-pnipam@rbt
(1)prunps的合成:将20mg的三氯化钌(rucl3)和40mg的聚乙烯吡咯烷酮(pvp)溶于10ml的三羧酸聚乙二醇(teg)中,油浴170℃加热80分钟。然后加入6mg的十六烷基三甲基溴化铵(ctab)继续加热140分钟。用蒸馏水和乙醇洗涤几次,在60℃烘干箱里获得粉末。
(2)pru-pnipam的合成:将150μl的0.2mm巯基修饰的的聚乙二醇(peg2000-sh)和8ml的1nmprunps混合,在室温下低速搅拌24小时。离心洗涤将未反应完的底物除去,用5ml蒸馏水重悬。取其中1ml溶液到烧瓶中,然后再加入0.8ml的80mmn-异丙基丙烯酰胺单体(nipam)水溶液、0.16ml的25mmn,n’-亚甲基双丙烯酰胺(mba)水溶液、0.032ml的100mm十二烷基硫酸钠(sds)溶液、0.32ml的10mm过硫酸钾(kps)溶液,通氮气30分钟以除去瓶内的氧气,最后在75℃下加热3.5小时。纳米形貌见图4。
(3)pru-pnipam@rbt的合成:将0.9ml1.5mg/mlrbt溶液与2ml2.2mg/mlpru-pnipam混合,在常温下低速搅拌10小时。高速离心机(12000rpm/min)离心10分钟,用蒸馏水反复洗涤3次,最后冷冻干燥得到粉末样品。
实施例3:纳米钌复合材料pru-pnipam@rbt
(1)prunps的合成:将17.5mg的三氯化钌(rucl3)和50mg的聚乙烯吡咯烷酮(pvp)溶于10ml的三羧酸聚乙二醇(teg)中,油浴175℃加热40分钟。然后加入6.6mg的十六烷基三甲基溴化铵(ctab)继续加热220分钟。用蒸馏水和乙醇洗涤几次,在60℃烘干箱里获得粉末。
(2)pru-pnipam的合成:将250μl的0.2mm巯基修饰的的聚乙二醇(peg2000-sh)和8ml的1nmprunps混合,在室温下低速搅拌24小时。离心洗涤将未反应完的底物除去,用5ml蒸馏水重悬。取其中1ml溶液到烧瓶中,然后再加入1.2ml的80mmn-异丙基丙烯酰胺单体(nipam)水溶液、0.24ml的25mmn,n’-亚甲基双丙烯酰胺(mba)水溶液、0.048ml的100mm十二烷基硫酸钠(sds)溶液、0.48ml的10mm过硫酸钾(kps)溶液,通氮气30分钟以除去瓶内的氧气,最后在65℃下加热4.5小时。纳米形貌见图4。
(3)pru-pnipam@rbt的合成:将0.8ml1.5mg/mlrbt溶液与2ml2.2mg/mlpru-pnipam混合,在常温下低速搅拌18小时。高速离心机(12000rpm/min)离心10分钟,用蒸馏水反复洗涤3次,最后冷冻干燥得到粉末样品。
实施例4:pru-pnipam@rbt的体外生物实验
本实验选择多种购自美国模式菌种收集中心(atcc)的细胞,包括小鼠胚胎成纤维细胞系nih/3t3,海拉细胞系hela,人乳腺癌细胞系mcf-7和人肝癌细胞系hepg2。
(1)细胞毒性试验
将nih/3t3细胞在96孔板中(密度为4×103/孔)培养24小时,然后再加入pru-pnipam@rbt孵育24小时。将培养基除去,加入100μl浓度为0.5mg/ml的3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(mtt)孵育4小时,将其除去后每孔再加入100μl的二甲基亚砜(dmso),最后在酶标仪580nm波长下检测。
同样的方法将hela,mcf-7和hepg2三种细胞在96孔板中培养,加入pru-pnipam@rbt孵育4小时。用功率从0.5到2w/cm2的808nm近红外激光照射7分钟。加入100μl浓度为0.5mg/ml的mtt孵育4小时,将其除去后每孔再加入100μl的二甲基亚砜(dmso),最后在酶标仪580nm波长下检测。结果见图5。
结果表明:细胞存活率是检测纳米药物生物相容性和杀伤效果的重要参数。对于正常细胞3t3细胞,即使在pru-pnipam@rbt较高的浓度100μg/ml下其细胞存活率依然很高,说明pru-pnipam@rbt的生物相容性很好。对于三种不同的肿瘤细胞hela,mcf-7和hepg2,在激光的照射下细胞存活率明显下降,并且具有激光功率依赖性,试验也发现,pru-pnipam@rbt对hepg2细胞有更明显的特性杀伤作用。
(2)进入细胞实现药物控制释放
将hepg2细胞种于共聚焦培养皿中,并分别与pru-pnipam@rbt孵育1、2、4、8小时,然后再分别与溶酶体染料lysotrackerred(500nm)共孵育10分钟,用冷的磷酸盐缓冲溶液(pbs)洗涤3次以除去残留的药物。在激光共聚焦显微镜下观察pru-pnipam@rbt进入细胞的途径,见图6。
结果表明:绿色表示pru-pnipam@rbt在细胞中的位置(绿色荧光其实是来自rbt的荧光),红色表示溶酶体的位置。可以看得出来,绿色荧光与红色荧光重叠,说明pru-pnipam@rbt是通过溶酶体途径进入细胞的,并且在4小时的时候pru-pnipam@rbt积累量最多,随后就逐渐被细胞代谢。
将hepg2细胞种于共聚焦培养皿中,并与pru-pnipam@rbt孵育4小时之后,用808nm的激光照射3分钟,再分别孵育1、2、4、6小时。用细胞核染料dapi和溶酶体染料lysotrackerred分别孵育15分钟、20分钟,再用冷的pbs洗涤3次除去剩余的染料。在激光共聚焦显微镜下观察药物释放情况,见图7。
结果表明:蓝色表示细胞核的位置。在激光照射后,绿色荧光从红色荧光中逐渐扩散,说明药物rbt从溶酶体中逃逸。在6小时的时候存在整个细胞质中,随后绿色荧光与蓝色荧光重叠,说明rbt从细胞质中进入了细胞核,并且杀死了细胞,箭头部分所指的是形态已经发生形变的细胞。
实施例5:多模生物成像
动物模型选用hepg2荷瘤小鼠
(1)荧光成像
rbt是荧光成像的造影剂,能够用来实时监控pru-pnipam@rbt在动物体内的传递情况。将25μl单独的rbt和纳米药物pru-pnipam@rbt分别瘤内注射到小鼠体内(10mg/kg),在4小时的时候用808nm照射小鼠肿瘤部位。用ivislumina成像系统(xenogen(caliperlifesciences),hopkinton,ma,usa)分别在预定的时间(1,4,8,12,24小时)检测动物的荧光情况。结果见图8。
结果表明:单独的rbt注射到小鼠的肿瘤内后,代谢明显比较快。特别是在第4小时激光照射后代谢速度加快。相比于单独的rbt,pru-pnipam@rbt注射到小鼠肿瘤后,在肿瘤部位的滞留时间比较长,在24小时后仍然还有较强烈的荧光可以被检测到。说明pru-pnipam@rbt在小鼠体内滞留不仅能被实时检测得到,还能够延长在肿瘤部位的滞留时间,达到更高的滞留效果。
(2)光声成像
将荷瘤小鼠分为4组,分别将25μl的pbs、rbt、pru-pnipam、pru-pnipam@rbt瘤内注射到荷瘤小鼠体内(10mg/kg)。1小时后,用nexus128system(endralifesciencesinc.,annarbor,michiganusa)光声成像系统在800nm激发波下对小鼠肿瘤部位进行光声成像。其2d/3d成像见图9。
结果表明:a图是小鼠肿瘤部位的2d光声成像图,颜色越深代表光声强度越大,药物在肿瘤部位聚集的更多。从a图中可以看出pru-pnipam@rbt组的光声强度最强,说明pru-pnipam@rbt在肿瘤部位的滞留时间最长,是提高治疗效率的基础条件之一。b图是小鼠肿瘤部位的3d光声成像图,包括3个方向。可以看出pru-pnipam@rbt组也是强度最大,成像效果最清晰,对比度最好,可以清楚地看到小鼠肿瘤部位的轮廓,这为精准的光治疗提供了指导。
实施例6:在动物上的治疗效果
通过多模生物成像可知药物的递送结果跟肿瘤轮廓,这为联合ptt/pdt治疗提供了指导。将荷瘤小鼠分为4组,分别瘤内注射pbs、rbt、pru-pnipam、pru-pnipam@rbt(25μl,5mg/kg)。在一个小时之后,用808nm激光照射7分钟,随着激光的照射,肿瘤部位的温度升高,药物rbt释放出来并产生活性氧。激光照射小鼠肿瘤部位温度情况见图10。将小鼠肿瘤部位温度进行定量,计算超过43℃的区域,即有效的光治疗区域,与光声成像的肿瘤轮廓面积相比较,达到较高的吻合,以此来提高光治疗的准确性。经过15天的治疗,检查小鼠肿瘤的大小来判断治疗效果,见图11。
结果表明:图10是小鼠的光热成像,可以看出有光热材料的两个组分pru-pnipam、pru-pnipam@rbt在激光的照射下温度明显升高,在7分钟时达到55℃以上(超过43℃就有光热治疗效果)。随着温度的升高,rbt会从pru-pnipam@rbt释放出来。在激光的作用下,rbt会产生活性氧进行光动力治疗。经过15天的治疗后,从图11中可以看出来pru-pnipam@rbt+激光组的小鼠肿瘤最小,说明治疗效果最好。从组织切片也可以看得出来,pru-pnipam@rbt+激光组的小鼠肿瘤部位组织凋亡最严重。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!