用于治疗和预防过敏性疾病的复合益生菌及其制备方法以及型剂与流程
本发明涉及一种复合益生菌配方、利用复合益生菌制备的食物组合物及药物组合物,尤其涉及一种用于治疗和预防过敏性疾病的复合益生菌及其制备方法以及食物组合物和药物组合物的型剂。
背景技术:
气喘(asthma,又称哮喘)是一种气道慢性之炎症疾病,由于具有复发的症状以及多种类之异变特征,且会令患者产生喘息、咳嗽、胸腔紧迫、胸闷和呼吸困难等症状,因此困扰相当多病患,医学界一般认为气喘除了有基因上的原因,也与环境因素中的过敏原(allergen)有相当程度之攸关。
通常在哺乳类动物内的抗体内会有免疫球蛋白e(immunoglobuline,简称ige),此种免疫球蛋白e(ige)是引发过敏反应的重要原因,当前述过敏原入侵时,血清中的免疫球蛋白e会提升,所以被称为「过敏抗体」。而前述过敏原与免疫球蛋白e(ige)结合时容易刺激生理释放组织胺等发炎物质,并产生例如前述气喘等发炎反应。虽然在医药界已经有用于治疗气喘的药物包括以沙丁胺醇(salbutamol)雾化吸入器等或是抗胆碱能支气管扩张剂等,或是类固醇长期控制等。
但是化学药剂的使用上,无论医疗人员或是病患都可能会担心有其它副作用或是后遗症,后有许多专家针对生物科技不断创新而发展出以益生菌降低肠道酸碱值,从而改变过敏蛋白质的抗原性,以及降低过敏反应的程度,例如lp33菌对抗过敏而可以减缓过敏性鼻炎症状。然而现今医药界以生物科技对于气喘(asthma)之特定性预防与治疗,并未成熟性的开展。
技术实现要素:
本发明所要解决的技术问题是针对现有技术的现状提供一种用于治疗和预防过敏性疾病的复合益生菌。
本发明所要解决的另一个技术问题是针对现有技术的现状提供用于一种治疗和预防过敏性疾病的复合益生菌的制备方法。
本发明所要解决的再一个技术问题是针对现有技术的现状提供一种治疗和预防过敏性疾病的复合益生菌食物组合物或药物组合物的剂型。
本发明解决上述技术问题所采用的技术方案为:该用于治疗和预防过敏性疾病的复合益生菌包含格式乳杆菌(lactobacillusgasseri)、唾液乳杆菌(lactobacillussalivarius)、约氏乳杆菌(lactobacillusjohnsonii)、副干酪乳杆菌(lactobacillusparacasei)、罗伊氏乳杆菌(lactobacillusreuteri)、动物双歧杆菌(bifidobacteriumanimals);具体为:
该用于治疗和预防过敏性疾病的复合益生菌,其特征在于包括下述重量组成的菌株组合物:
所述菌株组合物优选包括下述重量组成:
为方便该复合益生菌组合物的还包括益生元,所述益生元的用量为所述菌株组合物重量的20~40倍。
所述益生元又称益生质或益生素,选自各种寡糖或膳食纤维;优选采用低聚果糖。
上述各方案,优选该复合益生菌的总活菌数≥1×107cfu/g。
更好地,所述总活菌数≥1×109cfu/g。
上述复合益生菌的制备方法,其特征在于包括下述步骤:
1)挑选单菌落的格式乳杆菌、唾液乳杆菌、动物双岐杆菌、约氏乳杆菌、副干酪乳杆菌、和罗伊氏乳杆菌接种至培养瓶,在30~40℃下静置20~30小时;
2)然后移至发酵槽在培养基的存在下进行发酵培养,在30~40℃、20~30小时内放大80~120倍;
3)在发酵槽内培养基的存在下继续进行放大培养,在30~40℃、20~30小时内再放大8~12倍;
4)离心分离出菌泥;
5)在-30~-50℃下冷冻3~5小时,然后在25~35℃下干燥20~30小时,得到粉状菌株组合物。
所述培养基优选为葡萄糖或酵母抽取物。
采用上述各方案中的用于治疗和预防过敏性疾病的复合益生菌制备的食物组合物或药物组合物,其特征在于还包括赋形剂,所述赋形剂为不含水的食物载体或药物载体。
所述赋形剂优选为固体饮料、糖果、锭、剂、丸、囊或油滴。
作为药物或食物供人体使用时,优选总活菌数≥1×109cfu/g。
与现有技术相比,本发明所提供的用于治疗和预防过敏性疾病的复合益生菌对过敏性疾病具有良好的保护作用,不仅能够通过降低气道高反应性,减轻肺部炎症细胞浸润,抑制肥大细胞脱颗粒及杯状细胞的增生,纠正th1/th2细胞因子失衡,增加抗炎细胞因子的水平,降低特异性抗体ige和igg的表达来减轻过敏性炎症,而且能够通过减轻气道上皮下胶原的沉积抑制哮喘小鼠气道重塑,还能够纠正过敏性疾病肠道菌群的紊乱,增加有益菌的丰度及多样性。
附图说明
图1为本发明实施例采用实施例3中复合益生菌注射液进行小鼠实验的流程示意图;
图2为小鼠实验哮喘模型建立示意图;
图3为小鼠实验中乙酰甲胆碱(mch)浓度分别为50mg/ml和100mg/ml时,与对照组的对比示意图;
图4a和图4b分别为小鼠实验中采用实施例3注射液对小鼠肺泡灌洗液(balf)中白细胞总数及白细胞分类计数的影响示意图;
图5a至图5f为本发明小鼠实验益生菌组合物对小鼠肺泡灌洗液中细胞因子的影响示意图;
图6a和图6b分别为本发明小鼠实验益生菌组合物对ova刺激的小鼠脾细胞悬液中il-4及il-13的影响示意图;
图7为本发明小鼠实验益生菌组合物对小鼠balf中小鼠肥大细胞蛋白酶-1(mmcp-1)的影响示意图
图8为本发明小鼠实验益生菌组合物对小鼠血清中ova特异性免疫球蛋白的影响示意图;
图9a为本发明小鼠实验益生菌组合物对小鼠组织病理学的影响he染色结果显微图;
图9b为本发明小鼠实验益生菌组合物对小鼠组织病理学的影响pas染色结果显微图;
图9c为本发明小鼠实验益生菌组合物对小鼠组织病理学的影响masson染色结果示意图。
具体实施方式
以下结合附图实施例对本发明作进一步详细描述。
下述各实施例中的各菌株均购自宁波绿康康复科技有限公司,型号分别为:
实施例1:
本实施例配方如下:
菌株组合物0.05克
低聚果糖1.45克
其中菌株组合物的配方(重量组成)如下:
该复合益生菌的制备方法如下:
上述复合益生菌的制备方法,其特征在于包括下述步骤:
1)挑选单菌落的格式乳杆菌、唾液乳杆菌、动物双岐杆菌、约氏乳杆菌、副干酪乳杆菌、和罗伊氏乳杆菌接种至2l培养瓶,在35℃下静置24小时;
2)然后移至发酵槽在培养基的存在下进行发酵培养,在35℃、24小时内放大培养至200l;
3)在发酵槽内培养基的存在下继续进行放大培养,在35℃下、24小时内放大至2t;
4)在10000~20000rpm下离心分离出菌泥;本实施例为16000rpm;
5)在-40℃下冷冻4小时,然后在30℃下干燥24小时,得到粉状菌株组合物。
本实施例中的培养基采用葡萄糖或酵母抽取物。
将低聚果糖按配比加入到粉状菌株组合物中,入库保存。
实施例2
本实施例配方如下:
菌株组合物0.05克
低聚果糖1.45克
其中菌株组合物的配方(重量组成)如下:
其余内容与实施例1相同。
本实施例将得到的粉状复合益生菌制备成胶囊方便服用。
实施例3
本实施例配方如下:
将粉状菌株组合物加入到橄榄油中,配制成油滴;粉状菌株组合物:橄榄油=0.01克:5毫升。
橄榄油还可以用葵花籽油替代。
对实施例3制备得到的益生菌组合物进行效果验证。
【实验动物】
本发明是经过6~8周spf级(无特定病原体(specificpathogenfree,spf)),balb/c雄性小鼠(购自第四军医大学实验动物中心之白变种实验室老鼠)随机分为3组,每组25只,分别为对照组(control)、哮喘组(ova)及益生菌组合物干预组(ova+lk)。饲养于第四军医大学基础部动物房,恒定室温21~25℃,湿度50%~65%,光照10~12h/d,用不含ova(这里没看懂)的饲料进行喂养,整个过程遵循第四军医大学实验动物中心动物保护和使用指南。
【实验方法】
采用实施例3制备的油滴,按每只小鼠每天200ul,每200ul中含有1×107cfu,滴入小鼠口中口服。
哮喘模型的建立如第二图所示:
致敏:
将哮喘组、益生菌干预组小鼠于实验的第0,14,28,42天采用200ul致敏液[20ugova+1.5mgal(oh)3]进行致敏;对照组小鼠注射仅含有1.5mgal(oh)3的生理盐水溶液,注射方法、部位及剂量同实验组。
激发:
将哮喘组及益生菌干预组小鼠于实验的第21-45天置于密闭容器中,以1%ova雾化吸入激发,每周三次,每次30min,连续雾化4周。对照组小鼠采用生理盐水在相同条件下雾化吸入激发。
小鼠眼球采血及血清分离:
(1).左手抓取小鼠,剪去取血侧胡须;
(2).中指轻压小鼠胸部心脏部位,拇指和食指捻动取血侧眼部皮肤,使眼球充血突出;
(3).用眼科镊快速夹取眼球;
(4).捻动拇指与食指的方向,使眼球血垂直流入离心管;
(5).将离心管中的血室温放置2h;
(6).待血液凝固后,5000rpm离心10min;
(7).用移液器吸取上层血清置于另一清洁离心管中,-20℃保存备用。
小鼠肺泡灌洗(bal)及白细胞分类计数:
(1).小鼠眼球取血后,将小鼠放在操作台上,固定四肢及头部;
(2).将其颈部及胸部解剖,暴露小鼠气管及双肺,用穿刺针插入气管上端;
(3).用细丝线结扎固定防止穿刺针脱出;用1ml注射器针管吸取0.8ml预冷的pbs连接穿刺针冲洗小鼠气道,观察双肺膨胀状况,心中默数15s后回抽,每次回抽量≥80%,反复灌洗3次,收集三次灌洗液于清洁的4mlep管。
(4).用移液器吸取20μl肺泡灌洗液置于1.5mlep管中,加入180μl1%hcl裂解红细胞,用毛细吸管吸取此混液涂于血细胞计数板(用前酒精浸泡过夜)上,盖上载破片;
(5).将计数板放在显微镜下观察,计数白细胞数目;
(6).余肺泡灌洗液2500rpm,4℃离心5min后取上清并分装,-20℃保存备用;
(7).用20μl枪头均匀吹打离心后的细胞沉渣,吸取10μl此沉渣滴于两张载玻片上均匀涂片,大小似1角硬币,每个样本涂6张;
(8).待涂片晾干后,瑞氏-姬姆萨染色液染色涂片进行白细胞分类;
(9).瑞氏-姬姆萨染色的具体步骤为:将a液滴于涂片1min后再滴b液(a:b=1:2),用吸球迅速吹打混匀,9min后用自来水冲洗,晾干后油镜下进行白细胞分类(嗜酸粒细胞,中性粒细胞,淋巴细胞和巨噬细胞)计数。
气道高反应性(ahr)检测:
(1).气管插管针的制备取2.5ml注射器针头在砂纸上磨去针尖即制成自制插管针。
(2).气道高反应性的测定:
a.实验第29天,每组随机取5只小鼠进行小鼠气道总阻力(rrs)测定,首先给小鼠腹腔注射戊巴比妥(90mg/kg)进行麻醉,注射方法同上;
b.待小鼠完全麻醉后将小鼠放于实验台上,用75%的酒精棉签擦拭小鼠颈部皮肤进行消毒;
c.暴露小鼠气管,分开周围组织及筋膜,用1ml注射器针头于气管中上端刺破一小孔,取上述自制穿刺针沿刺破的针孔进入适当距离,并用细丝线结扎固定穿刺针防止脱出;
d.事先启动flexivent软件系统并进行校正,将插管成功的小鼠链接于y型管,选择snapshot模式测定小鼠气道总阻力;
e.通气3min后,采用强迫震荡法,采集给予乙酰甲胆碱(mch)前小鼠呼吸系统阻力r作为基础值;
f.给小鼠雾化吸入生理盐水(0mg/mlmch)1min,记录小鼠气道阻力值,正常通气2min后雾化吸入下一个浓度的mch;给小鼠雾化吸入浓度为1.5mg/mlmch1min后,记录小鼠气道阻力值,正常通气2min后雾化吸入下一个浓度的mch;
g.依次给小鼠雾化吸入3,6,12,25,50,100mg/mlmch,记录小鼠气道阻力值。
细胞因子及ova特异性抗体检测:
检测血清及balf检测细胞因子il-4、il-5、il-10、il-13、il-17、ifn-γ水平;检测血清中ova特异性igg1和ige抗体水平(具体方法见elisa试剂盒说明书)。
小鼠肥大细胞蛋白酶1(mmcp-1)检测:
balf中mmcp-1水平。
肺组织切片以he染色法(hematoxylin-eosinstaining)、pas染色法(periodicacid-schiffstain)以及masson染色法进行染色:
小鼠眼球取血后,将小鼠固定在实验台上,剖开小鼠胸部并取出左侧肺组织,立即置于盛有10%福尔马林溶液的ep管中并做相应标记,24h之内送往基础部病理科进行进行he、pas、masson染色,评估肺部炎症程度,黏液分泌以及胶原沉积。
小鼠脾细胞悬液制备及体外刺激试验:
将小鼠脱颈处死后立即放入75%乙醇中浸泡3-5分钟后,取出小鼠固定于实验台。剪开小鼠腹部皮肤,取出小鼠脾脏(sp),将其放至对应编号的6cm培养皿中,然后用封口膜封住培养皿。将sp移至200目滤网上,滴2滴培养液(rpmi-1640),用1ml注射器芯杆尾部研磨,加入培养液冲洗,收集滤液置于已标记的15ml离心管。离心滤液,1000rpm,5分钟。离心后去除上清,留细胞沉淀并加入3mlack裂解液,震荡混匀,室温静置5分钟后。1000rpm,离心5min,去除上清。将细胞沉淀用培养液按1:100稀释后用细胞计数板进行细胞计数。将细胞个数调为5×106cells/ml,加入ova(50ug/ml)后培养。培养96h后取上清置于-80℃冰箱保存备用检测上清中il-4和il-13含量。
小鼠肺引流淋巴结中treg细胞的表达:
实验第46天取小鼠肺引流淋巴结,细胞悬液制备方法同sp(上述)。采用流式细胞术上机检测肺引流淋巴结中cd4+cd25+foxp3+的检测情况。
小鼠肺部dc的迁移和活化:
实验第45天,经鼻滴入荧光标记的ova-488,100ug(30ul)/只。第46天取小鼠肺引流淋巴结,细胞悬液制备方法同sp(上述)。采用流式细胞术上机检测肺引流淋巴结中ova-488+dc数量、mhcii及cd80/cd86表达情况。
16srrna测序检测小鼠肠道、肺部菌群改变实验第45天收集小鼠粪便,置于1.5mlep管,每只小鼠收集4粒,分装两管,每管2粒,收集好后-80℃保存。实验第46天,小鼠处死后取其右肺置于1.5ml无菌ep管中,-80℃保存。送至illumina公司采用hiseq方法检测对比不同处理组小鼠肠道及肺部菌群多样性及丰度。
【实验结果】
益生菌组合物对小鼠气道高反应性的影响:
请参阅图3所示,当乙酰甲胆碱(mch,methacholine)浓度为50mg/ml和100mg/ml,与对照组相比示意图,哮喘组小鼠气道总阻力(rrs)明显增高,口服本发明益生菌组合物后,小鼠气道总阻力明显降低。
益生菌组合物对小鼠肺泡灌洗液(balf,bronchoalveolarlavagefluid)中白细胞及其分类计数的影响:
请参阅图4所示,可与对照组相比,哮喘组小鼠balf(bronchoalveolarlavagefluid)中白细胞数目明显升高,主要表现为嗜酸粒细胞(eosinophil)及中性粒细胞(neutrophil)的升高,口服本发明益生菌组合物后小鼠白细胞数目明显降低,亦主要表现为嗜酸粒细胞(eosinophil)和中性粒细胞(neutrophil)的降低。图4a和图4b分别代表小鼠balf中的白细胞总数及其分类计数。(与对照组,*p<0.05;与哮喘组相比,#p<0.05)。
益生菌组合物对小鼠肺泡灌洗液中细胞因子的影响:
请参阅图5所示,与对照组相比,哮喘组小鼠th2型细胞因子il-4、il-5和il-13及炎性细胞因子il-17a均明显升高,th1型细胞因子inf-γ及抗炎细胞因子il-10均明显降低,口服益生菌组合物后小鼠il-4、il-13及il-17a明显降低,而il-10和inf-γ均显著升高。图a-f分别代表小鼠balf中il-4、il-5、il-10、il-13、inf-γ及il-17a的水平。(与对照组相比,*p<0.05;与哮喘组相比,#p<0.05)。
益生菌组合物对ova刺激的小鼠脾细胞悬液中il-4及il-13的影响:
请参阅图6a和图6b所示,与对照组小鼠相比,哮喘组小鼠脾细胞悬液加入ova培养后il-4及il-13明显升高,益生菌组合物低剂量组il-13升高不明显,但il-4无显著变化,其余各组小鼠il-4及il-13均无明显变化。图a和b分别代表小鼠ova刺激的小鼠脾细胞悬液中il-4及il-13的水平。(与对照组相比,*p<0.05;与哮喘组相比,#p<0.05)
益生菌组合物对小鼠balf中小鼠肥大细胞蛋白酶-1(mmcp-1)的影响:
请参阅图7所示,与对照组相比,哮喘组小鼠balf中mmcp-1明显升高,口服益生菌组合物后小鼠mmcp-1均明显降低。(与对照组相比,*p<0.05;与哮喘组相比,#p<0.05)。
益生菌组合物对小鼠血清中ova特异性免疫球蛋白的影响:
请参阅图8a和图8b所示,与对照组相比,哮喘组小鼠ova特异性免疫球蛋白ige及igg1均显著升高,口服益生菌后小鼠这两种免疫球蛋白均明显降低。(与对照组相比,*p<0.05;与哮喘组相比,#p<0.05)。
益生菌组合物对小鼠组织病理学的影响:
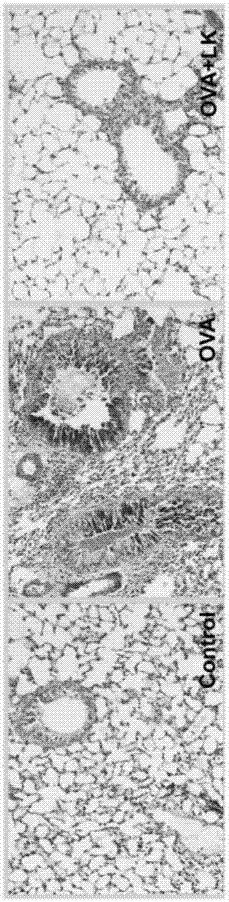
请参阅图9a:该图为he染色结果。从图中可以发现与对照组相比,哮喘组小鼠肺组织炎症细胞明显增多,可见肺泡间隔断裂,口服益生菌组合物后小鼠肺部炎症明显减轻。
请参阅图9b:
该图为pas染色结果。从图中可以发现与对照组相比,哮喘组小鼠支气管黏膜杯状细胞增生明显,口服益生菌组合物后小鼠支气管黏膜杯状细胞增生明显减少。
请参阅图9c:图9c为masson染色结果。从图中可以发现与对照组相比,哮喘组小鼠气道上皮下有大量胶原纤维沉积,口服益生菌组合物后小鼠气道上皮下胶原纤维明显减少。
益生菌组合物对小鼠肺引流淋巴结中treg细胞的表达及树突状细胞活化的影响
益生菌组合物对小鼠肺引流淋巴结中treg细胞的表达及树突状细胞活化的影响差异不显著,需要扩大样本进一步检测。
益生菌组合物对小鼠肠道和肺部菌群的影响:
目前益生菌组合物对小鼠肠道菌群的影响初步结果已确定,低剂量对小鼠肠道菌群的构成及多样性具有显著的影响。
【实验结论】
本发明所提供的益生菌组合物对过敏性哮喘具有良好的保护作用。益生菌不仅能够通过降低哮喘小鼠气道高反应性,减轻肺部炎症细胞浸润,抑制肥大细胞脱颗粒及杯状细胞的增生,纠正th1/th2细胞因子失衡,增加抗炎细胞因子的水平,降低ova特异性抗体的表达来减轻哮喘小鼠气道炎症,而且能够通过减轻气道上皮下胶原的沉积抑制哮喘小鼠气道重塑,还能够纠正哮喘小鼠肠道菌群的紊乱,增加有益菌的丰度及多样性。
- 还没有人留言评论。精彩留言会获得点赞!