miR-327抑制剂和/或FGF10促进剂在预防和/或治疗糖尿病的药物中的应用的制作方法
本发明涉及药物技术领域,特别是涉及mir-327抑制剂和/或fgf10促进剂在预防和/或治疗糖尿病的药物中的应用。
背景技术:
糖尿病是一组以高血糖为特征的代谢性疾病。高血糖则是由于胰岛素分泌缺陷或其生物作用受损,或两者兼有引起。糖尿病一般由遗传因素或环境因素导致,其中进食过多、体力活动减少并导致肥胖是ⅱ型糖尿病的最主要环境因素。随着时间的推移,糖尿病可能损害心脏、血管、眼睛、肾脏和神经。糖尿病成人出现心脏病发作和中风的危险会上升两至三倍;糖尿病视网膜病变是失明的主要病因,它是视网膜小血管长期累积受损的结果,2.6%的盲症可归咎于糖尿病;糖尿病位居肾衰竭主要病因之列。因此,预防和治疗糖尿病对自身的身体健康尤为重要。
目前,有许多预防和治疗糖尿病的方法,包括饮食控制、适度运动、药物治疗等。其中,药物治疗效果比其他方法的效果更为明显。但是,在市售的预防和治疗糖尿病的药物中,绝大部分药物都是基于刺激胰岛素的分泌、减少胃肠道对葡萄糖的吸收等原理控制糖尿病,但是长期使用这些药物会对肝脏等器官造成损伤不利于身体健康。因此,需要一种预防和治疗糖尿病,同时又不损害身体健康的药物。
技术实现要素:
为解决上述问题,本发明提供了一种mir-327抑制剂和/或fgf10促进剂在制备预防和/或治疗糖尿病的药物中的应用。mir-327抑制剂、fgf10促进剂均可促进fgf10的增加,促使脂肪细胞前体向棕色脂肪细胞分化,促进血糖消耗,提高机体对胰岛素敏感性,达到预防和/或治疗糖尿病的目的。
第一方面,本发明提供了mir-327抑制剂和/或fgf10促进剂在在制备预防和/或治疗糖尿病的药物中的应用。
其中,所述mir-327抑制剂用于靶向脂肪组织中基质血管成分(svf)中mir-327,降低mir-327的表达,促进了非脂肪细胞(即基质血管成分中的各类细胞)中作为mir-327靶标的成纤维细胞生长因子10(fgf10)的增加,促使基质血管成分中脂肪细胞前体向棕色脂肪细胞分化,增加机体代谢速率,促进血糖消耗,提高胰岛素敏感性。进而可以达到预防和/或治疗糖尿病的作用。
其中,所述fgf10促进剂可促进脂肪基质血管成分(svf)中fgf10的增加,促使svf中脂肪细胞前体向棕色脂肪细胞分化,增加机体代谢速率,促进血糖消耗,提高胰岛素敏感性。也可以达到预防和/或治疗糖尿病的作用。
可选地,所述预防和/或治疗糖尿病的药物中同时含有mir-327抑制剂和fgf10促进剂。两者同时存在下,可起到协同促进胰岛素敏感性的作用。
本发明中,mir-327是一种微小rna(microrna),短的非编码rna,在转录后调节蛋白质表达。
可选地,所述mir-327抑制剂包括抑制mir-327的化学药物、多肽类药物、蛋白类药物和基因类药物中的一种或多种。
进一步地,所述抑制mir-327的化学药物一般指小分子有机化合物。所述抑制mir-327的蛋白类药物包括天然蛋白、重组蛋白,包括但不限于抗体。所述抑制mir-327的“基因类药物”包括但不限于核酸片段,例如dna片段、rna片段。
在本发明一实施例中,所述mir-327抑制剂为在exiqon公司定制的拮抗mir-327的lna抑制剂探针,所述mir-327抑制剂可以靶向且抑制mir-327,所述mir-327抑制剂与mir-327的序列互补。其中,mir-327的核苷酸序列包括acuugaggggcaugaggau。
可选地,所述fgf10促进剂包括促进fgf10增加的化学药物、多肽类药物、蛋白药物和基因药物中的一种或多种。
进一步地,所述促进fgf10增加的化学药物一般指小分子有机化合物。所述促进fgf10增加的蛋白类药物包括天然蛋白、重组蛋白,包括但不限于抗体。所述促进fgf10增加的“基因类药物”包括但不限于核酸片段,例如dna片段、rna片段。具体地,所述fgf10促进剂包括fgf10蛋白等。
可选地,所述预防和/或治疗糖尿病的药物中还包括药学上可接受的载体。
可选地,所述药学上可接受的载体包括溶剂、聚合物、脂质体、重组病毒载体和真核重组表达载体中的至少一种,但不限于此。
其中,所述溶剂包括但不限于水、生理盐水,以及其他非水性溶剂。
所述聚合物包括聚赖氨酸、聚乙烯亚胺(支状和/或链状)及其改性物、聚酰胺-胺型树枝状高分子(pamam)及其衍生物、聚丙烯亚胺树枝状高分子(ppi)及其衍生物、壳聚糖、聚乳酸-羟基乙酸(plga)、聚乳酸、明胶、环糊精、海藻酸钠、白蛋白和血红蛋白中的一种或多种,但不限于此。其中,聚乙烯亚胺及其改性物、pamam及其衍生物、ppi及其衍生物、壳聚糖等可称为阳离子聚合物。
所述脂质体可以由阳离子类脂、中性辅助类脂、胆固醇、磷脂(如豆卵磷脂、蛋黄卵磷脂、脑磷脂等)自组装而成,也可以由二硬脂酰基磷脂酰乙醇胺-聚乙二醇(dspe-peg)穿插于磷脂分子形成的磷脂层中形成。
所述重组病毒载体可以包括慢病毒载体、腺病毒载体和逆转录病毒载体中的一种或多种,但不限于此。
在本发明中,“药学上可接受的载体”的作用是运输本发明中所述药物,使其发挥应有的作用。一般而言,运输是从一个器官或者某一部分到达另外一个器官或者另外一个部分,载体必须和药物成分相兼容,不影响药物的生物学活性,而且相对是无毒的,比如该载体进入体内而不会引起毒副作用或和其携带的药物发生严重的反应,其对患者不产生负面影响。
药物活性成分—mir-327抑制剂和/或fgf10促进剂可以分散或吸附在上述载体中而形成分散体系,也可以被上述脂质体、聚合物等包覆/包封起来,形成球状结构(例如纳米囊或微米囊)。例如,当所述mir-327抑制剂为抑制mir-327的核酸片段时,所述预防和/或治疗糖尿病的药物时,该药物包括但不限于包裹、结合或共混有核酸片段的阳离子聚合物、多肽、蛋白药物等。
再例如,被包封在球状结构中的mir-327抑制剂可以进行缓释、控释或靶向释放,让所述药物发挥最佳的效能,还能够提高所述药物的稳定性。举例来说,白蛋白、明胶、壳聚糖、聚乳酸通常可以形成能分散或包裹药物的微球。
可选地,所述预防和/或治疗糖尿病的药物中,所述mir-327抑制剂的含量为5-20mg/kg。进一步可选为5-10mg/kg。
可选地,所述预防和/或治疗糖尿病的药物中,所述fgf10促进剂的含量为1-100mg/kg。
进一步地,所述mir-327抑制剂与fgf10促进剂的含量比为(0.2-20):1。
本发明中,所述预防和/或治疗糖尿病的药物中,可以选择mir-327抑制剂作为单一活性成分,也可以选择fgf10促进剂作为单一活性成分,还可以采用含有mir-327抑制剂和fgf10促进剂作为其活性成分。这也是本发明中“mir-327抑制剂和/或fgf10促进剂”所代表的含义。
在此基础上,进一步地,所述预防和/或治疗糖尿病的药物中还含有其他药学上可接受的活性成分。所述mir-327抑制剂和/或fgf10促进剂可以与所述其他药学上可接受的活性成分共同作用,达到预防和/或治疗糖尿病的目的。
其中,所述其他药学上可接受的活性成分包括格列美脲、格列吡嗪、甲苯磺丁脲、曲格列酮、伏格列波糖和胰岛素的一种或多种。
优选地,所述预防和/或治疗糖尿病的药物中含有mir-327抑制剂和fgf10促进剂中的一种或两种,以及胰岛素;所述mir-327抑制剂和fgf10促进剂还用于提高胰岛素敏感性。
本发明提及的“胰岛素敏感性”是指机体细胞(或称为“施药对象”)对胰岛素作用的敏感程度。细胞通过胰岛素受体识别信号,继而通过pi3k/akt/mtor转导途径将信号传入,加速细胞对葡萄糖的利用以降低血糖。若胰岛素敏感性低,也称胰岛素抵抗(主要指肌细胞),此时机体往往需要更多内源或外源的胰岛素以维持血糖平衡,进而产生高胰岛素血症,也易患ii型糖尿病。
在本发明中,所述其他药学上可接受的活性成分具有预防和/或治疗糖尿病的效果。所述格列美脲(glimepiride)为第二代磺酰脲类口服降血糖药,其降血糖作用的主要机制是刺激胰岛β细胞分泌胰岛素,部分提高周围组织对胰岛素的敏感性。所述格列吡嗪(glipizide)为第二代磺酰脲类口服降糖药,能促进胰岛β细胞分泌胰岛素、增强胰岛素对靶组织的作用,也能刺激胰岛α细胞使胰高血糖素分泌受抑制,尚有抑制肝糖原分解、促进肌肉利用和消耗葡萄糖的作用。所述甲苯磺丁脲(tolbutamide)为第一代磺酰脲类口服降血糖药,选择性作用于胰岛β细胞,刺激胰岛素的分泌,降低血糖。所述曲格列酮(noscal)为噻唑烷二酮类药物,可改善胰岛素抵抗,增加人体组织对胰岛素的敏感性,增强胰岛素的作用。所述伏格列波糖(voglibose)为α葡萄糖苷酶抑制剂,抑制如麦芽糖酶、异麦芽糖酶、葡萄糖淀粉酶及蔗糖酶的活性,延缓糖分的消化和吸收,使淀粉分解成寡糖如麦芽糖(双糖)、麦芽三糖及糊精(低聚糖)进而分解成葡萄糖的速度减慢,使蔗糖分解成葡萄糖和果糖的速度减慢,因此造成肠道葡萄糖的吸收减缓,从而缓解餐后高血糖。所述胰岛素(insulin)参与调节糖代谢,控制血糖平衡,预防和/或治疗糖尿病。具体的,可以根据实际需要选择格列美脲、格列吡嗪、甲苯磺丁脲、曲格列酮、伏格列波糖、胰岛素或其他具有预防和/或治疗糖尿病的药物。
可选地,所述预防和/或治疗糖尿病的药物中还包括稀释剂和赋形剂中的一种或多种。
所述稀释剂的主要作用为填充片剂的重量或体积从而便于压片。可选地,所述稀释剂包括淀粉类、糖类、纤维素类和无机盐中的一种或多种。所述赋形剂是指在药物中的除了主要药物活性成以外的附加物,包括如片剂中的黏合剂、填充剂、崩解剂、润滑剂,丸剂中的酒、醋、药汁等,半固体制剂软膏剂、霜剂中的基质部分,液体制剂中的防腐剂、抗氧剂、矫味剂、芳香剂、助溶剂、乳化剂、增溶剂、渗透压调节剂、着色剂等。
可选地,所述预防和/或治疗糖尿病的药物的形式包括片剂、胶囊、粉剂、颗粒剂、丸剂、糖浆剂、溶液剂或混悬剂。所述预防和/或治疗糖尿病的药物的形式取决于在实际中的应用。
可选地,所述预防和/或治疗糖尿病的药物通过口服或注射的方式施用。
优选地,所述预防和/或治疗糖尿病的药物通过注射的方式施用。此时,所述预防和/或治疗糖尿病的药物最好为溶液剂,例如溶解在水中或生理盐水中。进一步地,所述注射通过腹膜内注射、皮下注射、肌肉注射或静脉注射的方式施用。
可选地,所述预防和/或治疗脂肪代谢症的药物可以通过局部给药或全身给药。
可选地,所述预防和/或治疗糖尿病的药物的施用量为每天5-20毫克/公斤体重。具体的,所述预防和/或治疗糖尿病的药物的用量取决于多种因素,包括但不限于所需的生物学活性以及施用对象对药物耐受性。
本发明第一方面提供的一种mir-327抑制剂和/或fgf10促进剂在制备预防和/或治疗糖尿病的药物中的应用。mir-327抑制剂、fgf10促进剂均可促进脂肪基质血管成分中fgf10的增加,促使基质血管成分中脂肪细胞前体向棕色脂肪细胞分化,促进血糖消耗,达到预防和/或治疗糖尿病的目的。在胰岛素存在下它们还可提高机体对胰岛素敏感性。本发明提供的mir-327抑制剂、fgf10促进剂的新用途。为糖尿病的治疗开辟了新的途径,具有较显著的预防或治疗效果,可有效降低人们患糖尿病的风险。
第二方面,本发明提供了一种预防和/或治疗糖尿病的药物,所述预防和/或治疗糖尿病的药物包括mir-327抑制剂和fgf10促进剂中的一种或多种,以及药学上可接受的载体。
其中,所述mir-327抑制剂用于靶向脂肪组织中基质血管成分(svf)中mir-327,降低mir-327的表达,促进了非脂肪细胞(即基质血管成分中的各类细胞)中作为mir-327靶标的成纤维细胞生长因子10(fgf10)的增加,促使基质血管成分中脂肪细胞前体向棕色脂肪细胞分化,增加机体代谢速率,促进血糖消耗。进而可以达到预防和/或治疗糖尿病的作用。
其中,所述fgf10促进剂可促进脂肪基质血管成分(svf)中fgf10的增加,促使svf中脂肪细胞前体向棕色脂肪细胞分化,增加机体代谢速率,促进血糖消耗。也可以达到预防和/或治疗糖尿病的作用。
其中,所述药学上可接受的载体如本发明第一方面所述。
其中,所述预防和/或治疗糖尿病的药物中还包括胰岛素。此时,在胰岛素存在下,mir-327抑制剂和fgf10促进剂均可提高机体对胰岛素敏感性。
本发明第二方面提供的一种预防和/或治疗糖尿病的药物,包括mir-327抑制剂和fgf10促进剂中的一种或多种,以及药学上可接受的载体。该药物可以促进脂肪基质血管成分中fgf10的增加,促使基质血管成分中脂肪细胞前体向棕色脂肪细胞分化,增加机体代谢速率,促进血糖消耗,进而改善糖尿病。
本发明实施例的优点将会在下面的说明书中部分阐明,一部分根据说明书是显而易见的,或者可以通过本发明实施例的实施而获知。
附图说明
图1为给予药物刺激与否的对照组2和对照组3的组织学检测结构。;
图2为给予寒冷刺激与否的对照组2和对照组3的脂肪细胞平均直径的量化图;
图3为给予寒冷刺激与否的对照组2和对照组3的葡萄糖耐量(a)、homa-ir(b)和核心体温(c)的测试结果;
图4为给予寒冷刺激与否的实验组与对照组1的组织学检测结果;
图5为给予寒冷刺激与否的实验组与对照组1的最大摄氧能力的测试结果;
图6为给予寒冷刺激与否的实验组与对照组1的胰岛素抵抗稳态模型评估(homa-ir)指标的测试结果;
图7为给予寒冷刺激与否的实验组与对照组1的核心体温的测试结果。
具体实施方式
以下所述是本发明实施例的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明实施例原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明实施例的保护范围。
实验组:选用定制的拮抗mir-327的lna抑制剂探针作为mir-327抑制剂(该mir-327抑制剂可靶向、抑制mir-327,其序列与mir-327的核苷酸序列互补。其中mir-327的核苷酸序列包括acuugaggggcaugaggau)。将8周龄的12只雌性c57bl/6小鼠置于热中性条件(30℃)下,将上述mir-327抑制剂对小鼠以8mg/kg剂量每周皮下注射1次,然后给予寒冷(4℃)或药物刺激(如β肾上腺素受体激动剂,如cl316243),注射一共进行2周。2周后分别进行以下实验:
(1)2周后对其中的6只小鼠采用过量co2处死,细致解剖其皮下脂肪,在精密天平上测量重量,并进行统计分析,得到小鼠脂肪组织称重结果。同时对小鼠脂肪组织进行组织学检测,具体包括:使用4%的pfa将脂肪组织固定,切成薄片,使用组织蛋白酶k(20mm)消化,并用100%甲醇透化。对样品采用含有3%牛奶的0.1%tritonx-100pbs溶液进行过夜封闭,在4℃与一抗如抗cd31(1:100,目录号af3628,r&d)和抗perilipin(1:200,目录号20r-pp004,fitzgeraldindustries),、抗ucp1(1:200,abcam)等抗体孵育。用pbs洗涤后,样品用3%牛奶封闭,并在室温下与荧光标记的二抗(1:300,thermofisherscientificinc.)孵育2小时。冲洗后,样品装片,在共聚焦显微镜(lsm510confocal,zeiss)上观察并测量。
(2)2周后对其中的6只小鼠先测量小鼠核心体温,具体如下:使用microtherma2t温度计,将探头插入小鼠直肠(货号tw2和ret-3,agntho'sab)检测各组小鼠的体温。
之后对这些雌性小鼠进行口服葡萄糖耐量试验,具体包括:禁食6小时,期间可以自由饮水。然后将葡萄糖目录号g8270,sigma-aldrich)溶于生理盐水中,以15mg/g小鼠体重的剂量饲喂小鼠。在每个时间点(0,15,30,60,120分钟)尾静脉采血,使用accu-chekaviva血糖仪和试纸(rochediagnostics)测量血糖水平。
第2天,对6只雌性小鼠进行胰岛素抵抗稳态模型评估(homa-ir)指标实验。其中,homa-ir是检测胰岛素抵抗的成熟方法。使用胰岛素elisa试剂盒检测小鼠血清样品中的空腹胰岛素水平。使用aviva血糖仪测量空腹血糖水平。使用如下公式计算homa-ir指数:空腹血糖(mgdl-1)×空腹胰岛素(mul-1)/405。
第3天,对这6只雌性小鼠进行代谢水平测定,包括如下步骤:使用耗氧量来量化代谢率和去甲肾上腺素(ne)诱导的产热。使用oxymaxclams-hc系统(columbusinstruments)。氧传感器加热至少6小时,稳定后使用两种参比气体校准。两种气体是100%氮气和20.5%的o2或0.5%的co2混合气体。为了测量基础代谢,将小鼠转移到oxymax小室,在不同条件下测量基础代谢。测量前在小室中适应24小时,测量48-72小时。在测量去甲肾上腺素诱导的产热时,将oxymax系统保持在热中性的30℃。以去甲肾上腺素注射前24小时的代谢率为基线,以1mg/kg体重的剂量皮下注射去甲肾上腺素。计算注射前30分钟到注射后140分钟区间的耗氧量的曲线下面积,进行组间比对。
对照组1:将不抑制mir-327的无作用mir抑制物药物(随机序列)以8mg/kg的剂量每周经皮下注射到8周龄的12只c57bl/6小鼠白色脂肪内,然后给予寒冷(4℃)刺激,每周注射1次,一共进行2周;2周后对其中6只小鼠使用过量co2处死,对其脂肪组织进行称重,并进行组织学检测;对另外6只小鼠依次进行小鼠核心体温测量、口服葡萄糖耐量试验、homa-ir指数测试、代谢水平测定。
对照组2:将携带无功能的mir的慢病毒载体(vectorbiosystems)以1×109pfu/每次的剂量经皮下注射到8周龄的12只c57bl/6小鼠白色脂肪内,一周后给予寒冷(4℃)刺激,每周注射1次,一共进行2周;2周后对其中6只小鼠使用过量co2处死,对其脂肪组织进行称重,并进行组织学检测;对另外6只小鼠依次进行小鼠核心体温测量、口服葡萄糖耐量试验、homa-ir指数测试、代谢水平测定。
对照组3:将过表达mmu-mir-327的腺病毒(ad-ef1a-mmu-mir-327-egfp;1×109pfu;vectorbiosystems)以1×109pfu/每次的剂量每周经皮下注射到8周龄的12只c57bl/6小鼠白色脂肪内,一周后给予寒冷(4℃)刺激,每周注射1次,一共进行2周;;2周后对其中6只小鼠使用过量co2处死,对其脂肪组织进行称重,并进行组织学检测;对另外6只小鼠依次进行小鼠核心体温测量、口服葡萄糖耐量试验、homa-ir指数测试、代谢水平测定。
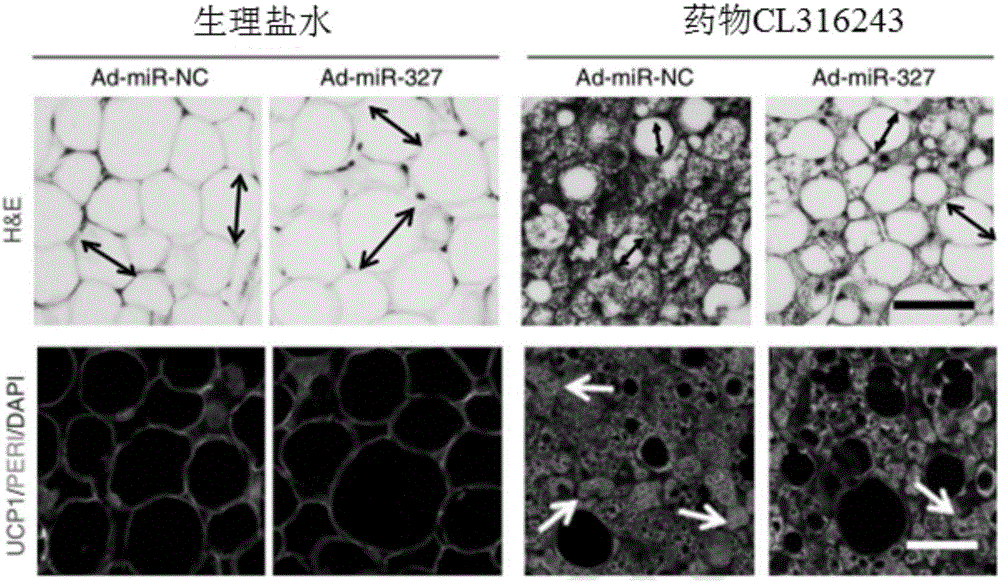
对照组2与对照组3的组织学检测结果如图1和图2所示,图1为对照组2和对照组3给予药物刺激与否时的组织学检测结果。图2为对照组2和对照组3给予寒冷刺激与否时的脂肪细胞平均直径的量化。其中,ad-mirnc代表对照组2,ad-mir-327代表对照组3。图1中,h&e代表使用苏木素和伊红进行脂肪组织形态学染色。ucp1染色显示棕色化位置,peri显示脂肪细胞形态,dapi对细胞核进行复染。
从图1和图2中可以看出,对对照组3而言,在小鼠中注射表达mir-327的腺病毒、并在其脂肪组织中表达mir-327之后(可简写为ad-mir-327),若无寒冷、药物等促进棕色化的刺激,其脂肪细胞大小与对照组2相比不变(其中双箭头指示脂肪细胞大小)。若有寒冷、药物等促进棕色化的刺激时,表达mir-327的脂肪组织其细胞直径不减小(即略有增加),ucp1染色显示其棕色化程度降低,箭头指示了明显棕色化的部位。
图3为给予寒冷刺激与否的对照组2和对照组3的葡萄糖耐量(a)、homa-ir(b)和核心体温(c)的测试结果。图3中的(a)和(b)显示,在脂肪组织中表达mir-327之后,有寒冷刺激或无寒冷刺激,均不影响胰岛素敏感性。其中,ns代表无明显差异。图3中的(c)显示,在脂肪组织中表达mir-327之后,若无寒冷、药物等促进棕色化的刺激,对照组3的身体核心温度与对照组2相比不变。若有寒冷、药物等促进棕色化的刺激时,脂肪中表达mir-327的小鼠其身体核心温度降低。
图1-图3的结果说明,使用病毒载体在小鼠脂肪组织中导入mir-327,会显著抑制白色脂肪细胞棕色化,阻碍燃脂效果。降低小鼠能量代谢。
实验组与对照组1的组织学检测、代谢测试结果如图4-图7所示,其中,inh-mirnc代表对照组1,inh-mir-327代表实验组。
从图4中可以看出,给小鼠注射mir-327抑制剂之后,若无寒冷、药物等促进棕色化的刺激,其脂肪细胞大小(双箭头指示脂肪细胞大小)已经与对照组1相比显著减小,ucp1染色显示其棕色化程度显著增高。若有寒冷、药物等促进棕色化的刺激时,注射mir-327抑制剂的小鼠的脂肪细胞大小进一步减小,ucp1染色显示其棕色化程度进一步增高,箭头指示了明显棕色化的部位。
从图5中看出,在给小鼠注射mir-327抑制剂之后,若无寒冷、药物等促进棕色化的刺激,其代谢指标—最大摄氧能力(vo2)与对照组1相比显著提高。若有寒冷、药物等促进棕色化的刺激时,注射mir-327抑制剂的小鼠其代谢指标进一步提高。
从图6中看出,在给小鼠注射mir-327抑制剂之后,在非寒冷条件下,homa-ir就已经显著降低,这说明mir-327抑制剂室温下就可以增加胰岛素敏感性。
从图7中看出,注射mir-327抑制剂之后,在非寒冷条件下,就已经可以增加小鼠的身体核心温度,提高代谢率。
图4-图7的结果说明,使用mir-327抑制剂可显著促进小鼠的白色脂肪棕色化,增加机体代谢速率,促进血糖消耗,提高胰岛素敏感性。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!
- SPNP‑I在制备Nav1.7通道工具试剂中的应用的制造方法与工艺
- SPNP‑I在制备Nav1.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.3通道工具试剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.5通道抑制剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- 一种多肽在制备Nav1.3钠通道工具试剂中的应用的制造方法与工艺
- SPKP‑XI在制备Kv4.2通道抑制剂中的应用的制造方法与工艺
- SGLT‑2糖尿病抑制剂及其中间体的制备方法与流程