包含富马酸二甲酯的药物珠粒制剂的制作方法
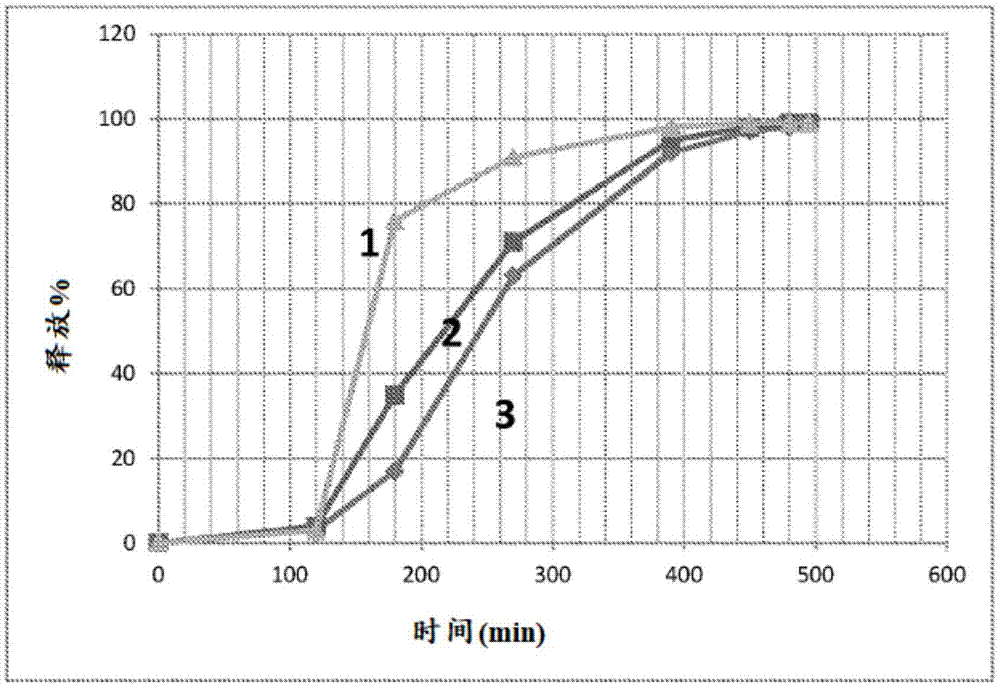
本申请要求于2016年2月11日提交的美国临时申请no.62/294,054的权益,其全部内容通过引用并入本文。发明背景(富马酸二甲酯)于2013年3月被fda批准用于治疗患有复发型多发性硬化(ms)的成人。当前批准的制剂的起始剂量是经口每天两次120mg。7天后,将剂量增加至经口每天两次240mg的维持剂量。富马酸二甲酯(dmf)在体内迅速被吸收并转化为富马酸单甲酯(mmf)。mmf的半衰期显示为约1小时(在大鼠中在100mg/kg经口剂量下0.9小时)。dmf和mmf两者都被酯酶代谢,所述酯酶在胃肠道、血液和组织中普遍存在。dmf在3期临床试验中证明了可接受的安全特性。然而,观察到诸如潮红和胃肠道事件的耐受性问题。虽然这些事件的严重程度通常为轻度至中度,但希望减少这些副作用。还希望开发一天一次的给药制剂,而不是当前的每天两次的制剂,以改善患者的顺应性和便利性。因此,需要新的富马酸二甲酯药物制剂,其具有改善的药代动力学特性和/或给药方案和降低的副作用。技术实现要素:本发明提供了富马酸二甲酯的新型药物组合物,其具有适合于每日一次给药方案的药代动力学特性。此外,本发明的药物组合物具有所需的延长释放特性,其可以减少对当前制剂观察到的胃肠副作用。此外,据信本发明的药物组合物具有最大化的富马酸二甲酯体内吸收。本发明的一个方面涉及包含第一药物珠粒组合物和第二药物珠粒组合物的药物组合物。第一药物珠粒组合物是包肠衣的立即释放组合物,并且第二药物珠粒组合物是包肠衣的控制释放组合物,其中第一药物珠粒组合物和第二药物珠粒组合物都包含富马酸二甲酯作为活性成分。在又一方面,本发明提供了治疗患有多发性硬化的受试者的方法。该方法包括向受试者施用有效量的本文所述的本发明的药物组合物。本发明还提供了用于治疗患有多发性硬化的受试者的本文所述的药物组合物。本发明还包括了本文所述的药物组合物用于制造治疗多发性硬化的医药的用途。附图说明图1.显示了使用溶出试验1,与包含单一类型珠粒的药物组合物(制剂3)相比,包含本发明的混合珠粒的药物组合物(制剂1和2)的体外溶出曲线。图2.显示了使用溶出试验2,与包含单一类型珠粒的药物组合物(制剂3)相比,包含本发明的混合珠粒的药物组合物(制剂1和2)的体外溶出曲线。具体实施方式如本文所用,术语“立即释放”是指在短时间内,诸如不到30分钟内在体内释放基本上所有(如,大于90%、95%、99%或99.9%)的活性成分(如,富马酸二甲酯)的药物组合物。如本文所用,术语“控制-释放”和“延缓-释放”在本文中可互换使用。它们是指在延长的时间段内(诸如在2小时、3小时、4小时、6小时、8小时、12小时、16小时或24小时内)在体内释放活性成分(如富马酸二甲酯)的药物组合物。在一个实施方案中,与立即释放制剂相比,活性物质富马酸二甲酯以延长的方式从本发明的控制释放药物珠粒组合物中释放。术语“延长”意指活性物质在比目前可商购获得的(富马酸二甲酯)制剂在更长的时间内释放,诸如至少在比当前可商购获得的制剂的时间段大至少1.2倍、至少1.5倍、至少2倍、至少3倍、至少4倍或至少5倍的时间段内。如本文所用,术语“包肠衣的”是指在核心或含有活性成分(如,富马酸二甲酯)的层周围具有肠溶包衣的药物组合物。在第一个实施方案中,本发明涉及包含第一药物珠粒组合物和第二药物珠粒组合物的药物组合物,其中第一药物珠粒组合物是包肠衣的立即释放珠粒组合物,并且第二药物珠粒组合物是包肠衣的控制释放珠粒组合物,其中第一药物珠粒组合物和第二药物珠粒组合物均包含富马酸二甲酯。在第二个实施方案中,对于第一个实施方案中描述的药物组合物,所述第一药物珠粒组合物包含:惰性核心;围绕所述惰性核心的第一层,其中所述第一层包含富马酸二甲酯和粘合剂;和围绕所述第一层的肠溶包衣;和所述第二药物珠粒组合物,其包括:惰性核心;围绕所述惰性核心的第一层,其中所述第一层包含富马酸二甲酯和粘合剂;围绕所述第一层的肠溶包衣;和围绕所述肠溶包衣的功能性包衣。在某些实施方案中,第一药物珠粒组合物的惰性核心、第一层和/或肠溶包衣与第二药物珠粒组合物的惰性核心、第一层和/或肠溶包衣不同。在某些实施方案中,第一药物珠粒组合物的惰性核心、第一层和/或肠溶包衣与第二药物珠粒组合物的惰性核心、第一层和/或肠溶包衣相同。如本文所用,术语“惰性核心”是指包含对活性物质和珠粒的任何组分不具反应性和/或对活性物质(即富马酸二甲酯)的生物活性没有影响的一种或多种材料的核心。此外,惰性核心不含任何活性物质。在某些实施方案中,本发明的第一药物珠粒组合物或第二药物珠粒组合物或第一和第二药物珠粒组合物两者中的惰性核心包含一种或多种药学上可接受的惰性材料。示例性惰性核心材料包括但不限于淀粉、右旋糖、蔗糖、乳糖、麦芽糖和微晶纤维素。在一个实施方案中,惰性核心包含乳糖。在一个替代实施方案中,惰性核包含淀粉。在又一个替代方案中,惰性核心包含蔗糖。在某些实施方案中,对于本发明的第一药物珠粒组合物或第二药物珠粒组合物或第一和第二药物珠粒组合物两者,惰性核心的重量百分比为惰性核心和第一层的总重量的10%-60%或20-40%。更具体地,惰性核心的重量百分比是惰性核心和第一层总重量的30%-40%或20-30%。甚至更具体地,惰性核心的重量百分比是惰性核心和第一层总重量的20-24%。或者,惰性核心的重量百分比是惰性核心和第一层的总重量的16-20%。在另一个替代方案中,惰性核心的重量百分比是惰性核心和第一层的总重量的16-22%。在另一个实施方案中,惰性核心的重量百分比是惰性核心和第一层的总重量的15-30%。在又一个实施方案中,惰性核心的重量百分比是惰性核心和第一层的总重量的16-26%。在某些实施方案中,对于本发明的第一药物珠粒组合物或第二药物珠粒组合物或第一和第二药物珠粒组合物两者,惰性核心是直径为200-850μm的球体。更具体地,球体的直径为250-350μm、300-400μm、500-600μm或700-850μm。甚至更具体地,球体的直径为350μm、550μm或750μm。在某些实施方案中,对于本发明的第一药物珠粒组合物或第二药物珠粒组合物或第一和第二药物珠粒组合物两者,珠粒的直径为0.5-2mm、0.5-1.5mm、0.8-2mm、0.8-1.5mm、1-2mm或1-1.5mm。更具体地,珠粒的直径为0.9-1.5mm、0.9-1.4mm、0.9-1.3mm、0.9-1.2mm、1-1.4mm、1-1.3mm或1-1.2mm。在某些实施方案中,对于本发明的第一药物珠粒组合物或第二药物珠粒组合物或第一和第二药物珠粒组合物两者,活性物质富马酸二甲酯在惰性核心上成层。更具体地,富马酸二甲酯通过在流化床系统诸如流化床喷涂装置中将含有富马酸二甲酯的溶液喷雾到惰性核心上而在惰性核上成层。流化床系统也可称为流化床。在某些实施方案中,对于本发明的第一药物珠粒组合物或第二药物珠粒组合物或第一药物珠粒组合物和第二药物珠粒组合物两者,富马酸二甲酯的重量百分比为惰性核心和第一层总重量的40%-80%、50%-75%、60-80%、60%-70%、65%-75%或70%-80%。更具体地,富马酸二甲酯的重量百分比是惰性核心和第一层的总重量的68%-72%。在一个具体实施方案中,富马酸二甲酯的重量百分比是惰性核心和第一层的总重量的70%。或者,富马酸二甲酯的重量百分比是惰性核心和第一层的总重量的60%-63%。在另一个实施方案中,富马酸二甲酯的重量百分比是惰性核和第一层的总重量的72%-76%。在另一个实施方案中,富马酸二甲酯的重量百分比是惰性核和第一层的总重量的74%。在某些实施方案中,对于本发明的第一药物珠粒组合物或第二药物珠粒组合物或第一和第二药物珠粒组合物两者,第一层还包含粘合剂。示例性粘合剂包括但不限于阿拉伯树胶、琼脂、海藻酸、氨基甲基丙烯酸酯共聚物、铵基甲基丙烯酸酯共聚物、铵基甲基丙烯酸酯共聚物分散体、碳酸钙、乳酸钙、卡波姆共聚物、卡波姆均聚物、卡波姆互聚物、羧甲基纤维素钠、微晶纤维素、硅化微晶纤维素、氢化椰子油、共聚维酮、玉米糖浆、玉米糖浆固体、葡萄糖结合剂、糊精、丙烯酸乙酯和甲基丙烯酸甲酯共聚物分散体、乙基纤维素、乙二醇和乙烯醇接枝共聚物、明胶、液体葡萄糖、山嵛酸甘油酯、瓜尔胶、羟乙基纤维素、羟丙基纤维素、低取代羟丙基纤维素、羟丙甲纤维素、乙酸羟丙甲纤维素琥珀酸酯、菊粉、α-乳清蛋白、乳糖一水合物、麦芽糖糊精、麦芽糖、甲基丙烯酸共聚物、甲基丙烯酸共聚物分散体、甲基丙烯酸和丙烯酸乙酯共聚物分散体、甲基纤维素、氢化棕榈油、聚卡波非、氢化聚右旋糖、聚环氧乙烷、聚乙酸乙烯酯、聚维酮、普鲁兰、海藻酸钠、预胶化淀粉、预胶化改性淀粉、玉米淀粉、羟丙基玉米淀粉、预胶化羟丙基玉米淀粉、豌豆淀粉、羟丙基豌豆淀粉、预胶化羟丙基豌豆淀粉、马铃薯淀粉、羟丙基马铃薯淀粉、预胶化羟丙基马铃薯淀粉、木薯淀粉、小麦淀粉、氢化淀粉水解物、蔗糖、葵花油、糖浆、海藻糖、氢化植物油、维生素e聚乙二醇琥珀酸酯、玉米醇溶蛋白、羟丙基甲基纤维素(hpmc)、聚乙烯吡咯烷酮(pvp)、甲基纤维素、乙基纤维素、羧甲基纤维素钠、聚乙二醇(peg)、聚乙烯醇、聚甲基丙烯酸酯、淀粉糊、淀粉钠、黄蓍胶、明胶、海藻酸盐、海藻酸钠、海藻酸、纤维素、小烛树蜡、巴西棕榈蜡、共聚维酮和含水乳糖。更具体地,粘合剂是hpmc。在某些实施方案中,对于本发明的第一药物珠粒组合物或第二药物珠粒组合物或第一和第二药物珠粒组合物两者,粘合剂的重量百分比为惰性核心和第一层的总重量的1-25%、1-20%或5-15%。更具体地说,粘合剂的重量百分比是惰性核心和第一层的总重量的5-10%(如,5%、6%、7%、8%、9%或10%)。在另一个具体的实施方案中,粘合剂的重量百分比是惰性核心和第一层的总重量的1-5%(如,1%、2%、3%、4%或5%)。在一个甚至更特定的实施方案中,粘合剂的重量百分比是7%。在某些实施方案中,本发明的药物珠粒组合物具有围绕包含富马酸二甲酯的第一层的肠溶包衣。如本文所用,“肠溶包衣“是指在胃中发现的高酸性ph(如,ph约3)下稳定但在酸性较弱的ph(如,ph7-9)下快速分解的包衣。本领域已知的肠溶包衣材料通常可用于本发明。在一个实施方案中,对于本文所述的药物组合物,肠溶包衣在包含富马酸二甲酯的第一层上成层。更具体地,通过在流化床中将含有肠溶包衣材料的溶液喷雾到第一层上,肠溶包衣在第一层上成层。在某些实施方案中,对于本发明的第一药物珠粒组合物或第二药物珠粒组合物或第一和第二药物珠粒组合物两者,肠溶包衣在功能性包衣上成层。更具体地,通过在流化床中将含有肠溶包衣材料的溶液喷雾到功能性包衣上,肠溶包衣在功能性包衣上成层。在某些实施方案中,对于本发明的第一药物珠粒组合物或第二药物珠粒组合物或第一和第二药物珠粒组合物两者,肠溶包衣包含选自由以下组成的组的赋形剂:甲基丙烯酸和甲基丙烯酸甲酯的共聚物,甲基丙烯酸和丙烯酸乙酯的共聚物,邻苯二甲酸羟丙甲纤维素(hpmcp),乙酸邻苯二甲酸纤维素。更具体地,肠溶包衣包含甲基丙烯酸和甲基丙烯酸甲酯的共聚物。更具体地说,共聚物中甲基丙烯酸与甲基丙烯酸甲酯的比率为0.8:1至1.2:1,(例如,1:1)。在一个甚至更特定的实施方案中,肠溶包衣包含l100(聚(甲基丙烯酸-甲基丙烯酸甲酯共聚物)1:1)。在某些实施方案中,对于本发明的第一药物珠粒组合物或第二药物珠粒组合物或第一和第二药物珠粒组合物两者,本发明的肠溶包衣还包含一种或多种增塑剂。示例性增塑剂包括但不限于柠檬酸乙酰基三乙酯、苯甲酸苄酯、蓖麻油、氯丁醇、二乙酰化单甘油酯、癸二酸二丁酯、邻苯二甲酸二乙酯、甘油、甘露糖醇、聚乙二醇、聚乙二醇单甲基醚、丙二醇、普鲁兰、山梨糖醇、山梨糖醇脱水山梨糖醇溶液、甘油三乙酸酯、柠檬酸三丁酯、柠檬酸三乙酯和维生素e。在一个更特定的实施方案中,增塑剂是柠檬酸三乙酯。在一个实施方案中,对于本发明的第一药物珠粒组合物或第二药物珠粒组合物或第一和第二药物珠粒组合物两者,本发明的肠溶包衣包含l100和柠檬酸三乙酯。更具体地,柠檬酸三乙酯与l100的重量比是1:1至1:20。甚至更具体地,柠檬酸三乙酯与l100的重量比是1:5。在某些实施方案中,对于本发明的第一药物珠粒组合物或第二药物珠粒组合物或第一和第二药物珠粒组合物两者,肠溶包衣的重量百分比是惰性核心和第一层的总重量的1-20%或5-15%。更具体地,肠溶包衣的重量百分比是惰性核心和第一层的总重量的10-15%(如,10%、11%、12%、13%或15%)。在另一个更特定的实施方案中,肠溶包衣的重量百分比是惰性核心和第一层的总重量的11-13%。甚至更具体地,肠溶包衣的重量百分比是惰性核心和第一层的总重量的12%。在某些实施方案中,对于本文所述的药物珠粒组合物,功能性包衣在珠粒的肠溶包衣上成层。更具体地,通过在流化床中将含有功能性包衣材料的溶液喷雾到肠溶包衣上,使功能性包衣在肠溶包衣上成层。在某些实施方案中,对于本文所述的药物珠粒组合物,使功能性包衣在珠粒的第一层上成层。更具体地,通过在流化床中将含有功能性包衣材料的溶液喷雾到功能性包衣上,使功能性包衣在第一层上成层。如本文所用,“功能性包衣“是指提供活性物质(即,富马酸二甲酯)延长释放的包衣。在某些实施方案中,对于本发明的第二药物珠粒组合物,功能性包衣包含一种或多种水溶性聚合物和一种或多种水不溶性聚合物的混合物。在某些实施方案中,功能性包衣包含选自由以下组成的组的一种或多种赋形剂:聚乙烯吡咯烷酮(pvp)、聚环氧乙烷(peo)、单硬脂酸甘油酯、羟丙基甲基纤维素(hpmc)、soluplus、聚乙烯醇(pva)、聚乙烯醇(pva)、乙酸羟丙基甲基纤维素琥珀酸酯(hpmcas)、乙烯乙酸乙烯酯(eva)、甲基丙烯酸酯(eudragittm)、乙酸丁酸纤维素(cab)、乙酸邻苯二甲酸纤维素(cap)、聚(乙二醇)、聚(乙酸乙烯酯)(pvac)、聚丙交酯(pla)、聚乙交酯(pga)、pla/pga和聚己内酯(pcl)的共聚物、聚乙烯吡咯烷酮-乙酸乙烯酯共聚物(kollidonva-64)、聚氨酯、聚(乳酸)、聚(乙醇酸)、聚(酸酐-酰亚胺)、聚(酸酐-酯)、聚(亚氨基碳酸酯)、聚(磷腈)、聚(磷酸酯)、乙基纤维素(ec)、羟丙基纤维素(hpc)、海藻酸、卡波姆共聚物、卡波姆均聚物、卡波姆互聚物、羧甲基纤维素钠、角叉菜胶、纤维醋丁酯、乙基纤维素水分散体、乙基纤维素分散体b型、单油酸甘油酯、瓜尔胶、羟丙基倍他环糊精、聚乙酸乙烯酯分散体、虫胶、海藻酸钠、预胶化淀粉、预胶化改性淀粉和黄原胶。在一个实施方案中,对于本文所述的第二药物珠粒组合物,功能性包衣包含乙基纤维素(ec)和羟丙基纤维素(hpc)的混合物。更具体地,功能性包衣包含ethoceltm10(对于于80%甲苯和20%乙醇中的5重量%溶液,粘度范围为9-11cp的乙基纤维素聚合物)和jf(对于于水中的5重量%溶液,粘度范围为150-400cp的羟丙基纤维素聚合物)的混合物。在一个实施方案中,乙基纤维素(ec)与羟丙基纤维素(hpc)(如,ethoceltm10与jf)的重量比介于90:10和10:90之间,介于80:20和20:80之间,介于80:20和50:50之间,介于75:25和60:40之间,介于70:30和55:45之间,介于70:30之间50:50,或介于65:35和55:45之间。更具体地,乙基纤维素(ec)与羟丙基纤维素(hpc)(如,ethoceltm10与jf)的重量比是70:30。更具体地,乙基纤维素(ec)与羟丙基纤维素(hpc)(如,ethoceltm10与jf)的重量比是65:35。在另一个具体的实施方案中,乙基纤维素(ec)与羟丙基纤维素(hpc)(如,ethoceltm10与jf)的重量比是60:40。在另一个实施方案中,对于本文所述的第二药物珠粒组合物,本发明的功能性包衣包含rs(聚(丙烯酸乙酯-甲基丙烯酸甲酯-甲基丙烯酸三甲基铵乙酯氯化物共聚物)1:2:0.1)和rl(聚(丙烯酸乙酯-甲基丙烯酸甲酯-甲基丙烯酸三甲基铵乙酯氯化物共聚物)1:2:0.2)的混合物。rs与rl的重量比介于95:5和5:95之间,介于90:10和50:50之间,介于90:10和60:40之间,或介于85:15和70:30之间。更具体地,rs与rl的重量比为75:25。或者,rs与rl的重量比为80:20。在某些实施方案中,对于本文所述的第二药物珠粒组合物,功能性包衣的重量百分比为惰性核心和第一层的总重量的1-30%、1-20%、4-12%、1-10%、1-7%或10-15%。更具体地,功能性包衣的重量百分比是惰性核心和第一层的总重量的2.0-3.0%。在另一个更具体的实施方案中,功能性包衣的重量百分比是惰性核心和第一层的总重量的4.0-5.0%。在另一个更具体的实施方案中,功能性包衣的重量百分比是惰性核心和第一层的总重量的4.5-5.5%。在另一个更具体的实施方案中,功能性包衣的重量百分比是惰性核心和第一层的总重量的5.0-6.0%。在又一个更具体的实施方案中,功能性包衣的重量百分比是惰性核心和第一层的总重量的11.5-12.5%。甚至更具体地,功能性包衣的重量百分比是惰性核心和第一层的总重量的2.5%。或者,功能性包衣的重量百分比是惰性核心和第一层的总重量的4.5%。在另一个替代方案中,功能性涂层的重量百分比是惰性核心和第一层总重量的5.0%。在又一个替代方案中,功能性包衣的重量百分比是惰性核心和第一层的总重量的5.5%。在又一个替代方案中,功能性包衣的重量百分比是惰性核心和第一层的总重量的12%。在第1个具体的实施方案中,本发明的药物组合物包含第一药物珠粒组合物和第二药物珠粒组合物,其中:(1)第一药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的40%-80%,并且粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的1-25%;和围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的1-20%;其中惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的10-60%;并且(2)第二药物珠粒组合物包含:惰性核心;围绕所述惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的40%-80%,并且粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的1-25%;和围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的1-20%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的1-30%,其中惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的10-60%。在第2个具体的实施方案中,本发明的药物组合物包含第一药物珠粒组合物和第二药物珠粒组合物,其中:(1)第一药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的50%-75%,并且粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的1-20%;和围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的5-15%;其中惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的20-40%;并且(2)第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的50%-75%,并且粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的1-20%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5-15%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的1-20%,其中惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的20-40%。在第3个具体的实施方案中,本发明的药物组合物包含第一药物珠粒组合物和第二药物珠粒组合物,其中:(1)第一药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的65%-75%,并且粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的5-15%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的10-15%;其中惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的20-30%;并且(2)第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的65%-75%,并且粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5-15%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的10-15%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比为第二药物珠粒组合物中的惰性核心和第一层的总重量的1-10%或10-15%,其中惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的20-30%。在第4个具体的实施方案中,本发明的药物组合物包含第一药物珠粒组合物和第二药物珠粒组合物,其中:(1)第一药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的68%-72%,并且粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;其中惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的20-24%;并且(2)第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第二层的总重量的68%-72%,并且粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第二药物珠粒组合物中惰性核心和第一层的总重量的11-13%;围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比为第二药物珠粒组合物中的惰性核心和第一层的总重量的2.0%-3.0%,其中惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的20-24%。在第5个具体的实施方案中,本发明的药物组合物包含第一药物珠粒组合物和第二药物珠粒组合物,其中:(1)第一药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的68%-72%,并且粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;其中惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的20-24%;并且(2)第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的68%-72%,并且粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比为第二药物珠粒组合物中的惰性核心和第一层的总重量的4.5%-5.5%,其中惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的20-24%。在第6个具体的实施方案中,本发明的药物组合物包含第一药物珠粒组合物和第二药物珠粒组合物,其中:(1)第一药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的68%-72%,并且粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;其中惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的20-24%;并且(2)第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的68%-72%,并且粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比为第二药物珠粒组合物中的惰性核心和第一层的总重量的5.0%-6.0%,其中惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的20-24%。在第7个具体的实施方案中,本发明的药物组合物包含第一药物珠粒组合物和第二药物珠粒组合物,其中:(1)第一药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的68%-72%,并且粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;其中惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的20-24%;并且(2)第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的68%-72%,并且粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比为第二药物珠粒组合物中的惰性核心和第一层的总重量的11.5%-12.5%,其中惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的20-24%。在第8个具体的实施方案中,本发明的药物组合物包含第一药物珠粒组合物和第二药物珠粒组合物,其中:(1)第一药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的72%-76%,并且粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;其中惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的16-22%;并且(2)第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的72%-76%,并且粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比为第二药物珠粒组合物中的惰性核心和第一层的总重量的2.0%-3.0%,其中惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的16-22%。在第9个具体的实施方案中,本发明的药物组合物包含第一药物珠粒组合物和第二药物珠粒组合物,其中:(1)第一药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的72%-76%,并且粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;其中惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的16-22%;并且(2)第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的72%-76%,并且粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比为第二药物珠粒组合物中的惰性核心和第一层的总重量的4.5%-5.5%,其中惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的16-22%。在第10个具体的实施方案中,本发明的药物组合物包含第一药物珠粒组合物和第二药物珠粒组合物,其中:(1)第一药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的72%-76%,并且粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;其中惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的16-22%;并且(2)第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的72%-76%,并且粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比为第二药物珠粒组合物中的惰性核心和第一层的总重量的5.0%-6.0%,其中惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的16-22%。在第11个具体的实施方案中,本发明的药物组合物包含第一药物珠粒组合物和第二药物珠粒组合物,其中:(1)第一药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的72%-76%,并且粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;其中惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的16-22%;并且(2)第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的72%-76%,并且粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比为第二药物珠粒组合物中的惰性核心和第一层的总重量的11.5%-12.5%,其中惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的16-22%。在第12个具体的实施方案中,本发明的药物组合物包含第一药物珠粒组合物和第二药物珠粒组合物,其中:(1)第一药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的72%-76%,并且粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;其中惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的16-22%;并且(2)第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的72%-76%,并且粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比为第二药物珠粒组合物中的惰性核心和第一层的总重量的4.0%-5.0%,其中惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的16-22%。在第13个具体的实施方案中,本发明的药物组合物包含第一药物珠粒组合物和第二药物珠粒组合物,其中:(1)第一药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的72%-76%,并且粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的6-8%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;(2)第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的72%-76%,并且粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的6-8%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的11-13%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的4.0%-5.0%。在第14个具体的实施方案中,本发明的药物组合物包含第一药物珠粒组合物和第二药物珠粒组合物,其中:(1)第一药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中的富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的74%,并且粘合剂的重量百分比是第一药物珠粒组合物中非惰性核心和第一层总重量的7%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的12%;(2)第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的74%,并且粘合剂的重量百分比是第二药物珠粒组合物中非惰性核心和第一层总重量的7%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的12%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的4.5%。更具体地,对于第1、第2、第3、第4、第5、第6、第7、第8、第9、第10、第11、第12、第13或第14个具体的实施方案中的药物珠粒组合物,惰性核心包含蔗糖或淀粉;粘合剂是hpmc;肠溶包衣包含甲基丙烯酸和甲基丙烯酸甲酯的共聚物,并且甲基丙烯酸与甲基丙烯酸甲酯的比率为1:1;并且功能性包衣包含乙基纤维素(ec)和羟丙基纤维素(hpc)的混合物,且乙基纤维素(ec)与羟丙基纤维素(hpc)的重量比为65:35。更具体地,肠溶包衣还包含柠檬酸三乙酯,并且甲基丙烯酸和甲基丙烯酸甲酯的共聚物与柠檬酸三乙酯的重量比为5:1;并且功能性包衣包含ethoceltm10(对于于80%甲苯和20%乙醇中的5重量%溶液,粘度范围为9-11cp的乙基纤维素聚合物)和jf(对于于水中的5重量%溶液,粘度范围为150-400cp的羟丙基纤维素聚合物)的混合物,其中ethoceltm10与jf的重量比是65:35。在另一个更具体的实施方案中,对于第1、第2、第3、第4、第5、第6、第7、第8、第9、第10、第11、第12、第13或第14个具体的实施方案中的药物珠粒组合物,惰性核心包含蔗糖或淀粉;粘合剂是hpmc;肠溶包衣包含甲基丙烯酸和甲基丙烯酸甲酯的共聚物,且甲基丙烯酸与甲基丙烯酸甲酯的比率为1:1;并且功能性包衣包含乙基纤维素(ec)和羟丙基纤维素(hpc)的混合物,且乙基纤维素(ec)与羟丙基纤维素(hpc)的重量比为60:40。更具体地,肠溶包衣还包含柠檬酸三乙酯,并且甲基丙烯酸和甲基丙烯酸甲酯的共聚物与柠檬酸三乙酯的重量比为5:1;并且功能性包衣包含ethoceltm10(对于于80%甲苯和20%乙醇中的5重量%溶液,粘度范围为9-11cp的乙基纤维素聚合物)和jf(对于于水中的5重量%溶液,粘度范围为150-400cp的羟丙基纤维素聚合物)的混合物,其中ethoceltm10与jf的重量比是60:40。在某些实施方案中,本文所述药物组合物中的富马酸二甲酯的量为90mg至960mg,更具体为120mg至480mg。在一个实施方案中,本文所述的单个胶囊中的富马酸二甲酯的量为240mg。或者,本文所述的单个胶囊中的富马酸二甲酯的量为480mg。在一方面,本发明在以下实施方案中描述:在实施方案(1)中,对于第一实施方案中所述的药物组合物,第一药物珠粒组合物包含惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯;和围绕第一层的肠溶包衣。在实施方案(2)中,对于实施方案(1)的药物组合物,第一药物珠粒组合物中的惰性核心包含选自由以下组成的组的一种或多种惰性物质:淀粉、右旋糖、蔗糖、乳糖、麦芽糖和微晶纤维素。在实施方案(3)中,对于实施方案(1)的药物组合物,第一药物珠粒组合物中的惰性核心包含乳糖。在实施方案(4)中,对于实施方案(1)的药物组合物,第一药物珠粒组合物中的惰性核心包含蔗糖。在实施方案(5)中,对于实施方案(1)的药物组合物,第一药物珠粒组合物中的惰性核心包含淀粉。在实施方案(6)中,对于实施方案(1)-(5)中的任一项的药物组合物,第一药物珠粒组合物中的惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的10%-60%。在实施方案(7)中,对于实施方案(6)的药物组合物,第一药物珠粒组合物中的惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的20%-40%。在实施方案(8)中,对于实施方案(6)的药物组合物,第一药物珠粒组合物中的惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的20%-30%。在实施方案(9)中,对于实施方案(6)的药物组合物,第一药物珠粒组合物中的惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的20%-24%。在实施方案(10)中,对于实施方案(6)的药物组合物,第一药物珠粒组合物中的惰性核心的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的16%-20%。在实施方案(11)中,对于实施方案(1)-(10)中的任一项的药物组合物,第一药物珠粒组合物中的惰性核心是直径为200-850μm的球体。在实施方案(12)中,对于实施方案(11)的药物组合物,第一药物珠粒组合物中的惰性核心球体的直径为250-350μm、500-600μm或700-850μm。在实施方案(13)中,对于实施方案(11)的药物组合物,第一药物珠粒组合物中的惰性核心球体的直径为350μm、550μm或750μm。在实施方案(14)中,对于实施方案(1)-(13)中的任一项的药物组合物,第一药物珠粒组合物中的富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的40%-80%。在实施方案(15)中,对于实施方案(14)的药物组合物,其中第一药物珠粒组合物中的富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的50%-75%。在实施方案(16)中,对于实施方案(14)的药物组合物,第一药物珠粒组合物中的富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的65%-75%。在实施方案(17)中,对于实施方案(14)的药物组合物,第一药物珠粒组合物中的富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的68%-72%。在实施方案(18)中,对于实施方案(14)的药物组合物,第一药物珠粒组合物中的富马酸二甲酯的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的72-76%。在实施方案(19)中,对于实施方案(1)-(18)中的任一项的药物组合物,第一药物珠粒组合物中的第一层还包含粘合剂。在实施方案(20)中,对于实施方案(19)的药物组合物,第一药物珠粒组合物的第一层中的粘合剂选自由以下组成的组:阿拉伯树胶、琼脂、海藻酸、氨基甲基丙烯酸酯共聚物、铵基甲基丙烯酸酯共聚物、铵基甲基丙烯酸酯共聚物分散体、碳酸钙、乳酸钙、卡波姆共聚物、卡波姆均聚物、卡波姆互聚物、羧甲基纤维素钠、微晶纤维素、硅化微晶纤维素、氢化椰子油、共聚维酮、玉米糖浆、玉米糖浆固体、葡萄糖结合剂、糊精、丙烯酸乙酯和甲基丙烯酸甲酯共聚物分散体、乙基纤维素、乙二醇和乙烯醇接枝共聚物、明胶、液体葡萄糖、山嵛酸甘油酯、瓜尔胶、羟乙基纤维素、羟丙基纤维素、低取代羟丙基纤维素、羟丙甲纤维素、乙酸羟丙甲纤维素琥珀酸酯、菊粉、α-乳清蛋白、乳糖一水合物、麦芽糖糊精、麦芽糖、甲基丙烯酸共聚物、甲基丙烯酸共聚物分散体、甲基丙烯酸和丙烯酸乙酯共聚物分散体、甲基纤维素、氢化棕榈油、聚卡波非、氢化聚右旋糖、聚环氧乙烷、聚乙酸乙烯酯、聚维酮、普鲁兰、海藻酸钠、预胶化淀粉、预胶化改性淀粉、玉米淀粉、羟丙基玉米淀粉、预胶化羟丙基玉米淀粉、豌豆淀粉、羟丙基豌豆淀粉、预胶化羟丙基豌豆淀粉、马铃薯淀粉、羟丙基马铃薯淀粉、预胶化羟丙基马铃薯淀粉、木薯淀粉、小麦淀粉、氢化淀粉水解物、蔗糖、葵花油、糖浆、海藻糖、氢化植物油、维生素e聚乙二醇琥珀酸酯、玉米醇溶蛋白、羟丙基甲基纤维素(hpmc)、聚乙烯吡咯烷酮(pvp)、甲基纤维素、乙基纤维素、羧甲基纤维素钠、聚乙二醇(peg)、聚乙烯醇、聚甲基丙烯酸酯、淀粉糊、淀粉钠、黄蓍胶、明胶、海藻酸盐、海藻酸钠、海藻酸、纤维素、小烛树蜡、巴西棕榈蜡、共聚维酮和含水乳糖。在实施方案(21)中,对于实施方案(20)的药物组合物,第一药物珠粒组合物的第一层中的粘合剂是羟丙基甲基纤维素(hpmc)。在实施方案(22)中,对于实施方案(19)-(21)中的任一项的药物组合物,第一药物珠粒组合物的第一层中的粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的1%-25%。在实施方案(23)中,对于实施方案(22)的药物组合物,第一药物珠粒组合物的第一层中的粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的1%-20%。在实施方案(24)中,对于实施方案(22)的药物组合物,第一药物珠粒组合物的第一层中的粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的5%-15%。在实施方案(25)中,对于实施方案(22)的药物组合物,第一药物珠粒组合物的第一层中的粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的5%-10%。在实施方案(26)中,对于实施方案(22)的药物组合物,第一药物珠粒组合物的第一层中的粘合剂的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的7%。在实施方案(27)中,对于实施方案(1)-(26)中的任一项的药物组合物,第一药物珠粒组合物中的肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的1-20%。在实施方案(28)中,对于实施方案(27)的药物组合物,第一药物珠粒组合物中的肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的5-15%。在实施方案(29)中,对于实施方案(27)的药物组合物,第一药物珠粒组合物中的肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的10-15%。在实施方案(30)中,对于实施方案(27)的药物组合物,第一药物珠粒组合物中的肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的11-13%。在实施方案(31)中,对于实施方案(27)的药物组合物,第一药物珠粒组合物中的肠溶包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的12%。在实施方案(32)中,对于第一实施方案的药物组合物,第一药物珠粒组合物包含含有富马酸二甲酯的核心;和围绕核心的肠溶包衣。在实施方案(33)中,对于实施方案(32)的药物组合物,第一药物珠粒组合物中的富马酸二甲酯的重量百分比是第一药物珠粒组合物中的核心的总重量的40%-80%。在实施方案(34)中,对于实施方案(33)的药物组合物,第一药物珠粒组合物中的富马酸二甲酯的重量百分比是第一药物珠粒组合物中的核心的总重量的60%-80%、60-70%或70-80%。在实施方案(35)中,对于实施方案(34)的药物组合物,第一药物珠粒组合物中的富马酸二甲酯的重量百分比是第一药物珠粒组合物中的核心的总重量的65%。在实施方案(36)中,对于实施方案(34)的药物组合物,第一药物珠粒组合物中的富马酸二甲酯的重量百分比是第一药物珠粒组合物中的核心的总重量的75%。在实施方案(37)中,对于实施方案(32)-(36)中的任一项的药物组合物,第一药物珠粒组合物中的核心还包含粘合剂。在实施方案(38)中,对于实施方案(37)的药物组合物,第一药物珠粒组合物的核心中的粘合剂选自由以下组成的组:阿拉伯树胶、琼脂、海藻酸、氨基甲基丙烯酸酯共聚物、铵基甲基丙烯酸酯共聚物、铵基甲基丙烯酸酯共聚物分散体、碳酸钙、乳酸钙、卡波姆共聚物、卡波姆均聚物、卡波姆互聚物、羧甲基纤维素钠、微晶纤维素、硅化微晶纤维素、氢化椰子油、共聚维酮、玉米糖浆、玉米糖浆固体、葡萄糖结合剂、糊精、丙烯酸乙酯和甲基丙烯酸甲酯共聚物分散体、乙基纤维素、乙二醇和乙烯醇接枝共聚物、明胶、液体葡萄糖、山嵛酸甘油酯、瓜尔胶、羟乙基纤维素、羟丙基纤维素、低取代羟丙基纤维素、羟丙甲纤维素、乙酸羟丙甲纤维素琥珀酸酯、菊粉、α-乳清蛋白、乳糖一水合物、麦芽糖糊精、麦芽糖、甲基丙烯酸共聚物、甲基丙烯酸共聚物分散体、甲基丙烯酸和丙烯酸乙酯共聚物分散体、甲基纤维素、氢化棕榈油、聚卡波非、氢化聚右旋糖、聚环氧乙烷、聚乙酸乙烯酯、聚维酮、普鲁兰、海藻酸钠、预胶化淀粉、预胶化改性淀粉、玉米淀粉、羟丙基玉米淀粉、预胶化羟丙基玉米淀粉、豌豆淀粉、羟丙基豌豆淀粉、预胶化羟丙基豌豆淀粉、马铃薯淀粉、羟丙基马铃薯淀粉、预胶化羟丙基马铃薯淀粉、木薯淀粉、小麦淀粉、氢化淀粉水解物、蔗糖、葵花油、糖浆、海藻糖、氢化植物油、维生素e聚乙二醇琥珀酸酯、玉米醇溶蛋白、羟丙基甲基纤维素(hpmc)、聚乙烯吡咯烷酮(pvp)、甲基纤维素、乙基纤维素、羧甲基纤维素钠、聚乙二醇(peg)、聚乙烯醇、聚甲基丙烯酸酯、淀粉糊、淀粉钠、黄蓍胶、明胶、海藻酸盐、海藻酸钠、海藻酸、纤维素、小烛树蜡、巴西棕榈蜡、共聚维酮和含水乳糖。在实施方案(39)中,对于实施方案(38)的药物组合物,第一药物珠粒组合物的核心中的粘合剂是微晶纤维素或淀粉。在实施方案(40)中,对于实施方案(38)或(39)的药物组合物,第一药物珠粒组合物的核心中的粘合剂的重量百分比是第一药物珠粒组合物中的核心的重量的1-50%。在实施方案(41)中,对于实施方案(38)或(39)的药物组合物,第一药物珠粒组合物的核心中的粘合剂的重量百分比是第一药物珠粒组合物中的核心的重量的15-35%。在实施方案(42)中,对于实施方案(32)-(41)中的任一项的药物组合物,第一药物珠粒组合物中的肠溶包衣的重量百分比是第一药物珠粒组合物中的核心的总重量的1-20%。在实施方案(43)中,对于实施方案(42)的药物组合物,其中第一药物珠粒组合物包衣中的肠溶包衣的重量百分比是第一药物珠粒组合物中的核心的总重量的5-15%。在实施方案(44)中,对于实施方案(42)的药物组合物,其中第一药物珠粒组合物中的肠溶包衣的重量百分比是第一药物珠粒组合物中的核心的总重量的10-15%。在实施方案(45)中,对于实施方案(42)的药物组合物,第一药物珠粒组合物中的肠溶包衣的重量百分比是第一药物珠粒组合物中的核心的总重量的11-13%。在实施方案(46)中,对于实施方案(42)的药物组合物,第一药物珠粒组合物中的肠溶包衣的重量百分比是第一药物珠粒组合物中的核心的总重量的12%。在实施方案(47)中,对于实施方案(1)-(46)中的任一项的药物组合物,第一药物珠粒组合物中的肠溶包衣包含选自由以下组成的组的赋形剂:甲基丙烯酸和甲基丙烯酸甲酯的共聚物,甲基丙烯酸和丙烯酸乙酯的共聚物,邻苯二甲酸羟丙甲纤维素(hpmcp),乙酸邻苯二甲酸纤维素。在实施方案(48)中,对于实施方案(47)的药物组合物,第一药物珠粒组合物中的肠溶包衣包含甲基丙烯酸和甲基丙烯酸甲酯的共聚物。在实施方案(49)中,对于实施方案(48)的药物组合物,共聚物中的甲基丙烯酸与甲基丙烯酸甲酯的比率为0.8:1至1.2:1。在实施方案(50)中,对于实施方案(49)的药物组合物,共聚物中的甲基丙烯酸与甲基丙烯酸甲酯的比率为1:1(eudragitl100)。在实施方案(51)中,对于实施方案(1)-(50)中的任一项的药物组合物,第一药物珠粒组合物中的肠溶包衣包含增塑剂。在实施方案(52)中,对于实施方案(51)的药物组合物,第一药物珠粒组合物的肠溶包衣中的增塑剂选自由以下组成的组:柠檬酸乙酰基三丁酯、柠檬酸乙酰基三乙酯、苯甲酸苄酯、蓖麻油、氯丁醇、二乙酰化单甘油酯、癸二酸二丁酯、邻苯二甲酸二乙酯、甘油、甘露糖醇、聚乙二醇、聚乙二醇单甲基醚、丙二醇、普鲁兰、山梨糖醇、山梨糖醇脱水山梨糖醇溶液、甘油三乙酸酯、柠檬酸三丁酯、柠檬酸三乙酯和维生素e。在实施方案(53)中,对于实施方案(52)的药物组合物,增塑剂是柠檬酸三乙酯。在实施方案(54)中,对于实施方案(53)的药物组合物,柠檬酸三乙酯与甲基丙烯酸和甲基丙烯酸甲酯的共聚物的重量比为1:1至1:20。在实施方案(55)中,对于实施方案(54)的药物组合物,柠檬酸三乙酯与甲基丙烯酸和甲基丙烯酸甲酯的共聚物的重量比为1:5。在实施方案(56)中,对于实施方案(1)-(31)和(47)-(55)中的任一项的药物组合物,第一药物珠粒制剂还包含围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比是第一药物珠粒制剂的惰性核心和第一层的总重量的0.1-3.9%。在实施方案(57)中,对于实施方案(1)-(31)和(47)-(55)中的任一项的药物组合物,第一药物珠粒制剂还包含功能性包衣,其中功能性包衣在第一层和肠溶包衣之间(即,功能性包衣围绕第一层,并且肠溶包衣围绕功能性包衣),并且功能性包衣的重量百分比是第一药物珠粒制剂的惰性核心和第一层的总重量的0.1-3.9%。在实施方案(58)中,对于实施方案(56)或(57)的药物组合物,第一药物珠粒组合物中的功能性包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的2.0-3.0%。在实施方案(59)中,对于实施方案(58)的药物组合物,第一药物珠粒组合物中的功能性包衣的重量百分比是第一药物珠粒组合物中的惰性核心和第一层的总重量的2.5%。在实施方案(60)中,对于实施方案(32)-(55)中的任一项的药物组合物,第一药物珠粒制剂还包含围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比是第一药物珠粒制剂的核心的总重量的0.1-3.9%。在实施方案(61)中,对于实施方案(32)-(55)中的任一项的药物组合物,第一药物珠粒制剂还包含功能性包衣,其中功能性包衣在核心和肠溶包衣之间(即,功能性包衣围绕核心,并且肠溶包衣围绕功能性包衣),并且功能性包衣的重量百分比是第一药物珠粒制剂的核心的总重量的0.1-3.9%。在实施方案(62)中,对于实施方案(60)或(61)的药物组合物,第一药物珠粒组合物中的功能性包衣的重量百分比是第一药物珠粒组合物中的核心的总重量的2.0-3.0%。在实施方案(63)中,对于实施方案(60)或(61)的药物组合物,第一药物珠粒组合物中的功能性包衣的重量百分比是第一药物珠粒组合物中的核心的总重量的2.5%。在实施方案(64)中,对于实施方案(56)-(63)中的任一项的药物组合物,第一药物珠粒组合物中的功能性包衣包含一种或多种水不溶性聚合物和一种或多种水溶性聚合物的混合物。在实施方案(65)中,对于实施方案(56)-(63)中的任一项的药物组合物,其中第一药物珠粒组合物中的功能性包衣包含选自由以下组成的组的一种或多种赋形剂:聚乙烯吡咯烷酮(pvp)、聚环氧乙烷(peo)、单硬脂酸甘油酯、羟丙基甲基纤维素(hpmc)、soluplus、聚乙烯醇(pva)、聚乙烯醇(pva)、乙酸羟丙基甲基纤维素琥珀酸酯(hpmcas)、乙烯乙酸乙烯酯(eva)、甲基丙烯酸酯(eudragittm)、乙酸丁酸纤维素(cab)、乙酸邻苯二甲酸纤维素(cap)、聚(乙二醇)、聚(乙酸乙烯酯)(pvac)、聚丙交酯(pla)、聚乙交酯(pga)、pla/pga和聚己内酯(pcl)的共聚物、聚乙烯吡咯烷酮-乙酸乙烯酯共聚物(kollidonva-64)、聚氨酯、聚(乳酸)、聚(乙醇酸)、聚(酸酐-酰亚胺)、聚(酸酐-酯)、聚(亚氨基碳酸酯)、聚(磷腈)、聚(磷酸酯)、乙基纤维素(ec)、羟丙基纤维素(hpc)、海藻酸、卡波姆共聚物、卡波姆均聚物、卡波姆互聚物、羧甲基纤维素钠、角叉菜胶、纤维醋丁酯、乙基纤维素水分散体、乙基纤维素分散体b型、单油酸甘油酯、瓜尔胶、羟丙基倍他环糊精、聚乙酸乙烯酯分散体、虫胶、海藻酸钠、预胶化淀粉、预胶化改性淀粉和黄原胶。在实施方案(66)中,对于实施方案(65)的药物组合物,其中第一药物珠粒组合物中的功能性包衣包含乙基纤维素(ec)和羟丙基纤维素(hpc)的混合物。在实施方案(67)中,对于实施方案(65)的药物组合物,第一药物珠粒组合物中的功能性包衣包含ethoceltm10(对于于80%甲苯和20%乙醇中的5重量%溶液,粘度范围为9-11cp的乙基纤维素聚合物)和jf(对于于水中的5重量%溶液,粘度范围为150-400cp的羟丙基纤维素聚合物)的混合物。在实施方案(68)中,对于实施方案(66)或(67)的药物组合物,乙基纤维素与羟丙基纤维素的重量比为90:10至10:90。在实施方案(69)中,对于实施方案(68)的药物组合物,乙基纤维素与羟丙基纤维素的重量比为80:20至20:80。在实施方案(70)中,对于实施方案(68)的药物组合物,乙基纤维素与羟丙基纤维素的重量比为80:20至50:50。在实施方案(71)中,对于实施方案(68)的药物组合物,乙基纤维素与羟丙基纤维素的重量比为75:25至60:40。在实施方案(72)中,对于实施方案(68)的药物组合物,乙基纤维素与羟丙基纤维素的重量比为70:30。在实施方案(73)中,对于实施方案(68)的药物组合物,乙基纤维素与羟丙基纤维素的重量比为65:35。在实施方案(74)中,对于实施方案(68)的药物组合物,乙基纤维素与羟丙基纤维素的重量比为60:40。在实施方案(75)中,对于实施方案(65)的药物组合物,第一药物珠粒组合物中的功能性包衣包含rs(聚(丙烯酸乙酯-甲基丙烯酸甲酯-甲基丙烯酸三甲基铵乙酯氯化物共聚物)1:2:0.1)和rl(聚(丙烯酸乙酯-甲基丙烯酸甲酯-甲基丙烯酸三甲基铵乙酯氯化物共聚物)1:2:0.2)的混合物。在实施方案(76)中,对于实施方案(75)的药物组合物,rs与rl的重量比在95:5至5:95之间。在实施方案(77)中,对于实施方案(75)的药物组合物,rs与rl的重量比在90:10至50:50之间。在实施方案(78)中,对于实施方案(75)的药物组合物,其中rs与rl的重量比在90:10至60:40之间。在实施方案(79)中,对于实施方案(75)的药物组合物,其中rs与rl的重量比在85:15至70:30之间。在实施方案(80)中,对于实施方案(75)的药物组合物,其中rs与rl的重量比是75:25。在实施方案(81)中,对于实施方案(75)的药物组合物,其中rs与rl的重量比是80:20。在实施方案(82)中,对于实施方案(1)-(81)中的任一项的药物组合物,第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯;围绕第一层的肠溶包衣;和围绕肠溶包衣的功能性包衣。在实施方案(83)中,对于实施方案(1)-(81)中的任一项的药物组合物,第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯;围绕第一层的肠溶包衣;和围绕功能性包衣的肠溶包衣。在实施方案(84)中,对于实施方案(82)或(83)的药物组合物,第二药物珠粒组合物中的惰性核心包含选自由以下组成的组的一种或多种惰性物质:淀粉、右旋糖、蔗糖、乳糖、麦芽糖和微晶纤维素。。在实施方案(85)中,对于实施方案(82)或(83)的药物组合物,第二药物珠粒组合物中的惰性核心包含乳糖。在实施方案(86)中,对于实施方案(82)或(83)的药物组合物,第二药物珠粒组合物中的惰性核心包含蔗糖。在实施方案(87)中,对于实施方案(82)或(83)的药物组合物,第二药物珠粒组合物中的惰性核心包含淀粉。在实施方案(88)中,对于实施方案(82)-(87)中的任一项的药物组合物,第二药物珠粒组合物中的惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的10%-60%。在实施方案(89)中,对于实施方案(88)的药物组合物,第二药物珠粒组合物中的惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的20%-40%。在实施方案(90)中,对于实施方案(88)的药物组合物,第二药物珠粒组合物中的惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的20%-30%。在实施方案(91)中,对于实施方案(88)的药物组合物,第二药物珠粒组合物中的惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的20%-24%。在实施方案(92)中,对于实施方案(88)的药物组合物,第二药物珠粒组合物中的惰性核心的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的16%-20%。在实施方案(93)中,对于实施方案(82)-(92)中的任一项的药物组合物,第二药物珠粒组合物中的惰性核心是直径为200-850μm的球体。在实施方案(94)中,对于实施方案(93)的药物组合物,第二药物珠粒组合物中的惰性核心球体的直径为250-350μm、500-600μm或700-850μm的球体。在实施方案(95)中,对于实施方案(93)的药物组合物,第二药物珠粒组合物中的惰性核心球体的直径为350μm、550μm或750μm。在实施方案(96)中,对于实施方案(82)-(95)中的任一项的药物组合物,第二药物珠粒组合物中的富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的40%-80%。在实施方案(97)中,对于实施方案(96)的药物组合物,第二药物珠粒组合物中的富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的50%-75%。在实施方案(98)中,对于实施方案(96)的药物组合物,第二药物珠粒组合物中的富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的65%-75%。在实施方案(99)中,对于实施方案(96)的药物组合物,第二药物珠粒组合物中的富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的68%-72%。在实施方案(100)中,对于实施方案(96)的药物组合物,第二药物珠粒组合物中的富马酸二甲酯的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的72-76%。在实施方案(101)中,对于实施方案(82)-(100)中的任一项的药物组合物,第二药物珠粒组合物中的第一层还包含粘合剂。在实施方案(102)中,对于实施方案(101)的药物组合物,第二药物珠粒组合物的第一层中的粘合剂选自由以下组成的组:阿拉伯树胶、琼脂、海藻酸、氨基甲基丙烯酸酯共聚物、铵基甲基丙烯酸酯共聚物、铵基甲基丙烯酸酯共聚物分散体、碳酸钙、乳酸钙、卡波姆共聚物、卡波姆均聚物、卡波姆互聚物、羧甲基纤维素钠、微晶纤维素、硅化微晶纤维素、氢化椰子油、共聚维酮、玉米糖浆、玉米糖浆固体、葡萄糖结合剂、糊精、丙烯酸乙酯和甲基丙烯酸甲酯共聚物分散体、乙基纤维素、乙二醇和乙烯醇接枝共聚物、明胶、液体葡萄糖、山嵛酸甘油酯、瓜尔胶、羟乙基纤维素、羟丙基纤维素、低取代羟丙基纤维素、羟丙甲纤维素、乙酸羟丙甲纤维素琥珀酸酯、菊粉、α-乳清蛋白、乳糖一水合物、麦芽糖糊精、麦芽糖、甲基丙烯酸共聚物、甲基丙烯酸共聚物分散体、甲基丙烯酸和丙烯酸乙酯共聚物分散体、甲基纤维素、氢化棕榈油、聚卡波非、氢化聚右旋糖、聚环氧乙烷、聚乙酸乙烯酯、聚维酮、普鲁兰、海藻酸钠、预胶化淀粉、预胶化改性淀粉、玉米淀粉、羟丙基玉米淀粉、预胶化羟丙基玉米淀粉、豌豆淀粉、羟丙基豌豆淀粉、预胶化羟丙基豌豆淀粉、马铃薯淀粉、羟丙基马铃薯淀粉、预胶化羟丙基马铃薯淀粉、木薯淀粉、小麦淀粉、氢化淀粉水解物、蔗糖、葵花油、糖浆、海藻糖、氢化植物油、维生素e聚乙二醇琥珀酸酯、玉米醇溶蛋白、羟丙基甲基纤维素(hpmc)、聚乙烯吡咯烷酮(pvp)、甲基纤维素、乙基纤维素、羧甲基纤维素钠、聚乙二醇(peg)、聚乙烯醇、聚甲基丙烯酸酯、淀粉糊、淀粉钠、黄蓍胶、明胶、海藻酸盐、海藻酸钠、海藻酸、纤维素、小烛树蜡、巴西棕榈蜡、共聚维酮和含水乳糖。在实施方案(103)中,对于实施方案(102)的药物组合物,第二药物珠粒组合物的第一层中的粘合剂是羟丙基甲基纤维素(hpmc)。在实施方案(104)中,对于实施方案(101)-(103)中的任一项的药物组合物,第二药物珠粒组合物的第一层中的粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的1%-25%。在实施方案(105)中,对于实施方案(104)的药物组合物,第二药物珠粒组合物的第一层中的粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的1%-20%。在实施方案(106)中,对于实施方案(104)的药物组合物,第二药物珠粒组合物的第一层中的粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5%-15%。在实施方案(107)中,对于实施方案(104)的药物组合物,第二药物珠粒组合物的第一层中的粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5%-10%。在实施方案(108)中,对于实施方案(104)的药物组合物,第二药物珠粒组合物的第一层中的粘合剂的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的7%。在实施方案(109)中,对于实施方案(82)-(108)中的任一项的药物组合物,第二药物珠粒组合物中的肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的1-20%。在实施方案(110)中,对于实施方案(109)的药物组合物,第二药物珠粒组合物中的肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5-15%。在实施方案(111)中,对于实施方案(109)的药物组合物,第二药物珠粒组合物中的肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的10-15%。在实施方案(112)中,对于实施方案(109)的药物组合物,第二药物珠粒组合物中的肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的11-13%。在实施方案(113)中,对于实施方案(109)的药物组合物,第二药物珠粒组合物中的肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的12%。在实施方案(114)中,对于实施方案(82)-(113)中的任一项的药物组合物,其中第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的1-30%。在实施方案(115)中,对于实施方案(114)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的1-20%。在实施方案(116)中,对于实施方案(114)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的4-12%。在实施方案(117)中,对于实施方案(114)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的1-10%。在实施方案(118)中,对于实施方案(114)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的10-15%。在实施方案(119)中,对于实施方案(114)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的4.5-5.5%。在实施方案(120)中,对于实施方案(114)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5.0%。在实施方案(121)中,对于实施方案(114)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的4.0-5.0%。在实施方案(122)中,对于实施方案(114)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的4.5%。在实施方案(123)中,对于实施方案(114)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5.0-6.0%。在实施方案(124)中,对于实施方案(114)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的5.5%。在实施方案(125)中,对于实施方案(114)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的11.5-12.5%。在实施方案(126)中,对于实施方案(114)的药物组合物,其中第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的12%。在实施方案(127)中,对于实施方案(1)-(81)中的任一项的药物组合物,第二药物珠粒组合物包含:包含富马酸二甲酯的核心;围绕核心的肠溶包衣;和围绕肠溶包衣的功能性包衣。在实施方案(128)中,对于实施方案(1)-(81)中的任一项的药物组合物,第二药物珠粒组合物包含:包含富马酸二甲酯的核心;围绕核心的功能性包衣;和围绕功能性包衣的肠溶包衣。在实施方案(129)中,对于实施方案(127)或(128)的药物组合物,第二药物珠粒组合物中的富马酸二甲酯的重量百分比是第二药物珠粒组合物中的核心的总重量的40%-80%。在实施方案(130)中,对于实施方案(129)的药物组合物,第二药物珠粒组合物中的富马酸二甲酯的重量百分比是第二药物珠粒组合物中的核心的总重量的60%-80%、60-70%或70-80%。在实施方案(131)中,对于实施方案(130)的药物组合物,第二药物珠粒组合物中的富马酸二甲酯的重量百分比是第二药物珠粒组合物中的核心的总重量的65%。在实施方案(132)中,对于实施方案(130)的药物组合物,第二药物珠粒组合物中的富马酸二甲酯的重量百分比是第二药物珠粒组合物中的核心的总重量的75%。在实施方案(133)中,对于实施方案(127)-(132)中的任一项的药物组合物,第二药物珠粒组合物中的核心还包含粘合剂。在实施方案(134)中,对于实施方案(133)的药物组合物,第二药物珠粒组合物的核心中的粘合剂选自由以下组成的组:阿拉伯树胶、琼脂、海藻酸、氨基甲基丙烯酸酯共聚物、铵基甲基丙烯酸酯共聚物、铵基甲基丙烯酸酯共聚物分散体、碳酸钙、乳酸钙、卡波姆共聚物、卡波姆均聚物、卡波姆互聚物、羧甲基纤维素钠、微晶纤维素、硅化微晶纤维素、氢化椰子油、共聚维酮、玉米糖浆、玉米糖浆固体、葡萄糖结合剂、糊精、丙烯酸乙酯和甲基丙烯酸甲酯共聚物分散体、乙基纤维素、乙二醇和乙烯醇接枝共聚物、明胶、液体葡萄糖、山嵛酸甘油酯、瓜尔胶、羟乙基纤维素、羟丙基纤维素、低取代羟丙基纤维素、羟丙甲纤维素、乙酸羟丙甲纤维素琥珀酸酯、菊粉、α-乳清蛋白、乳糖一水合物、麦芽糖糊精、麦芽糖、甲基丙烯酸共聚物、甲基丙烯酸共聚物分散体、甲基丙烯酸和丙烯酸乙酯共聚物分散体、甲基纤维素、氢化棕榈油、聚卡波非、氢化聚右旋糖、聚环氧乙烷、聚乙酸乙烯酯、聚维酮、普鲁兰、海藻酸钠、预胶化淀粉、预胶化改性淀粉、玉米淀粉、羟丙基玉米淀粉、预胶化羟丙基玉米淀粉、豌豆淀粉、羟丙基豌豆淀粉、预胶化羟丙基豌豆淀粉、马铃薯淀粉、羟丙基马铃薯淀粉、预胶化羟丙基马铃薯淀粉、木薯淀粉、小麦淀粉、氢化淀粉水解物、蔗糖、葵花油、糖浆、海藻糖、氢化植物油、维生素e聚乙二醇琥珀酸酯、玉米醇溶蛋白、羟丙基甲基纤维素(hpmc)、聚乙烯吡咯烷酮(pvp)、甲基纤维素、乙基纤维素、羧甲基纤维素钠、聚乙二醇(peg)、聚乙烯醇、聚甲基丙烯酸酯、淀粉糊、淀粉钠、黄蓍胶、明胶、海藻酸盐、海藻酸钠、海藻酸、纤维素、小烛树蜡、巴西棕榈蜡、共聚维酮和含水乳糖。在实施方案(135)中,对于实施方案(133)的药物组合物,第二药物珠粒组合物的核心中的粘合剂是微晶纤维素或淀粉。在实施方案(136)中,对于实施方案(133)-(135)中的任一项的药物组合物,第二药物珠粒组合物的核心中的粘合剂的重量百分比是第二药物珠粒组合物中的核心的重量的1-50%。在实施方案(137)中,对于实施方案(136)的药物组合物,第二药物珠粒组合物的核心中的粘合剂的重量百分比是第二药物珠粒组合物中的核心的重量的15-35%。在实施方案(138)中,对于实施方案(127)-(137)中的任一项的药物组合物,第二药物珠粒组合物中的肠溶包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的1-20%。在实施方案(139)中,对于实施方案(138)的药物组合物,第二药物珠粒组合物中的肠溶包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的5-15%。在实施方案(140)中,对于实施方案(138)的药物组合物,第二药物珠粒组合物中的肠溶包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的10-15%。在实施方案(141)中,对于实施方案(138)的药物组合物,第二药物珠粒组合物中的肠溶包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的11-13%。在实施方案(142)中,对于实施方案(138)的药物组合物,第二药物珠粒组合物中肠溶包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的12%。在实施方案(143)中,对于实施方案(127)-(142)中的任一项的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的1-30%。在实施方案(144)中,对于实施方案(143)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的1-20%。在实施方案(145)中,对于实施方案(143)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的4-12%。在实施方案(146)中,对于实施方案(143)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的1-10%。在实施方案(147)中,对于实施方案(143)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的10-15%。在实施方案(148)中,对于实施方案(143)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的4.5-5.5%。在实施方案(149)中,对于实施方案(143)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的5.0%。在实施方案(150)中,对于实施方案(143)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的5.0-6.0%。在实施方案(151)中,对于实施方案(143)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的5.5%。在实施方案(152)中,对于实施方案(143)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的11.5-12.5%。在实施方案(153)中,对于实施方案(143)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的12%。在实施方案(154)中,对于实施方案(143)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的4.0-5.0%。在实施方案(155)中,对于实施方案(154)的药物组合物,第二药物珠粒组合物中的功能性包衣的重量百分比是第二药物珠粒组合物中的核心的总重量的4.5%。在实施方案(156)中,对于实施方案(82)-(155)中的任一项的药物组合物,第二药物珠粒组合物中的肠溶包衣包含选自由以下组成的组的赋形剂:甲基丙烯酸和甲基丙烯酸甲酯的共聚物、甲基丙烯酸和丙烯酸乙酯的共聚物、邻苯二甲酸羟丙甲纤维素(hpmcp)、乙酸邻苯二甲酸纤维素。在实施方案(157)中,对于实施方案(156)的药物组合物,第二药物珠粒组合物中的肠溶包衣包含甲基丙烯酸和甲基丙烯酸甲酯的共聚物。在实施方案(158)中,对于实施方案(157)的药物组合物,其中共聚物中的甲基丙烯酸与甲基丙烯酸甲酯的比率为0.8:1至1.2:1。在实施方案(159)中,对于实施方案(158)的药物组合物,其中共聚物中的甲基丙烯酸与甲基丙烯酸甲酯的比率为1:1(eudragitl100)。在实施方案(160)中,对于实施方案(82)-(159)中的任一项的药物组合物,其中第二药物珠粒组合物中的肠溶包衣包含增塑剂。在实施方案(161)中,对于实施方案(160)的药物组合物,第二药物珠粒组合物的肠溶包衣中的增塑剂选自由以下组成的组:柠檬酸乙酰基三丁酯、柠檬酸乙酰基三乙酯、苯甲酸苄酯、蓖麻油、氯丁醇、二乙酰化单甘油酯、癸二酸二丁酯、邻苯二甲酸二乙酯、甘油、甘露糖醇、聚乙二醇、聚乙二醇单甲基醚、丙二醇、普鲁兰、山梨糖醇、山梨糖醇脱水山梨糖醇溶液、甘油三乙酸酯、柠檬酸三丁酯、柠檬酸三乙酯和维生素e。在实施方案(162)中,对于实施方案(161)的药物组合物,第二药物珠粒组合物的肠溶包衣中的增塑剂是柠檬酸三乙酯。在实施方案(163)中,对于实施方案(162)的药物组合物,柠檬酸三乙酯与甲基丙烯酸和甲基丙烯酸甲酯的共聚物的重量比为1:1至1:20。在实施方案(164)中,对于实施方案(163)的药物组合物,其中柠檬酸三乙酯与甲基丙烯酸和甲基丙烯酸甲酯的共聚物的重量比为1:5。在实施方案(165)中,对于实施方案(82)-(164)中的任一项的药物组合物,第二药物珠粒组合物中的功能性包衣包含一种或多种水不溶性聚合物和一种或多种水溶性聚合物的混合物。在实施方案(166)中,对于实施方案(82)-(164)中的任一项的药物组合物,第二药物珠粒组合物中的功能性包衣包含选自由以下组成的组的一种或多种赋形剂:聚乙烯吡咯烷酮(pvp)、聚环氧乙烷(peo)、单硬脂酸甘油酯、羟丙基甲基纤维素(hpmc)、soluplus、聚乙烯醇(pva)、聚乙烯醇(pva)、乙酸羟丙基甲基纤维素琥珀酸酯(hpmcas)、乙烯乙酸乙烯酯(eva)、甲基丙烯酸酯(eudragittm)、乙酸丁酸纤维素(cab)、乙酸邻苯二甲酸纤维素(cap)、聚(乙二醇)、聚(乙酸乙烯酯)(pvac)、聚丙交酯(pla)、聚乙交酯(pga)、pla/pga和聚己内酯(pcl)的共聚物、聚乙烯吡咯烷酮-乙酸乙烯酯共聚物(kollidonva-64)、聚氨酯、聚(乳酸)、聚(乙醇酸)、聚(酸酐-酰亚胺)、聚(酸酐-酯)、聚(亚氨基碳酸酯)、聚(磷腈)、聚(磷酸酯)、乙基纤维素(ec)、羟丙基纤维素(hpc)、海藻酸、卡波姆共聚物、卡波姆均聚物、卡波姆互聚物、羧甲基纤维素钠、角叉菜胶、纤维醋丁酯、乙基纤维素水分散体、乙基纤维素分散体b型、单油酸甘油酯、瓜尔胶、羟丙基倍他环糊精、聚乙酸乙烯酯分散体、虫胶、海藻酸钠、预胶化淀粉、预胶化改性淀粉和黄原胶。在实施方案(167)中,对于实施方案(82)-(164)中的任一项的药物组合物,第二药物珠粒组合物中的功能性包衣包含乙基纤维素(ec)和羟丙基纤维素(hpc)的混合物。在实施方案(168)中,对于实施方案(167)的药物组合物,第二药物珠粒组合物中的功能性包衣包含ethoceltm10(对于于80%甲苯和20%乙醇中的5重量%溶液,粘度范围为9-11cp的乙基纤维素聚合物)和jf(对于于水中的5重量%溶液,粘度范围为150-400cp的羟丙基纤维素聚合物)的混合物。在实施方案(169)中,对于实施方案(167)或(168)的药物组合物,乙基纤维素与羟丙基纤维素的重量比为90:10至10:90。在实施方案(170)中,对于实施方案(169)的药物组合物,乙基纤维素与羟丙基纤维素的重量比在80:20至20:80之间。在实施方案(171)中,对于实施方案(169)的药物组合物,乙基纤维素与羟丙基纤维素的重量比在80:20至50:50之间。在实施方案(172)中,对于实施方案(169)的药物组合物,乙基纤维素与羟丙基纤维素的重量比在75:25至60:40之间。在实施方案(173)中,对于实施方案(169)的药物组合物,乙基纤维素与羟丙基纤维素的重量比为70:30。在实施方案(174)中,对于实施方案(169)的药物组合物,乙基纤维素与羟丙基纤维素的重量比为65:35。在实施方案(175)中,对于实施方案(166)的药物组合物,其中乙基纤维素与羟丙基纤维素的重量比为60:40。在实施方案(176)中,对于实施方案(82)-(164)中的任一项的药物组合物,第二药物珠粒组合物中的功能性包衣包含rs(聚(丙烯酸乙酯-甲基丙烯酸甲酯-甲基丙烯酸三甲基铵乙酯氯化物共聚物)1:2:0.1)和rl(聚(丙烯酸乙酯-甲基丙烯酸甲酯-甲基丙烯酸三甲基铵乙酯氯化物共聚物)1:2:0.2)的混合物。在实施方案(177)中,对于实施方案(176)的药物组合物,rs与rl的重量比在95:5至5:95之间。在实施方案(178)中,对于实施方案(176)的药物组合物,rs与rl的重量比在90:10至50:50之间。在实施方案(179)中,对于实施方案(176)的药物组合物,rs与rl的重量比在90:10至60:40之间。在实施方案(180)中,对于实施方案(176)的药物组合物,rs与rl的重量比在85:15至70:30之间。在实施方案(181)中,对于实施方案(176)的药物组合物,其中rs与rl的重量比是75:25。在实施方案(182)中,对于实施方案(176)的药物组合物,其中rs与rl的重量比是80:20。在实施方案(183),对于实施方案(82)、(84)-(127)和(129)-(182)中的任一项的药物组合物,第二药物珠粒组合物还包含围绕功能性包衣的第二肠溶包衣。在实施方案(184)中,对于实施方案(183)的药物组合物,第二肠溶包衣包含选自由以下组成的组的赋形剂:甲基丙烯酸和甲基丙烯酸甲酯的共聚物,甲基丙烯酸和丙烯酸乙酯的共聚物,邻苯二甲酸羟丙甲纤维素(hpmcp),乙酸邻苯二甲酸纤维素。在实施方案(185)中,对于实施方案(183)的药物组合物,第二肠溶包衣包含甲基丙烯酸和甲基丙烯酸甲酯的共聚物。在实施方案(186)中,对于实施方案(185)的药物组合物,共聚物中的甲基丙烯酸与甲基丙烯酸甲酯的比率为0.8:1至1.2:1。在实施方案(187)中,对于实施方案(186)的药物组合物,其中共聚物中的甲基丙烯酸与甲基丙烯酸甲酯的比率为1:1(eudragitl100)。在实施方案(188)中,对于实施方案(183)-(187)中的任一项的药物组合物,第二肠溶包衣包含增塑剂。在实施方案(189)中,对于实施方案(188)的药物组合物,第二肠溶包衣中的增塑剂选自由以下组成的组:柠檬酸乙酰基三丁酯、柠檬酸乙酰基三乙酯、苯甲酸苄酯、蓖麻油、氯丁醇、二乙酰化单甘油酯、癸二酸二丁酯、邻苯二甲酸二乙酯、甘油、甘露糖醇、聚乙二醇、聚乙二醇单甲基醚、丙二醇、普鲁兰、山梨糖醇、山梨糖醇脱水山梨糖醇溶液、甘油三乙酸酯、柠檬酸三丁酯、柠檬酸三乙酯和维生素e。在实施方案(190)中,对于实施方案(189)的药物组合物,第二肠溶包衣中的增塑剂是柠檬酸三乙酯。在实施方案(191)中,对于实施方案(190)的药物组合物,柠檬酸三乙酯与甲基丙烯酸和甲基丙烯酸甲酯的共聚物的重量比为1:1至1:20。在实施方案(192)中,对于实施方案(191)的药物组合物,柠檬酸三乙酯与甲基丙烯酸和甲基丙烯酸甲酯的共聚物的重量比为1:5。在实施方案(193)中,对于实施方案(183)-(192)中的任一项的药物组合物,第二肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的1-20%。在实施方案(194)中,对于实施方案(193)的药物组合物,第二肠溶包衣的重量百分比是是第二药物珠粒组合物中的惰性核心和第一层的总重量的5-15%。在实施方案(195)中,对于实施方案(193)的药物组合物,第二肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的10-15%。在实施方案(196)中,对于实施方案(193)的药物组合物,第二肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的11-13%。在实施方案(197)中,对于实施方案(193)的药物组合物,第二肠溶包衣的重量百分比是第二药物珠粒组合物中的惰性核心和第一层的总重量的12%。在实施方案(198)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是惰性核心和第一层的总重量的68%-72%,并且粘合剂的重量百分比是惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是惰性核心和第一层的总重量的11-13%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比是惰性核心和第一层的总重量的4.5%-5.5%,其中惰性核心的重量百分比是惰性核心和第一层的总重量的20-24%。在实施方案(199)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是惰性核心和第一层的总重量的68%-72%,并且粘合剂的重量百分比是惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是惰性核心和第一层的总重量的11-13%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比是惰性核心和第一层的总重量的5.0%-6.0%,其中惰性核心的重量百分比是惰性核心和第一层的总重量的20-24%。在实施方案(200)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是惰性核心和第一层的总重量的68%-72%,并且粘合剂的重量百分比是惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是惰性核心和第一层的总重量的11-13%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比是惰性核心和第一层的总重量的11.5%-12.5%,其中惰性核心的重量百分比是惰性核心和第一层的总重量的20-24%。在实施方案(201)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是惰性核心和第一层的总重量的72%-76%,并且粘合剂的重量百分比是惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是惰性核心和第一层的总重量的11-13%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比是惰性核心和第一层的总重量的4.0%-5.0%,其中惰性核心的重量百分比是惰性核心和第一层的总重量的20-24%。在实施方案(202)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是惰性核心和第一层的总重量的72%-76%,并且粘合剂的重量百分比是惰性核心和第一层的总重量的5-10%;围绕第一层的肠溶包衣,其中肠溶包衣的重量百分比是惰性核心和第一层的总重量的11-13%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比是惰性核心和第一层的总重量的4.0%-5.0%,其中惰性核心的重量百分比是惰性核心和第一层的总重量的16-20%。在实施方案(203)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是惰性核心和第一层的总重量的68%-72%,并且粘合剂的重量百分比是惰性核心和第一层的总重量的5-10%;围绕第一层的功能性包衣,其中功能性包衣的重量百分比为惰性核心和第一层的总重量的4.5%-5.5%;和围绕功能性包衣的肠溶包衣,其中肠溶包衣的重量百分比是惰性核心和第一层总重量的11-13%;其中惰性核心的重量百分比是惰性核心和第一层的总重量的20-24%。在实施方案(204)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是惰性核心和第一层的总重量的68%-72%,并且粘合剂的重量百分比是惰性核心和第一层的总重量的5-10%;围绕第一层的功能性包衣,其中功能性包衣的重量百分比为惰性核心和第一层的总重量的5.0%-6.0%;和围绕功能性包衣的肠溶包衣,其中肠溶包衣的重量百分比是惰性核心和第一层总重量的11-13%;和其中惰性核心的重量百分比是惰性核心和第一层的总重量的20-24%。在实施方案(205)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是惰性核心和第一层的总重量的68%-72%,并且粘合剂的重量百分比是惰性核心和第一层的总重量的5-10%;围绕第一层的功能性包衣,其中功能性包衣的重量百分比为惰性核心和第一层的总重量的11.5%-12.5%;和围绕功能性包衣的肠溶包衣,其中肠溶包衣的重量百分比是惰性核心和第一层总重量的11-13%;其中惰性核心的重量百分比是惰性核心和第一层的总重量的20-24%。在实施方案(206)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:惰性核心;围绕惰性核心的第一层,其中第一层包含富马酸二甲酯和粘合剂,并且其中富马酸二甲酯的重量百分比是惰性核心和第一层的总重量的72%-76%,并且粘合剂的重量百分比是惰性核心和第一层的总重量的5-10%;围绕第一层的功能性包衣,其中功能性包衣的重量百分比为惰性核心和第一层的总重量的4.0%-5.0%;和围绕功能性包衣的肠溶包衣,其中肠溶包衣的重量百分比是惰性核心和第一层总重量的11-13%;其中惰性核心的重量百分比是惰性核心和第一层的总重量的16-20%。在实施方案(207)中,对于实施方案(198)-(206)中的任一项的药物组合物,其中第二药物珠粒组合物中的惰性核心包含蔗糖或淀粉;第二药物珠粒组合物中的粘合剂是hpmc;第二药物珠粒组合物中的肠溶包衣包含甲基丙烯酸和甲基丙烯酸甲酯的共聚物,且共聚物中的甲基丙烯酸与甲基丙烯酸甲酯的比率为1:1;并且第二药物珠粒组合物中的功能性包衣包含乙基纤维素(ec)和羟丙基纤维素(hpc)的混合物,且乙基纤维素(ec)与羟丙基纤维素(hpc)的重量比为65:35。在实施方案(208)中,对于实施方案(207)的药物组合物,第二药物珠粒组合物中的肠溶包衣还包含柠檬酸三乙酯,且甲基丙烯酸和甲基丙烯酸甲酯的共聚物与柠檬酸三乙酯的重量比为5:1;并且第二药物珠粒组合物中的功能性包衣包含ethoceltm10(对于于80%甲苯和20%乙醇中的5重量%溶液,粘度范围为9-11cp的乙基纤维素聚合物)和jf(对于于水中的5重量%溶液,粘度范围为150-400cp的羟丙基纤维素聚合物)的混合物,其中ethoceltm10与jf的重量比是65:35。在实施方案(209),对于实施方案(198)-(206)中的任一项的药物组合物,其中第二药物珠粒组合物中的惰性核心包含蔗糖或淀粉;第二药物珠粒组合物中的粘合剂是hpmc;第二药物珠粒组合物的肠溶包衣包含甲基丙烯酸和甲基丙烯酸甲酯的共聚物,且共聚物中的甲基丙烯酸与甲基丙烯酸甲酯的比率为1:1;并且第二药物珠粒组合物中的功能性包衣包含乙基纤维素(ec)和羟丙基纤维素(hpc)的混合物,且乙基纤维素(ec)与羟丙基纤维素(hpc)的重量比为60:40。在实施方案(210),对于在实施方案(209)的药物组合物,第二药物珠粒组合物中的肠溶包衣还包含柠檬酸三乙酯,且甲基丙烯酸与甲基丙烯酸甲酯的共聚物与柠檬酸三乙酯的重量比为5:1;并且第二药物珠粒组合物中的功能性包衣包含ethoceltm10(对于于80%甲苯和20%乙醇中的5重量%溶液,粘度范围为9-11cp的乙基纤维素聚合物)和jf(对于于水中的5重量%溶液,粘度范围为150-400cp的羟丙基纤维素聚合物)的混合物,其中ethoceltm10与jf的重量比是60:40。在实施方案(211)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:包含活性物质的核心,其中活性物质是富马酸二甲酯;围绕核心的肠溶包衣,其中肠溶包衣的重量百分比是核心的总重量的11%-13%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比为核心的总重量的4.5%-5.5%,其中富马酸二甲酯的重量百分比是核心的总重量的60%-80%。在实施方案(212)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:包含活性物质的核心,其中活性物质是富马酸二甲酯;围绕核心的肠溶包衣,其中肠溶包衣的重量百分比是核心的总重量的11%-13%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比为核心的总重量的5.0%-6.0%,其中富马酸二甲酯的重量百分比是核心的总重量的60%-80%。在实施方案(213)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:包含活性物质的核心,其中活性物质是富马酸二甲酯;围绕核心的肠溶包衣,其中肠溶包衣的重量百分比是核心的总重量的11%-13%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比为核心的总重量的11.5%-12.5%,其中富马酸二甲酯的重量百分比是核心的总重量的60%-80%。在实施方案(214)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:包含活性物质的核心,其中活性物质是富马酸二甲酯;围绕核心的肠溶包衣,其中肠溶包衣的重量百分比是核心的总重量的11%-13%;和围绕肠溶包衣的功能性包衣,其中功能性包衣的重量百分比为核心的总重量的4.0%-5.0%,其中富马酸二甲酯的重量百分比是核心的总重量的60%-80%。在实施方案(215)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:包含活性物质的核心,其中活性物质是富马酸二甲酯;围绕芯的功能性包衣,其中功能性包衣的重量百分比为核心的总重量的4.5%-5.5%,围绕功能性包衣的肠溶包衣,其中肠溶包衣的重量百分比为核心的总重量的11%-13%;和其中富马酸二甲酯的重量百分比是核心的总重量的60%-80%。在实施方案(216)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:包含活性物质的核心,其中活性物质是富马酸二甲酯;围绕核心的功能性包衣,其中功能性包衣的重量百分比为核心的总重量的5.0%-6.0%,围绕功能性包衣的肠溶包衣,其中肠溶包衣的重量百分比为核心的总重量的11%-13%;和其中富马酸二甲酯的重量百分比是核心的总重量的60%-80%。在实施方案(217)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:包含活性物质的核心,其中活性物质是富马酸二甲酯;围绕核心的功能性包衣,其中功能性包衣的重量百分比为核心的总重量的11.5%-12.5%,围绕功能性包衣的肠溶包衣,其中肠溶包衣的重量百分比为核心的总重量的11%-13%;和其中富马酸二甲酯的重量百分比是核心的总重量的60%-80%。在实施方案(218)中,对于实施方案(1)-(81)中的任一项的药物组合物,其中第二药物珠粒组合物包含:包含活性物质的核心,其中活性物质是富马酸二甲酯;围绕核心的功能性包衣,其中功能性包衣的重量百分比为核心的总重量的4.0%-5.0%,围绕功能性包衣的肠溶包衣,其中肠溶包衣的重量百分比为核心的总重量的11%-13%;和其中富马酸二甲酯的重量百分比是核心的总重量的60%-80%。在实施方案(219)中,对于实施方案(211)-(218)中的任一项的药物组合物,第二药物珠粒组合物中的肠溶包衣包含甲基丙烯酸和甲基丙烯酸甲酯的共聚物,且共聚物中的甲基丙烯酸与甲基丙烯酸甲酯的比率为1:1;并且功能性包衣包含乙基纤维素(ec)和羟丙基纤维素(hpc)的混合物,且乙基纤维素(ec)与羟丙基纤维素(hpc)的重量比为65:35。在实施方案(220)中,对于实施方案(219)的药物组合物,第二药物珠粒组合物中的肠溶包衣还包含柠檬酸三乙酯,且甲基丙烯酸和甲基丙烯酸甲酯的共聚物与柠檬酸三乙酯的重量比为5:1;并且功能性包衣包含ethoceltm10(对于于80%甲苯和20%乙醇中的5重量%溶液,粘度范围为9-11cp的乙基纤维素聚合物)和jf(对于于水中的5重量%溶液,粘度范围为150-400cp的羟丙基纤维素聚合物)的混合物,其中ethoceltm10与jf的中重量比是65:35。在实施方案(221)中,对于实施方案(211)-(218)中的任一项的药物组合物,第二药物珠粒组合物中的肠溶包衣包含甲基丙烯酸和甲基丙烯酸甲酯的共聚物,且共聚物中的甲基丙烯酸与甲基丙烯酸甲酯的比率为1:1;并且功能性包衣包含乙基纤维素(ec)和羟丙基纤维素(hpc)的混合物,且乙基纤维素(ec)与羟丙基纤维素(hpc)的重量比为60:40。在实施方案(222)中,对于实施方案(221)的药物组合物中,第二药物珠粒组合物中的肠溶包衣还包含柠檬酸三乙酯,且甲基丙烯酸和甲基丙烯酸甲酯的共聚物与柠檬酸三乙酯的重量比为5:1;并且功能性包衣包含ethoceltm10(对于于80%甲苯和20%乙醇中的5重量%溶液,粘度范围为9-11cp的乙基纤维素聚合物)和jf(对于于水中的5重量%溶液,粘度范围为150-400cp的羟丙基纤维素聚合物)的混合物,其中ethoceltm10与jf的重量比是60:40。在实施方案(223)中,对于实施方案(32)-(55)和(60)-(81)中的任一项的药物组合物,第一药物珠粒组合物中的核心的直径在0.5mm至2.0mm的范围内。在实施方案(224)中,对于实施方案(223)的药物组合物,第一药物珠粒组合物中的核心的直径在0.6mm至2.0mm的范围内。在实施方案(225)中,对于实施方案(223)的药物组合物,第一药物珠粒组合物中的核心的直径在0.5mm至1.5mm的范围内。在实施方案(226)中,对于实施方案(127)-(197)和(211)-(225)中的任一项的药物组合物,第二药物珠粒组合物中的核心的直径在0.5mm至2.0mm的范围内。在实施方案(227)中,对于实施方案(226)的药物组合物,第二药物珠粒组合物中的核心的直径在0.6mm至2.0mm的范围内。在实施方案(228)中,对于实施方案(226)的药物组合物,第二药物珠粒组合物中的核心的直径在0.5mm至1.5mm的范围内。本发明的控制释放药物珠粒组合物(即,第二药物珠粒组合物)当进行溶出试验时,提供活性物质富马酸二甲酯的延长释放。溶出试验可根据由usp-nf公开的标准程序进行。在一个实施方案中,本发明的药物组合物的溶出曲线是通过以下来确定的:在usp装置ii(桨式装置)中,在试验的前2小时内使用0.1n盐酸作为溶出介质并且然后使用不含胰酶的usp模拟肠液(sif)作为溶出介质使本发明的药物组合物进行体外溶出试验(试验1)。或者,溶出曲线是通过以下来确定的:在usp装置iv(流通池)中,在试验的前2小时内使用不含胃蛋白酶的usp模拟胃液(sgf)作为溶出介质并且然后使用不含胰酶的usp模拟肠液(sif)作为溶出介质使本发明的药物组合物进行体外溶出试验(试验2)。在又一个实施方案中,溶出曲线是通过以下来确定的:在usp装置iv(流通池)中,使用不含胰酶的usp模拟肠液(sif)使本发明的药物组合物进行体外溶出试验(试验3)。uspsif和sgf溶液可根据usp35-nf30中描述的程序制备。在某些实施方案中,当进行溶出试验1时,本发明的药物珠粒组合物具有以下溶出曲线:在试验的前2小时内,释放出片剂中的小于10重量%的活性物质;在试验的前4小时内,释放出片剂中的10-70重量%的活性物质;和在试验的前7小时内,释放出片剂中的50-100重量%的活性物质。在某些实施方案中,当进行溶出试验1时,本发明的片剂组合物具有以下溶出曲线:在试验的前2小时内,释放出片剂中的小于10重量%的活性物质;和在试验的前4小时内,释放出片剂中的90-100重量%的活性物质。在某些实施方案中,当进行溶解试验2时,本发明的珠粒组合物具有以下溶出曲线:在试验的前2小时内,释放出片剂中的小于10重量%的活性物质;在试验的前4小时内,释放出片剂中的10-70重量%的活性物质;和在试验的前9小时内,释放出片剂中的50-100重量%的活性物质。在某些实施方案中,当进行溶解试验2时,本发明的珠粒组合物具有以下溶出曲线:在试验的前2小时内,释放出片剂中的小于10重量%的活性物质;在试验的前4小时内,释放出片剂中的70-90重量%的活性物质;和在试验的前9小时内,释放出片剂中的90-100重量%的活性物质。在某些实施方案中,本发明的控制释放药物珠粒组合物(即,第二药物珠粒组合物)在本文所述的体内药代动力学研究中在3-10小时内、优选4-8小时内、更优选4-6小时内从组合物释放80%的富马酸二甲酯。特别地,向狗施用含有240mgdmf的本发明的药物组合物。在某些实施方案中,本发明的药物组合物呈胶囊形式,其中第一药物珠粒组合物和第二药物组合物囊封在胶囊中。本领域已知的任何类型的胶囊均可用于本发明。在一个实施方案中,胶囊是硬胶囊。在另一个实施方案中,胶囊是软胶囊。在又一个实施方案中,胶囊是明胶胶囊。在另一个实施方案中,胶囊是硬明胶胶囊。更具体地,胶囊是0号硬明胶胶囊。本发明还提供了治疗患有多发性硬化的受试者(例如,复发缓解性ms、继发性进行性ms、原发性进行性ms、进行性复发性ms)的方法,其包括向受试者施用有效量的本文所述的药物组合物。在一个实施方案中,本发明的方法可用于治疗复发缓解性ms。如本文所用,术语“治疗(treating)”或“处理(treatment)”是指获得所需的药理学和/或生理学作用。该作用可以是治疗性的,其包括部分或基本上实现以下结果中的一种或多种:部分或完全减少疾病、病症或综合征的程度;改善或提高与该病症相关的临床症状或指标;或延迟、抑制或降低疾病、病症或综合征的进展的可能性。如本文所用,术语“受试者”和术语“患者”可以互换使用,并且它们指的是需要治疗的哺乳动物,如,伴侣动物(如,狗、猫等)、农场动物(如,牛、猪、马、绵羊、山羊等)和实验室动物(如,大鼠、小鼠、豚鼠等)。通常,受试者是需要治疗的人。本文所述的药物组合物的经施用以治疗患者的有效量或治疗剂量取决于许多因素,包括但不限于患者的体重和年龄、施用途径、待治疗的疾病的潜在原因,以及待治疗的疾病的严重程度。在一个实施方案中,有效剂量的范围可以为1mg/kg至50mg/kg(如,2.5mg/kg至20mg/kg或2.5mg/kg至15mg/kg)。在一个实施方案中,待施用(例如经口)给受试者的dmf的有效量,可以是每天0.1g至1g,例如每天200mg至800mg(如,每天240mg至720mg;或每天480mg至720mg;或每天480mg;或每天720mg)。每日剂量的范围可以是但不限于,总量为60mg至800mg、60mg至720mg、60mg至500mg、60mg至480mg、60mg至420mg、60mg至360mg、60mg至240mg、60mg至220mg、60mg至200mg、60mg至180mg、60mg至160mg、60mg至140mg、60mg至120mg、60mg至100mg、60mg至80mg、80mg至480mg、100mg至480mg、120mg至480mg、140mg至480mg、160mg至480mg、180mg至480mg、200mg至480mg、220mg至480mg、240mg至480mg、300mg至480mg、360mg至480mg、400mg至480mg、450mg至500mg、480mg至500mg、80至400mg、100至300mg、120至180mg或140mg至160mg。在一个实施方案中,每日剂量是240mg。或者,每日剂量是480mg。dmf的一个或多个每日剂量可以单次施用或以2、3、4或6个相等剂量来单独施用。在一个实施方案中,有效每日剂量为每天480mg,并以一个剂量施用给有需要的受试者。在另一个实施方案中,有效每日剂量为每天240mg,并以一个剂量施用给有需要的受试者。在一个实施方案中,本发明的药物组合物在有需要的受试者食用食物之前或之后至少一小时施用。在受试者经历副作用(例如,潮红或胃肠不适)的情况下,受试者可以在施用药物组合物之前不久(如,30分钟至1小时)食用食物。在一个实施方案中,施用本发明的药物组合物的受试者可以在服用药物组合物之前(例如,之前10分钟至1小时,如30分钟)服用一种或多种非甾体抗炎药(如,阿司匹林)。在一个实施方案中,施用药物组合物的受试者服用一种或多种非甾体抗炎药(如阿司匹林)以控制副作用(如,潮红)。在另一个实施方案中,所述一种或多种非甾体抗炎药选自由以下组成的组:阿司匹林、布洛芬、萘普生、酮洛芬、塞来昔布、mk-0524及其组合。在服用上述剂型之前,一种或多种非甾体抗炎药可以以50mg至500mg的量施用。在一个实施方案中,受试者在服用上述每种剂型之前,服用325mg阿司匹林。在一个实施方案中,向需要治疗的受试者施用第一剂量的本文所述的药物组合物持续第一给药期;并且施用第二剂量的本文所述的药物组合物持续第二给药期。在一个实施方案中,第一剂量低于第二剂量(如,第一剂量是第二剂量的一半)。在一个实施方案中,第一给药期是至少一周(如1-4周)。在一个实施方案中,第一剂量的药物组合物包含240mg的dmf,并且药物组合物在第一次给药期间每天一次施用给受试者。在一个实施方案中,第二剂量的药物组合物包含480mg的dmf,并且药物组合物在第二次给药期间每天一次施用给受试者。在一个实施方案中,如果受试者在第二次给药期间被施用剂量后经历超过预期的副作用水平(如,潮红或胃肠道紊乱),则受试者可使用较低剂量(如,第一给药期的剂量)持续足以使副作用在恢复至第二给药期的剂量之前减少的一段时间(如1-4周或更长)。在一个实施方案中,第一剂量的药物组合物包含240mg的dmf且药物组合物每天一次施用给受试者至少一周,并且第二剂量的药物组合物包含480mg的dmf且药物组合物每天一次施用给受试者至少两周。在一个实施方案中,向受试者施用第一剂量持续一周和第二剂量持续至少48周的第二给药期。在另一个实施方案中,向受试者施用第一剂量持续一周和第二剂量持续至少两年的第二给药期。在另一个实施方案中,向受试者施用第一剂量持续一周和第二剂量直至受试者不需要治疗。在某些实施方案中,治疗患有本文所述的多发性硬化的受试者的方法还包括向患者施用第二治疗剂。在一个实施方案中,第二治疗剂是疾病改善剂。在一个实施方案中,第二治疗剂减轻富马酸二甲酯的副作用。例如,第二治疗剂可以是可以减少潮红(如,阿司匹林)或胃肠道紊乱(如,洛哌丁胺)的治疗剂。在另一个实施方案中,第二治疗剂是nrf-2调节剂。在另一个实施方案中,第二治疗剂可以是如干扰素β-1a格拉默莫达非尼、硫唑嘌呤、泼尼松龙、霉酚酸酯、吗替、米托蒽醌、那他珠单抗sphinogosie-1磷酸盐调节剂,如芬戈莫德和其它可用于ms治疗的药物,诸如特立氟胺、吡罗昔康和菲尼酮。本发明的药物dmf组合物和第二治疗剂可以同时施用(作为单独的组合物或一起以单一剂型)或连续地以重叠或非重叠的间隔施用。在连续的施用中,dmf组合物和第二治疗剂可以任何顺序施用。在一些实施方案中,重叠间隔的长度大于2、4、6、12、24、48周或更久。为了可以更全面地理解本文所述的发明,提出以下实施例。应当理解,这些实施例仅用于说明目的,而不应解释为以任何方式限制本发明。实施例实施例1.用于制备本发明的药物珠粒组合物的方法使用具有wurster插入物的流化床造粒机进行以下包衣工艺。通过将含dmf的溶液(表1)喷雾到流化床中的糖球上,首先将api富马酸二甲酯成层到糖球表面上。表1:dmf溶液制剂成分重量%dmf21%hpmc(hpmce5)2%乙醇(96%v/v)62%去离子水15%总计100%然后将api成层的球体包肠衣以用于酸保护。表2:肠溶包衣制剂然后将持续释放功能性包衣(表3、4、5和6)涂覆到肠溶包衣的球体上。表3:ec/hpc65/35的包衣溶液制剂成分重量%ec(ethocel10)3.9hpc(kluceljf)2.1水11.3ipa82.7总计100%表4:ec/hpc70/30的包衣溶液制剂成分重量%ec(ethocel10)4.2hpc(kluceljf)1.8水11.3ipa82.7总计100%表5:rs/rl75/25的包衣溶液制剂成分重量%eudragitrs4.5eudragitrl1.5水11.3ipa82.7总计100%表6:rs/rl80/20的包衣溶液制剂成分重量%eudragitrs4.8eudragitrl1.2水11.3ipa82.7总计100%具体地,根据上述一般程序使用表1中所述的dmf溶液和表2中所述的肠溶包衣溶液制备制剂d。制剂d没有功能性包衣。根据制剂d的程序制备制剂e和f,并将其用表3中所述的功能性包衣溶液进一步包衣。制剂e中的功能性包衣的重量百分比是糖球和dmf层的总重量的2.5%。制剂f中的功能性包衣的重量百分比是糖球和dmf层的总重量的5.0%。制剂d、e和f是直径为1-1.2mm的珠粒。根据上述一般程序使用表1中所述的dmf溶液、表2中所述的肠溶包衣溶液和表3a中所述的功能性包衣溶液制备制剂a。表3a.ec/hpc60/40的包衣溶液制剂成分重量%ec(ethocel10)3.6hpc(kluceljf)2.4水11.3ipa82.7总计100%制剂a中的每种成分的重量百分比如下:糖核心-糖球和dmf层的总重量的19%;dmf-糖球和dmf层的总重量的74%;粘合剂-糖球和dmf层的总重量的7%;肠溶包衣-糖球和dmf层的总重量的12%;和功能性包衣-糖球和dmf层的总重量的4.5%。根据上述一般程序使用表1中所述的dmf溶液和表2中所述的肠溶包衣溶液制备制剂b。制剂b没有功能性包衣。制剂b中的每种成分的重量百分比如下:糖核心-糖球和dmf层的总重量的19%;dmf-糖球和dmf层的总重量的74%;粘合剂-糖球和dmf层的总重量的7%;和肠溶包衣-糖球和dmf层的总重量的12%。实施例2.制备本发明的药物组合物(混合珠粒制剂)通过使用带有两种输入的囊封器(其中每种输入用于每种类型的珠粒),将第一药物珠粒组合物(上述制剂b)和第二药物珠粒组合物(上述制剂a)合并并囊封在具有白色不透明体和白色不透明帽的0号硬明胶胶囊中来制备混合珠粒制剂。第一药物珠粒组合物(制剂b)和第二药物珠粒组合物(制剂a)的重量比为3:1。实施例3.混合珠粒制剂的溶出曲线根据下述方法测定具有不同的第一种药物珠粒组合物和第二药物珠粒组合物的重量比的各种珠粒制剂的溶出曲线,所述方法是由usp-nf使用usp装置ii和iv公布的标准程序。试验1.在usp装置ii(桨式装置)中,在试验的前2小时内使用0.1n盐酸作为溶出介质并且然后使用不含胰酶的usp模拟肠液(sif)作为溶出介质使本发明的药物组合物进行体外溶出试验。试验2.在usp装置iv(流通池)中,在试验的前2小时内使用不含胃蛋白酶的usp模拟胃液(sgf)作为溶出介质并且然后使用不含胰酶的usp模拟肠液(sif)作为溶出介质使本发明的药物组合物进行体外溶出试验。试验3.在usp装置iv(流通池)中,使用不含胰酶的usp模拟肠液(sif)作为溶出介质使本发明的药物组合物进行体外溶出试验。uspsif溶液可根据usp35-nf30中描述的程序制备。对于1l规模,可以通过将6.8g磷酸二氢钾溶解在250ml水中然后混合来制备sif溶液。依序添加77ml的0.2n氢氧化钠和500ml的水。用0.2n氢氧化钠或0.2n盐酸调节所得溶液的ph至6.8±0.1的ph,然后用水稀释至1000ml。uspsgf溶液可根据usp35-nf30中描述的程序制备。对于1l规模,可以通过将2.0g氯化钠(nacl)溶解在7.0ml盐酸(hcl)和足够的水中得到1000ml来制备sgf溶液。制剂1含有珠粒制剂b和珠粒制剂a的混合物,其中制剂b和制剂a的重量比为3:1。制剂2含有珠粒制剂b和珠粒制剂a的混合物,其中制剂b和制剂a的重量比为1:3。制剂3仅含有珠粒制剂a。制剂1、2和3的溶出曲线显示在图1(使用试验1)和图2(使用试验2)中。实施例4.通过挤出滚圆制备珠粒制剂的方法或者,可以使用挤出滚圆法制备珠粒制剂。首先将dmf与赋形剂和溶剂混合成湿团块。然后迫使湿团块通过挤出机以形成圆柱形丸。根据设备的设置,丸的直径范围为0.6mm至2mm。然后将挤出的丸在具有旋转盘的球形化器中滚圆。根据初始圆柱形丸尺寸,球体的直径可以在0.6至2mm的范围内。下表7和8列出了示例性制剂。表7:供挤出滚圆的示例性制剂dmf65%65%微晶纤维素(avicelph101)11%/微晶纤维素(avicelph102)/15%乳糖一水合物fastflo/10%淀粉15004%/ac-di-sol10%10%peo10%/peo4000//表8:供挤出滚圆的示例性制剂然后用肠溶包衣和上述功能性包衣对dmf球体进行包衣。实施例5.通过流化床滚圆制备珠粒制剂的方法也可以利用glatt的cps装置,使用溶剂(水、乙烯醇或api)将富马酸二甲酯和赋形剂(mcc和崩解剂)滚圆成尺寸范围为500um至1.5mm的球体来制备本发明的珠粒制剂。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1