响应性壳聚糖微球/纤维素水凝胶载药复合膜的制备及产品的制作方法
本发明属于生物医药技术领域,涉及一种响应性壳聚糖微球/纤维素水凝胶载药复合膜的制备及产品。
背景技术
癌症是导致人类死亡的一个主要原因,目前每年在全球夺去800多万人的生命。通常的癌症治疗方法主要分为手术切除癌组织和放化疗。通过手术切除癌组织,一方面可能会引发感染,通常使用抑菌药物治疗,药物主要通过自由扩散的方式作用于人体,因此药量很难得到控制,而且高浓度的药量会给正常的组织和器官带来副作用。更重要的是,手术可能会出现组织损伤以及微小病灶的残留,肿瘤细胞会进入人体的循环系统,并因此导致复发和转移,而且,手术无法完全清除肿瘤干细胞。有许多抗癌药用于癌症疾病的治疗当中,其中5-氟尿嘧啶是一种治疗癌症的药物,在临床上已广泛用于治疗乳腺癌、胃癌、肠癌和结肠癌。但其半衰期很短只有10-20min,因此需要通过药物控释技术来减少给药次数和提升疾病治疗效果。
水凝胶是一类具有三维网络结构的交联聚合物,由于水凝胶表面不易黏附蛋白质和细胞,故在与血液、体液以及人体组织相接触时会表现出良好的生物相容性;另外,水凝胶由于含有大量的水分而非常柔软,类似于生物体组织。由于水凝胶对低分子溶质具有良好的透过性,可以作为将较低的药物长时间维持在患者体内的药物传输系统。当水凝胶移植入生物体后,其能够维持或向体液控制释放包埋在水凝胶中的药物,从而发挥疗效。智能水凝胶对环境的微小变化能够快速响应,作为新型的生物医用材料已经引起了研究者的关注。细胞的癌变会引起细胞内外谷胱甘肽浓度的变化,与正常细胞存在差异性,这是还原响应性水凝胶重要的刺激因素。以还原响应性水凝胶膜
常用于构建水凝胶的材料包括天然材料如胶原、纤维素、海藻酸钠等和合成材料如聚乙烯醇(pva)、聚乙二醇(peg)等。其中多糖类物质具有可反应的官能团,通过化学改性可形成多种特定功能的水凝胶。羧甲基纤维素是纤维素的衍生物,在其链上含有大量的羧基和羟基等亲水基团,以羧甲基纤维素及其衍生物为基质制备的水凝胶基于其生物相容性、高吸水性等被广泛应用于药物载体领域。以羧甲基纤维素为原料,为可植入的水凝胶膜提供了基础。壳聚糖具有可被体内多种酶生物降解,降解产物无毒且能被生物体吸收等特点,是药物缓释的理想载体。因此我们选择用壳聚糖负载抑菌药物,以达到缓释的目的。
目前,尚未有研究或报道关于载药壳聚糖微球与载药羧甲基纤维素水凝胶复合而成的可植入的还原响应性水凝胶膜,实现抗癌药物的靶向释放和抑菌药物的缓释,兼具抗癌和抑菌功能。
技术实现要素:
本发明的目的在于提供一种响应性壳聚糖微球/纤维素水凝胶载药复合膜的制备及产品,微球和水凝胶使用的都是具有良好生物可相容性的降解材料,对人体没有毒副作用,具有靶向释放抗癌药物的作用,同时可以缓慢释放抑菌药物,预防感染。
本发明所述的响应性壳聚糖微球/纤维素水凝胶载药复合膜的制备及产品的制备方法,具体步骤如下:
(1)制备载盐酸四环素的壳聚糖微球,其特征在于,称取0.12-0.6g壳聚糖,加入到6-30ml1%的醋酸溶液中,搅拌至壳聚糖完全溶解,然后加入0.04-0.2g盐酸四环素,搅拌至完全溶解,加入1-2ml的吐温-80,超声1-2min,作为水相;量取24-120ml的液体石蜡,加入150-750μl的浓度为25%的戊二醛溶液和1-2ml的司班-80,超声1-3min,作为油相。将水相滴入油相中,持续搅拌30-40min后,滴入50-250μl的浓度为25%的戊二醛溶液,40℃下持续搅拌2h后离心分离,沉淀物用石油醚洗涤三次后真空冷冻干燥24h,得到载盐酸四环素的壳聚糖微球。
(2)制备载药水凝胶薄膜:称取0.1-0.3g的羧甲基纤维素,溶于10ml水中,得到浓度为1-3%的羧甲基纤维素溶液。加入0.18-0.52g的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和0.09-0.26g的n-羟基琥珀酰亚胺活化20-40min。称取0.1-0.3g的胱胺二盐酸盐,溶于10ml水中,得到浓度为1-3%的胱胺二盐酸盐溶液,0.025-0.125g的5-氟尿嘧啶,0.01-0.03g载盐酸四环素的壳聚糖微球溶于上述胱胺二盐酸盐溶液中,上述两种溶液在室温下按1∶3-3∶1的体积比搅拌均匀,脱去气泡后,倾倒于培养皿,室温静置成凝胶后,烘箱干燥成膜。
本发明具有以下优点:
(1)制备方法操作简单,实验条件温和;
(2)将载抑菌药物的壳聚糖微球与纤维素水凝胶复合,兼具抑菌和抗癌作用;
(3)本发明的载药复合膜具有还原响应性,靶向释放抗癌药物;
(4)本发明的载药复合膜具有药物缓释功能,能避免高浓度抗癌药对人体带来的伤害,延长低浓度抗癌药的作用时间,而且该载药复合膜抑菌效果明显;
(5)本发明的载药复合膜可作为一种植入材料,为植入水凝胶膜的研究提供了基础。
附图说明
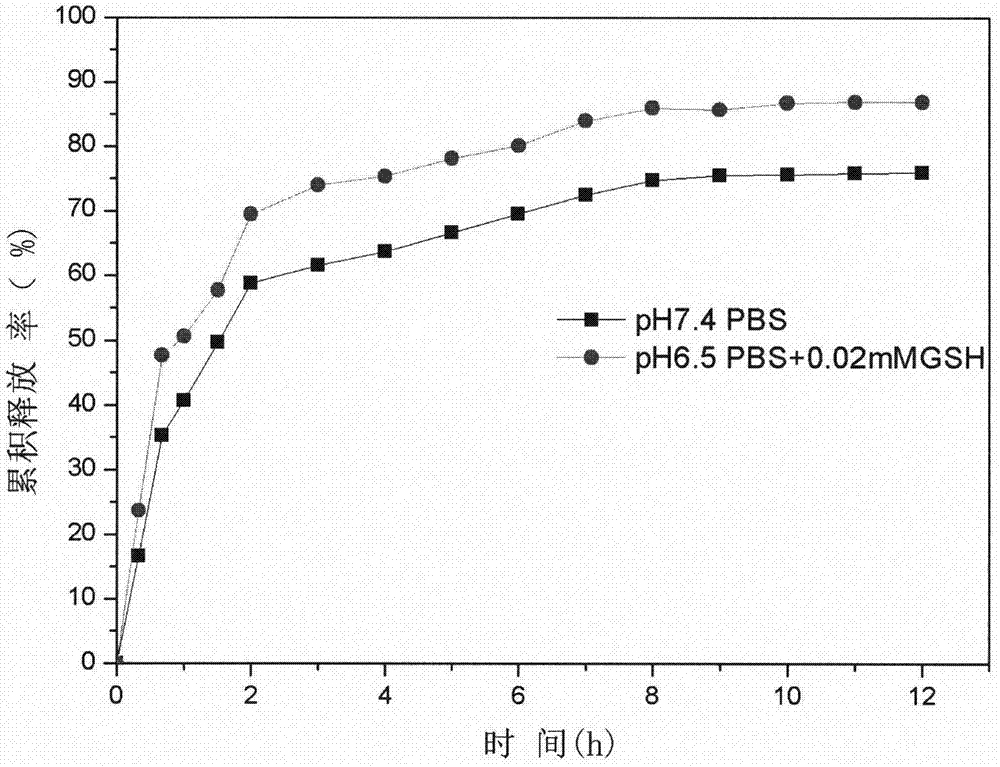
图1为具体实施例4中的载药复合膜在不同介质中的药物缓释图。
图2为对比实施例中的水凝胶膜(左)与具体实施例4中的载药复合膜(右)对金黄色葡萄球菌的抑制效果图。
具体实施方式
下面结合实施例和对比例对本发明进行详细说明,下述实施例仅用来对说明书的详细解释,并不作为对于本发明的限制。
实施例1
(1)制备载抑菌药物的壳聚糖微球。称取0.12g壳聚糖,加入到6ml1%的醋酸溶液中,搅拌至壳聚糖完全溶解,然后加入0.04g盐酸四环素,搅拌至完全溶解,加入1ml的吐温-80,超声1min,作为水相;量取24ml的液体石蜡,加入150μl浓度为25%的戊二醛溶液和1ml的司班-80,超声2min,作为油相。将水相滴入油相中,持续搅拌30min后,滴入50μl浓度为25%的戊二醛溶液,40℃下持续搅拌2h后离心分离,沉淀物用石油醚洗涤三次后真空冷冻干燥24h,得到载盐酸四环素的壳聚糖微球。
(2)制备载药复合膜。称取0.1g的羧甲基纤维素,溶于10ml水中,得到浓度为1%的羧甲基纤维素溶液。加入0.18的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和0.09g的n-羟基琥珀酰亚胺活化20min。称取0.1g的胱胺二盐酸盐,溶于10ml水中,得到浓度为1%的胱胺二盐酸盐溶液,0.025g的5-氟尿嘧啶,0.01g载盐酸四环素的壳聚糖微球溶于上述胱胺二盐酸盐溶液中,上述两种溶液在室温下按1∶3的体积比搅拌均匀,脱去气泡后,倾倒于培养皿,室温静置成凝胶后,烘箱干燥成膜。
实施例2
(1)称取0.24g壳聚糖,加入到12ml1%的醋酸溶液中,搅拌至壳聚糖完全溶解,然后加入0.08g盐酸四环素,搅拌至完全溶解,加入1ml的吐温-80,超声1min,作为水相;量取48ml的液体石蜡,加入300μl浓度为25%的戊二醛溶液和1ml的司班-80,超声1min,作为油相。将水相滴入油相中,持续搅拌35min后,滴入100μl浓度为25%的戊二醛溶液,40℃下持续搅拌2h后离心分离,沉淀物用石油醚洗涤三次后真空冷冻干燥24h,得到载盐酸四环素的壳聚糖微球。
(2)制备载药复合膜。称取0.15g的羧甲基纤维素,溶于10ml水中,得到浓度为1.5%的羧甲基纤维素溶液。加入0.26的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和0.13g的n-羟基琥珀酰亚胺活化25min。称取0.15g的胱胺二盐酸盐,溶于10ml水中,得到浓度为1.5%的胱胺二盐酸盐溶液,0.05g的5-氟尿嘧啶,0.015g载盐酸四环素的壳聚糖微球溶于上述胱胺二盐酸盐溶液中,上述两种溶液在室温下按1∶2的体积比搅拌均匀,脱去气泡后,倾倒于培养皿,室温静置成凝胶后,烘箱干燥成膜。
实施例3
(1)称取0.36g壳聚糖,加入到18ml1%的醋酸溶液中,搅拌至壳聚糖完全溶解,然后加入0.08g盐酸四环素,搅拌至完全溶解,加入2ml的吐温-80,超声1min,作为水相;量取72ml的液体石蜡,加入450μl浓度为25%的戊二醛溶液和1ml的司班-80,超声1.5min,作为油相。将水相滴入油相中,持续搅拌40min后,滴入150μl浓度为25%的戊二醛溶液,40℃下持续搅拌2h后离心分离,沉淀物用石油醚洗涤三次后真空冷冻干燥24h,得到载盐酸四环素的壳聚糖微球。
(2)制备载药复合膜。称取0.2g的羧甲基纤维素,溶于10ml水中,得到浓度为2%的羧甲基纤维素溶液。加入0.36的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和0.18g的n-羟基琥珀酰亚胺活化30min。称取0.2g的胱胺二盐酸盐,溶于10ml水中,得到浓度为2%的胱胺二盐酸盐溶液,0.075g的5-氟尿嘧啶,0.02g载盐酸四环素的壳聚糖微球溶于上述胱胺二盐酸盐溶液中,上述两种溶液在室温下按1∶1的体积比搅拌均匀,脱去气泡后,倾倒于培养皿,室温静置成凝胶后,烘箱干燥成膜。
实施例4
(1)称取0.48g壳聚糖,加入到24ml1%的醋酸溶液中,搅拌至壳聚糖完全溶解,然后加入0.16g盐酸四环素,搅拌至完全溶解,加入2ml的吐温-80,超声1min,作为水相;量取96ml的液体石蜡,加入600μl浓度为25%的戊二醛溶液和2ml的司班-80,超声2min,作为油相。将水相滴入油相中,持续搅拌30min后,滴入200μl浓度为25%的戊二醛溶液,40℃下持续搅拌2h后离心分离,沉淀物用石油醚洗涤三次后真空冷冻干燥24h,得到载盐酸四环素的壳聚糖微球。
(2)制备载药复合膜。称取0.25g的羧甲基纤维素,溶于10ml水中,得到浓度为2.5%的羧甲基纤维素溶液。加入0.44的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和0.22g的n-羟基琥珀酰亚胺活化35min。称取0.25g的胱胺二盐酸盐,溶于10ml水中,得到浓度为2.5%的胱胺二盐酸盐溶液,0.1g的5-氟尿嘧啶,0.025g载盐酸四环素的壳聚糖微球溶于上述胱胺二盐酸盐溶液中,上述两种溶液在室温下按2∶1的体积比搅拌均匀,脱去气泡后,倾倒于培养皿,室温静置成凝胶后,烘箱干燥成膜。
实施例5
(1)称取0.6g壳聚糖,加入到30ml1%的醋酸溶液中,搅拌至壳聚糖完全溶解,然后加入0.18g盐酸四环素,搅拌至完全溶解,加入2ml的吐温-80,超声1min,作为水相;量取120ml的液体石蜡,加入750μl浓度为25%的戊二醛溶液和2ml的司班-80,超声2min,作为油相。将水相滴入油相中,持续搅拌35min后,滴入250μl浓度为25%的戊二醛溶液,40℃下持续搅拌2h后离心分离,沉淀物用石油醚洗涤三次后真空冷冻干燥24h,得到载盐酸四环素的壳聚糖微球。
(2)制备载药复合膜。称取0.3g的羧甲基纤维素,溶于10ml水中,得到浓度为3%的羧甲基纤维素溶液。加入0.52g的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和0.26g的n-羟基琥珀酰亚胺活化40min。称取0.3g的胱胺二盐酸盐,溶于10ml水中,得到浓度为3%的胱胺二盐酸盐溶液,0.125g的5-氟尿嘧啶,0.03g载盐酸四环素的壳聚糖微球溶于上述胱胺二盐酸盐溶液中,上述两种溶液在室温下按3∶1的体积比搅拌均匀,脱去气泡后,倾倒于培养皿,室温静置成凝胶后,烘箱干燥成膜。
对比实施例1
称取0.15g的羧甲基纤维素,溶于10ml水中,得到浓度为1.5%的羧甲基纤维素溶液。加入0.26g的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和0.13g的n-羟基琥珀酰亚胺活化25min。称取0.15g的胱胺二盐酸盐,溶于10ml水中,得到浓度为1.5%的胱胺二盐酸盐溶液,上述两种溶液在室温下按2∶1的体积比搅拌均匀,脱去气泡后,倾倒于培养皿,室温静置成凝胶后,烘箱干燥成膜。
分别测定实施例1-5制备而得的载药壳聚糖微球的平均粒径和载药率以及实施例1-5和对比例1制备而得的载药复合膜的溶胀率,其结果见表1。对比可以看出,载药壳聚糖微球的加入明显提高了膜的溶胀率。
分别将实施例4和对比例1制备而得的样品切成直径为10mm的圆片进行抑菌测试。具体步骤如下:将活化后的菌种稀释至1×105cfu/ml,量取0.1ml菌液至tsa固体平板培养基上,涂布均匀。分别将样品依次贴附在固体培养基上,37℃恒温倒置培养24h,测量抑菌圈直径。
结果如图2所示。对比可以看出,实施例4的载药复合膜出现明显的抑菌圈而对比例没有出现抑菌圈,表明本发明的载药复合膜具有优异的抑菌性能。
表1不同条件下制备而得的载药壳聚糖微球的粒径和药物载药率以及各载药复合膜的溶胀率
有益效果
从图1可以看出,在ph7.4的pbs中,5-氟尿嘧啶的最大累积释放率为65%左右,药物释放来自扩散作用。而在癌细胞周围组织液内,二硫键逐渐断裂,药物的累积释放率高达92%,药物释放来自于扩散作用和载体的降解。因此本发明的复合药膜在生理条件下具有药物缓释的性能而在病灶部分加速药物的释放。图2表明,没有添加载药壳聚糖微球的水凝胶膜几乎没有出现抑菌圈,表明此膜没有抑菌性能,然而添加载药壳聚糖微球后,复合药膜出现抑菌圈,具有优异的抑菌性能。本发明的载药复合膜制备简单且环保,原料生物可降解,且具有还原响应性,将载药壳聚糖微球分散于羧甲基纤维素水凝胶的三维网络结构中,一方面能实现药物的缓释和靶向释放,避免高浓度药物对人体的伤害,又能提高药物的利用率;另一方面,兼具抗癌和抑菌作用,为植入水凝胶膜的研究提供了理论基础。
上述仅对本发明中的几种具体实施例加以说明,但并不能作为本发明的保护范围,凡是依据本发明中的设计精神所作出的等效变化或修饰或等比例放大或缩小等,均应认为落入本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!