α受体阻滞剂在制备治疗急性胰腺炎的药物中的应用的制作方法
本发明属于医药技术领域,涉及α肾上腺素能受体阻滞剂(α受体阻滞剂)的用途,尤其是在制药中的用途。
背景技术:
急性胰腺炎是临床常见疾病,在全球范围内的发病率在13~45/100,000左右,其中约有20%可能进展为重症急性胰腺炎,其病死率高达36%-50%,目前尚无特效药物。目前急性胰腺炎的发病机制尚不完全十分明确,但其中胰腺腺泡细胞钙超载起着重要作用。寻找更多能够治疗/辅助治疗/预防急性胰腺炎的药物,以更有效的预防疾病的发生、在临床上如何更有效的阻断炎症扩散,治疗急性胰腺炎,使它避免发展成重症急性胰腺炎,减少多功能器官衰竭,降低病死率,对于急性胰腺炎的发病机制并开发相应的预防和治疗方法尤为重要。
α肾上腺素能受体阻滞剂是可以选择性的与α肾上腺受体结合,并不激动或减弱激动肾上腺素受体,却能阻滞相应的神经递质及药物与α受体结合,从而产生抗肾上腺素作用。其中α1肾上腺素能受体阻滞剂能降低外周血管阻力,对收缩压和舒张压都有降低作用;具有松弛膀胱和前列腺平滑肌的作用,可缓解良性前列腺肥大而引起的排尿困难症状,常用于治疗良性前列腺增生和高血压。近年来有文献报道α1肾上腺素能受体阻滞剂---特拉唑嗪(terazosin,tz)可降低小鼠脓毒症的器官功能损伤并提高其存活率,其机制可能是抑制细胞凋亡,但在急性胰腺炎的治疗以及机制作用尚无研究报道。
技术实现要素:
本发明的目的在于证明α受体阻滞剂的新用途,即在制药中的新用途,为治疗急性胰腺炎提供新的药品。
本发明经研究发现,α受体阻滞剂能够降低胆囊收缩素(cholecystokininoctapeptidesulfated,cck)及胆酸(taurolithocholicacid3-sulfatedisodiumsalt,tlcs)等引起的胰腺腺泡细胞钙超载。α受体阻滞剂能够提高cck、tcls刺激后的胰腺腺泡细胞存活率。因此,α受体阻滞剂对急性胰腺炎具有很好的改善作用。
本发明经研究进一步发现,α受体阻滞剂能够降低小鼠急性胰腺炎血清谷氨酸氨基转移酶(alanineaminotransferase,alt)、尿素氮(ureanitrogen,bun)、肌钙蛋白(troponin,ctnt)的水平,从而降低肝、肾、心脏的损伤程度,改善急性胰腺炎严重程度。α受体阻滞剂能够缓解小鼠急性胰腺炎胰腺组织水肿及炎症浸润程度。α受体阻滞剂能够降低急性胰腺炎小鼠循环组蛋白水平(当有广泛的细胞死亡才出现循环组蛋白),从而改善急性胰腺炎严重程度。
本发明对所述α受体阻滞剂没有特别的限制,所有能够抑制或阻滞α受体的化合物都适用于本发明,例如α1肾上腺素能受体阻滞剂。α1肾上腺素能受体阻滞剂为特拉唑嗪(terazosin,tz)或哌唑嗪(prazosin,pz)等。tz分子式为c19h25n5o4,pz分子式为c19h21n5o4·hcl。
本发明提供的α受体阻滞剂在制备治疗急性胰腺炎药物中的应用,对治疗急性胰腺炎药物的剂型和制备方法没有特别限制,可采用本领域常规通用的制备方法制成片剂、胶囊、颗粒剂、缓释剂、注射剂等各种剂型。
与现有技术相比,本发明α受体阻滞剂在制备治疗急性胰腺炎药物中的应用具有以下有益效果:
(1)本发明提供的治疗急性胰腺炎药物中含有α受体阻滞剂,能够减轻胰腺腺泡细胞对钙的敏感度,减少cck,tlcs等刺激因素所导致的钙超载,从而提高胰腺腺泡细胞的存活率。
(2)本发明提供的治疗急性胰腺炎药物中含有α受体阻滞剂,能够明显减轻肝、肾、心脏等器官损伤,并减少毒性物质释放,进而降低因急性胰腺炎导致的病死率。
(3)本发明提供的治疗急性胰腺炎药物中含有α受体阻滞剂,作为良性前列腺增生症及高血压病的治疗药物被用于临床治疗多年,其毒副作用已知,无需进一步对其进行毒性分析等,进而能够降低其在治疗急性胰腺炎药物中的研究成本及研发周期。
(4)本发明对已知的α受体阻滞剂发掘了新的医疗用途,开拓了一个新的应用领域,有望成为预防和治疗急性胰腺炎的有效药物。
附图说明
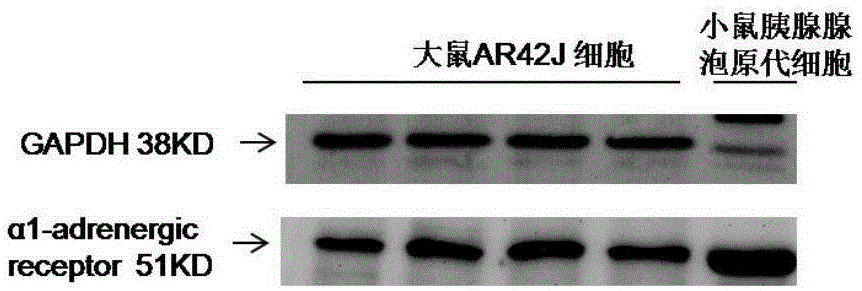
图1为胰腺腺泡细胞的westernblot电泳图,图中α1-adrenergicreceptor为α1肾上腺素能受体,gapdh为内参。
图2为在不同药物(cck、tz、tz+cck)作用下小鼠胰腺腺泡原代细胞钙离子内流图;其中2a为在不同药物作用下小鼠胰腺腺泡原代细胞钙离子内流动态图;2b为不同药物作用下小鼠胰腺腺泡原代细胞内钙离子峰值图;图中cck表示胆囊收缩素(100nm)刺激组,tz表示α1肾上腺素能受体阻滞剂(特拉唑嗪,200nm)刺激组,tz+cck表示α1肾上腺素能受体阻滞剂(200nm)干预5min后再行胆囊收缩素(100nm)刺激组,对照组是未进行任何刺激的小鼠胰腺腺泡原代细胞实验组,*vs.对照组p<0.05,#vs.cck刺激组p<0.05。
图3为在不同药物(tlcs、tz、tz+tlcs)作用下小鼠胰腺腺泡原代细胞钙离子内流图;其中3a为在不同药物作用下小鼠胰腺腺泡原代细胞钙离子内流动态图;3b为不同药物作用下小鼠胰腺腺泡原代细胞内钙离子峰值图;图中tlcs表示胆酸(500μm)刺激组,tz表示α1肾上腺素能受体阻滞剂(特拉唑嗪,200nm)刺激组,tz+tlcs表示α1肾上腺素能受体阻滞剂(200nm)干预5min后再行胆酸刺激(500μm)的实验组,对照组是未进行任何刺激的小鼠胰腺腺泡原代细胞实验组,*vs.对照组p<0.05,#vs.tlcs刺激组p<0.05。
图4为在不同浓度的cck作用下大鼠ar42j细胞钙离子内流图;分为cck(1μm)低剂量刺激组,cck(10μm)高剂量刺激组;其中4a为在不同浓度的cck作用下大鼠ar42j细胞钙离子内流动态图;4b为不同浓度的cck作用下大鼠ar42j细胞钙离子峰值图;对照组是未进行任何刺激的大鼠ar42j细胞实验组;*vs.对照组p<0.05。
图5为在不同药物(cck、tz、tz+cck、tlcs、tz+tlcs)作用下大鼠ar42j细胞钙离子内流图;其中5a为在不同药物(cck、tz、tz+cck)作用下大鼠ar42j细胞内钙离子内流动态图;5b为不同药物(cck、tz、tz+cck)作用下大鼠ar42j细胞内钙离子各组峰值比较图;5c为在不同药物(tlcs、tz、tz+tlcs)作用下大鼠ar42j细胞内流动态图;5d为不同药物(tlcs、tz、tz+tlcs)作用下大鼠ar42j细胞内钙离子各组峰值比较图;图中cck表示高剂量胆囊收缩素(10μm)刺激组,tz表示α1肾上腺素能受体阻滞剂(特拉唑嗪,200nm)刺激组,tz+cck表示α1肾上腺素能受体阻滞剂(200nm)干预5min后再行胆囊收缩素(10μm)刺激的实验组,tlcs表示胆酸(500μm)刺激组,tz+tlcs表示α1肾上腺素能受体阻滞剂(200nm)干预5min后再行胆酸(500μm)刺激的实验组,对照组是未进行任何刺激的大鼠ar42j细胞实验组,*vs.对照组p<0.05,#vs.cck刺激组ortlcs刺激组p<0.05。
图6为在不同药物(cck、pz、pz+cck、tlcs、pz+tlcs)作用下大鼠ar42j细胞内钙离子内流图;其中6a为在不同药物(cck、pz、pz+cck)作用下大鼠ar42j细胞内流动态图;6b为不同药物(cck、pz、pz+cck)作用下大鼠ar42j细胞内钙离子各组峰值比较图;6c为在不同药物(tlcs、pz、pz+tlcs)作用下大鼠ar42j细胞内钙离子内流动态图;6d为不同药物(tlcs、pz、pz+tlcs)作用下大鼠ar42j细胞内钙离子各组峰值比较图;图中cck表示胆囊收缩素(10μm)刺激组,pz表示α1肾上腺素能受体阻滞剂(哌唑嗪,200nm)刺激组,pz+cck表示α1肾上腺素能受体阻滞剂(200nm)干预5min后再行胆囊收缩素(10μm)刺激的实验组,tlcs表示胆酸(500μm)刺激组,pz+tlcs表示α1肾上腺素能受体阻滞剂(200nm)干预5min后再行胆酸(500μm)刺激的实验组。对照组是未进行任何刺激的大鼠ar42j细胞实验组。*vs.对照组p<0.05,#vs.cck刺激组ortlcs刺激组p<0.05。
图7为在不同药物(cck、tz、tz+cck、tlcs、tz+tlcs)作用下胰腺腺泡细胞存活率图;其中7a为在不同药物(cck、tz、tz+cck)作用下小鼠胰腺腺泡原代细胞存活率图;图7b为不同药物(tlcs、tz+tlcs)作用下小鼠胰腺腺泡原代细胞存活率图;7c为在不同药物(cck、tz、tz+cck)作用下大鼠胰腺腺泡细胞ar42j存活率图;7d为不同药物(tlcs、tz+tlcs)作用下大鼠胰腺腺泡细胞ar42j存活率图;7a和7b采用小鼠胰腺腺泡原代细胞为研究对象,图中cck表示胆囊收缩素(100nm)刺激组,tz表示α1肾上腺素能受体阻滞剂(特拉唑嗪,200nm)刺激组,tz+cck表示α1肾上腺素能受体阻滞剂干预2小时后再行胆囊收缩素刺激的实验组,tlcs表示胆酸刺激组,分为低剂量(250μm)组,高剂量(500μm)组,tz+tlcs表示α1肾上腺素能受体阻滞剂干预2小时后再行胆酸刺激的实验组,对照组是未进行任何刺激的小鼠胰腺腺泡原代细胞实验组。7c和7d采用大鼠腺泡ar42j细胞为研究对象,图中cck表示胆囊收缩素(10μm)刺激组,tz表示α1肾上腺素能受体阻滞剂(特拉唑嗪,200nm)刺激组,tz+cck表示α1肾上腺素能受体阻滞剂干预4小时后再行胆囊收缩素刺激的实验组,tlcs表示胆酸(500μm)刺激组,tz+tlcs表示α1肾上腺素能受体阻滞剂干预4小时后再行胆酸刺激的实验组,对照组是未进行任何刺激的大鼠ar42j细胞实验组。*vs.对照组p<0.05,#vs.cck刺激组ortlcs低剂量组p<0.05,△vs.tlcs高剂量组p<0.05,**vs.tlcs刺激组p<0.05。
图8为各小鼠急性胰腺炎模型组血清amylase(amy)、alt、bun、ctnt的水平图;其中8a为小鼠急性胰腺炎血清amy水平图;8b为小鼠急性胰腺炎血清alt水平图;8c为小鼠急性胰腺炎血清bun水平图;8d为小鼠急性胰腺炎血清ctnt水平图;图中cae-ap表示蛙皮素(cerulein,cae)诱导小鼠急性胰腺炎组,tz+cae-ap表示α1肾上腺素能受体阻滞剂(特拉唑嗪,0.4mg/kg小鼠)干预蛙皮素诱导的小鼠急性胰腺炎组,tlc-ap表示牛磺胆酸钠(sodiumtaurocholate,tlc)诱导小鼠急性胰腺炎组,tz+tlc-ap表示α1肾上腺素能受体阻滞剂(特拉唑嗪,0.4mg/kg小鼠)干预牛磺胆酸钠诱导的小鼠急性胰腺炎组,*vs.cae-aportlc-ap,p<0.05。
图9为各小鼠急性胰腺炎模型组胰腺组织检测结果;其中9a为各小鼠急性胰腺炎模型组胰腺组织水肿及炎症浸润程度图;9b为各小鼠急性胰腺炎模型组胰腺组织评分图,*vs.cea-ap,p<0.05。
图10为各小鼠急性胰腺炎模型组循环组蛋白检测结果;其中10a为各组循环组蛋白westernblot电泳图;10b为各组循环组蛋白水平图;图中cae-ap表示蛙皮素诱导小鼠急性胰腺炎组,tz+cae-ap表示α1肾上腺素能受体阻滞剂(特拉唑嗪,0.4mg/kg小鼠)干预蛙皮素诱导的小鼠急性胰腺炎组,tlc-ap表示牛磺胆酸钠诱导小鼠急性胰腺炎组,tz+tlc-ap表示α1肾上腺素能受体阻滞剂(特拉唑嗪,0.4mg/kg小鼠)干预牛磺胆酸钠诱导的小鼠急性胰腺炎组,*vs.tlc-ap,p<0.05。
图11为急性胰腺炎小鼠生存率图;图中ap表示牛磺胆酸钠诱导小鼠急性胰腺炎组,tz+ap表示α1肾上腺素能受体阻滞剂(特拉唑嗪,0.4mg/kg小鼠)干预牛磺胆酸钠诱导的小鼠急性胰腺炎组。apvs.tz+ap,p<0.05。
具体实施方式
以下将结合附图对本发明各应用例的技术方案进行清楚、完整的描述,显然,所描述应用例仅仅是本发明的一部分应用例,而不是全部的应用例。基于本发明中的应用例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它应用例,都属于本发明所保护的范围。
以下应用例中采用的小鼠胰腺腺泡细胞采用下方法获得:
采用酶机械分离方法分离出小鼠的胰腺腺泡细胞,新鲜剥离的胰腺组织于ph=7.3的含有浓度为10mm的hepes的hbss(hank'sbalancedsaltsolution)溶液中清洗2次,清洗后的胰腺组织在hbss溶液【含有浓度为10mm的hepes和浓度为0.1mg/ml的胶原蛋白水解酶(sigma,usa)】中于37℃水浴加热15-20min,加热结束后经吹打、过筛(100目细胞筛)、离心(260xg,4min),除去上清液,得到新鲜的胰腺腺泡细胞(即小鼠胰腺腺泡原代细胞),用加入含20%胎牛血清、100u/ml青霉素和100μg/ml链霉素的ham’sf12k培养基中重悬细胞,将细胞以2-3×105/l的密度接种于12孔培养板中,开始实验。
大鼠胰腺腺泡细胞ar42j(atcc,usa)细胞系具有胰腺腺泡的绝大多数功能,而成为急性胰腺炎体外实验研究的标准胰腺腺泡细胞系。将ar42j细胞培养于含20%胎牛血清、100u/ml青霉素和100μg/ml链霉素的ham’sf12k培养基中,于37℃、含5%co2的培养箱中进行培养,培养24小时后进行实验。
采用westernblot法,对上述小鼠胰腺腺泡原代细胞及ar42j细胞进行目标蛋白检测。将新鲜的小鼠胰腺腺泡原代细胞,重悬于含20%胎牛血清、100u/ml青霉素和100μg/ml链霉素的ham’sf12k培养基中,以2.5×105/l的密度接种12孔板中,于37℃、含5%co2的培养箱中孵育30min。将大鼠ar42j胰腺腺泡细胞以2.5×105/l的密度接种于12孔板中,加入含20%胎牛血清、100u/ml青霉素和100μg/ml链霉素的ham’sf12k培养基中2ml,于37℃、含5%co2的培养箱中孵育24小时。孵育结束后,将小鼠胰腺炎腺泡原代细胞离心(260xg,4min),弃上清,每孔分别用70μl裂解液(由ph=6.8的含有10%sds10ml,甘油10ml,1mtris(ph=6.8)12ml,0.5medta(ph=8.0)5ml,蒸馏水63ml混合得到)裂解;将孵育的大鼠ar42j细胞,弃上清,同样每孔分别用70μl裂解液(由ph=6.8的含有10%sds10ml,甘油10ml,1mtris(ph=6.8)12ml,0.5medta(ph=8.0)5ml,蒸馏水63ml混合得到)裂解,然后对每个样品进行5-6秒的超声。样品在100℃煮沸10分钟。变性蛋白的总量采用bca法,由bsa作为标准液体,测量每个样品蛋白总含量。加载等量的蛋白质50μg(ar42j细胞),25ug(小鼠胰腺腺泡原代细胞),使用15%sds胶通过电泳转移到immobilon-p膜。膜在含有5%脱脂牛奶、1%牛血清白蛋白(bsa)和160μlh2o2的tbst50ml于室温下被封闭2小时。封闭结束后用洗涤缓冲液洗膜3次,每次15min,之后用一抗(抗-α1-adrenergic受体抗体,1:500,ab3462,abcam,uk)在1%bsa溶液中于室温下孵育3小时,再用洗涤缓冲液洗涤3次,然后用二抗(山羊抗兔igg-hrp,sc-2004,1:10000,santacruzblotechology,usa)在1%bsa中室温孵育1小时。继后将gapdh蛋白(14c10,1:600,cellsignalingtechnology,beverly,ma,usa)作为内参蛋白于室温下孵育1小时,同样的洗涤3次后,然后用二抗(山羊抗兔igg-hrp,sc-2004,1:10000,santacruzblotechology,usa)在1%bsa中室温孵育1小时。最后用化学发光系统检测免疫反应,用全自动凝胶成像系统(sydr4/1769,syngenegbox,uk)放射显影,采用genetools软件定量(syngene,uk),检测结果如图1所示。
从图1中可以看出,检测的胰腺腺泡细胞(小鼠胰腺腺泡原代细胞以及ar42j细胞)内均存在α1肾上腺素能受体。
应用例1α1肾上腺素能受体阻滞剂降低cck引起的小鼠胰腺腺泡原代细胞钙超载
以fluo-4am作为荧光探针,采用激光共聚焦显微镜对细胞内钙离子([ca2+]i)动态测定。钙离子的浓度的计算公式为:[ca2+]i=kd*[(r-rmin)/(rmax-r)],其中kd是fluo-4am与ca2+反应的解离常数(设定在340nm),激发波490nm,发射波540nm,r为各测定点荧光强度,rmax和rmin分别测定的最大和最小荧光值。图像和数据用(zen2012)软件处理。
将新鲜的小鼠胰腺腺泡原代细胞,重悬于含20%胎牛血清、100u/ml青霉素和100μg/ml链霉素的ham’sf12k培养基中,以2×105/l的密度接种于4份35mm激光共聚焦专用培养皿,于37℃、含5%co2的培养箱中进行培养条件下孵育2h,加入fluo-4am(终浓度为5μm),于37℃、含5%co2的培养箱中孵育30min。将溶液慢慢吸出,用磷酸缓冲盐溶液(phosphatebuffersaline,pbs)无钙溶液清洗2次,缓慢加入至1mlpbs(无钙)溶液中。向第一份样本中加入胆囊收缩素(cholecystokininoctapeptidesulfated,cck)(cck的终浓度为100nm),作为胆囊收缩素刺激组;向第二份样本中加入α1肾上腺素能受体阻滞剂特拉唑嗪(terazosin,tz)(tz的终浓度为200nm),作为α1肾上腺素能受体阻滞剂刺激组;向第三份样本中首先加入tz(tz的终浓度为200nm)5min干预后再加入cck(cck的终浓度为100nm)刺激小鼠胰腺腺泡原代细胞,作为经tz干预后的胆囊收缩素刺激组;第四份空白对照组。使用激光共聚焦显微镜(leicamicrosystems,wetzlar,germany)对四个实验组进行连续拍摄图像,拍摄间隔为10s,拍摄期间加入cck、tz药物,测定各时间点荧光值即为r值。待加入cck、tz药物后5min首先向其中加入离子霉素(终浓度为20μm),使fluo-4和ca2+结合达到饱和,此时测得的荧光值即为rmax。此后5min,向其中加入egta(终浓度为10mm,ph=8.0),以充分螯合ca2+,使fluo-4游离,此时测得的荧光值即为rmin。以上实验重复4次。将检测的图像(zen2012)软件进行处理,采用公式数据输入后得到小鼠胰腺腺泡原代细胞钙离子内流图,如图2a所示。将图2a中各实验组对应检测到的细胞内ca2+浓度峰值进行统计,统计结果如图2b所示。
胰腺腺泡细胞钙超载在急性胰腺炎发病机制中起着重要作用。cck可促进胰腺腺泡分泌各种消化酶。在体外实验研究中,高剂量的cck可以刺激胰腺腺泡细胞造成急性胰腺炎,其通过激活磷脂酰基醇系统,在ca2+介导下对胰腺起作用。本应用例采用新鲜分离的小鼠胰腺腺泡原代细胞,采用cck和tz分别刺激胰腺腺泡细胞,以及提前tz干预5min后,再用cck刺激胰腺腺泡细胞的方式研究tz对cck刺激胰腺腺泡细胞的影响,检测分析数据如图2所示。从图中可以看出,cck刺激小鼠胰腺腺泡细胞钙离子迅速流入细胞内,其峰值可高出正常细胞内钙离子浓度的8倍,因此采用α1肾上腺素能受体阻滞剂干预后,其钙离子内流显著降低,其峰值较cck刺激组明显降低。
应用例2α1肾上腺素能受体阻滞剂降低tlcs引起的小鼠胰腺腺泡原代细胞钙超载
本应用例采用与应用例1中通过的方法对经tlcs刺激后的小鼠胰腺腺泡原代细胞内钙离子([ca2+]i)动态进行测定。
将新鲜的小鼠胰腺腺泡原代细胞,重悬于含20%胎牛血清、100u/ml青霉素和100μg/ml链霉素的ham’sf12k培养基中,以2×105/l的密度接种于4份35mm激光共聚焦专用培养皿,于37℃、含5%co2的培养箱中进行培养条件下孵育2h。加入fluo-4am(终浓度为5μm),于37℃、含5%co2的培养箱中进行培养条件下孵育30min。将溶液慢慢吸出,用磷酸缓冲盐溶液(phosphatebuffersaline,pbs)无钙溶液清洗2次,缓慢加入至1mlpbs(无钙)溶液中。向第一份样本中加入胆酸(taurolithocholicacid3-sulfatedisodiumsalt,tlcs)(tlcs的终浓度为500μm),作为胆酸刺激组;向第二份样本中加入α1受体阻滞剂特拉唑嗪(terazosin,tz)(tz的终浓度为200nm),作为α1肾上腺素能受体阻滞剂刺激组;向第三份样本中首先加入tz(tz的终浓度为200nm)5min干预后再加入tlcs(tlcs的终浓度为500μm))刺激胰腺腺泡细胞,作为经tz干预后的胆酸刺激组;第四份空白对照组。使用激光共聚焦显微镜(leicamicrosystems,wetzlar,germany)对四个实验组进行连续拍摄图像,拍摄间隔为10s,拍摄期间加入cck、tz药物,测定各时间点荧光值即为r值。待加入tz、tlcs药物后5min首先向其中加入离子霉素(终浓度为20μm),使fluo-4和ca2+结合达到饱和,此时测得的荧光值即为rmax。此后5min,向其中加入egta(终浓度为10mm,ph=8.0),以充分螯合ca2+,使fluo-4游离,此时测得的荧光值即为rmin。以上实验重复4次。将检测的图像(zen2012)软件进行处理,采用公式数据输入后得到小鼠胰腺腺泡原代细胞钙离子内流图,如图3a所示。将图3a中各实验组对应检测到的细胞内ca2+浓度峰值进行统计,统计结果如图3b所示。
tlcs能使胰腺腺泡细胞发生ca2+依赖性的细胞死亡,从而引起急性胰腺炎。本应用例采用新鲜分离的小鼠胰腺腺泡原代细胞,采用tlcs和tz分别刺激胰腺腺泡细胞,以及提前tz干预5min后,再用tlcs刺激胰腺腺泡细胞的方式研究tz对tlcs刺激胰腺腺泡细胞的影响,检测分析数据如图3所示。从图中可以看出,tlcs刺激小鼠胰腺腺泡细胞钙离子迅速流入细胞内,其峰值可高出正常细胞内钙离子浓度的4倍多,因此采用α1肾上腺素能受体阻滞剂干预后,其钙离子内流显著降低,其峰值较tlcs刺激组明显降低。
应用例3α1肾上腺素能受体阻滞剂亦能降低cck及tlcs引起的ar42j细胞内钙超载
本应用例采用与应用例1和2中同样的方法研究α1肾上腺素能受体阻滞剂对大鼠胰腺腺泡ar42j细胞钙离子内流的影响。
首先将大鼠ar42j胰腺腺泡细胞,重悬于含20%胎牛血清、100u/ml青霉素和100μg/ml链霉素的ham’sf12k培养基中,以2×105/l的密度接种于3份35mm激光共聚焦专用培养皿,于37℃、含5%co2的培养箱中进行培养条件下孵育24小时后,加入含fluo-4am(终浓度为5μm),于37℃、含5%co2的培养箱中进行培养条件下孵育30min。。将溶液慢慢吸出,用pbs无钙溶液清洗2次,缓慢加入至1mlpbs(无钙)溶液中。向第一份样本中加入低剂量组cck(cck的终浓度为1μm),作为cck低剂量组;向第二份样本中加入高剂量组cck(cck的终浓度为10μm),作为cck高剂量组;第三份空白对照组。使用激光共聚焦显微镜(leicamicrosystems,wetzlar,germany)对3个实验组进行连续拍摄图像(激发波490nm,发射波540nm),拍摄间隔为10s,拍摄期间加入cck、tz药物,测定各时间点荧光值即为r值。待加入cck药物后5min首先向其中加入离子霉素(终浓度为20μm),使fluo-4和ca2+结合达到饱和,此时测得的荧光值即为rmax。此后5min,向其中加入egta(终浓度为10mm,ph=8.0),以充分螯合ca2+,使fluo-4游离,此时测得的荧光值即为rmin。以上实验重复4次。将检测的图像(zen2012)软件进行处理,采用公式数据输入后得到大鼠胰腺腺泡原代细胞钙离子内流图,如图4a所示。将图4a中各实验组对应检测到的细胞内ca2+浓度峰值进行统计,统计结果如图4b所示。
大鼠胰腺腺泡细胞ar42j(atcc,usa)细胞系具有胰腺腺泡的绝大多数功能,而成为急性胰腺炎体外实验研究的标准胰腺腺泡细胞系。该实验证明了cck同样可以引起ar42j细胞钙超载,由于ar42j细胞耐受性较原代胰腺腺泡细胞好,因此cck剂量也有不同调整。紧接着,采用高剂量cck进行下一步实验。
接下来将大鼠ar42j胰腺腺泡细胞,重悬于含20%胎牛血清、100u/ml青霉素和100μg/ml链霉素的ham’sf12k培养基中,以2×105/l的密度接种于6份35mm激光共聚焦专用培养皿,于37℃、含5%co2的培养箱中进行培养条件下孵育24小时后,加入含fluo-4am(终浓度为5μm),于37℃、含5%co2的培养箱中进行培养条件下孵育30min。将溶液慢慢吸出,用pbs无钙溶液清洗2次,缓慢加入至1mlpbs(无钙)溶液中。向第一份样本中加入cck(cck的终浓度为10μm),作为胆囊收缩素刺激组;向第二份样本中加入tz(tz的终浓度为200nm),作为α1肾上腺素能受体阻滞剂刺激组;向第三份样本中首先加入tz(tz的终浓度为200nm)5min干预后再加入cck(cck的终浓度为10μm)刺激胰腺腺泡细胞,作为经tz干预后的胆囊收缩素组;第四份为空白对照组;向第五份加入tlcs(tlcs的终浓度为500μm),作为胆酸刺激组;向第六份样本中首先加入tz(tz的终浓度为200nm)5min干预后再加入tlcs(tlcs的终浓度为500μm))刺激胰腺腺泡细胞,作为经tz干预后的胆酸组。使用激光共聚焦显微镜(leicamicrosystems,wetzlar,germany)对六个实验组进行连续拍摄图像拍摄间隔为10s,拍摄期间加入cck、tlcs、tz药物,测定各时间点荧光值即为r值。待加入cck、tlcs、tz药物后5min首先向其中加入离子霉素(终浓度为20μm),使fluo-4和ca2+结合达到饱和,此时测得的荧光值即为rmax。此后5min,向其中加入egta(终浓度为10mm,ph=8.0),以充分螯合ca2+,使fluo-4游离,此时测得的荧光值即为rmin。以上实验重复4次。将检测的图像(zen2012)软件进行处理,采用公式数据输入后得到大鼠胰腺腺泡原代细胞钙离子内流图,统计如图5a、5c所示。将各实验组对应检测到的细胞内ca2+浓度峰值进行统计,如图5b、5d所示。
从图5可以看出,cck或tlcs均能刺激大鼠胰腺腺泡ar42j细胞钙离子迅速流入细胞内,采用α1肾上腺素能受体阻滞剂tz干预后,其钙离子内流明显降低,其峰值较cck与tlcs刺激组显著降低。
为了验证不同α1肾上腺素能受体阻滞剂对cck及tlcs引起腺泡细胞钙离子内流的抑制作用,本应用例进一步将特拉唑嗪(terazosin,tz,200nm))替换为哌唑嗪(prazosin,pz,200nm)进行干预,具体流程同tz干预。检测结果如图6a-d所示,从图中可以看出,cck或tlcs均能刺激大鼠胰腺腺泡ar42j细胞钙离子迅速流入细胞内,采用α1肾上腺素能受体阻滞剂pz干预后,其钙离子内流明显降低,其峰值较cck与tlcs刺激组显著降低。由此可见,多种α1肾上腺素能受体阻滞剂均可降低cck及tlcs引起的胰腺腺泡细胞内钙超载。
应用例4α1肾上腺素能受体阻滞剂提高cck及tlcs刺激胰腺腺泡细胞存活率
为了证实α1肾上腺素能受体阻滞剂对急性胰腺炎状态下的胰腺腺泡细胞可起到保护作用。本应用例采用碘化丙啶染色,应用流式细胞仪进行细胞死亡的检测方式研究了α1肾上腺素能受体阻滞剂对cck及tlcs诱导胰腺腺泡细胞存活率的影响。
(1)小鼠胰腺腺泡原代细胞:从新鲜小鼠胰腺中分离出的新鲜胰腺腺泡细胞(即小鼠胰腺腺泡原代细胞),重悬于5%胎牛血清、100u/ml青霉素和100μg/ml链霉素的ham’sf12k培养基中,以2.5×105/l密度接种于8组24孔板上(每组3孔),于37℃、含5%co2的培养箱中孵育10min。孵育结束后,向第一组每孔加入cck(终浓度为100nm),在37℃下、含5%co2的培养箱中孵育2小时;向第二组和第三组每孔加入tlcs(终浓度为250or500μm),在37℃下、含5%co2的培养箱中孵育2小时;向第四组每孔加入tz(终浓度为200nm),在37℃下、含5%co2的培养箱中孵育2小时;对于第五至第七组每孔,先向每孔加入tz(终浓度为200nm)预处理2小时,之后将cck(终浓度为100nm)或tlcs(终浓度为250or500μm)加入24孔板中,在37℃下、含5%co2的培养箱中孵育2小时;第8组为空白对照组。每组样本采用药物处理结束后,在每孔中加入碘化丙啶(碘化丙啶与培养液体积比为1:100),之后继续在37℃下、含5%co2的培养箱中继续孵育10min,然后收获细胞和上清液,置放于冰上,采用流式细胞仪进行细胞死亡的检测。以上实验重复3次。检测结果如图7a和7b所示。
(2)大鼠胰腺腺泡细胞ar42j:将ar42j细胞重悬于含20%胎牛血清、100u/ml青霉素和100μg/ml链霉素的ham’sf12k培养基中,以2.5×105/l密度接种于6组24孔板上(每组3孔),于37℃、含5%co2培养箱中孵育24h。孵育结束后采用无血清培养基清洗2次,向第一组每孔加入cck(终浓度为10μm),在37℃下、含5%co2的培养箱中孵育24小时;向第二组本每孔加入tlcs(终浓度500μm),在37℃下、含5%co2的培养箱中孵育6小时;向第三组每孔加入tz(终浓度为200nm),在37℃下、含5%co2的培养箱中孵育4小时;对于第四和第五组每孔,先向每孔加入tz(终浓度为200nm)预处理4小时,之后将cck(终浓度为10μm)加入第四组每孔中,在37℃、含5%co2的培养箱中孵育24小时,将tlcs(终浓度500μm)加入第五组每孔中,在37℃、含5%co2的培养箱中孵育6小时,第6组为空白对照组。每组样本采用药物处理结束后,在每孔中加入碘化丙啶(碘化丙啶与培养液体积比为1:100),之后继续在37℃、含5%co2的培养箱中孵育10min,然后收获细胞和上清液,置放于冰上,采用流式细胞仪进行细胞死亡的检测。以上实验重复4次。检测结果如图7c和7d所示。
从图7中可以看出,经cck及tlcs刺激后的胰腺腺泡存活率明显下降,而对于经α1肾上腺素能受体阻滞剂tz干预后,cck及tlcs刺激后的胰腺腺泡存活率明显得到了提升,说明α1肾上腺素能受体阻滞剂tz能明显减少cck及tlcs诱导胰腺腺泡细胞(包括小鼠胰腺腺泡原代细胞及大鼠胰腺腺泡细胞ar42j)死亡,从而提高了胰腺腺泡细胞的存活率。
应用例5动物试验
1.急性胰腺炎模型建立及分组
采用两种急性胰腺炎动物模型,一是采用腹腔注射胆囊收缩素(cck)类似物---蛙皮素(caerulein,cae),制作轻型急性胰腺炎小鼠模型。二是采用经典的胆酸(tlcs)同类物质---牛磺胆酸钠(sodiumtaurocholate,tlc)逆行胰胆管注射,制作重型急性胰腺炎小鼠模型。
将雄性c57bl/6小鼠按照每组20-30只随机分成对照组、蛙皮素急性胰腺炎组(cae-ap)、牛磺胆酸钠急性胰腺炎组(tlc-ap)、药物组(①特拉唑嗪+蛙皮素急性胰腺炎模型(tz+cae-ap)和②特拉唑嗪+牛磺胆酸钠急性胰腺炎模型(tz+tlc-ap))。cae-ap组采用腹腔注射的方式给予小时注射蛙皮素(cae,50ug/kg),每小时注射一次,连续注射12次。tlc-ap采用牛磺胆酸钠(tlc(3.5%,w/v),50mg/kg)逆行胰胆管注射一次。tz-cae和tz-tlc组均于开始制作急性胰腺炎模型2小时前腹腔注射特拉唑嗪(terazosin,0.4mg/kg)一次。对照组包括对照组一和对照组二,对照组一是采用生理盐水注射进行对照(具体方式同蛙皮素急性胰腺炎组),二是采用假手术,采用开腹后,按照牛磺胆酸钠组实验方法,仅外翻十二指肠后关腹。
2.tz降低小鼠急性胰腺炎血清amy、alt、bun、ctnt的水平
淀粉酶(amylase,amy)在急性胰腺炎发生时明显升高,血清谷氨酸氨基转移酶(alanineaminotransferase,alt)、尿素氮(ureanitrogen,bun)、肌钙蛋白(troponin,ctnt)分别反应肝、肾、心脏的器官功能损伤情况,而amy反应鉴别急性胰腺炎是否发生。
采用临床检验系统(au5800clinicalchemistrysysterm)分别对各组模型的amy进行检验,检查结果如图8a所示。从图中可以看出,对于蛙皮素急性胰腺炎组(cae-ap)和牛磺胆酸钠急性胰腺炎组(tlc-ap),amy含量明显增加,表明这两个模型组的小鼠发生了急性胰腺炎。而对于采用tz干预后的模型组特拉唑嗪+蛙皮素急性胰腺炎模型(tz+cae-ap)和特拉唑嗪+牛磺胆酸钠急性胰腺炎模型(tz+tlc-ap),相比于前两组,amy的含量得到了有效抑制,表明tz能够有效改善急性胰腺炎。
采用临床检验系统(au5800clinicalchemistrysysterm)分别对各组模型的alt进行检验,检查结果如图8b所示。从图中可以看出,对于蛙皮素急性胰腺炎组(cae-ap)和牛磺胆酸钠急性胰腺炎组(tlc-ap),alt含量明显增加,表明这两个模型组的小鼠肝脏受到了损伤。而对于采用tz干预后的模型组特拉唑嗪+蛙皮素急性胰腺炎模型(tz+cae-ap)和特拉唑嗪+胆酸急性胰腺炎模型(tz+tlc-ap),相比于前两组,alt的含量得到了有效抑制,表明肝功能损伤程度明显降低。
采用临床检验系统(au5800clinicalchemistrysysterm)分别对各组模型的bun进行检验,检查结果如图8c所示。从图中可以看出,对于蛙皮素急性胰腺炎组(cae-ap)和牛磺胆酸钠急性胰腺炎组(tlc-ap),bun含量都有所增加,特别是牛磺胆酸钠急性胰腺炎组(tlc-ap),增加尤为明显,表明这两个模型组的小鼠肾功能受到了损伤。而对于采用tz干预后的模型组特拉唑嗪+蛙皮素急性胰腺炎模型(tz+cae-ap)和特拉唑嗪+牛磺胆酸钠急性胰腺炎模型(tz+tlc-ap),相比于前两组,bun的含量得到了有效抑制,表明肾功能损伤程度明显降低。
采用临床检验系统(au5800clinicalchemistrysysterm)分别对各组模型的ctnt进行检验,检查结果如图8d所示。从图中可以看出,对于蛙皮素急性胰腺炎组(cae-ap)和牛磺胆酸钠急性胰腺炎组(tlc-ap),ctnt含量都有所增加,特别是胆酸急性胰腺炎组(tlc-ap),增加尤为明显,表明这两个模型组的小鼠心脏受到了损伤。而对于采用tz干预后的模型组特拉唑嗪+蛙皮素急性胰腺炎模型(tz+cae-ap)和特拉唑嗪+牛磺胆酸钠急性胰腺炎模型(tz+tlc-ap),相比于前两组,ctnt的含量得到了有效抑制,表明心脏损伤程度明显降低。
从上述分析可以看出,tz能够降低急性胰腺炎发生时血清amy、alt、bun、ctnt的水平。结果表明,tz能够降低明显降低小鼠急性胰腺炎肝、肾、心脏的损伤程度,从而改善急性胰腺炎。
3.α1肾上腺素能受体阻滞剂缓解小鼠急性胰腺炎胰腺组织水肿及炎症浸润程度
采用he染色的方法,首先将各模型组的胰腺组织经固定、脱水、染色、脱蜡、透明和封片等主要过程制作病理切片。
采用光学显微镜观察胰腺组织的组织完整性,胰腺水肿、坏死程度和炎症细胞浸润程度,结果如图9a所示。从图中可以看出,对照组胰腺组织结构密实,无明显裂纹。胰腺炎组cae-ap及tlc-ap小鼠胰腺组织结构疏松,有明显水肿及炎症浸润现象,tlc-ap组小鼠胰腺炎组还可见明显坏死组织。经α1肾上腺素能受体阻滞剂提前干预后的药物组tz+cae-ap胰腺组织结构有明显改善,对tz+tlc-ap胰腺组织结构有改善的趋势。
采用胰腺病理学评分进行鉴定。胰腺病理学评分标准参照spormann等评定标准评分。采用单盲法进行病理评分。将每一张切片随机选取高倍视野10个,取其10个视野评分的平均值为该病理切片的病理评分。对各模型组胰腺组织评分结果如图9b所示,从图中看出,经α1肾上腺素能受体阻滞剂提前干预后的药物组tz+cae-ap有明显的改善作用。tz+tlc-ap组小鼠胰腺病理评分较tlc组降低不明显,其原因可能为,牛磺酸钠(tlc)是直接逆行胰胆管注射,tlc除了通过钙超载破坏细胞外,还可直接溶解细胞膜,造成细胞死亡,病变出现快。
4.α1肾上腺素能受体阻滞剂降低急性胰腺炎小鼠循环组蛋白水平
组蛋白是一类碱性蛋白,在dna包和基因调控中起重要作用,在组织损伤和细胞死亡时,核染色质在细胞外分裂和释放,组蛋白被降解成单个进入循环中。循环组蛋白在血液循环中几乎检测不到,除非有广泛的细胞死亡。目前研究发现在小鼠急性胰腺炎模型中,循环组蛋白的水平高低与小鼠器官衰竭程度成一致性改变,最近研究还发现循环组蛋白可预测急性胰腺炎患者持续性器官衰竭和病死率。
采用westernblot法,测定上述各模型组血浆中循环组蛋白。加载等量的血浆3ul,使用15%sds胶,电泳,转移到immobilon-p膜。膜在含有5%脱脂牛奶、1%牛血清白蛋白(bsa)和160μlh2o2的tbst50ml于室温下被封闭2小时,之后用洗涤缓冲液洗涤3次,每次15min,所得膜用一抗(anti-activeh3抗体,1:2000,ab1791abcam,uk)在1%bsa溶液中于4℃孵育过夜,之后用洗涤缓冲液洗涤3次;所得膜再用二抗(山羊抗兔igg-hrp,sc-2004,1:10000,santacruzblotechology)在1%bsa中于室温孵育1小时,之后用洗涤缓冲液洗3次,每次15min。所得膜最后用化学发光系统检测免疫反应,用全自动凝胶成像系统(sydr4/1769,syngenegbox,uk)放射显影,采用genetools软件定量(syngene,uk),测定结果如图10所示。
图10a为各模型组循环组蛋白westernblot电泳图,图10b为各模型组循环组蛋白水平图。从图中可以看出,胰腺炎组cae-ap及tlc-ap,均检测到了循环组蛋白,tlc-ap组中条带尤为清晰,表明循环组蛋白数量较多,反映出tlc-ap组小鼠持续性器官衰竭尤为严重。而经α1肾上腺素能受体阻滞剂提前干预后的药物组tz+cae-ap未检测出循环组蛋白,即使tz+tlc-ap组有检测到,由于条带不清晰,表明其检测到的循环组蛋白数量很少。
因此可以看出,α1肾上腺素能受体阻滞剂能降低tlcs诱导的小鼠急性胰腺炎循环组蛋白水平,从而改善急性胰腺炎。
5.α1肾上腺素能受体阻滞剂降低急性胰腺炎小鼠病死率
对17只采用牛磺胆酸钠(tlc(3.5%,w/v),50mg/kg)逆行胰胆管注射的胰腺炎组(ap)及19只先采用tz提前干预2小时后采用牛磺胆酸钠(tlc(3.5%,w/v),50mg/kg)逆行胰胆管注射的药物组(tz+ap)的小鼠存活时间进行考察,结果如图11所示。从图中可以看出,tz干预后明显降低小鼠急性胰腺炎病死率。
- 还没有人留言评论。精彩留言会获得点赞!