自组装多肽新生抗原肿瘤疫苗及其制备方法与流程
本发明涉及医药领域,特别是一种自组装多肽新生抗原肿瘤疫苗及其制备方法。
背景技术:
肿瘤新生抗原(neoantigens)通常由肿瘤细胞基因组突变产生,仅存在于肿瘤细胞,是肿瘤特异性抗原(tumorspecificantigen,tsa)中的一类。从2013年rosenberg团队率先利用外显子技术在肿瘤细胞系上发现肿瘤新生抗原并验证了其能激起机体免疫反应至今,基于新生抗原的个体化肿瘤疫苗已经得到了巨大的发展。由于正常细胞不会产生和表达新生抗原,所以新生抗原能更有效的特异性地激发机体免疫反应,被认为是肿瘤免疫治疗的终极靶点。2017年《nature》杂志发表了两篇针对新生抗原的肿瘤疫苗相关文章。美国波士顿dana-farber癌症中心的catherinewu教授团队和德国美因茨大学ugursahin团队分别使用针对肿瘤新生抗原的个体化多肽疫苗和个体化rna疫苗治疗黑色素瘤中晚期复发高危患者。这两个实验的结果为个体化肿瘤新抗原疫苗的安全性、免疫原性、有效性提供了证据。
由于开发基于新生抗原的个体化肿瘤疫苗目的是要帮助并训练患者的免疫系统特异性地识别肿瘤,从而进一步对肿瘤细胞进行杀伤并预防肿瘤细胞复发;如何高效地将抗原递呈给免疫系统在很大程度上决定了免疫系统的激活程度和反应时长,进而决定了疫苗的功效。目前全球范围内在研的新生抗原肿瘤疫苗主要包括多肽疫苗、rna疫苗、dna疫苗与细胞疫苗。其中,由于多肽疫苗具有易于合成与纯化,且应用安全、无潜在致癌性等优点,国内外已有多个相关临床试验正在进行。已有多个研究结表明仅仅直接采用可溶性多肽与佐剂联合给药很可能无法引起足够强烈的免疫反应。一个主要原因是这种给药方式不能将抗原和佐剂同时递送到引流淋巴结,从而导致部分经佐剂刺激的apc细胞未能接触到抗原,或部分接触到抗原的apc细胞未经过佐剂刺激;从而引起了免疫耐受及ctlfratricide。因此,如果疫苗中携带抗原的有效药物成分能够同时具有佐剂效应,将能产生更加强烈有效的免疫反应。
另外,目前已经被fda批准的广泛用于人疫苗的铝盐佐剂,对相对分子质量小的多肽抗原几乎没有佐剂活,参考(严琴英,etal.,cgamp:一种新型疫苗佐剂.中华微生物学和免疫学杂志,2017.37(10):p.790-793)。费氏佐剂由于所含的矿物油成分不能被机体代谢,容易引起注射部位的炎症反应、肉芽肿、溃疡及发热等副反应,通常不用于人用疫苗。尽管近年来为了提高抗原的免疫原性,众多学者对新型免疫佐剂如细胞因子佐剂、免疫刺激复合物、纳米材料(如脂质体、高分子聚合物)等进行了广泛的研究。但是这些新型免疫佐剂的有效性和安全性还有待进一步的研究,需要更多的临床数据支持。以目前引起广泛关注的纳米材料——脂质体和高分子聚合物为基础的药物载体/纳米佐剂为例,尽管已有多种制备合成的方法,但是如何提高抗原负载效率、降低制备过程中的活性损失、并减小纳米材料载体在体内的代谢产物对人体的影响和副作用,仍然是需要攻克的难题。
由于新生抗原多肽肿瘤疫苗均为患者个体定制,每条多肽序列和理化特性均不同,仅仅使用含有新生抗原表位的多肽进行肿瘤免疫治疗,难以保证其免疫原性。同时,因为个体化定制的新生抗原多肽的不同特性,也难以简单高效地应用一般的常见方法直接制备合成性质稳定均一的负载多肽的纳米脂质体或聚合物载体。
近年来,由于易于制备、且注射后在体内代谢的产物为对人体无害的氨基酸,自组装多肽已被广泛地研究应用于药物载体、组织工程以及疫苗等生物医学领域。通过对氨基酸序列的设计,可以得到具有不同二级结构(如α-螺旋和β-折叠)的多肽,并在合适的条件下通过自组装形成特定的超分子结构。已有研究结果证明自组装多肽能在体内产生强烈的佐剂效应,参考(rudra,j.s.,etal.,aself-assemblingpeptideactingasanimmuneadjuvant.proceedingsofthenationalacademyofsciences,2009.107(2):p.622-627.)和(rudra,j.s.,etal.,modulatingadaptiveimmuneresponsestopeptideself-assemblies.acsnano,2012.28(6):p.1557-64.)。且自组装多肽疫苗的免疫原性是t细胞相关的,由多肽自组装形成的结构所决定,因此并不只局限于某种特定的自组装多肽序列。如果进一步在自组装多肽的氨基酸序列的n-端和/或c-端按照应用的需要增加新的氨基酸序列、脂肪链基团、或其它官能团(如巯基、马来酰亚胺基、叠氮基团等),即可以得到具有不同特性的产物。
本发明将自组装多肽应用到新生抗原多肽肿瘤疫苗,解决了可溶性多肽疫苗加上佐剂无法达到的肿瘤疫苗功效,及避免了使用佐剂引起的影响和副作用。
技术实现要素:
为解决现有技术的不足,本发明的目的在于提供一种自组装多肽新生抗原肿瘤疫苗及其制备方法,本发明引入了自组装多肽概念,通过对新生抗原多肽序列的合理设计,使得到的多肽在携带新生抗原表位的同时能够自组装形成特定的超分子结构,在体内起到佐剂效应,进一步提升肿瘤疫苗功效并减少副反应。
为了实现上述目标,本发明采用如下的技术方案:
自组装多肽新生抗原肿瘤疫苗,包括:将预测出的患者自身hla有亲和力的多肽序列作为新生抗原多肽序列,标记为a段序列;将能够自组装的多肽作为自组装多肽序列,标记为b段序列;通过spacer序列连接所述a段序列和b段序列成为完整的多肽疫苗序列,再按照完整的多肽疫苗序列制备多肽,得到自组装多肽新生抗原肿瘤疫苗;
自组装多肽为可通过肽键间的氢键作用、氨基酸残基之间的氢键作用、静电作用、疏水作用以及π-π堆积作用有效实现分子自组装的多肽。
前述的自组装多肽新生抗原肿瘤疫苗,新生抗原多肽序列的ic50小于50nm;ic50为利用亲和力预测算法netmhcpan分析短多肽与患者自身hla的结合能力的预测结果。
前述的自组装多肽新生抗原肿瘤疫苗,自组装多肽序列先形成β-折叠二级结构,再进一步自组装形成纳米纤维、纳米带、纳米管这几类超分子结构。
前述的自组装多肽新生抗原肿瘤疫苗,自组装多肽序列包括:ff、iiik、lllllk、kiiiik、ivd、kffe、fkfe、keffffke、keffffef、kfefkfef、klvff、klvffae、qqrqqqqqeqq、qqrfqwqfeqq、qqkfqfqfeqq、(aeak)4、(aeaeakak)2、aeaeaeaeakakakak、fefefkfkfefefkfk、(rada)4、raradadararadada、gnnqqny、gvfvlgflgfla、siinfekl。
前述的自组装多肽新生抗原肿瘤疫苗,spacer序列与a段序列和b段序列之间的连接方式包括:ax-s-b,ax-s-b-s-ay,ax-s-b-s-ay-s-b-s-az。
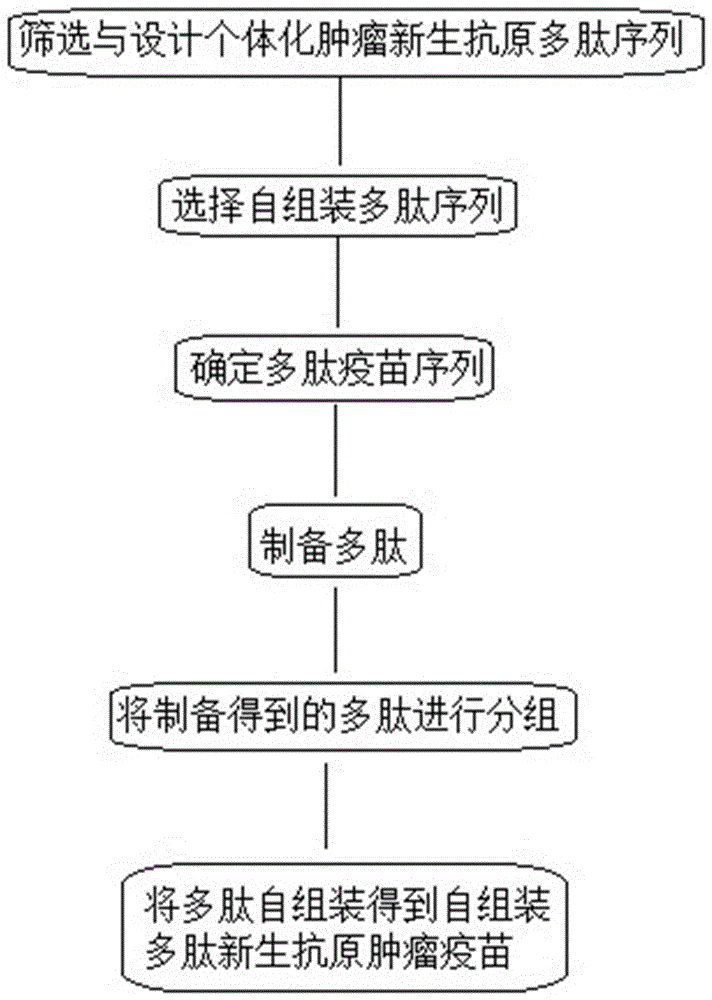
自组装多肽新生抗原肿瘤疫苗的制备方法,包括如下步骤:
步骤一,个体化肿瘤新生抗原多肽序列的筛选与设计;
分别将肿瘤患者的正常细胞dna测序结果和肿瘤细胞dna测序结果比对到人类参考基因组(ensemblhg38),从比对结果中鉴定出肿瘤细胞特有的体细胞突变;
根据这些突变信息预测可能存在于肿瘤细胞中的新生抗原,同时,从比对结果中预测患者自身的i类hla分型;
根据i类hla能够结合的多肽长度8-11个氨基酸,截取含有突变氨基酸的多肽序列,利用亲和力预测算法netmhcpan分析短多肽与患者自身hla的结合能力;
根据与hla的亲和力、突变的可信程度、突变频率筛选出一批突变位点,以此作为合成多肽的序列来源合成多肽,多肽的数量范围为5~20条,得到新生抗原多肽序列;
步骤二,自组装多肽序列的选择;
自组装多肽序列:ff、iiik、lllllk、kiiiik、ivd、kffe、fkfe、keffffke、keffffef、kfefkfef、klvff、klvffae、qqrqqqqqeqq、qqrfqwqfeqq、qqkfqfqfeqq、(aeak)4、(aeaeakak)2、aeaeaeaeakakakak、fefefkfkfefefkfk、(rada)4、raradadararadada、gnnqqny、gvfvlgflgfla、siinfekl;
步骤三,多肽疫苗序列的确定与多肽制备;
将筛选得到的新生抗原多肽序列标记为a段序列;将选择的自组装多肽序列标记为b段序列;
将a段序列通过spacer序列与b段序列连接成完整的多肽疫苗序列,再按照完整的多肽疫苗序列制备多肽;
步骤四,多肽的分组与自组装得到自组装多肽新生抗原肿瘤疫苗;
将制备得到的多肽进行分组,分组数量为2~4组;
将多肽自组装得到自组装多肽新生抗原肿瘤疫苗;
自组装方式包括:在多肽分组混合后按照适用于所选择的自组装多肽序列的自组装条件进行多肽的自组装,在单条多肽的自组装完成后再进行多肽的分组混合。
前述的自组装多肽新生抗原肿瘤疫苗的制备方法,突变位点筛选的标准为:亲和力小于50nm;突变事件经实验验证为阳性;突变频率大于等于0.1。
前述的自组装多肽新生抗原肿瘤疫苗的制备方法,将制备得到的多肽进行分组,分组标准包括:a.每组多肽数量不超过5条;b.各组间多肽的平均突变率相对差异不超过10%;c.indel突变设计的多肽平均分配到各组;d.同一突变位点设计的多肽平均分配到各组。
前述的自组装多肽新生抗原肿瘤疫苗的制备方法,制备得到的自组装多肽新生抗原肿瘤疫苗采用冻干粉状态避光密封冷冻保存。
前述的自组装多肽新生抗原肿瘤疫苗的制备方法,
步骤四,多肽的分组与自组装得到自组装多肽新生抗原肿瘤疫苗;
将制备得到的多肽进行分组,分组数量为4组;
分组标准包括:a.每组多肽数量不超过5条;b.各组间多肽的平均突变率相对差异不超过10%;c.indel突变设计的多肽平均分配到各组;d.同一突变位点设计的多肽平均分配到各组;
将多肽自组装得到自组装多肽新生抗原肿瘤疫苗;
自组装方式为将单条多肽自组装完成后再进行多肽的分组混合。
本发明的有益之处在于:
自组装多肽新生抗原肿瘤疫苗携带新生抗原表位且同时能够自组装形成特定的超分子结构从而在体内起到佐剂效应,相比可溶性多肽疫苗加上佐剂这种组合,具有更强的免疫原性,能够更高效地被抗原递呈细胞吞噬;
自组装新生抗原多肽疫苗能够激起cd8+t细胞对肿瘤细胞更强烈的杀伤反应,能在人源化小鼠体内能引起更强烈的免疫反应,具有更好的肿瘤疫苗功效;
由于不需要使用其它的免疫佐剂用于提升这种新型的肿瘤疫苗的功效,从而减少了其它佐剂的应用可能引起的影响和副作用;
并且可以减少购买使用其它免疫佐剂的花费,从而降低这部分的成本。
附图说明
图1是本发明制备方法的一种流程图;
图2是本发明的抗原递呈细胞的多肽摄取情况示意图(横坐标:m-c小鼠体内被巨噬细胞-控制组,m-p小鼠体内被巨噬细胞-对照组,m-s小鼠体内被巨噬细胞-自组装多肽组,d-c树突细胞-控制组,d-p树突细胞-对照组,d-s树突细胞-自组装多肽组;纵坐标:细胞摄取率);
图3是实验三中c组、p组、s组各随机选取一个的elispot的检测结果示意图(横坐标:c组为对照组,p组为对照新生抗原多肽组,s组为可自组装新生抗原多肽组;纵坐标:细胞斑点数);
图4是实验四中多肽疫苗在小鼠体内对肿瘤的抑制效果示意图(横坐标:天数,纵坐标:相对肿瘤体积/mm3);
图5是实验五多肽疫苗在小鼠体内对肿瘤的预防效果示意图(横坐标:天数,纵坐标:肿瘤体积/mm3)。
具体实施方式
以下结合附图和具体实施例对本发明作具体的介绍。
自组装多肽新生抗原肿瘤疫苗的制备方法,包括如下步骤:
步骤一,个体化肿瘤新生抗原多肽序列的筛选与设计:利用已公开专利,申请号为201810101691.2中的肿瘤新抗原筛选方法。分别将肿瘤患者的正常细胞dna测序结果和肿瘤细胞dna测序结果比对到人类参考基因组(ensemblhg38),从比对结果中鉴定出肿瘤细胞特有的突变(即体细胞突变),然后根据这些突变信息预测可能存在于肿瘤细胞中的新生抗原,同时,从比对结果中预测患者自身的i类hla分型。然后,根据i类hla能够结合的多肽长度(8-11)截取含有突变氨基酸的多肽序列,利用亲和力预测算法netmhcpan分析短多肽与患者自身hla的结合能力。
预测结果用ic50分值表示,ic50小于500nm表示该多肽与hla有弱亲和力,ic50小于50nm表示该多肽与hla具有强亲和力。
最后根据与hla的亲和力、突变的可信程度、突变频率等条件筛选出一批突变位点,以此作为合成多肽的序列来源,具体标准为:亲和力小于50nm;突变事件经实验验证为阳性;突变频率大于等于0.1。合成多肽的数量范围为5~20条。优选多肽数量为8~15条。每条多肽长度不超过30个氨基酸。由于后续步骤中新生抗原多肽疫苗还需通过spacer序列与自组装多肽序列相连接,所以优选多肽长度为8~25个氨基酸。
步骤二,自组装多肽序列的选择:可在这种新型肿瘤疫苗的多肽序列中引入的自组装多肽序列包括但不限于以下多肽序列:ff、iiik、lllllk、kiiiik、ivd、kffe、fkfe、keffffke、keffffef、kfefkfef、klvff、klvffae、qqrqqqqqeqq、qqrfqwqfeqq、qqkfqfqfeqq、(aeak)4、(aeaeakak)2、aeaeaeaeakakakak、fefefkfkfefefkfk、(rada)4、raradadararadada、gnnqqny、gvfvlgflgfla、siinfekl等。
由于后面步骤中还需要通过spacer序列连接自组装多肽序列与新生抗原多肽序列,在完整多肽序列的长度被限定不超过为30个氨基酸的情况下,当使用氨基酸数量较少的自组装短肽时,该多肽疫苗能够携带更多的新生抗原表位。因此,优选的自组装多肽序列长度为2~8个氨基酸。
步骤三,多肽疫苗序列的确定与多肽制备:
将筛选得到的新生抗原多肽序列(按ic50分值升序顺序标记;如筛选得到10条多肽,则依次标记为a1、a2、a3、a4、a5、a6、a7、a8、a9、a10)分别通过spacer序列(如sgsg、ggg等)与所选择的自组装多肽序列(b段)连接成完整的多肽疫苗序列。
可以采用的连接方式包括:ax-s-b、ax-s-b-s-ay、ax-s-b-s-ay-s-b-s-az(s为spacer序列,x、y、z分别代表不同的数字)等。由于设计所得多肽的长度受限,所以优选ax-s-b这种连接方式。
按照确定的完整的多肽疫苗序列制备多肽。
多肽的制备方式包括:化学合成方式,核酸分子(例如dna和rna)通过转录和翻译的方式,细菌或病毒为载体表达方式。作为一种实施例,若采用常规的化学合成多肽的制备方法,按照设计确定的多肽序列依次开展多肽合成、切割、纯化、冻干工艺,可得到目标多肽。多肽的制备方式都是现有技术,在此不再赘述。
步骤四,多肽的分组与自组装:
将上一步骤中制备得到的多肽按照下列标准进行分组:a.每组多肽数量不超过5条;b.各组间多肽的平均突变率尽量接近;c.indel突变设计的多肽平均分配到各组;d.同一突变位点设计的多肽平均分配到各组。分组数量通常在2~4组,优选4组。
可在多肽分组混合后按照适用于所选择的自组装多肽序列的自组装条件进行多肽的自组装;也可在单条多肽的自组装完成后再进行多肽的分组混合。
由于采用多肽分组混合后再自组装会为自组装过程增加不确定性,更难以得到稳定均一的超分子结构;优选将单条多肽自组装完成后再进行多肽的分组混合。作为一种实施例,在合适的多肽浓度(100μm)与温度(37℃)下孵育包含klvff自组装多肽片段的单条多肽2h,使其形成纤维状的自组装结构。可将单条多肽自组装形成超分子稳定结构后按前述标准分组混合后,再将其制成冻干粉进行存储直至使用。
实验验证部分:
实验1.携带多个新生抗原表位且同时能够自组装形成特定超分子结构的自组装多肽新生抗原肿瘤多肽疫苗的设计、制备与表征;
实验目的:验证设计制备得到的多肽能够进行自组装形成稳定的超分子结构。
利用已公开专利,申请号为201810101691.2中的肿瘤新抗原筛选方法。分别将肿瘤患者的正常细胞dna测序结果和肿瘤细胞dna测序结果比对到人类参考基因组(ensemblhg38),从比对结果中鉴定出肿瘤细胞特有的突变(即体细胞突变),然后根据这些突变信息预测可能存在于肿瘤细胞中的新生多肽抗原,同时,从比对结果中预测患者自身的i类hla分型。然后,根据i类hla能够结合的多肽长度(8-11)截取含有突变氨基酸的多肽序列,利用亲和力预测算法netmhcpan分析短多肽与患者自身hla的结合能力。预测结果用ic50分值表示,ic50小于500nm表示该多肽与hla有弱亲和力,ic50小于50nm表示该多肽与hla具有强亲和力。
选取了自有数据库中的一例黑色素瘤患者,通过上述方法,预测出了所有与该患者自身hla有亲和力的多肽。每条多肽长度不超过30个氨基酸。在该实施例中,为了便于展示,选取了ic50分值最小的10条多肽,预测亲和力得分如下表1所示。将这部分多肽序列标记为a段序列。
表1.筛选得到的亲和力最高的多肽列表
可选取的自组装多肽序列如表2所示:
表2.自组装多肽序列表
自组装多肽主要通过其肽键间的氢键作用、氨基酸残基之间的氢键作用、静电作用、疏水作用以及π-π堆积作用等有效实现分子自组装。表2中所列的自组装多肽均可在一定的反应条件下先形成β-折叠二级结构,再进一步自组装形成纳米纤维、纳米带、纳米管这几类超分子结构。已有文献表明具有这样的超分子结构的自组装多肽能在体内产生强烈的免疫佐剂效应,参考文献(rudra,j.s.,etal.,aself-assemblingpeptideactingasanimmuneadjuvant.proceedingsofthenationalacademyofsciences,2009.107(2):p.622-627)和(rudra,j.s.,etal.,modulatingadaptiveimmuneresponsestopeptideself-assemblies.acsnano,2012.28(6):p.1557-64)。
此实施例中选取klvff序列作为能够自组装的多肽的序列代表,标记为b段。选取sgsg作为spacer序列连接a段序列与b段序列,形成完整的a+spacer+b类型的多肽序列。连接序列的工作交付给多肽合成公司完成。
同时将筛选设计得到的a段多肽序列单独作为对照组多肽疫苗。
设计的多肽序列委托多肽生产公司代生产,主要质控指标:纯度≥95%,内毒素≤10eu/mg,无菌。生产工艺为常规的多肽制备方法:依次开展多肽合成、切割、纯化、冻干工艺,最终得到目标多肽。多肽冻干粉-20℃下密封避光保存。
使用无菌去离子超纯水溶解单条自组装新生抗原多肽,按照6:1的体积比与pbs溶液混合,得到终浓度为300μm的多肽溶液。在37℃下孵育该多肽溶液4h,使带有klvff片段的多肽自组装形成纤维状的超分子结构。为了考察形成的多肽超分子结构的稳定性,将完成自组装的多肽溶液进行分装后部分样品密封避光保存在4℃冰箱。另一部分的多肽样品制成冻干粉后在-20℃密封避光保存。采用透射电镜(tem)表征0、7、30、90、180天这5个时间点的多肽样品的稳定性。
实验结果:t0为稳定性实验初始时间点。选取s1、s2、s3三条多肽为代表,tem结果表明这三条多肽序列均能成功自组装形成纳米纤维结构。采用两种不同的保存方式。多肽冻干粉在-20℃密封避光保存180天后,仍能通过自组装形成稳定的纳米纤维状的超分子结构。而自组装完成的多肽溶液在4℃冰箱密封避光保存30天即可发现多肽的超分子纳米纤维结构发生改变,部分纤维断裂,结构不稳定。因此,设计得到的可自组装的新生抗原多肽疫苗应采用冻干粉状态避光密封冷冻保存。
实验2:多肽的抗原递呈细胞摄取实验;
实验目的:通过该试验验证与对照组的新生抗原多肽相比,自组装后的具有超分子结构的新生抗原多肽能够更多地被抗原递呈细胞摄取。
从10条自组装多肽中任意选取3条,使用荧光标记物tamra(mce公司)通过nhs活性酯与氨基的偶联反应分别标记自组装后的多肽(s组:s1、s2、s3)与对应的对照组多肽(p组:p1、p2、p3)。采用pbs溶液作为阴性对照组(c组:c)。选用8周龄人源化小鼠b-nsg(cd34+)21只,随机分为7组,每组3只。分别将上述7组多肽(s1、s2、s3、p1、p2、p3、c)分两次注射入小鼠腹腔内(每次50l)。20h后,处死小鼠,注射2mlhbss缓冲液至小鼠腹腔,按揉40次,再从腹腔取出1ml体液。通过离心(400g,5min)收集体液中的细胞。使用流式细胞仪进行分析表征。
实验结果:如图2所示,定量分析流式细胞实验的结果表明,自组装多肽组(s组)与对照多肽组(p组)和阴性对照组相比较,其在小鼠体内被巨噬细胞(macrophage)和树突细胞(dccell)的摄取率均显著提高(p<0.01)。
实验3:多肽的免疫原性测定;
实验目的:通过elispot实验,验证与只携带新生抗原表位的肿瘤多肽疫苗(对照组)相比,本发明中自组装新生抗原多肽疫苗能在人源化小鼠体内能引起更强烈的免疫反应,具有更好的免疫效果。
实验方法:
为了检测多肽的免疫反应,实施ifn-γ酶联免疫吸附(elispot)测定法。详细的实验过程如下:将10条自组装新生抗原多肽混合后作为自组装新生抗原混合多肽组(s组);将对照组的10条新生抗原多肽混合后作为新生抗原混合多肽对照组(p组);采用pbs溶液为阴性对照组(c组)。选用8周龄人源化小鼠b-nsg(cd34+)18只,随机分为3组,每组6只。适应一周后开始小鼠免疫接种实验。s组:10条多肽按每条多肽10μg混合后溶解在2mlpbs缓冲液中,与弗氏不完全佐剂freund’sadjuvant(fia,sigma-aldrich)1:1混匀,乳化30分钟。p组:10条多肽按每条多肽10μg混合后溶解在2mlpbs缓冲液中,与弗氏不完全佐剂freund’sadjuvant(fia,sigma-aldrich)1:1混匀,乳化30分钟。c组:采用pbs溶液与弗氏不完全佐剂1:1混合乳化30分钟作为阴性对照。每组6只小鼠,分四次于颈背部右胸皮下免疫,总剂量200μl/只。1周接种一次,持续三周,第三次免疫后第10天,处死小鼠,取小鼠脾脏,制备小鼠淋巴细胞悬液,用于elispot检测。
elispot检测结果中,ifn-γ呈阳性结果的多肽,即判定为阳性候选多肽。将小鼠淋巴细胞稀释成浓度为1-2*106/ml,铺24孔板,每孔1ml,分为对照组n组(与多肽相同浓度的dmso)、s组(s1、s2、s3、s4、s5、s6)、p组(p1、p2、p3、p4、p5、p6)、c组(c1、c2、c3、c4、c5、c6),共计19组,分别加入相应的多肽(10μg/ml),预孵育72h后离心分离细胞,调整细胞浓度为2*106/ml,上ifn-γelispot板(每只小鼠3个重复),按照ifn-γelispot试剂盒的说明书方法进行显色,运用ctl-immunospots5系列酶联斑点分析仪读取产生的斑点数。ifn-γ阳性结果表明有抗原特异性t细胞产生,视为多肽能引起机体的免疫反应,斑点数的多少反映其免疫的强弱。
实验结果:
c组为对照组,p组为对照新生抗原多肽组,s组为可自组装新生抗原多肽组。每组各随机选取一个elispot的结果为代表,如图3a所示。定量分析各组所有实验结果。如图3b所示,每百万个细胞中,s组的混合多肽能产生约616-826个斑点。p组的混合多肽能产生约369-505个斑点。阴性对照组基本无斑点产生。结果说明与新生抗原多肽疫苗相比,可自组装新生抗原多肽疫苗能够引起更强的免疫反应(p<0.01)。
实验4:人源化小鼠模型中本发明疫苗对肿瘤治疗效力的评价;
实验目的:验证自组装新生抗原多肽肿瘤疫苗能否在体内激发t细胞对肿瘤细胞的杀伤,且杀伤效果强于对照组新生抗原多肽肿瘤疫苗的杀伤效果。
实验过程:
选用8周龄人源化小鼠b-nsg(cd34+)18只,适应一周后,收集对数生长期的bxpc-3(mut6)细胞,制备成5*106/ml细胞悬液,以0.2ml种于小鼠左前肢腋下。以皮下肿瘤结节直径达5mm左右为成瘤标准,9-12天内成瘤,选择无出血、无坏死、无感染的小鼠,随机分为3组(可自组装新生抗原多肽疫苗s组(s1、s2、s3、s4、s5、s6)、对照新生抗原多肽疫苗p组(p1、p2、p3、p4、p5、p6)、阴性对照c组(c1、c2、c3、c4、c5、c6)),每组6只,分组之后当天免疫,免疫方式参见实验3免疫接种部分。第28天处死小鼠,用游标卡尺日测量肿瘤长径和短径,计算肿瘤体积:tv=1/2×a×b2,其中a、b分别表示长径和短径,根据测量结果计算出相对肿瘤体积(relativetumorvolume,rtv),rtv=vt/v0。其中v0为分笼时(即d0)测量所得肿瘤体积,vt为每个测量时间点的肿瘤体积,绘制相对肿瘤体积曲线,并记录各组动物体重。
实验结果:
分组处理之前各组移植瘤的生长情况基本一致,体积大小无明显差异(p>0.05)。如图4所示,横坐标表示疫苗注射后的天数,纵坐标表示相对肿瘤体积。s组为可自组装新生抗原多肽疫苗组,p组为新生抗原多肽疫苗组,control代表阴性对照组。免疫后1周,s组与p组的移植瘤与对照组相比,其体积明显更小(p>0.05),随着免疫次数增多和时间的延长,s组、p组与对照组相比,瘤体大小受抑程度越来越明显,说明两种多肽疫苗均能在小鼠体内起到抑制肿瘤生长的作用。同时,从第二周起,相比p组,s组的瘤体体积减小的更多(p<0.01),说明其具有更强烈的肿瘤抑制作用。免疫后2周,其肿瘤已出现缩小的情况,到免疫后4周,s组的瘤体显著缩小,说明s组疫苗激发的免疫响应对肿瘤细胞产生了强烈的杀伤作用。
实验5:人源化小鼠模型中本发明疫苗对肿瘤预防效力的评价;
实验目的:验证自组装新生抗原多肽肿瘤疫苗在人源化小鼠上安全有效且能有效预防肿瘤的发生。
实验过程:
选用8周龄人源化小鼠b-nsg(cd34+)18只,随机分为3组(参见实验4分组方式:s组、p组与n组),每组6只,适应一周后,对小鼠进行免疫接种,方法参见实验3的免疫接种方法。第三次免疫接种后1周,收集对数生长期的bxpc-3(mut6)细胞,制备成5*106个/ml细胞悬液,以0.2ml种于小鼠左前肢腋下。
每天记录各组动物的肿瘤发生情况,肿瘤长出后,用游标卡尺日测量肿瘤长径和短径,计算肿瘤体积:tv=1/2×a×b2,其中a、b分别表示长径和短径,并记录各组动物体重。评价:接种肿瘤四周后,处死所有小鼠,终止实验,计算抑瘤率并进行评价。
抑瘤率(%)=(对照组肿瘤平均体积-实验组肿瘤平均体积)/对照组肿瘤平均体积×100%。
数据处理:采用spss软件进行统计学分析,采用单因素方差分析进行比较,p<0.05为差异有统计学意义。
实验结果:如图5所示,横坐标表示疫苗注射后的天数,纵坐标表示肿瘤体积。s组为可自组装新生抗原多肽疫苗组,p组为新生抗原多肽疫苗组,control代表阴性对照组。接种肿瘤10天之后,对照组肿瘤开始缓慢增大,s组与p组的肿瘤体积抑制明显。与对照组相比,第16天时,各实验组仍无肿瘤形成。随着时间的延长,p组瘤体大小缓慢增大,但增长速度明显低于对照组(p<0.01)。同时,s组的瘤体增长速度也明显小于p组(p<0.01)。且在接种肿瘤28天时,s组仍有2只小鼠的瘤体几乎不可见。本试验证实了可自组装新生抗原多肽疫苗能够更有效地预防肿瘤的发生。
由以上实验综合可知:自组装多肽新生抗原肿瘤疫苗携带新生抗原表位且同时能够自组装形成特定的超分子结构从而在体内起到佐剂效应,相比可溶性多肽疫苗加上佐剂这种组合,具有更强的免疫原性,能够更高效地被抗原递呈细胞吞噬,能够激起cd8+t细胞对肿瘤细胞更强烈的杀伤反应,能在人源化小鼠体内能引起更强烈的免疫反应,具有更好的肿瘤疫苗功效;由于不需要使用其它的免疫佐剂用于提升这种新型的肿瘤疫苗的功效,从而减少了其它佐剂的应用可能引起的影响和副作用;并且可以减少购买使用其它免疫佐剂的花费,从而降低这部分的成本。
以上显示和描述了本发明的基本原理、主要特征和优点。本行业的技术人员应该了解,上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
序列表
<110>杭州纽安津生物科技有限公司
<120>自组装多肽新生抗原肿瘤疫苗及其制备方法
<141>2019-07-10
<160>35
<170>siposequencelisting1.0
<210>1
<211>2
<212>prt
<213>peptidesequence
<400>1
phephe
1
<210>2
<211>4
<212>prt
<213>peptidesequence
<400>2
ileileilelys
1
<210>3
<211>6
<212>prt
<213>peptidesequence
<400>3
leuleuleuleuleulys
15
<210>4
<211>6
<212>prt
<213>peptidesequence
<400>4
lysileileileilelys
15
<210>5
<211>3
<212>prt
<213>peptidesequence
<400>5
ilevalasp
1
<210>6
<211>4
<212>prt
<213>peptidesequence
<400>6
lysphepheglu
1
<210>7
<211>4
<212>prt
<213>peptidesequence
<400>7
phelyspheglu
1
<210>8
<211>8
<212>prt
<213>peptidesequence
<400>8
lysgluphephephephelysglu
15
<210>9
<211>8
<212>prt
<213>peptidesequence
<400>9
lysgluphephephephegluphe
15
<210>10
<211>8
<212>prt
<213>peptidesequence
<400>10
lysphegluphelysphegluphe
15
<210>11
<211>5
<212>prt
<213>peptidesequence
<400>11
lysleuvalphephe
15
<210>12
<211>7
<212>prt
<213>peptidesequence
<400>12
lysleuvalphephealaglu
15
<210>13
<211>11
<212>prt
<213>peptidesequence
<400>13
glnglnargglnglnglnglnglngluglngln
1510
<210>14
<211>11
<212>prt
<213>peptidesequence
<400>14
glnglnargpheglntrpglnphegluglngln
1510
<210>15
<211>11
<212>prt
<213>peptidesequence
<400>15
glnglnlyspheglnpheglnphegluglngln
1510
<210>16
<211>16
<212>prt
<213>peptidesequence
<400>16
alaglualalysalaglualalysalaglualalysalaglualalys
151015
<210>17
<211>16
<212>prt
<213>peptidesequence
<400>17
alaglualaglualalysalalysalaglualaglualalysalalys
151015
<210>18
<211>16
<212>prt
<213>peptidesequence
<400>18
alaglualaglualaglualaglualalysalalysalalysalalys
151015
<210>19
<211>16
<212>prt
<213>peptidesequence
<400>19
phegluphegluphelysphelysphegluphegluphelysphelys
151015
<210>20
<211>16
<212>prt
<213>peptidesequence
<400>20
argalaaspalaargalaaspalaargalaaspalaargalaaspala
151015
<210>21
<211>16
<212>prt
<213>peptidesequence
<400>21
argalaargalaaspalaaspalaargalaargalaaspalaaspala
151015
<210>22
<211>7
<212>prt
<213>peptidesequence
<400>22
glyasnasnglnglnasntyr
15
<210>23
<211>12
<212>prt
<213>peptidesequence
<400>23
glyvalphevalleuglypheleuglypheleuala
1510
<210>24
<211>8
<212>prt
<213>peptidesequence
<400>24
serileileasnpheglulysleu
15
<210>25
<211>9
<212>prt
<213>peptidesequence
<400>25
asnasnaspilepheleutyrgluile
15
<210>26
<211>8
<212>prt
<213>peptidesequence
<400>26
thrthrgluilethrtyrprothr
15
<210>27
<211>11
<212>prt
<213>peptidesequence
<400>27
sermetthrgluilethrtyrprothrsermet
1510
<210>28
<211>10
<212>prt
<213>peptidesequence
<400>28
metarggluilethrtyrprothrthrmet
1510
<210>29
<211>14
<212>prt
<213>peptidesequence
<400>29
prothrthrmetthrgluthrserserthralathrserleu
1510
<210>30
<211>9
<212>prt
<213>peptidesequence
<400>30
lysargargargglyleuleugluval
15
<210>31
<211>10
<212>prt
<213>peptidesequence
<400>31
valalaserlysglyargglyglyleulys
1510
<210>32
<211>9
<212>prt
<213>peptidesequence
<400>32
argilethrglugluglntyrargile
15
<210>33
<211>11
<212>prt
<213>peptidesequence
<400>33
argilethrglugluglntyrargilegluala
1510
<210>34
<211>11
<212>prt
<213>peptidesequence
<400>34
glyprophealaargserileaspileserphe
1510
<210>35
<211>11
<212>prt
<213>peptidesequence
<400>35
argproglyglyaspglygluglyaspthrasn
1510
- 还没有人留言评论。精彩留言会获得点赞!
- 一种用于b细胞抗原表位筛查的多肽阵列合成技术的制作方法
- 一组抗原表位多肽及其应用的制作方法
- 一种新的多肽——高迁移率组分蛋白12.87和编码这种多肽的多核苷酸的制作方法
- 包含结合Fc受体的多肽和抗原性多肽的用于介导免疫应答的融合蛋白的制作方法
- 一种新的多肽——高迁移率组分蛋白家族10.45和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——高迁移率组分蛋白10和编码这种多肽的多核苷酸的制作方法
- 含有来自乙肝病毒x蛋白的肽抗原的脂质体的制作方法
- 一种新的多肽——人一种组织或发育阶段特异转录因子相关因子11和编码这种多肽的多 ...的制作方法
- 肿瘤热休克蛋白-多肽复合物抗原的分离纯化方法
- 组织保护活性多肽及其应用的制作方法