一种负载外泌体的金属基植入材料及其制备方法和应用与流程
本发明属于生物医用金属材料表面改性技术领域,具体涉及一种负载外泌体的金属基植入材料及其制备方法和应用。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
在牙科、骨科等领域,金属基植入材料是常用的承重部位硬组织修复或替换材料。为了使金属与人骨表面发生骨性结合,往往需要对材料进行表面改性,以提高其生物活性。随着种植适用症的不断扩大,对于较为复杂的临床病例,尤其对患有糖尿病、骨质疏松症的患者而言,由于骨缺损局部骨代谢紊乱,成骨细胞活性降低,严重妨碍了植入后材料表面的骨整合。利用生物活性因子修饰材料可迅速提高材料表面生物活性。然而临床应用中发现,较高浓度的人重组骨形态发生蛋白会引起并发症甚至导致肿瘤发生,而且大多数生物活性因子存在半衰期短、免疫原性高且稳定性差等缺陷,活性因子的递送、剂量和价格也是其应用的障碍。因此迫切需要新的策略提高骨质疏松环境下骨缺损部位金属植入材料表面的骨长入能力。
近年来,携带有特异性功能蛋白质和核酸的细胞外囊泡——外泌体,具有低免疫原性、较长半衰期以及高稳定性等特点,引起了研究人员的关注。众多研究表明,细胞分泌的外泌体具有促进细胞增殖分化、调节免疫等功能,依靠其内含的蛋白质和核酸,尤其是mi-rna,在成骨细胞、破骨细胞和骨髓基质细胞之间的细胞间通讯中发挥至关重要的作用。因此,利用外泌体修饰金属基植入材料表面,可显著缩短植入体表面骨整合时间,对于骨科领域金属基植入材料在促进骨再生和血管新生方面具有极大的应用前景和价值。
发明人发现,国内外目前关于外泌体的修饰多聚焦于聚合物基质,而对于金属材料结合外泌体的报道非常少,主要是缺乏金属表面有效固定外泌体的手段和方法。金属表面一般通过静电作用可吸附少量生物大分子,但这种物理结合效率很低,而且吸附作用极不稳定。也有学者利用聚多巴胺薄膜作为连接材料和功能分子活性基团的过渡层,但是聚多巴胺薄膜无法提供粗糙表面或微纳尺度结构以增加外泌体的结合量。
技术实现要素:
针对上述现有技术中存在的问题,本发明的目的是提供一种负载外泌体的金属基植入材料及其制备方法和应用。
为了解决以上技术问题,本发明的技术方案为:
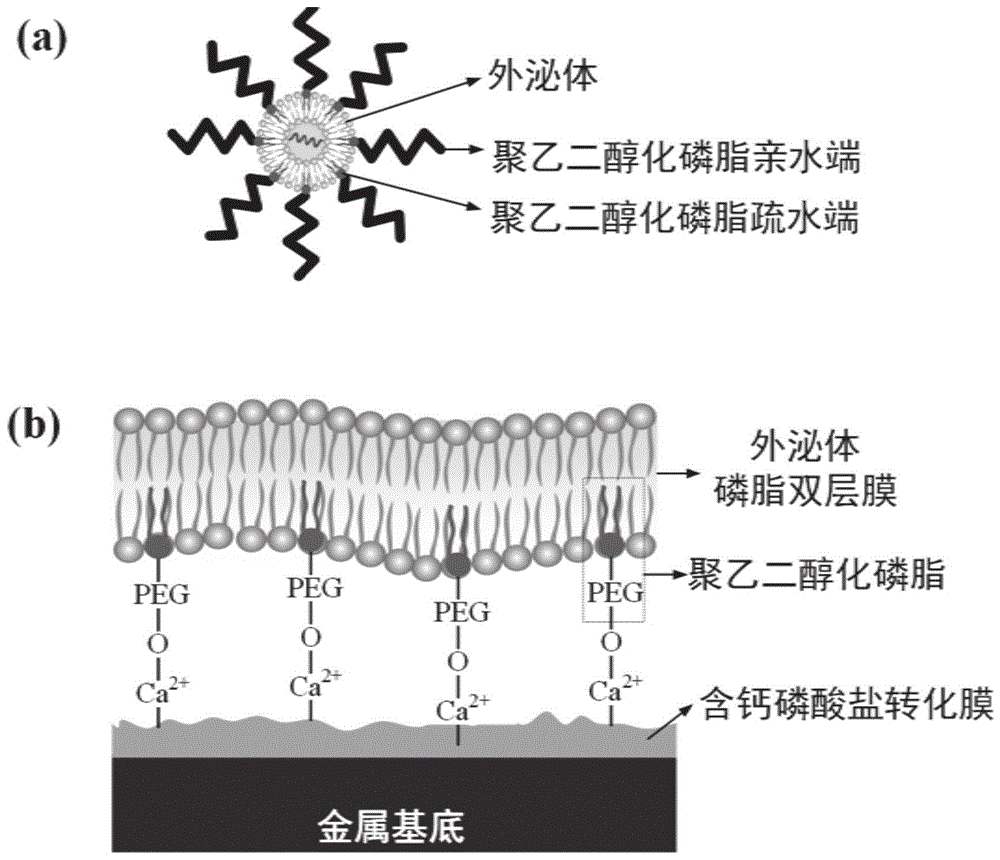
第一方面,一种负载外泌体的金属基植入材料,包括金属基体、钙磷酸盐转化膜、表面修饰聚乙二醇化磷脂的外泌体,金属基体的表面覆盖钙磷酸盐转化膜,钙磷酸盐转化膜与表面修饰聚乙二醇化磷脂的外泌体连接,聚乙二醇化磷脂亲水端与钙磷酸盐转化膜形成ca2+-o-peg络合物,聚乙二醇化磷脂疏水端与外泌体的磷脂双分子结构层结合。
金属基体的外表面覆盖钙磷酸盐转化膜层,钙磷酸盐转化膜层的外表面覆盖聚乙二醇化磷脂层,聚乙二醇化磷脂层的外表面覆盖一层外泌体层。金属基植入材料是基底材料,钙磷酸盐转化膜是涂层材料,外泌体为纳米级囊泡,聚乙二醇磷脂是两亲性分子,它其实是形成胶束,将外泌体封装起来的,然后与磷酸钙膜层形成络合物。金属基植入材料的形状不限。
本发明通过金属基植入材料表面含钙磷酸盐转化膜可固定经聚乙二醇化磷脂修饰的外泌体。
聚乙二醇(peg)化磷脂对细胞表面具有修饰作用,其脂质端能通过疏水作用固定在细胞的磷脂双分子层上,而不破坏膜结构。而且聚乙二醇化磷脂对细胞无毒性,可从细胞表面释放而不引起细胞内吞。另一方面,聚乙二醇化磷脂溶于水可形成peg-oh键,与ca2+可产生络合作用,形成ca2+-o-peg络合物。金属基材料表面含钙磷酸盐转化膜一方面可为络合peg提供ca2+,另一方面,可提供微纳尺度和粗糙表面来提高外泌体的结合比表面积。
外泌体具有与细胞膜类似的典型磷脂双层结构。
第二方面,上述负载外泌体的金属基植入材料的制备方法,所述方法具体步骤为:
将金属基体浸泡于含有磷源和钙源、氧化性促进剂的磷酸盐化学转化液中,得到金属表面覆盖钙磷酸盐转化膜的金属植入材料;
分别制备外泌体悬液、聚乙二醇化磷脂溶液,并将外泌体悬液和聚乙二醇化磷脂溶液混合,孵育后得到表面修饰聚乙二醇化磷脂的外泌体混合溶液;
将表面修饰聚乙二醇化磷脂的外泌体混合溶液滴加在覆盖钙磷酸盐转化膜的金属基体的表面,孵育后得到负载外泌体的金属基植入材料。
第三方面,上述负载外泌体的金属基植入材料在牙科、骨科领域中的应用。
上述一个或多个技术方案的有益技术效果:
本发明公开了一种金属基体表面稳定固定外泌体的方法,且通过金属表面含钙磷酸盐转化膜的微纳尺度和粗糙表面能够提高外泌体的负载量,能够有效解决金属表面难以高效固定外泌体的问题。
利用本发明方法可以制备出负载外泌体的金属基植入材料,赋予材料表面特异性蛋白质、mirna等生物活性因子,可以显著促进金属基植入材料表面生物活性和骨再生能力。
附图说明
构成本发明的一部分的说明书附图用来提供对本申请的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
图1为一种负载外泌体的金属基植入材料的结构示意图,(a)为外泌体封装于聚乙二醇化磷脂胶束的结构示意图,(b)为金属基底材料表面含钙磷酸盐转化膜层结合聚乙二醇化磷脂修饰的外泌体的结构示意图;
图2为纯钛基底表面微纳结构的羟基磷灰石转化膜负载外泌体的表面形貌图;
图3为成骨细胞在纯钛(bareti)和固定外泌体的钛样本(exo-ti)表面培养不同时间的细胞计数情况;
图4为成骨细胞在纯钛(bareti)和固定外泌体的钛样本(exo-ti)表面矿化过程中碱性磷酸酶(alp)活性检测结果;
图5为成骨细胞在纯钛(bareti)和固定外泌体的钛样本(exo-ti)表面培养7天和14天后成骨相关基因表达结果。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
第一方面,一种负载外泌体的金属基植入材料,包括金属基体、钙磷酸盐转化膜、表面修饰聚乙二醇化磷脂的外泌体,金属基体的表面覆盖钙磷酸盐转化膜,钙磷酸盐转化膜与表面修饰聚乙二醇化磷脂的外泌体连接,聚乙二醇化磷脂亲水端与钙磷酸盐转化膜形成ca2+-o-peg络合物,聚乙二醇化磷脂疏水端与外泌体的磷脂双分子结构层结合。
本发明通过金属基体表面含钙磷酸盐转化膜可固定经聚乙二醇化磷脂修饰的外泌体。
如图1所示,聚乙二醇(peg)化磷脂对细胞表面具有修饰作用,其脂质端能通过疏水作用固定在细胞的磷脂双分子层上,而不破坏膜结构。而且聚乙二醇化磷脂对细胞无毒性,可从细胞表面释放而不引起细胞内吞,如图1中的(a)所示。另一方面,聚乙二醇化磷脂溶于水可形成peg-oh键,与ca2+可产生络合作用,形成ca2+-o-peg络合物。金属基体表面含钙磷酸盐转化膜一方面可为络合peg提供ca2+,另一方面,可提供微纳尺度和粗糙表面来提高外泌体的结合比表面积,如图1的(b)所示。
外泌体具有与细胞膜类似的典型磷脂双层结构。
在本发明的一些实施方式中,金属基体包括钛及其合金、镁及其合金、316l不锈钢或锌合金。本发明的负载外泌体的金属基体可以适用于多种金属基材料,作为硬组织修复或替换材料,促进金属与人骨表面发生骨性结合,广泛应用于骨科或牙科领域中。
在本发明的一些实施方式中,含钙磷酸盐转化膜的物相成分包括以下一种或几种:羟基磷灰石、磷酸钙、磷酸氢钙、磷酸锌钙。含钙磷酸盐转化膜主要提供钙离子,金属表面与钙磷酸盐结合的原理为:金属表面在磷酸盐化学转化液中受到游离酸的浸蚀发生阳极溶解从而失去电子,氢离子在阴极通过可溶性盐的水解而放电,从而使金属与溶液界面的酸度降低,由于化学平衡作用,驱使金属表面可溶性钙磷酸盐向不溶性的钙磷酸盐转化,并沉积在金属表面与金属晶格形成结合键,最终形成金属表面钙磷酸盐转化膜。
在本发明的一些实施方式中,外泌体包括骨髓间充质干细胞来源外泌体、脂肪间充质干细胞来源外泌体、成骨细胞来源外泌体、成肌细胞来源外泌体或内皮细胞来源外泌体。外泌体具有促进细胞增殖分化、调节免疫等功能,本发明中结合的外泌体含量较高,有助于缩短骨整合时间,生物活性好。
在本发明的一些实施方式中,聚乙二醇化磷脂为二硬脂酰基磷脂酰乙醇胺-聚乙二醇(dspe-peg)、二肉豆蔻酰基磷脂酰乙醇胺-聚乙二醇(dmpe-peg)、二棕榈酰基磷脂酰乙醇胺-聚乙二醇(dppe-peg)。
第二方面,上述负载外泌体的金属基植入材料的制备方法,所述方法具体步骤为:
将金属基体浸泡于含有磷源和钙源、氧化性促进剂的磷酸盐化学转化液中,得到金属表面覆盖钙磷酸盐转化膜的金属基体;
分别制备外泌体悬液、聚乙二醇化磷脂溶液,并将外泌体悬液和聚乙二醇化磷脂溶液混合,孵育后得到表面修饰聚乙二醇的外泌体混合溶液;
将表面修饰聚乙二醇的外泌体混合溶液滴加在覆盖钙磷酸盐转化膜的金属基体的表面,孵育后得到负载外泌体的金属基植入材料。
在本发明的一些实施方式中,磷酸盐化学转化液中的钙源为ca(h2po4)2·h2o、ca(no3)2·4h2o、cao中的一种或多种。优选的,磷酸盐化学转化液中ca(h2po4)2·h2o的浓度为8-10g/l,ca(no3)2·4h2o的浓度为10-11g/l,cao的浓度为1-1.4g/l。
在本发明的一些实施方式中,磷酸盐化学转化液中的磷源为h3po4、ca(h2po4)2·h2o、zn(h2po4)2·2h2o中的一种或多种。优选的,磷酸盐化学转化液中的ca(h2po4)2·h2o的浓度为10-12g/l,h3po4的浓度为6-8ml/l,zn(h2po4)2·2h2o的浓度为1-3g/l或25-27g/l。
钙源和磷源通过混合反应得到钙磷酸盐,比如羟基磷灰石、磷酸钙、磷酸氢钙、磷酸锌钙。磷酸盐化学转化液中加入氧化性促进剂有助于促进磷化的过程。金属表面钙磷酸盐转化膜是由大量结晶良好的不溶性钙磷酸盐晶体组成,原则上,结晶形状和晶体尺度可以通过调整金属表面状态、溶液配方(如浓度、催化剂含量等)以及成膜工艺参数(温度、ph值、反应时间等)来调控。另外,转化液中所含ca2+能细化晶粒,抑制磷化晶粒的生长,在金属表面形成平滑、排列紧密的短棒状和颗粒状晶体,有效提高膜层的晶体密度和柱状晶体的数量,有利于微纳尺度特征膜层的形成。
在本发明的一些实施方式中,氧化性促进剂的浓度为1.5-4g/l。氧化性促进剂可以为硝酸钠、亚硝酸钠、硝酸镍、柠檬酸。
在本发明的一些实施方式中,覆盖钙磷酸盐转化膜的金属基体的制备过程中的反应条件为:温度为50-80℃,反应时间为20-150min;优选的,温度为55-75℃,时间为30-120min。
在本发明的一些实施方式中,外泌体悬液的制备方法为将外泌体利用pbs缓冲液重悬得到外泌体悬液。外泌体为通过分离方法得到。通过将上述的细胞进行培养,将培养上清液进行差速离心或超速离心法得到。在本发明的一些实施方式中,外泌体悬液的浓度为10-250μg/ml。
在本发明的一些实施方式中,聚乙二醇化磷脂溶液的溶剂为无水乙醇,聚乙二醇化磷脂的质量浓度为1-5mmol/ml;优选为2-3mmol/ml。
外泌体悬液和聚乙二醇化磷脂溶液在孵育的过程中,聚乙二醇化磷脂脂质端通过疏水作用锚定外泌体的磷脂双分子层。在本发明的一些实施方式中,外泌体悬液和聚乙二醇化磷脂溶液孵育的温度为3-6℃,避光孵育10-30min;优选的,孵育的温度为4℃。
在钙磷酸盐转化膜表面滴加表面修饰聚乙二醇的外泌体,络合反应后得到络合物,使钙磷酸盐转化膜与外泌体结合,由于钙磷酸盐转化膜表面的粗糙表面为微纳尺度的结构,使结合的外泌体的含量增多,可以缩短植入体表面骨整合时间,提高骨长入能力。
在本发明一些实施方式中,表面修饰聚乙二醇的外泌体和覆盖钙磷酸盐转化膜的金属基体混合孵育的温度为3-6℃,避光孵育2-24h;优选的,孵育的温度为4℃。
在本发明一些实施方式中,表面修饰聚乙二醇化磷脂的外泌体混合溶液与覆盖钙磷酸盐转化膜的金属基体反应后进行超声清洗,然后干燥,超声清洗的时间为10-50s;优选为15-30s。超声清洗去掉金属基体表面未固定的多余外泌体,干燥可以进行室温下干燥。
第三方面,上述负载外泌体的金属基植入材料在牙科和骨科领域中的应用。
下面结合实施例对本发明进一步说明
实施例1
本实施例所记载的一种在纯钛表面固定骨髓间充质干细胞源外泌体的方法,其具体步骤如下:
(1)将经过酸洗活化后的纯钛置于ph值为5.00的含有7ml/lh3po4,9g/lca(h2po4)2·h2o,2g/lzn(h2po4)2·2h2o和4g/l氧化性促进剂的磷酸盐化学转化液中,75℃条件下反应120min,得到纯钛表面具有微纳尺度表面形貌的羟基磷灰石膜层。
(2)收集小鼠骨髓间充质干细胞培养上清液进行差速离心:700g,15min取上清;2000g,20min取上清;16000g,20min弃上清,用适量pbs缓冲液重悬底部沉淀,调整得到终浓度为100μg/ml的外泌体悬液。
(3)将5.6mg二硬脂酰基磷脂酰乙醇胺-聚乙二醇(dspe-peg)粉末溶于1ml无水乙醇,得到浓度为2mmol/l的dspe-peg溶液。
(4)取10μl步骤(2)中的外泌体悬液与步骤(3)中的溶液充分混合均匀,4℃下避光孵育10min。
(5)将步骤(4)中的混合溶液均匀滴加至步骤(1)中的纯钛表面羟基磷灰石膜层上,4℃条件下避光孵育2h。
(6)将步骤(5)中反应后样品用去离子水超声清洗15s,去掉钛表面未固定的多余外泌体,室温下干燥,得到纯钛表面羟基磷灰石膜层固定骨髓间充质干细胞源外泌体的材料。
负载外泌体的金属基植入材料的sem表征如图2所示,纳米级外泌体囊泡附着在微纳尺度的絮状羟基磷灰石膜层表面。
实施例2
本实施例所记载的一种在钛合金(ti-6al-4v)表面固定脂肪干细胞源外泌体的方法,其具体步骤如下:
(1)将经过预处理后的钛合金置于ph值为3.50的含有10g/lca(no3)2·4h2o,26g/lzn(h2po4)2·2h2o和1.5g/l氧化性促进剂的磷酸盐化学转化液中,55℃条件下反应30min,得到钛合金表面具有微纳尺度表面形貌的磷酸锌钙膜层。
(2)采用常规超速离心法分离和提取人脂肪干细胞来源的外泌体,用适量pbs缓冲液重悬底部沉淀,调整得到终浓度为10μg/ml的外泌体悬液。
(3)将3.4mg二肉豆蔻酰基磷脂酰乙醇胺-聚乙二醇(dmpe-peg)粉末溶于1ml无水乙醇,得到浓度为2mmol/l的dmpe-peg溶液。
(4)取10μl步骤(2)中的外泌体悬液与步骤(3)中的溶液充分混合均匀,4℃下避光孵育20min。
(5)将步骤(4)中的混合溶液均匀滴加至步骤(1)中的钛合金表面磷酸锌钙膜层上,4℃条件下避光孵育12h。
(6)将步骤(5)中反应后样品用去离子水超声清洗20s,去掉钛合金表面未固定的多余外泌体,室温下干燥,得到钛合金表面磷酸锌钙膜层固定脂肪干细胞源外泌体的材料。
实施例3
本实施例所记载的一种在316l不锈钢表面固定成骨细胞外泌体的方法,其具体步骤如下:
(1)将经过预处理后的316l不锈钢置于ph值为4.00的含有7ml/lh3po4,11g/lca(no3)2·4h2o,1.2g/lcao和1.5g/l氧化性促进剂的磷酸盐化学转化液中,55℃条件下反应30min,得到316l不锈钢表面具有微纳尺度表面形貌的磷酸钙膜层。
(2)采用常规超速离心法分离和提取成骨细胞来源的外泌体,用适量pbs缓冲液重悬底部沉淀,调整得到终浓度为250μg/ml的外泌体悬液。
(3)将6mg二棕榈酰基磷脂酰乙醇胺-聚乙二醇(dppe-peg)粉末溶于1ml无水乙醇,得到浓度为3mmol/l的dppe-peg溶液。
(4)取10μl步骤(2)中的外泌体悬液与步骤(3)中的溶液充分混合均匀,4℃下避光孵育30min。
(5)将步骤(4)中的混合溶液均匀滴加至步骤(1)中的316l不锈钢表面磷酸钙膜层上,4℃条件下避光孵育24h。
(6)将步骤(5)中反应后样品用去离子水超声清洗30s,去掉316l不锈钢表面未固定的多余外泌体,室温下干燥,得到316l不锈钢表面磷酸钙膜层固定成骨细胞源外泌体的材料。
试验例
成骨细胞培养的操作过程为冻存的mg63成骨细胞株复苏后置于37℃,5%co2的饱和湿度恒温箱,用含10%胎牛血清和1%青霉素-链霉素的dmem培养液进行培养,每隔48h更换一次培养液并观察细胞生长情况。细胞密度达到80%接触率时,按1:3传代,传代到2-3次后,细胞达到良好生长状态,加入1ml0.25%胰蛋白酶消化后,加入5mldmem培养液终止消化得到细胞悬浮液。将不同样本经环氧乙烷灭菌后置于24孔板内,以5×104/孔的密度接种于样本表面,每孔加入1mldmem培养液,然后置于37℃,5%co2的饱和湿度恒温箱中,继续培养至试验点。
分别选择实施例1的负载外泌体的金属基植入材料(exos-ti)和纯钛(bare-ti)。得到的结果分别如图3、图4、图5所示。通过图3可以得到,在6、12、24h的时间点上,实施例1的负载外泌体的金属基植入材料相比于纯钛具有更多的成骨细胞数量,说明实施例1的负载外泌体的金属基植入材料更有利于成骨细胞的黏附。
通过图4可以得到,随着培养时间的延长,实施例1的负载外泌体的金属基植入材料相比于纯钛碱性磷酸酶(alp)活性更高,说明实施例1的负载外泌体的金属基植入材料更有利于促进成骨细胞早期分化。
通过图5可以得到,实施例1的负载外泌体的金属基植入材料相比于纯钛相关基因表达效果更好,其中alp表示碱性磷酸酶,ocn表示骨钙素,osx表示成骨相关转录因子抗体,runx2表示转录因子,bmp-2表示骨形成蛋白-2,col-1表示i型胶原。从成骨相关基因表达结果上可以看到,实施例1的负载外泌体的金属基植入材料具有更好的生物活性和骨再生能力。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!