VEGFR-2拮抗剂及其应用的制作方法
本发明涉及医药领域。
背景技术:
血管内皮生长因子(vegf)家族包括vegf-a等,vegf-a可以激活表达在内皮细胞上的酪氨酸激酶受体血管内皮生长因子受体2(vegfr-2),刺激血管内皮细胞增殖、促进新生血管形成,并进一步促进视网膜病变的发展。首次报道中显示,vegfr-2是跨膜激酶受体,全长1356个氨基酸。
丹酚酸c(salvianolicacidc)是种植物提取物,经检索,未见其在vegf靶点的研究。
技术实现要素:
本发明克服了现有技术的不足,通过大量筛选,得到了一种新型vegfr-2拮抗剂。
本发明公开了丹酚酸c作为vegfr-2拮抗剂的用途,或者在哺乳动物中抑制vegf诱导型血管生成相关疾病,比如肿瘤或视网膜疾病,如早产儿视网膜病变。
所述拮抗剂是指,能与相应的受体vegf结合,并能够与配体竞争性结合受体活性位点的一类物质的总称。
所述vegf诱导型血管生成是指,由细胞因子vegf诱导细胞形成新生血管。
附图说明
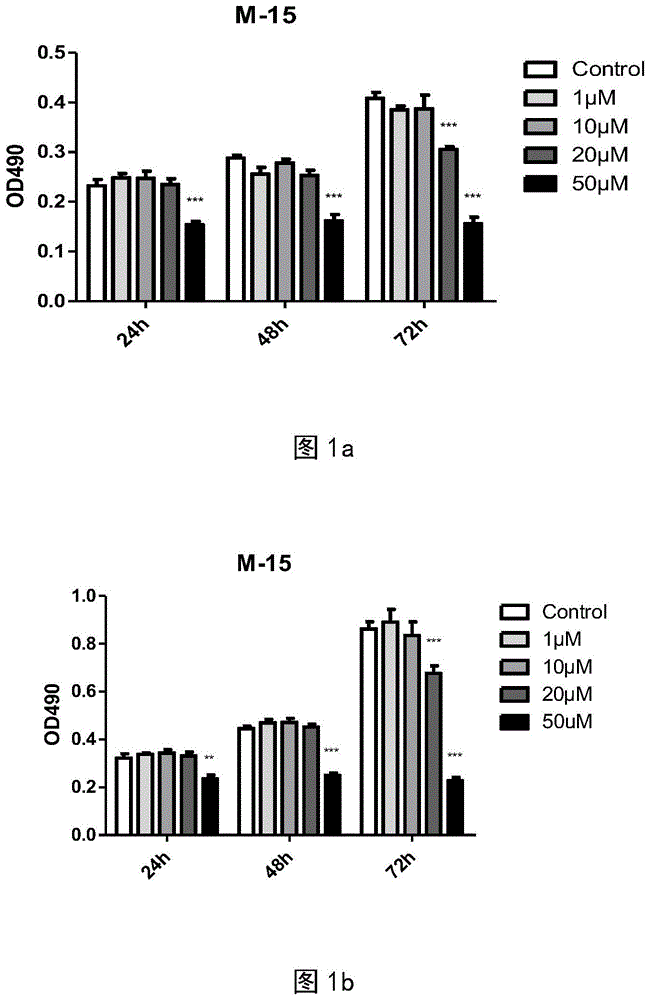
图1展示了对细胞增殖的影响,其中图1a为对arpe-19细胞的,图1b为对huvec细胞的。
图2为划痕实验结果,其中图2a为对arpe-19细胞的,图2b为对huvec细胞的。
图3为对细胞侵袭的影响。
图4为对管状形成的影响,其中图4a为对arpe-19细胞的,图4b为对huvec细胞的。
具体实施方式
下面实验可能涉及的英文缩写:
续表
一、对候选小分子m-15(丹酚酸c),研究内容与方法概述如下:
1.6.1候选小分子化合物的亲和力筛选
微量热涌动(mst)技术检测小分子化合物与vegfr-2蛋白的亲和力,并以vegf165蛋白作为阳性对照。
1.6.2候选小分子化合物的体外活性研究
(1)通过mtt实验技术检测m-15小分子化合物分别对huvec和arpe-19细胞生长增殖的影响。
(2)利用划痕实验,测定m-15小分子化合物分别对huvec和arpe-19细胞迁移的影响。
(3)利用transwell实验,测定m-15小分子化合物对arpe-19细胞侵袭的影响。
(4)利用管状形成实验,测定m-15小分子化合物分别对huvec和arpe-19细胞成管能力的影响。
二、具体实验及结果如下:
2vegfr-2拮抗剂的亲和力筛选:
2.1部分主要试剂说明
humanvegfr-2protein(histag)北京百普赛斯生物科技公司
humanvegf165protein北京百普赛斯生物科技公司
5×mstbuffernt.115(50mmtris-hcl德国nanotemper公司
ph7.4,150mmnacl,10mmmgcl2,
0.05%tween-20)
monolithnt.115capillarykits德国nanotemper公司
monolithnttmproteinlabelingkit德国nanotemper公司
red-nhs
2.3实验方法-小分子化合物分子水平亲和力测定
(1)利用nt.115tm蛋白标记试剂盒red进行靶蛋白vegfr-2的标记,得到染料-蛋白复合物。nt647染料标记人vegfr-2-his蛋白本次实验所用到的vegfr-2-his蛋白初始摩尔浓度为:2.35μm。将20μm50μl的nt647染料与vegfr-2蛋白混匀,室温,避光反应30min。
(2)在此期间进行层析柱的平衡,用pbs7.2平衡3个柱体积(约500μl)即可。
(3)标记蛋白的纯化:反应30min结束后,将标记好的蛋白进行凝胶过滤层析,除去未结合的染料。染料蛋白复合物溶液过凝胶柱,待溶液刚渗入柱子后,加入400μlpbs7.2。随着刚加入的400ulpbs7.2刚好完全渗入柱子,立刻加入600μl的pbs7.2。从柱子中滴下的第一滴液体开始接样,总接样量300-400μl左右。最后将凝胶柱冲洗干净,测定标记效率,根据具体的标记强弱进行适当稀释。
(4)样品的配制:设定小分子化合物的最高浓度为400μm,然后进行梯度稀释,依次设置16个浓度梯度,每管体积为10μl。最后向稀释的小分子溶液中加入10μl标记好的靶蛋白,等体积混匀。用毛细管吸取混合样品,根据浓度由内向外依次升高摆放于样品槽中。
(5)样品的检测:利用软件进行检测、实验数据的分析。
2.4实验结果
候选小分子化合物与vegfr-2蛋白的亲和情况:
实验中我们选择了其配体蛋白vegf165作为阳性对照,vegf165蛋白初始浓度只有1.23μm,无法达到结合浓度的饱和点。但多次重复实验发现mst点始终在拟合的s型曲线周围且重复性良好,说明实验中mst体系可靠。其中m-15的结合力强且拟合曲线比较完美,kd值为0.30μm
3vegfr-2拮抗剂的体外活性研究:
3.1主要试剂:
rpmi-1640培养基solarbio公司
dmem/f12液体培养基bi公司
mttsigma-aldrich公司
胎牛血清bi公司
基质胶bd公司
结晶紫染液北京索莱宝科技有限公司
多聚甲醛天津科密欧试剂厂
3.2主要试剂配制:
(1)pbs(ph=7.2)溶液:首先称取0.2gkcl,0.2gkh2po4,8.0gnacl及2.08gna2hpo412h2o,然后用双蒸水定容至1000ml,121℃,高压蒸汽灭菌30min,最后4℃贮存备用。
(2)0.25%胰蛋白酶溶液:首先称取40mgedta溶于100mlpbs(ph=7.2)溶液中,121℃,30min,进行高压蒸汽灭菌,然后称取0.5g胰蛋白酶溶于常温的上述混合溶液中,并用0.22μm滤膜过滤除菌,最后分装并保存于-20℃冰箱备用。
(3)mtt溶液:用分析天平称取10mg的mtt粉末于20mlpbs(ph=7.2)中进行溶解,为了加快溶解,可将溶液放置于37℃摇床中避光摇晃至溶解,随后过滤除菌,以上操作过程中要注意避光,最后在细胞间生物安全柜中进行分装,并置于-20℃低温中避光保存备用。
(4)0.2%结晶紫溶液:电子天平称取0.2g结晶紫粉末,加入到100ml甲醇中超声溶解,之后过滤并避光保存于4℃冰箱。
(5)100ng/μlvegf:将装有10μgvegf粉末的ep管进行离心(12000rpm,1min),使管内蛋白粉末至管底。在生物安全柜中,加入100μl无菌的去离子水,稍稍晃动ep管使粉末沉至管底,常温静置30min溶解。移液枪轻轻吹打混匀,分装于无菌的ep管中,每管分装5μl,此时的vegf浓度为1ug/μl。取出一管分装好的蛋白,再加入90μl无菌水,充分混匀后的蛋白浓度即100ng/μl,将其再分装至无菌的ep管中,于-80℃低温中保存备用。
3.3实验方法
3.3.1细胞的复苏、培养及冻存
3.3.1.1复苏细胞
(1)从-80℃超低温冰箱中取出arpe-19和huvec细胞,迅速将装有细胞的冻存管放入预热的37℃水浴锅中,并不断摇动,使管内液体均匀融化。
(2)待冻存管内液体完全溶解可流动时放入离心机中2000rpm,离心5min。
(3)离心结束后,从离心机中取出细胞冻存管,拿入生物安全柜中。
(4)酒精消毒后,旋开管盖,弃上清液,加入1ml含10%胎牛血清(fbs)的培养基,并重悬轻柔吹打成细胞悬液。
(5)将已经吹散的单细胞悬液,转移至已预先加入适量培养基的培养皿中,轻轻摇晃让细胞均匀分布在皿中。放置于37℃,5%co2细胞培养箱中培养。arpe-19细胞用含10%fbs的dmem/f12培养基培养,huvec细胞用含10%fbs的rpmi-1640培养基培养。
(6)24h后吸取旧培养基加入适量新鲜培养基,继续培养。
3.3.1.2细胞培养
(1)arpe-19和huvec细胞均为贴壁细胞,细胞长满后开始传代。
(2)取已灭菌的pbs缓冲液(ph7.2)和已经预热好的培养液,用酒精棉球擦拭好瓶口的放入生物安全柜中备用。
(3)从培养箱内取出细胞,小心吸出旧培养液,用pbs缓冲液清洗1-2遍后,加入适量0.25%胰蛋白酶液,放在37℃培养箱中消化1-2min左右。
(4)待细胞消化完成后,吸弃胰蛋白酶液,轻轻拍打培养皿,加入新鲜的培养液2-3ml,轻柔吹打分散细胞,将细胞吹打成单细胞悬液。
(5)将细胞悬液平均转移至2个已预先加入适量培养基的培养皿中,放置于37℃,5%co2细胞培养箱中培养。
(6)及时观察细胞的状态,并根据情况给予换液或者传代,待细胞增殖进入对数增长期时即可进行后续实验。
3.3.1.3细胞收集
(1)细胞传至3代左右,可以恢复良好活性,选择处于对数生长期的细胞,吸弃旧培养基,用pbs(ph7.2)洗1遍,接着用0.25%胰蛋白酶液于37℃消化1-2min左右。
(2)吸弃胰蛋白酶液,加入新鲜培养液,将细胞吹打成单细胞悬液。
(3)吸取适量的细胞悬液于15ml离心管中,将离心管放入台式低温冷冻离心机中,以2000rpm/min,4℃条件下离心5min。
(4)弃上清,重悬细胞,调整细胞密度至相应的实验浓度待用。
3.3.2细胞增殖实验
(1)细胞铺板:将处于生长对数期的arpe-19和huvec细胞,用0.25%胰酶消化后处理成细胞悬液,分别用含10%胎牛血清的dmem/f12和rpmi-1640培养基将细胞悬液密度调至4.5×104个/ml和3×104个/ml,接种于96孔板,利用排枪每孔100μl随机铺板,设置调零组、对照组和3个实验组,每组6个复孔,最后将孔板边缘用pbs填充。
(2)细胞同步化:细胞过夜培养后,弃旧的含10%fbs的dmem/f12和rpmi-1640培养基,重新加入100μl无血清培养基饥饿处理12个小时,使细胞同步化。
(3)加药处理:细胞同步化结束后,以每孔200μl的终体积,将无血清培养基稀释后的m-15小分子溶液80μl,分别加入不同的实验孔中,使m-15小分子在200μl体系中终浓度为1μm、10μm、20μm和50μm。在调零孔中加入180μl无血清培养基,m-15对照孔中加入180μl含有0.5%(以最高实验浓度所含dmso为标准)dmso的无血清培养基,加药6h后每孔补加20μl胎牛血清。
(4)mtt反应:以加入小分子后开始计时,37℃培养箱分别培养24h、48h、72h后,每孔避光加入20μl浓度为5mg/ml的mtt,随后放回co2培养箱内继续培养4个小时。
(5)检测od值:反应结束后从培养箱内取出孔板,弃上清,每孔加入150μl的dmso,震荡10min使甲瓒充分溶解,利用酶标仪检测490nm波长下每孔的吸光度。结果为3次独立重复实验的平均值。
3.3.3划痕实验
(1)0.25%胰酶分别消化处理状态良好的arpe-19和huvec细胞,成单细胞悬液后,转移至50ml无菌离心管中,计数,调整arpe-19和huvec细胞密度分别至2×105个/ml和1×105个/ml。
(2)将调整好密度的细胞以每孔1ml的体积铺于24孔板中,置于37℃培养箱中过夜培养,当细胞长至孔底的95%左右,用马克笔沿直尺在24孔板底部均匀的标记出两个十字。
(3)用中号枪头沿对应位置垂直于孔板底部均匀划线,划线时速度需均匀,否则划伤的细胞层宽窄不同,影响实验结果。用pbs(或无血清培养基)洗去划伤而脱落的细胞团,因此时细胞较脆弱,需缓慢的加入pbs进行清洗以免影响细胞状态。清洗2遍后加入无血清培养基,放于co2培养箱。
(4)药物配置:培养基稀释药物,使m-15小分子在相应实验孔中的终浓度分别为1μm、10μm和20μm;对照组为含0.2%dmso的培养基,每个浓度梯度设置3个复孔。
(5)加入小分子后开始计时,培养0h、24h、48h后取出24孔板,显微镜下随机选取4个视野进行拍照,imagej软件计算划痕面积,并根据公式计算细胞的迁移率。结果为3次独立重复实验的平均值。
迁移率公式:迁移率(%)=[1-s24h/s0h]×100%.
3.3.4transwell小室实验
(1)将生长状态良好的arpe-19细胞消化成单细胞悬液,收集于15ml离心管,4℃,1000rpm,离心5min,倒上清,去除管内残余的血清。同上加入pbs(ph=7.2)再次离心,最后用无血清培养基将细胞重悬,计数,调整arpe-19细胞密度为5×105个/ml。
(2)准备24孔板,加入600μl含10%fbs的培养基,将无菌的transwell小室放于24孔板中,上室加入250μl无血清细胞悬液,37℃培养箱培养24h。
(3)药物配置:培养基稀释药物,使m-15小分子在相应实验孔中的终浓度分别为1μm、10μm和20μm;对照组为含0.2%dmso的培养基,每个浓度梯度设置5个复孔。
(4)细胞培养24h后取出,弃去上下室培养基,pbs溶液清洗两遍。随后上室和下室分别加入250μl和600μl的多聚甲醛,固定30min左右。固定时上下室之间要避免有气泡。
(5)固定结束后,pbs清洗两遍,除去多聚甲醛,用棉签将小室上层的细胞拭去,0.2%结晶紫染液染色20min左右,用pbs溶液清洗两遍。
(6)显微镜下观察,每个小室选取10个视野进行拍照记录,imagej软件内进行计数,结果为3次独立重复实验的平均值。
3.3.5体外管状形成实验
(1)实验前需将基质胶放入4℃冰箱过夜解冻,使其溶化成可流动的液体状,因基质胶常温下会凝固,故需提前预冷96孔板和枪头。实验时,将预冷的96孔板放于提前备好的冰盒内操做,预冷的枪头迅速向96孔板中加入基质胶,每孔50μl,为避免基质胶铺不均影响后续拍照取样,可提前润洗孔板。
(2)37℃,5%co2培养箱内放置30min,以使基质胶凝固。
(3)在此期间,消化处理状态良好的arpe-19和huvec细胞,用含有10%胎牛血清的培养基将细胞密度调至1×105个/ml,每孔200μl,并加入50ng/ml的细胞因子vegf。
(4)加入m-15(体系终浓度为1μm、10μm和20μm)和对照组即含0.2%dmso的培养基,每个浓度设3个复孔。
(5)37℃,5%co2培养箱内培养一定时间,显微镜下随机挑选5个视野,拍照取样。arpe-19细胞培养4h,huevc培养5h时形成的管状较好。
3.3.6统计学分析
使用spss19.0进行统计学分析。实验数据用平均数±sd表示。采用t检验比较差异显著性,*p<0.05差异显著;**p<0.01差异很显著;***p<0.001差异极其显著。
3.4实验结果
为验证m-15对arpe-19和huvec细胞的增殖是否有影响,设计了mtt实验。实验中发现m-15在50μm时对细胞具有毒副作用,致使大量细胞死亡,而浓度在20μm及以下时对细胞的生长状态无影响。图1展示了m-15小分子对细胞增殖影响的结果,图1a:m-15对arpe-19细胞增殖影响的结果,图1b:m-15对huvec细胞增殖影响的结果。图中统计结果显示:m-15在20μm浓度下显著抑制arpe-19和huvec细胞的增殖。
为验证m-15对arpe-19和huvec细胞迁移和侵袭能力的影响,设计了划痕和transwell小室实验。图2为划痕实验验证m-15对细胞迁移影响的结果。图2a:m-15对arpe-19细胞迁移的影响,结果显示:m-15能够明显抑制arpe-19细胞的迁移。图2b:m-15对huvec细胞迁移的影响,结果显示:m-15能够显著抑制huvc细胞的迁移,且具有浓度依赖性。
transwell实验结果如图3,m-15对arpe-19细胞侵袭的影响。结果显示:不同浓度的m-15实验组均能显著抑制arpe-19细胞的侵袭。
本次实验同样利用vegf诱导arpe-19和huvec细胞体外模拟管状形成,验证m-15对细胞成管能力是否有影响。图4为m-15对arpe-19细胞和huvec的管状形成的影响。图4a结果显示:在4h时m-15小分子在不同的浓度梯度下对arpe-19细胞成管能力均有抑制作用。图4b结果显示:m-15对vegf诱导的huvec细胞管状形成能力具有显著的抑制。
- 还没有人留言评论。精彩留言会获得点赞!