用于铁和铝的选择性分离的方法与流程
优先权文件
本申请要求于2014年8月7日提交的题为“铁分离方法”的澳大利亚临时专利申请no.2014903073的优先权,其内容通过引用整体并入本文。
本公开涉及从含有铁和其它金属如铝的原料中分离铁的方法。在具体形式中,本公开涉及用于从粗浸出液例如煤矸石浸出液中分离铁的方法。
背景技术:
煤矸石是煤加工和选矿的主要副产物。它含有约18%至40%的氧化铝和40至65%的二氧化硅。由于铝土矿储量的减少和矿体的降解,高铝含量(≥30%)煤矸石已经成为主要铝源铝土矿的有希望的替代品。已经进行了许多尝试以从煤矸石中萃取铝和硅产物以及有价值的金属如镓和钛(qian和li2015;geng等人,2012;zhao2014)。例如,通过酸浸从煤矸石生产铝产物。然而,铁(iii)是煤矸石中第三丰富的元素,占总量的2-10%,并且在浸出过程中将原料中的铁带入浸出溶液中,这沾污并污染了所得到的产物。因此,从煤矸石浸出溶液中除去铁是必要的,以便从这些溶液中获得商业上可接受的铝或具有高纯度的其它有价值的金属产物。
目前,通常通过沉淀从浸出溶液中除去铁(chang等人,2010,swarnkar等人,1996)。然而,该方法具有一些缺点,例如由于共沉淀导致的低选择性和难以从浸出液中除去的细小沉淀物的产生。此外,通常含有重金属离子的沉淀物在环境方面引起关注。此外,由于严格的环境法规,它们在受控池中的处置变得越来越昂贵。
溶剂萃取可以分离、纯化和浓缩金属离子,导致随后产生纯产物。其是允许两种或更多种组分由于它们在两个不混溶的液相中不相等的溶解度而分离的方法。它是金属离子分离的重要方法,也是具有重要意义的常用工业技术例如连续操作模式、设备简单以及高生产量(tian,li等人2010)。在溶剂萃取中,溶解的金属通过萃取剂从水溶液中选择性地与其它组分分离。传统上,溶剂萃取涉及与水不混溶的有机溶剂,其中许多是易燃的、挥发性的或有毒的。这引起对环境和工作场所的危害。
因此,需要提供可用于从含有其它非铁金属如铝的原料中选择性除去铁的方法。
技术实现要素:
本公开来自对使用经济的离子液体(例如cyphosil101和aliquat336)既作为萃取剂和又作为溶剂以在煤矸石浸出液中分离铁和铝的研究。
根据第一方面,提供了从含有fe(iii)离子和非铁离子的含水原料中选择性萃取fe(iii)离子的方法,所述方法包括使原料与包含
根据第二方面,提供了
根据第三方面,提供了从煤矸石浸出液中选择性除去fe(iii)离子的方法,所述方法包括使浸出液与包含
根据第四方面,提供了从煤矸石中回收高纯度铝产物如氯化铝的方法,所述方法包括浸提煤矸石以提供浸出液,使浸出液与包含
在第一至第四方面的实施方案中,有机相基本上不含外来有机萃取剂。
在第一至第四方面的实施方案中,有机相基本上不含
在第一至第四方面的实施方案中,有机相基本上由
在第一至第四方面的实施方案中,所述方法进一步包括处理含水原料或浸出液以在与有机相接触之前增大其中无机阴离子的浓度。这些实施方案中的无机阴离子可以是选自碘离子、溴离子、氯离子和氟离子的卤离子。在具体的实施方案中,无机阴离子是氯离子。处理含水原料以增大无机阴离子的浓度的步骤可以包括向含水原料中加入无机阴离子源。
在第一和第二方面的实施方案中,原料中的非铁离子选自由铝、镁、钙和钾离子组成的离子组中的一种或多种。
在第一和第二方面的实施方案中,含水原料是浸出液。在实施方案中,浸出液含有选自由铝、钠、钙和镁组成的组中的非铁离子。在实施方案中,浸出液是煤矸石浸出液。
在实施方案中,
在实施方案中,
在实施方案中,
根据第五方面,提供通过第一、第三或第四方面的方法或第二方面的用途获得的负载有fe(iii)的有机相。
根据第五方面,提供了通过第一、第三或第四方面的方法或第二方面的用途获得的包含fe(iii)离子的组合物。
附图说明
将参照附图讨论本发明的实施方案,其中:
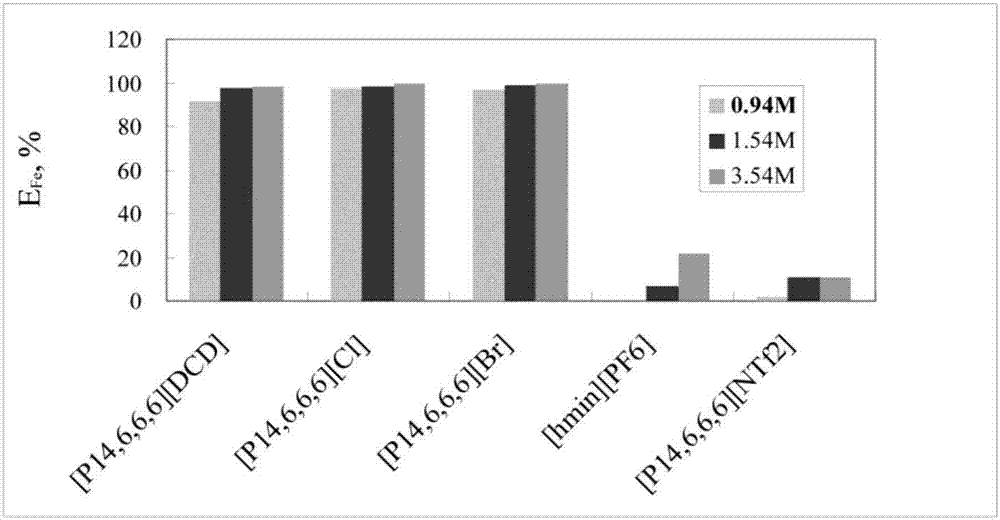
图1示出了显示使用不同hcl浓度的各种离子液体的fe(iii)的萃取百分比的图;
图2示出了显示利用不同cl-浓度的各种离子液体的fe(iii)的萃取百分比的图;
图3示出了显示hcl浓度对使用cyphosil101(水溶液:13.5g·l-1fe(iii),0-10mol·l-1hcl)从氯化物介质萃取fe(iii)的影响的图;
图4示出了显示cl-浓度对使用cyphosil101(水溶液:13.5g·l-1fe(iii),1mol·l-1hcl,1.72-5.72mol·l-1cl-,nacl作为氯化物源,[cl-]是水溶液中来自nacl、hcl和fecl3的cl-总和)从氯化物介质萃取fe(iii)的影响的图;
图5示出了显示时间对使用cyphosil101(水溶液:13.5g·l-1fe(iii),3mol·l-1hcl)从氯化物介质萃取fe(iii)的影响的图;
图6示出了显示作为包含4.5-72g·l-1fe(iii)和3mol·l-1hcl的进料溶液中铁浓度的函数的萃取效率的图;
图7示出了显示作为包含4.5-72g·l-1fe(iii)和3mol·l-1hcl的进料溶液中铁浓度的函数的分布系数(dfe)的图;
图8示出了显示使用cyphosil101和包含4.5-72g·l-1fe(iii),3mol·l-1hcl的进料溶液的fe(iii)的萃取等温线的图;
图9示出了在一系列氯化物浓度溶液(1mol·l-1hcl,1-13mol·l-1的cl-,licl作为氯化物源)中的fe(iii)-氯配合物的uv-可见光谱;
图10示出了在一系列hcl浓度溶液(6-12mol·l-1hcl)中fe(iii)-氯配合物的uv-可见光谱;
图11示出了在200-500nm波长范围内负载有fe(iii)的cyphosil101的uv-可见吸收光谱;
图12示出了在500-900nm波长范围内负载有fe(iii)的cyphosil101的uv-可见吸收光谱;
图13示出了负载有fe(iii)的cyphosil101(在il相中为50g·l-1fe(iii))的拉曼光谱;
图14示出了未稀释的cyphosil101(萃取前)和负载有fe(iii)的cyphosil101(萃取后)的ftir光谱;
图15示出了显示hcl浓度对使用aliquat336(水溶液:13.5g·l-1fe(iii),0-10mol·l-1hcl)从氯化物介质萃取fe(iii)的影响的图;
图16示出了显示cl-浓度对使用aliquat336(水溶液:13.5g·l-1fe(iii),1mol·l-1hcl)从氯化物介质萃取fe(iii)的影响的图;
图17示出了显示接触时间对使用aliquat336(水溶液:13.5g·l-1fe(iii),3mol·l-1hcl)从氯化物介质萃取fe(iii)的影响的图;
图18示出了显示作为aliquat336(水溶液:4.5-72g·l-1fe(iii),3mol·l-1hcl)的进料溶液中的铁浓度的函数的萃取效率的图;
图19示出了显示作为包含4.5-72g·l-1fe(iii)和3mol·l-1hcl的进料溶液中铁浓度的函数的分布系数(dfe)的图;
图20示出了显示使用aliquat336作为萃取剂和包含4.5-72g·l-1fe(iii)和3mol·l-1hcl的进料溶液的fe(iii)的萃取等温线的图;
图21示出了显示在500至900nm波长下负载有fe(iii)的aliquat336的摩尔吸收光谱的图;
图22示出了显示温度对fe(iii)反萃(stripping)效率(o/w,1:4,1mol·l-1h2so4作为反萃溶液)的影响的图;
图23示出了用aliquat336除去铁后的alcl3·6h2o的tg分析;
图24示出了除铁过程前后晶体产物的xrd图形;和
图25示出了显示在不同循环时间下利用再生的il的fe(iii)的萃取效率的图。
具体实施方式
本发明来自令人惊奇的发现,即
因此,本文提供了一种从含有fe(iii)离子和非铁离子的含水原料中选择性萃取fe(iii)离子的方法。该方法包括使原料与包含
离子液体被广泛使用并被称为绿色溶剂并且已经用于金属离子萃取(seddon2000;wei,yang等人2003)。通常,离子液体在使用有机萃取剂的萃取中用作替代溶剂。有机萃取剂是形成在离子液体相中具有较高溶解度的中性金属-有机配合物的金属螯合剂。因此,金属离子从水溶液萃取到离子液体相中。例如,[c4mim][pf6]用作重金属离子如pb、cd、cr、hg的液/液萃取中的溶剂。使用双硫腙作为金属螯合剂以与重金属离子形成金属-双硫腙络合物,其在[c4mim][pf6]和水相之间具有高的分配比(wei,yang等人2003)。
与基于咪唑
在本文所述的方法中,离子液体充当萃取剂和溶剂以在盐酸浸出溶液中将铁和铝与煤矸石分离。因此,原料在液-液萃取条件下与离子液体接触足够时间,以允许至少一些fe(iii)离子从原料转移到有机相。如本文所用,术语“离子液体”、“il”和类似术语是指由庞大的不对称有机阳离子和较小阴离子组成的盐。“室温离子液体”或“rtil”在相对低的温度下是液体(例如低于约100℃)。一系列il可商购或可使用已知方法合成。
在实施方案中,
在实施方案中,
il可以是纯的或半纯的il。rtil基本上不含外来有机萃取剂,其重要性将在后面更详细地描述。
可以使用适于液-液萃取的任何装置或技术使原料与有机相接触。例如,可以通过在合适的容器中合并两相并混合以使相至少部分地彼此分散而使原料与有机相接触。混合所用的时间将根据原料、使用的具体离子液体、温度等而变化。本体相溶剂萃取的方法是本领域已知的。
或者,可以在微流体液-液萃取装置中混合原料和有机相。微流体液-液萃取装置可以如题为“萃取方法”的公开申请wo2010/022441(其公开内容整体并入本文)和/或题为“高流通量微流体装置”的公开申请wo2012/075527中描述的,和/或使用本领域已知的任何微流体分离技术。
在原料和有机相已经彼此接触足够时间以允许将至少一些fe(iii)离子从原料转移到有机相中之后,将负载有fe(iii)离子的有机相与贫fe(iii)离子的原料分离。在大多数情况下,使用本领域中为此目的已知的任何技术将两相彼此物理分离。
该方法可以进一步包括处理原料以在与有机相接触之前增大原料中无机阴离子的浓度。在实施方案中,“无机阴离子”选自卤离子、硫氰酸根离子、硫代硫酸根离子、硝酸根离子和高氯酸根离子。在一些实施方案中,卤离子选自碘离子、溴离子、氯离子和氟离子。在一些具体实施方案中,卤离子是氯离子。
原料中无机阴离子的浓度可以通过加入无机阴离子源而增大。可以将含有无机阴离子的盐加入到原料中。例如,可以通过向原料中加入卤化物盐来提高含水原料中卤离子的浓度。在氯化物的情况下,合适的卤化物盐包括hcl、kcl、nacl、nh4cl等。可以使用等价的碘化物、溴化物、氟化物、硫氰酸盐、硝酸盐或高氯酸盐。
在一些具体实施方案中,该方法包括用hcl处理含水原料,以在与rtil接触之前增大原料中的氯化物浓度。加入原料中的hcl的量可以取决于目标金属和/或使用的rtil。在一些实施方案中,含水原料为约0.01mol·l-1至约10mol·l-1hcl。在一些具体实施方案中,含水原料为约0.01mol·l-1至约0.090mol·l-1hcl。在一些其它具体实施方案中,含水原料为约1mol·l-1至约9mol·l-1hcl。在一些其它具体实施方案中,含水原料为约2mol·l-1至约4mol·l-1hcl。在一些其它具体实施方案中,含水原料为约6mol·l-1至约9mol·l-1hcl。在一些其它具体实施方案中,含水原料为约0.02mol·l-1hcl。在一些其它具体实施方案中,含水原料为约3mol·l-1hcl。在一些其它具体实施方案中,含水原料为约7mol·l-1hcl。
在负载有fe(iii)离子的有机相与贫fe(iii)离子的原料分离之后,可以从有机相中回收fe(iii)。从溶剂或溶液中回收金属离子或金属的方法是本领域已知的,并且可以用于本发明的方法中。例如,可以通过使负载有fe(iii)离子的有机相与水溶液在条件下接触以允许至少一些fe(iii)离子从负载有fe(iii)离子的有机相转移到水溶液中,可以从有机相中除去至少一些fe(iii)。有利地,我们已经发现,当水和硫酸水溶液用于从负载有fe(iii)离子的有机相中反萃fe(iii)离子时,提供高的萃取效率。例如,0.5mol·l-1h2so4是有效的反萃溶液,其在三个反萃步骤后使得接近100%的fe(iii)离子从负载有fe(iii)离子的有机相中萃取。在用水反萃的三个步骤后,可以反萃92.51%的fe(iii)离子。盐酸是最不有效的反萃溶液。在使用h2so4的三个反萃步骤之后,离子液体可以再利用以从水溶液中有效地萃取新的fe(iii)负载。与cyphosil101相比,铁从负载有fe的aliquat336中反萃比从负载有fe的cyphosil101更容易。
在负载有fe(iii)离子的有机相与贫fe(iii)离子的原料分离之后,可以从贫fe(iii)离子的原料中回收al或其它感兴趣的非铁离子如na、ca或mg。应当理解,存在于贫fe(iii)离子的原料中的al含有低水平的铁,因此可以用于生产高纯度和/或商业上可接受的铝基材。
本文还提供了
如所讨论的,本文所述的方法可以特别适合于从煤矸石浸出液中除去fe(iii)离子。因此,本文提供了从煤矸石浸出液中选择性除去fe(iii)离子的方法,所述方法包括使浸出液与包含
然后可以从负载有fe(iii)离子的有机相中反萃fe(iii)离子,并且可以从贫fe(iii)的浸出液中回收高纯度的铝产物。因此,本文还提供了从煤矸石回收高纯度铝产物如氯化铝的方法,所述方法包括浸提煤矸石以提供浸出液,使浸出液与包含
下文通过以下非限制性实施例描述本发明。
实施例
反应物
本研究中使用的所有il均购自德国的iolitec。分析级氯化铁六水合物(fecl3·6h2o,98%)、氯化铝六水合物(alcl3·6h2o,98%)、盐酸(hcl,37%)、硝酸(hno3)、氯化钠(nacl)、氯化锂(licl)购自sigma-aldrich。从millipore水系统(advantagea10,德国merckmillipore)获得去离子水(电阻率18.2mω.cm)。所用的五种离子液体列于下表中:
表1-用于本研究的离子液体(kevinj.fraser2009)
仪器和测量方法
使用感应耦合等离子体发光光谱法(icp-aes,perkinelmer-optima5300dv)测定水相中的金属离子浓度。铁测定样品用0.1mol·l-1hno3酸化。基于重复分析的fe的分析误差在102%置信水平下为±1%。
ft-ir和拉曼光谱用于表征离子液体在萃取前后的结构。在thermonicoletft-irnexus470上以衰减全反射(atr)模式记录红外光谱。在ir测量之前,将样品用去离子水洗涤三次以除去离子液体相中的萃取的酸,然后在真空下蒸发以除去离子液体中剩余的水。在alpha300r显微镜/光谱仪(witec,德国)上进行拉曼光谱。该系统具有用于具有1cm-1分辨率的样品照明的532nm二极管激光器和热电冷却ccd检测器。单个拉曼光谱的获取时间为10秒。
使用uv-可见分光光度计(shimadzuuv-2600)定性测量离子液体相和水溶液中存在的铁物质的形式。使用1.0cm2石英比色杯在室温下在200-900nm的波长范围内收集吸收。对于每个样品,在测量含fe溶液之前收集无fe空白溶液的光谱。对于在200-500nm波长范围内的离子液体相中的铁物质的测量,使用乙醇稀释离子液体,其在210nm的波长具有uv吸收截止(cut-off)。
萃取方法
所有储备溶液用超纯水制备。对于酸浓度对铁萃取的影响,通过加入不同体积的浓hcl(37%,1.18g·ml-1)制备溶液。对于氯化物浓度对铁萃取的影响,通过加入不同量的nacl或licl制备溶液,且酸浓度保持在1mol·l-1。为了确定作为进料溶液中存在的铁浓度的函数的萃取效率,制备盐酸含量为3mol·l-1的和铁浓度为4.5至72g·l-1的fe(iii)水溶液。为了检测al(iii)溶液中fe(iii)的萃取选择性,用不同al(iii)/fe(iii)摩尔比的进料水溶液在两种酸浓度3mol·l-1和7mol·l-1下进行萃取。在萃取过程中使用1ml的每种il。将1ml未稀释的离子液体用作萃取相,并根据表1中的密度通过天平上的当量质量进行测量。在室温(25±2℃)下以1:2的rtil/水体积比进行fe(iii)萃取。在萃取前,将1ml的rtil在萃取ph下用水饱和,然后使其与2ml的含有金属离子的水相接触。使用磁力搅拌装置(rt10,ika)将溶液剧烈混合30分钟。通过在4000rpm离心5分钟(2-16p,sigma)实现相分离。通过改变混合时间研究接触时间对萃取效率的影响,同时保持其余实验条件恒定。
相分离后,通过icp测定水相中的金属离子浓度。确定金属离子的萃取效率、分配比和分离因子。金属的萃取百分比(e)定义为
其中[m]0和[m]aq表示萃取前后水相中的金属浓度(g·l-1)。
使用下面给出的等式计算金属的分配比(d):
其中vaq和vorg是水相和离子液体相的体积(ml)。
分离因子α表示两种金属之间的分离效率,它可以定义为
其中
fe(ⅲ)配合物在酰氯溶液中的形式
研究了fe(iii)物质在cl-浓度从1增至13mol·l-1的水溶液中的形式。用licl,fecl3·6h2o和hcl制备溶液。每种溶液中的fe(iii)浓度为约0.4mmol·l-1(因为fe(iii)物质在紫外区具有强吸收,fe(iii)浓度高于此可实现饱和吸收)。在本研究中使用的样品溶液的总氯化物和铁浓度列于表2中。
表2-用于测量uv光谱的样品溶液的组成
反萃方法
使用包含水、0.5mol·l-1hcl、1mol·l-1hcl、0.1mol·l-1h2so4、0.5mol·l-1h2so4、1mol·l-1h2so4的各种反萃溶液反萃负载的有机相。反萃溶液与负载有fe(iii)的有机相的体积比为4:1。使用新反萃溶液连续重复反萃实验四次,并且报告的数据是它们的平均值。在25±2℃下以1000rpm剧烈搅拌30分钟后,通过以4000rpm离心5分钟分离两相。使用icp测量水相中的铁浓度。fe(iii)的反萃百分比(s)定义为
其中vs和vo表示反萃溶液和负载有fe(iii)的有机相的体积(ml)。[fe]o表示反萃前有机相中的fe(iii)浓度(g·l-1)。[fe]s表示反萃后水相中的fe(iii)浓度(g·l-1)。
实施例1-使用
hcl浓度对铁萃取效率的影响
使用各种离子液体在两种不同浓度的hcl情况下萃取铁。萃取效率(%e)如图1所示。结果表明[p14,6,6,6][cl]、[p14,6,6,6][br]和[p14,6,6,6][dcd]可以很大程度上将fe(iii)在盐酸浓度为0.3mol·l-1和1mol·l-1下从水溶液中萃取。其中,[p14,6,6,6][cl]从0.3mol·l-1和1mol·l-1hcl溶液中萃取出高于95%的铁;而[p14,6,6,6][br]和[p14,6,6,6][dcd]对铁的萃取百分比取决于酸浓度,其中水溶液中较高的酸浓度产生更高的萃取效率。然而,[hmin][pf6]和[p14,6,6,6][ntf2]仅萃取很低百分比的fe(iii)。
cl-浓度对铁萃取效率的影响
使用各种离子液体在三种不同浓度的cl-情况下萃取铁。萃取效率(%e)如图2所示。结果表明,对于所有选择的rtil,铁的萃取效率随着cl-浓度的增大而增大。[p14,6,6,6][cl]、[p14,6,6,6][br]和[p14,6,6,6][dcd]在不同浓度的cl-下从0.3mol·l-1hcl溶液中高效地萃取fe(iii)。然而,在3.54mol·l-1的cl-浓度下[hmin][pf6]仅萃取约20%的铁和[p14,6,6,6][ntf2]仅约10%。
上述结果表明,il的阴离子在铁从水溶液中的萃取效率和选择性中起重要作用。涉及更亲水性阴离子的il显示更好的萃取fe的能力。
实施例2-使用
il也被评价为用于al(iii)萃取的萃取剂,结果示于表3中。结果表明,在选定的实验条件下,使用
表3-在0.3mol·l-1hcl溶液中用不同离子液体在不同cl-浓度下萃取al(iii)
实施例3-使用
测试三种
表4-使用三种
结果表明,使用这三种离子液体萃取超过99%的fe(iii),而大部分al(iii)保留在水相中。对于[p14,6,6,6][cl]实现了3084的分离因子,对于[p14,6,6,6][br]的分离因子为1206,和对于[p14,6,6,6][dcd]的分离因子为1657。[p14,6,6,6][br]和[p14,6,6,6][dcd]都具有与[p14,6,6,6][cl]的结果相当的结果,但溴化物的毒性比氯化物更大。此外,考虑到使用hcl浸出方法,[p14,6,6,6][cl]不会向水相中引入额外的阴离子。对于[p14,6,6,6][dcd],在液-液界面萃取后观察到乳液的部分形成。然后[p14,6,6,6][c1]被选中进一步工作。
实施例4-使用cyphosil101从水溶液萃取铁
hcl浓度对萃取效率的影响
研究了在进料溶液中fe(iii)浓度恒定为0.24mol·l-1(13.5g·l-1)时hcl浓度在0-10mol·l-1范围内对fe(iii)萃取的影响。结果示于图3中。在hcl浓度为0-10mol·l-1时,fe(iii)萃取百分比从88.3%增加到99.7%。
cl-浓度对萃取效率的影响
当改变hcl浓度时,溶液酸度和氯化物浓度都改变。为了研究cl-浓度对铁(iii)萃取的影响,通过在进料溶液中加入所需量的nacl来调节cl-浓度,同时hcl浓度固定在1m。然后通过改变在1.72mol·l-1至5.72mol·l-1范围内的cl浓度来研究在进料溶液中13.5g·l-1fe(iii)的萃取。结果示于图4中。随着氯化物浓度的增大,fe(iii)的萃取百分比从98.3%提高到99.7%。nacl浓度对fe(iii)萃取的影响与hcl的趋势相同,表明nacl可用作氯化物源以增强fe(iii)萃取。这表明可以在较低的酸浓度介质中实现使用cyphosil101高效萃取fe(iii),而当使用有机膦如tbp、cyanex921和cyanex923从酰氯溶液萃取fe(iii)时,需要高浓度的hcl(mishra等人,2010)。不受理论的束缚,我们建议进料溶液中的氯离子浓度在fe(iii)萃取中起作用,而fe(iii)的水解被溶液的酸度抑制。
搅拌时间的影响
为了研究混合时间对萃取fe(iii)的影响,将含有13.5gl-1fe(iii)、3mol·l-1hcl和cyphosil101的氯化物水溶液以2:1的体积比,以从0分钟至60分钟的各种混合时间进行接触。如图5所示,使用cyphosil101的fe(iii)萃取非常快,在5分钟内萃取超过99.5%的fe(iii)。此外,相分离快速,没有形成乳液。相反,在常规溶剂萃取期间,通常遇到第三相的形成,特别是在hcl介质中,其中施加有机萃取剂和稀释剂(zhu,2005)。
fe(iii)浓度的影响
测定作为进料溶液中fe(iii)浓度的函数的fe(iii)萃取。当fe(iii)浓度低于36g·l-1时,fe(iii)萃取百分比几乎保持恒定,随着原料中fe(iii)含量的增加,fe(iii)萃取百分比急剧下降。在小于36g·l-1时,溶液中的fe(iii)几乎全部被萃取,而在72g·l-1时fe(iii)萃取百分比为52.8%。这是因为高于36g·l-1的fe(iii)浓度导致cyphosil101中的最大负载。
计算相应的分布系数(dfe)并示于图7中。发现当fe(iii)浓度低于36g·l-1时,dfe首先增加,之后明显降低。这是由于低于36g·l-1时溶液中fecl3的盐析效应的影响。将fe(iii)浓度增大到36g·l-1以上导致cyphosil101中fe(iii)的最大负载。
铁萃取等温线
研究了从3mol·l-1的hcl进料溶液中萃取fe(iii)的等温线。使用1ml的cyphosil101,而在2ml的3mol·l-1hcl水溶液中的fe(iii)浓度从4.5变化至72g·l-1。cyphosil101相中的fe(iii)浓度相对于水相中的fe(iii)浓度绘图,并示于图8中。可以看出,在cyphosil101中fe(iii)的负载随着fe(iii)浓度的增大而增加,然后达到最大值。在cyphosil101中fe(iii)的最大负载计算为约83.2g·l-1,这相当于1.49×10-3摩尔的fe(iii)。当1ml的cyphosil101等于1.64×10-3摩尔的cyphosil101时,fe(iii)与cyphosil101的摩尔比约为0.91。已经报道,hcl可以在cyphosil101相中萃取并以[hcl2]-的形式存在(wellens,thijs等人,2012)。水可以通过在cyphosil101的cl-阴离子和水分子之间形成弱氢键与cyphosil101相互作用。因此,由于它们与fe(iii)的共萃取,假定过量的cyphosil101被hcl和水占据。fe(iii)的最大负载可以受酸的共萃取影响。
实施例5-从含有不同金属离子的混合溶液中选择性萃取fe(iii)
除了fe(iii)外,存在于来自煤矸石的hcl浸出溶液中的主要金属离子包括al(iii)、mg(ii)、ca(ii)和k(i)。为了检测fe(iii)从al(iii)溶液中的萃取选择性,使用不同的al(iii)/fe(iii)摩尔比的进料水溶液在3mol·l-1hcl下进行萃取。fe(iii)浓度保持在13.5g·l-1。剩余的fe(iii)和al(iii)浓度和分布系数以及分离因子列于表5中。
表5-从不同[fe(iii)]/[al(iii)]的混合物溶液中选择性萃取fe(iii)的结果
fe(iii)的分布系数大,表明fe(iii)大量萃取到cyphosil101中,而al(iii)具有非常小的分布系数,这意味着大部分al(iii)保留在水相中。cyphosil101因此是将fe(iii)与al(iii)分离的高选择性萃取剂。此外,fe(iii)的分布系数和分离因子随着al(iii)的浓度增大而显著增加,这可归因于液-液萃取期间的盐析效应。已经报道,al(iii)由于其较小的离子半径和较高的电荷可以具有强的盐析效应。此外,al(iii)在水相中的存在可降低水相的介电常数,从而抑制fe(iii)水合,这可进一步增强fe(iii)萃取(yu和wu,1986)。
从含有mg(ii)、ca(ii)和k(i)的混合溶液中萃取fe(iii)进一步在3mol·l-1hcl溶液中实施。表6所示的结果表明,cyphosil101几乎不萃取mg(ii)、ca(ii)和k(i)。这些金属离子在溶液中的存在不干扰fe(iii)的萃取,相反,它们由于盐析效应而增强了fe(iii)的萃取。因此,发现镁、钙和钾保留在水溶液中,并且获得铁与这些金属离子的高选择性分离。
表6-铁(iii)、钙(ii)、镁(ii)和钾(i)的分布系数
实施例6-fe(iii)从rtil相中的反萃
从离子液体相中反萃的fe(iii)的百分比示于表7中。
表7-各种所选反萃溶液的反萃结果
s1+2表示来自第一阶段(s1)和第二阶段(s2)的铁(iii)反萃效率的总和。s1+2+3和s1+2+3+4分别表示来自连续的三阶段和四阶段的铁反萃效率的总和。e(%)2代表使用再循环cyphosil101的铁(iii)的萃取百分比。
fe(iii)分别用0.5和1mol·l-1hcl反萃取。在三个阶段的反萃后,小于10%的总fe(iii)被反萃,表明hcl不能有效地从cyphosil101中反萃fe(iii)。水可以在四个阶段的反萃后反萃取约50.8%的fe(iii)。然而,发现硫酸是最有效的反萃溶液。fe(iii)的反萃百分比随着反萃溶液中h2so4浓度的增大而增大。在四个阶段的反萃后,用1mol·l-1h2so4完全反萃取fe(iii)。反萃后的cyphosil101用3mol·l-1hcl洗涤以洗掉残余的金属离子并再生cyphosil101。将再循环的cyphosil101重新用于从新制备的溶液中萃取fe(iii)。fe(iii)的萃取百分比可以达到99%,这与使用新鲜cyphosil101所达到的一样高。
水溶液中铁-氯物质的特征
在水溶液中,铁具有在具有物质fe3+、[fecl]2+、[fecl2]+、fecl3和[fecl4]-的不同分布的酰氯介质中形成一系列氯化铁配合物的倾向,取决于氯化物浓度和溶液条件。我们调查了fe(iii)物质分别在1至13mol·l-1的cl-浓度范围的1mol·l-1hcl溶液中和浓hcl溶液中的形成。每个样品溶液的详细组成在表8中给出。在25℃下收集样品的uv-可见光谱,并显示在图9和10中。
表8-用于uv-可见光测量的溶液的组成(licl作为氯化物源)
当cl-浓度低于3mol·l-1时,由于形成[fecl]2+配合物,在222nm和336nm处出现两个主要谱带。当氯化物浓度增大到5mol·l-1以上时,在344nm处出现了新的宽谱带,这归因于[fecl2]+的形成。当氯化物浓度增大到7mol·l-1以上时,由于fecl3(水性)的吸收,出现了360nm处的新峰和314nm处的肩峰。当氯化物浓度超过9mol·l-1时,在258nm处出现新峰,同时,360nm处的吸收最大值移动4nm到更长波长,并变得更加强烈,表明[fecl4]-是溶液中的主要物质。每个物质的这些结果和计算的摩尔吸收率(ε)与以前的研究中报告的那些(stefánsson和seward,2008,liu,etschmann等人,2006)一致。
图10显示了fe(iii)-氯配合物在6-12mol·l-1范围内的一系列hcl浓度的uv-可见光谱。观察到在242nm、314nm和362nm处出现的三个不同的吸收谱带。当在有机相中记录[fecl4]-的光谱时,已经报道了这三个谱带。在浓缩的licl和hcl溶液中[fecl4]-的特征谱带的移动可以通过溶剂对uv-可见光谱的影响来解释,其受溶剂极性和酸浓度的影响。
在cyphosil101中负载的fe(iii)物质的表征
为了理解存在于cyphosil101相中的fe(iii)物质,记录了负载有fe(iii)的cyphosil101的uv-可见光谱并示于图11(在紫外范围内)和图12(在可见光范围)。
三个谱带出现在uv区域中的242nm、315nm和362nm处,并发现另外三个主谱带在可见光区域中的530nm、620nm和685nm处,根据图11中所示的结果,其可以归属于[fecl4]-的特征吸收谱带。[fecl4]-的摩尔吸收率在200-500nm波长区域是强的,表明这些谱带源自从配体到金属(l→fe(iii))电荷转移跃迁。在500-900nm波长区域,其摩尔吸收率非常弱(≤1.5l·cm-1·mol-1),这是由d-d跃迁引起的。上述结果表明[fecl4]-是在cyphosil101相中形成的唯一配合物。
通过拉曼和ft-ir光谱进一步表征负载有fe(iii)的cyphosil101。在拉曼光谱中的333.75cm-1处出现尖峰(图13),其归属于存在于[fecl4]-中的对称fe-cl键的伸缩振动。拉曼分析进一步证明了[fecl4]-阴离子在cyphosil101中的存在。记录未稀释的cyphosil101和纯化的负载有fe(iii)的cyphosil101的ir光谱,并显示在图14中。两个样品都具有出现在2928cm-1、2855cm-1和1457cm-1处的吸收谱带,其归属于来自[p14,6,6,6]+阳离子的脂族c-h振动。然而,未稀释的cyphosil101在3370cm-1、3380cm-1和1626cm-1处存在三个额外的吸收谱带。这些谱带由cyphosil101中游离水的吸收引起,cyphosil101在测量前未纯化以除去水。由于从cyphosil101相中除去水,这些谱带从纯化的负载有fe(iii)的cyphosil101样品中消失。除了吸收谱带,两个样品的ftir光谱是相同的,表明[p14,6,6,6]+阳离子在萃取过程中没有改变。
结论
未稀释的
实施例7-使用aliquat336萃取铁
hcl浓度对fe(iii)萃取的影响
研究了在进料溶液中时,在13.5g·l-1的恒定铁浓度下,hcl浓度在0至10mol·l-1范围内对fe(iii)萃取的影响。aliquat336的fe(iii)萃取如图15所示。随着hcl浓度从0增大到3mol·l-1hcl,fe(iii)萃取百分比从63.70%增大到99.72%,然后在3-10mol·l-1的hcl浓度范围内达到平台。当溶于水时,氯化铁(iii)可以水解,但是溶液是酸性的,ph低于2。在萃取过程中,在所有hcl浓度范围内没有观察到沉淀,因为fe(iii)在ph高于2.8时沉淀。hcl在萃取过程中起到多功能作用,包括防止fe(iii)水解、作为氯化物源,但也用作盐析剂。
cl-浓度对fe(iii)萃取的影响
研究了在含有1mol·l-1hcl的溶液中氯离子浓度在1.72mol·l-1至5.72mol·l-1的范围内对萃取fe(iii)的影响。实验数据绘制在图16中,说明随着氯化物浓度从1.72增大到5.72mol·l-1,铁萃取百分比从96.14增大到99.57%。氯化物盐如nacl可用作fe(iii)萃取中的氯化物源,表明fe(iii)萃取可在低酸性溶液中进行。与之前的报道相比,使用胺萃取剂如alamine336和n503的fe(iii)萃取仅在高hcl浓度下才有效(deng,1982,lee和lee2005)。使用aliquat336的fe(iii)萃取可以在较温和的酸性条件下进行。
接触时间对fe(iii)萃取的影响
如图17所示,用aliquat336萃取fe(iii)非常快。5分钟后获得fe(iii)百分比萃取的恒定值(efe≈100%)。萃取后的相分离非常快速和良好,没有观察到乳液的形成。
铁浓度对fe(iii)萃取的影响
如图18所示,当fe(iii)浓度低于40g·l-1时,fe(iii)萃取百分比几乎恒定,但随着fe(iii)的进一步增加,fe(iii)萃取百分比降低,其中在72g·l-1fe(iii)时仅萃取了66.7%fe(iii)。在低于36g·l-1铁时,萃取了超过99.5%的fe(iii)。计算相应的分布比(dfe)并示于图19中。数据表明,dfe受进料溶液中铁浓度的影响,当fe(iii)浓度低于36g·l-1时dfe增加,然后急剧下降。这些结果表明aliquat336可以有效地和高效地从酸性氯化物介质中萃取fe(iii)。此外,混合后的相分离快,并且没有观察到第三相和乳液的形成,这在常规胺萃取系统中普遍遇到。
fe(ⅲ)萃取等温线
研究了使用aliquat336的fe(iii)萃取的等温线。离子液体相中的fe(iii)浓度([fe]il)相对于水相中的相应浓度的曲线绘制在图20中。在1mlaliquat336中,fe(iii)的最大负载为103.1g·l-1,aliquat336具有比cyphosil101更高的负载能力,这是由于在1ml离子液体的当量体积中aliquat336有较高摩尔数。fe(iii)与aliquat336的摩尔比计算为0.84。剩余的aliquat336被hcl的吸附占据,这是由于在以hcl2-形式存在的离子液相中与fe(iii)共萃取。然而,在相同的萃取条件下,发现对于fe(iii)与cyphosil101的摩尔比为0.91,表明aliquat336与hcl具有更强的相互作用,导致更多的hcl分子被共萃取。据报道,在含有30%n503和20%煤油的体系中,fe(iii)的负载能力为20.9g·l-1(enxinma1986),而在含40%tbp的体系中为27g·l-1(deng,1982)。与传统的fe(iii)萃取系统相比,离子液体显示出高得多的负载能力。
记录了il相中fe(iii)物质的uv-可见光谱(显示在图21中)。在可见光区域出现在531nm、619nm和685nm处的三个吸收谱带是fecl4-的特征吸收谱带,表明fecl4-是aliquat336中形成的唯一物质(deng等人,2011)。ir分析显示,在负载有fe(iii)的aliquat336和未稀释的aliquat336之间发现相同的阳离子光谱,表明aliquat336的阳离子不受萃取的影响。在从酸性氯化物溶液的铁(iii)萃取中,aliquat336和cyphosil101之间获得了类似的光谱结果,提出了相同的萃取机理,其中fecl3离子与aliquat336的cl-阴离子的缔合和fecl4-阴离子与aliquat336的cl-阴离子的交换在铁(iii)萃取中起关键作用。
实施例8-从含有不同金属离子的混合溶液中选择性萃取fe(iii)
为了检验al(iii)浓度对fe(iii)离子选择性的影响,用不同al(iii)/fe(iii)浓度比的进料水溶液在3mol·l-1hcl下进行萃取。fe(iii)浓度保持在13.5g·l-1。剩余的fe(iii)和al(iii)浓度、分布系数以及分离因子列于表9中。
表9-用aliquat336从不同fe(iii)/al(iii)浓度比的一系列混合物溶液中选择性萃取铁的结果
表9中所示的数据表明铁被大量萃取到aliquat336,而铝保留在水相中。已发现al(iii)具有非常低的分布系数,其不受溶液条件的显著影响。fe(iii)的分布系数高得多,随着al(iii)浓度的增加,fe(iii)的分布系数进一步显著增加,导致高al(iii)浓度溶液中的分离因子afe,al高得多。通常接受的是,离子强度随着电解质浓度的增大而增强,导致水相的介电常数的降低,其影响离子物质的活性系数。因此,由于在水相中加入铝盐,这增强了fe(iii)萃取,fe(iii)水合作用被抑制。
除了al(iii)、ca(ii)、mg(ii)和k(i)外,煤矸石浸出液中存在其他金属离子。进行从含有ca(ii)、mg(ii)和k(i)的混合溶液中选择性萃取fe(iii)。每种金属的分布比在表10中给出。镁、钙和钾离子保留在水溶液中,因此可以与铁分离。
表10-铁(iii)、钙(ii)、镁(ii)和钾(i)的分布比
几乎没有萃取ca(ii)、mg(ii)和k(i),而由于盐析效应,在溶液中存在上述金属离子的情况下增强了fe(iii)的萃取(cui等人,2015)。在浸出液中fe(iii)对包括al(iii)、ca(ii)、mg(ii)和k(i)在内的金属离子的高选择性表明在离子液体相中获得了高纯度的fe(iii)物质,其具有用作纯fe(iii)源以从煤废弃物生产高质量铁产物的潜力。这将为煤矸石处理的这一过程带来经济效益。
实施例9-fe(iii)从aliquat336相中的反萃
各种所研究的反萃溶液的回收结果示于表11中。
表11-各种所研究的反萃溶液的回收结果
s1+2是铁反萃效率的第一(s1)和第二(s2)时间的总和。s1+2+3是连续三次铁反萃效率的总和。efe2代表使用回收离子液体的铁的萃取百分比。
观察到0.5mol·l-1的h2so4是有效的反萃溶液,因为它在三个反萃步骤后能够从负载的aliquat336中除去几乎100%的fe(iii)。96.10%的铁可以在用水反萃的三个步骤后反萃。盐酸是最不有效的反萃溶液。在使用h2so4的三个反萃步骤之后,离子液体相可以被再利用以从水溶液中有效地萃取新的fe(iii)负载。与cyphosil101相比,铁从负载有fe的aliquat336中反萃更容易。
进一步研究了温度对从aliquat336和cyphosil101的fe(iii)反萃效率的影响,结果示于图22中。从aliquat336和cyphosil101的fe(iii)反萃效率随着反萃温度的升高而降低,表明fe(iii)反萃过程是放热的。总体上,与cyphosil101相比,fe(iii)可以容易地从aliquat336反萃。
结论
aliquat336可以有效地从氯化铝溶液中萃取铁。在5分钟内,超过99.5%的铁(iii)从3mol·l-1hcl溶液萃取到aliquat336中。观察到铁(iii)萃取相对于al(iii)、ca(iii)、mg(ii)和k(i)具有高选择性,在[al(iii)]/[fe(iii)]为3情况下,分离因子为14330。nacl可用作从酸性氯化物介质中萃取的氯化物源。fe(iii)的最大负载量为103g·l-1。fe(iii)可以从aliquat336用0.5mol·l-1h2so4有效地反萃。与cyphosil101相比,fe(iii)更容易从aliquat336反萃。
实施例10-从废煤hcl液体中萃取铁
将10ml预饱和的cyphosil101/aliquat336与20ml废煤浸出液混合。在每次用20ml新鲜水性进料萃取四个阶段后,产生含铝的萃余液和负载有fe(iii)的il。收集前者以制备alcl3·6h2o,并且后者进入铁反萃过程。将负载有fe(iii)的il在三个阶段中反萃,每次用40ml0.5mh2so4,以从il相中除去铁。每个反萃阶段使用新的反萃溶液。将il用3mhcl溶液进一步洗涤。再生的il被重新用于新的循环fe(iii)萃取-反萃过程。
alcl3·6h2o的结晶和表征
用il进行铁分离后,将浸出液蒸发并浓缩,直到出现少量alcl3·6h2o晶体。然后将hcl气体喷射到饱和浸出液中。纯alcl3·6h2o从溶液中沉淀出来。alcl3·6h2o的量随着喷入水溶液中的hcl气体的增加而增加。alcl3·6h2o的结晶效率为73%。升高温度对于结晶是不利的。所得alcl3·6h2o中的铁含量低于0.01%。
萃取后,使用前述的水性萃余液进行alcl3·6h2o的结晶。为了抑制alcl3·6h2o的水解,在减压下进行结晶以降低水蒸发的温度并减少hcl挥发。用icp测量所得晶体中的金属含量。两批产物的alcl3·6h2o和其它金属杂质的重量百分比示于表12。对直接从浸出液中结晶而没有萃取的alcl3·6h2o的icp分析作为比较。
表12-alcl3·6h2o的定量分析
晶体1表示从废煤浸出液中无需除铁的alcl3·6h2o,晶体2和3表示用cyphosil101和aliquat336除铁后从废煤浸出液制备的alcl3·6h2o。
进行tg分析仪和xrd以表征制备的alcl3·6h2o晶体的纯度和结构。alcl3·6h2o晶体的热分解可以描述如下:2alcl3·6h2o→al2o3+6hcl+9h2o。根据该方程,由于hcl和h2o的热损失,获得78.8%的重量损失。从图23所示的制备的alcl3·6h2o晶体可以发现等效量的热损失。这意味着一个氯化铝分子在晶体中具有六个缔合的水分子,表明获得了高纯度alcl3·6h2o产物。
xrd分析显示在图24中,进一步证明alcl3·6h2o产物在除去fe(iii)后具有高纯度和结晶度。然而,没有除去fe(iii)的晶体的xrd图案分别在30.97°和63.37°的2θ位置增加了强度。这可能是由于晶体产物中fe(iii)的高含量所致。
实施例11-il的再生和再利用能力
再利用il相的能力在基于il的萃取的工业应用的可行性中是重要的。用再生的aliquat336和cyphosil101重复萃取-反萃过程的循环六次。fe(iii)的萃取结果示于图25。
来自循环1至6的fe(iii)的萃取效率对于cyphosil101分别为99.75%、99.58%、99.67%、99.58%、99.33%、99.02%,和对于aliquat336分别为98.98%、98.98%、98.99%、98.80%、98.72%和98.59%。结果表明,cyphosil101具有比aliquat336稍微更高的从煤矸石酸浸出滤液的fe(iii)萃取效率。然而,cyphosil101具有更长的循环周期,因为其使用0.5mol·l-1h2so4进行更多的反萃次数。随着循环数增加,fe(iii)萃取效率的轻微降低是由萃取-反萃过程中的il损失引起的。
与基于ntf2-、bf4-和pf6-的离子液体相比,aliquat336和cyphosil101由于氯阴离子而趋向于更亲水。aliquat336和cyphosil101的溶解性大于其他离子液体。此外,由于aliquat336/cyphosil101和水溶液之间的低界面张力,在相分离后,少量非常细小的il的液滴悬浮在水相中,导致延长的相分离和离子液体损失。使用水相中的总有机碳(toc)含量评价离子液体的损失。混合物沉降3小时后,水溶液的toc值为130-140mg·l-1,沉降48小时后为30-40mg·l-1。尝试了两种方法来加速相分离并回收离子液体损失。一种方法是混合后离心分离,另一种方法是使用0.45μm膜过滤。混合物沉降1.5小时后,用0.45μm膜过滤每次萃取或反萃过程后的水相。膜上收集的离子液体可以再循环。已经报道离子液体的损失可以通过盐析过程降低,或者可以使用纳滤技术回收il(wellens,goovaerts等人2013)。
结论
该技术可有效地应用于从煤矸石的hcl浸出溶液中除去fe(iii),这对于从煤矸石中获得高质量的氯化铝(iii)产物至关重要。还测试了aliquat336/cyphosil101的再生。在除去铁(iii)后,从浸出溶液制备alcl3·6h2o。所得alcl3·6h2o晶体中的铁含量小于0.005%(重量),表明获得了高纯度和结晶度的alcl3·6h2o晶体。这项工作发现了从废煤浸出液中除去铁(iii)的有效方法,有利于从废煤中生产高附加值的铝产物。
本领域技术人员应当理解,本发明的使用不限于所描述的特定应用。关于本文描述或描绘的特定元素和/或特征,本发明不限于其优选实施方案。应当理解,本发明不限于所公开的一个或多个实施方案,而是能够在不脱离由所附权利要求阐述和限定的本发明的范围的情况下进行多种重置、修改和替换。
参考文献
amani,v.,safarin.khavasih.r.(2007)."synthesis,characterizationandcrystalstructuredeterminationofiron(iii)hetero-ligandcomplexescontaining2,2′-bipyridine,5,5′-dimethyl-2,2′-bipyridineandchloride,[fe(bipy)cl4][bipy·h]and[fe(dmbipy)2cl2][fecl4]."polyhedron26(15):4257-4262.
anne.visser,r.p.s.,w.matthewreichert,heatherd.willauer,jonthang.huddleston,robind.rogers·(2003)."roomtemperatureionicliquidsasreplacementsfortraditionalorganicsolventsandtheirapplicationstowards"greenchemistry"inseparationprocesses."greenindustrialapplicationsofionicliquids.r.d.rogers,seddon,k.r.,volkov,s.,andeds.,dordrecht,thenetherlands:137-156.
baileyj.k.,brinkerc.j.,mecartneym.l.(1993)."growthmechanismsofironoxideparticlesofdifferingmorphologiesfromtheforcedhydrolysisofferricchloridesolutions."journalofcolloidandinterfacescience(157):1-13.
bradaric,c.j.,downard,a.,kennedy,c.,robertson,a.j.andzhou,y.(2003)."industrialpreparationofphosphoniumionicliquids."greenchemistry,2003,5(2):143-152.
brennam.krieger,h.y.l.,thomasj.emge,jamesf.wishart,edwardw.castner,jr.(2010)."ionicliquidsandsolidswithparamagneticanions."phys.chem.chem.phys.,(12):8919-8925.
chang,y.zhai,x.li,b.fu,y.(2010)."removalofironfromacidicleachliquoroflateriticnickelorebygoethiteprecipitate."hydrometallurgy,101,84-87.
cieszynska,a.andwisniewskim.(2010)."extractionofpalladium(ii)fromchloridesolutionswith
delsesto,mccleskeyt.m.,burrella.k.,bakerg.a.,thompsonj.d.(2008)."structureandmagneticbehavioroftransitionmetalbasedionicliquids."chemcommun,(4):447-449.
deng,n.,lim.,zhaol.,luc.,derooys.l.,warners.m.(2011)."highlyefficientextractionofphenoliccompoundsbyuseofmagneticroomtemperatureionicliquidsforenvironmentalremediation."jhazardmater192(3):1350-1357.
deng."extractionofironfromco(ⅱ)andni(ⅱ)solution."nonferrousmetal,1982(4),38-42.
earlem.j.,seddon,k.r.(2000)."ionicliquids.greensolventsforthefuture."pureappl.chem.72(7):1391-1398.
fraserk.j.andmacfarlaned.r.(2009)."phosphonium-basedionicliquids:anoverviewcopy."aust.j.chem.62:309-321.
frost,r.l.,keeffee.c.(2009)."ramanspectroscopicstudyofthesulphitebearingmineralsscotlandite,hannebachiteandorschallite–implicationsforthedesulphationofsoils."journaloframanspectroscopy40(3):244-248.
gengx.w.,ma.h.w.,sus.q.(2012)."thepreparationofaluminiumhydroxidefromhigh-aluminaganguedesilicationresiduesbasedonsodalimesinteringmethod."bulletinofmineralogy,petrologyandgeochemistry,31(6):635-640.
jains.k.,gargb.s.,bhoon,y.k.(1986)."iron(iii)complexesof2-acetylpyridine-4-phenyl-3-thiosemicarbazones:magnetic,e.s.r.andspectralstudies."transitionmet.chem.11:89-95.
kogelnig,d.,stojanovica.,jirsaf.,
kogelnig;,stojanovica.,et.al.,(2011)."quaternaryammoniumandphosphonium."ionicliquids:theory,properties,newapproaches:657-680.
lee,m.s.andleek.j.(2005)."separationofironandnickelfromaspentfecl3etchingsolutionbysolventextraction."hydrometallurgy,80(3):163-169.
li,m.,hez.,zhoul.(2011)."removalofironfromindustrialgradealuminiumsulfatebyprimaryamineextractionsystem."hydrometallurgy106(3-4):170-174.
liuw.,etschmannb.,bruggerj.,spiccial.,forang.,mcinnesb.(2006)."uv–visspectrophotometricandxafsstudiesofferricchloridecomplexesinhyper-salineliclsolutionsat25–90℃."chemicalgeology231(4):326-349.
nayl,a.a.(2010)."extractionandseparationofco(ii)andni(ii)fromacidicsulfatesolutionsusingaliquat336".journalofhazardousmaterials173(1-3):223-230.
mae.,yans.,wangs.,chengyey."studyontheequilibbriumandcoordinationcompoundofionextractionwithn,n-di(1-methylheptyl)acetamideinhydrochloricacid."chinesejournalofappliedchemistry,1986,3(6):37-39.
mishra,r.k.rout,p.c.sarangi,k.nathsarma,k.c.(2010)."acomparativestudyonextractionoffe(iii)fromchlorideleachliquorusingtbp,cyanex921andcyanex923."hydrometallurgy,104,298-303.
qian,t.andlij.(2015)"synthesisofna-azeolitefromcoalganguewiththein-situcrystallizationtechnique."advancedpowdertechnology,26(1):98-104.
quinn,j.e.,ogdenm.d.,soldenhoffk.(2013)."solventextractionofuranium(vi)fromchloridesolutionsusingcyphosil-101."solventextractionandionexchange31(5):538-549.
rabinowitche.,stockmayerw.h.(1942)."associationofferricionsandchloride,bromideandhydroxylions(aspectroscopicstudy)."j.am.chem.soc.,64:335-347.
stefánsson,a.andsewardt.m.(2008)."aspectrophotometricstudyofiron(iii)hydrolysisinaqueoussolutionsto200℃."chemicalgeology249(1-2):227-235.
stefánsson,a.,lemkek.h.,sewardt.m.(2008).iron(iii)complexationinhydrothermalsolutions–anexperimentalandtheoreticalstudy.proceedingsofthe15thinternationalconferenceonthepropertiesofwaterandsteam,15,1-7,berlin.
stefansson,a.(2007)."iron(iii)hydrolysisandsolubilityat25℃."environ.sci.technol.41:6117-6123.
swarnkar,s.r.,gupta,b.l.,sekharan,r.d.(1996)."ironcontrolinzincplantresidueleachsolution."hydrometallurgy,42,21-26.
sun,z.c.,etal.(2011)."synthesis,characterizationandspectralpropertiesofsubstitutedtetraphenylporphyrinironchloridecomplexes."molecules16(12):2960-2970.
tian,g.c.,etal.(2010)."applicationofionicliquidsinhydrometallurgyofnonferrousmetals."transactionsofnonferrousmetalssocietyofchina20(3):513-520.
wei,g.t.,yangz.,chenc.j.(2003)."roomtemperatureionicliquidasanovelmediumforliquid/liquidextractionofmetalions."analyticachimicaacta488(2):183-192.
wellens,s.,thijs,b.,binnemans,k.(2012)."anenvironmentallyfriendlierapproachtohydrometallurgy:highlyselectiveseparationofcobaltfromnickelbysolventextractionwithundilutedphosphoniumionicliquids."greenchem.,14,1657-1665.
wellens,s.,goovaerts,r.,
xie,z.l.andtauberta.(2011)."thermomorphicbehavioroftheionicliquids[c4mim][fecl4]and[c12mim][fecl4]."chemphyschem12(2):364-368.
yu,s.q.;wu,z.c.applicationoftheprincipleofhardandsoftacidsandbasestosalting-outeffectinsolventextraction.journalofnuclearandradiochemistry,1986,3,181-184.
zhao,r.andpanp.(2001)."aspectrophotometricstudyoffe(ii)-chloridecomple×esinaqueoussolutionsfrom10to100℃."canadianjournalofchemistry79(2):131-144.
zhao,h.(2014)."introductionofhighaluminacoalgangueresourcesandindrustrilizationofaluminaextractiontechnologiesinchina."conservationandutilizationofminingresources,1:54-58.
zhu,t.solventextractionandionexchange,firsted.,metallurgicalindustrypress,beijing,2005.
在整个说明书和随后的权利要求书中,除非上下文另有要求,否则术语“包括(comprise)”和“包含(include)”以及诸如“包括(comprising)”和“包含(including)”的变形将被理解为暗示包括所述的整数或整数组在内,但不排除任何其它整数或整数组。
在本说明书中对任何现有技术的引用不是并且不应当被认为是承认任何形式的暗示这样的现有技术形成公知常识的一部分。
- 还没有人留言评论。精彩留言会获得点赞!