金属氧化物的制备方法与流程
本发明涉及湿法冶金领域,具体而言,涉及一种金属氧化物的制备方法。
背景技术:
目前,工业生产上制备金属氧化物的常规方法为化学液相沉淀法,即以金属化合物溶液为原料,将其与沉淀剂溶液混合,形成不溶性的金属氢氧化物、碳酸盐或草酸盐等,经过高温分解或脱水得到相应金属氧化物。化学液相沉淀法常用的沉淀剂包括:铵类沉淀剂(主要包括碳酸铵、碳酸氢铵和氨水);碱金属氢氧化物、碳酸盐及碳酸氢盐沉淀剂(主要是指氢氧化钠、碳酸钠及碳酸氢钠等);草酸沉淀剂等,这三类沉淀剂在发生液相反应过程中,均属于液液反应,产品性能受反应过程中体系过饱和度的影响很大,容易发生局部过饱和度过高引起粉体粒度不均,产品性能难以满足应用要求。同时,此三类沉淀剂还存在氨氮、高钠盐、草酸废水问题,而碱金属氢氧化物、碳酸盐及碳酸氢盐沉淀剂则容易造成产品纯度低的问题。此外,沉淀后得到的金属碳酸盐和金属草酸盐需要焙烧获得稀土氧化物,将产生大量的副产物二氧化碳温室气体,目前,本行业对CO2温室气体的排放尚未提出有效的解决方案。
有中国专利申请公开了以无机金属盐作为原料,金属组分通过金属无机盐水溶液和有机胺反应,产生沉淀,又在沉淀过程中加入一种或多种有机化合物作为稳定剂制备纳米金属氧化物。该方法以有机胺为沉淀剂,并加入有机化合物作为稳定剂,会产生大量含氨及COD的废水,同时,难以避免液相反应过程中的非均相沉淀。
此外,还有中国专利文件报道,以稀土的硝酸或盐酸水溶液为原料,直接加入碳酸盐或通入二氧化碳进行沉淀;或者以硝酸或盐酸溶解稀土氧化物,稀土离子浓度控制在0.1~0.4mol/L,加入碳酸盐或二氧化碳进行沉淀。这两项专利申请均是以二氧化碳作为沉淀剂来制备稀土氧化物。但由于该制备方法所使用的反应原料为经硝酸或盐酸溶解制备的稀土硝酸盐或氯化物盐,该溶液体系酸度很高,在实际反应过程中,直接通入二氧化碳气体反应根本无法得到金属碳酸盐。
鉴于上述问题,亟待提出一种高品质金属氧化物的绿色制备方法,同时解决目前工业上广泛存在的含氨废水及CO2温室气体大量排放的问题。
技术实现要素:
本发明的主要目的在于提供一种金属氧化物的制备方法,以解决现有技术中的金属氧化物制备过程中存在的氨氮废水及温室气体排放等造成环境污染的问题,从而实现有色金属湿法冶金行业的绿色、低碳、循环发展。
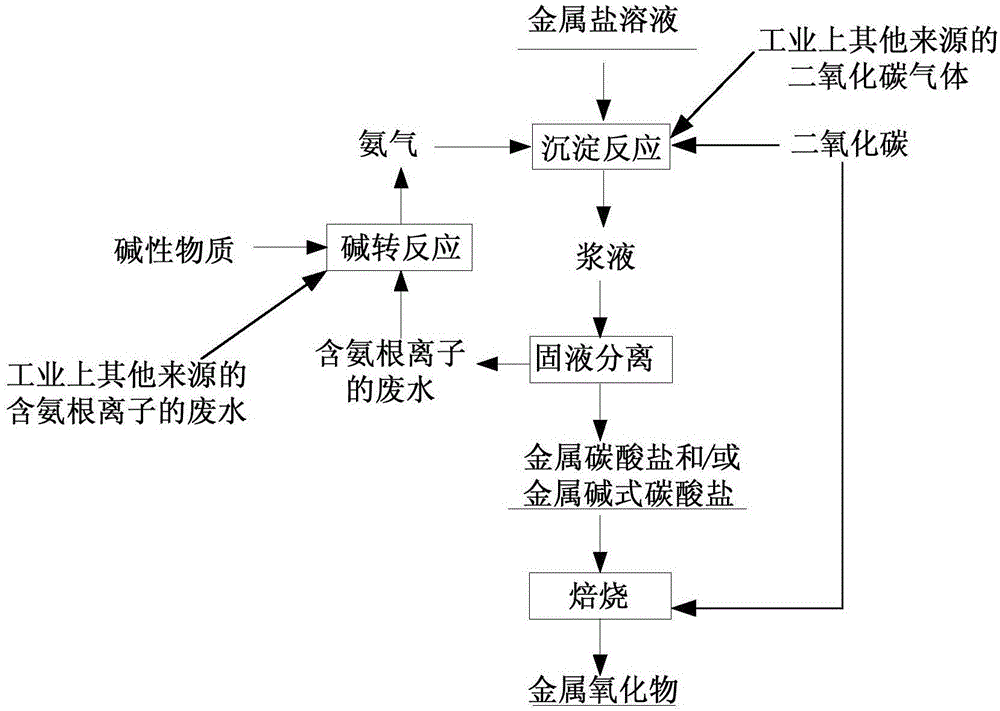
为了实现上述目的,根据本发明的一个方面,提供了一种金属氧化物的制备方法,该制备方法包括:步骤S1,利用氨气和二氧化碳气体对金属盐溶液进行沉淀反应,并控制三者的质量比使混合体系的pH值在2.0~10.0范围内,得到浆液;步骤S2,对浆液进行固液分离,得到含铵根离子的废液以及金属碳酸盐和/或金属碱式碳酸盐;以及步骤S3,对金属碳酸盐和/或金属碱式碳酸盐进行焙烧,得到金属氧化物和含二氧化碳气体的废气;其中,氨气由含铵根离子的废水经碱性物质调节pH后汽提富集得到。
进一步地,金属盐溶液为单一金属盐溶液或多种金属盐溶液的混合溶液。
进一步地,步骤S1中,氨气与二氧化碳气体的质量比为1.2:1~1:4。
进一步地,氨气通过如下步骤得到:向含铵根离子的废水中加入碱性物质调节pH至3.0~6.0,得到固液混合物;对固液混合物进行固液分离,得到滤液;向滤液中继续加入碱性物质,得到氨水;对氨水进行汽提富集,得到氨气。
进一步地,步骤S1中,控制混合体系在压强为0.1~0.95MPa,温度为10~95℃的条件下持续0.5~4小时。
进一步地,步骤S1中,金属盐溶液包括碱金属盐溶液、碱土金属盐溶液、过渡金属盐溶液、镓盐溶液、锗盐溶液、锡盐溶液以及锑盐溶液中的任一种。
进一步地,碱金属盐溶液包括钠盐溶液;碱土金属溶液包括钙盐溶液或镁盐溶液;过渡金属盐溶液包括稀土盐溶液、锆盐溶液、铪盐溶液、钴盐溶液、镍盐溶液、铜盐溶液以及锌盐溶液中的任一种。
进一步地,金属盐溶液为氯化物溶液、硝酸盐溶液、硫酸盐溶液、醋酸盐溶液以及高氯酸盐溶液中任意一种或多种。
进一步地,二氧化碳气体为工业级二氧化碳气体或者由含二氧化碳气体的废气回收得到,含二氧化碳气体的废气为步骤S3中得到的二氧化碳气体和/或金属碳酸盐沉淀气体、金属碳酸盐焙烧窑气、草酸盐焙烧窑气以及锅炉烟气中的一种或几种。
进一步地,含铵根离子废水为工业生产过程中产生的废水,工业生产过程产生的废水包括金属萃取分离过程产生的废水和/或金属沉淀过程产生的废水;其中,金属沉淀过程产生的废水包括步骤S2中得到的含铵根离子的废液。
进一步地,碱性物质为氢氧化钙、氧化钙、氧化镁、氢氧化镁、轻烧白云石、氢氧化钠以及氢氧化钾中的一种或几种,优选碱性物质为氧化钙或氢氧化钠。
进一步地,步骤S3包括:将金属碳酸盐和/或金属碱式碳酸盐置于400℃~1100℃的高温下焙烧0.5~12小时,得到金属氧化物和含二氧化碳气体的废气。
应用本发明的技术方案,通过将金属盐溶液与氨气及CO2气体混合,通过气液反应制备金属氧化物,通过调节金属盐溶液与氨气及CO2气体的质量比,使得反应体系的pH可控,进 而能够得到组成、结构、形貌的金属碳酸盐或碱式碳酸盐,经焙烧得到不同晶型、粒度和形貌的金属氧化物产品。在本发明的制备方法中,氨气由废水回收处理得到,二氧化碳气体同样由废气回收得到或者为工业级二氧化碳,而且,废水和废气可以为上述制备步骤所产生,也可以为工业生产中的其他工艺步骤所产生。因而,本发明的制备方法具有整个制备过程流程短、铵封闭循环,原料成本低、低碳环保且产品性能可控的优势。
附图说明
构成本申请的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1示出了根据本发明的一种优选实施例中金属氧化物的制备方法流程示意图;
图2示出了根据本发明的另一种优选实施例中金属氧化物的制备方法流程示意图;
图3示出了实施例3中氧化铈粉体SEM图;
图4示出了实施例4中碳酸铈粉体SEM图;
图5示出了实施例4中氧化铈粉体SEM图;以及
图6示出了实施例7中氧化锆粉体SEM图。
具体实施方式
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
针对现有技术中金属氧化物制备过程中存在的氨氮废水及温室气体排放等造成环境污染的问题,在本发明一种典型的实施方式中,提供了一种金属氧化物的制备方法,如图1所示,该制备方法包括:步骤S1,利用氨气和二氧化碳气体对金属盐溶液进行沉淀反应,并控制三者的质量比使混合体系的pH值在2.0~10.0范围内,得到浆液;步骤S2,对浆液进行固液分离,得到含铵根离子的废液以及金属碳酸盐和/或金属碱式碳酸盐;以及步骤S3,对金属碳酸盐和/或金属碱式碳酸盐进行焙烧,得到金属氧化物和含二氧化碳气体的废气;其中,氨气由含铵根离子的废水经碱性物质调节pH后汽提富集得到。
本发明的上述金属氧化物的制备方法,通过将金属盐溶液与氨气及CO2气体混合,通过气液反应制备金属氧化物,通过调节金属盐溶液、氨气、CO2气体的质量比,使得反应体系的pH可控,进而能够得到不同物性的金属碳酸盐或碱式碳酸盐,经焙烧得到不同晶型、粒度和形貌的金属氧化物产品。在该制备方法中,氨气由废水回收处理得到,二氧化碳气体同样可以由废气回收得到或者为工业级二氧化碳,而且,废水和废气可以为上述制备步骤所产生,也可以为工业生产中的其他工艺步骤所产生。因而,本发明的制备方法具有整个制备过程流程短、铵封闭循环,原料成本低、低碳环保且产品性能可控的优势。
在本发明的上述步骤S1中,氨气和二氧化碳的作用如下:①调节碳化体系pH值;②作为合成金属碳酸盐和/或金属碱式碳酸盐的原料;③通过调节氨气和二氧化碳气体的相对用量、通入方式可对制备的金属氧化物晶型、形貌、粒度、孔结构进行调整。在实际制备过程中,可加入晶型调节剂控制各晶面的生长速率从而控制所形成的金属氧化物晶型,具体的晶型调节剂包括但不仅限于晶型金属碳酸盐、聚丙烯酸、焦磷酸钠、EDTA、EDTA的碱金属盐类、三乙醇胺以及无机酸中的一种或多种,加入量的控制,通常不超过所得金属氧化物重量的5%。此外,在碳化反应结束后,可加入分散剂调节粒子表面电荷,以得到分散性好的金属碳酸盐和/或金属碱式碳酸盐,从而进一步有利于获得不同物性的金属氧化物。常用的分散剂的种类包括聚羧酸钠盐、聚丙烯酸钠盐、分子量为600-10000的聚乙二醇、十二烷基磺酸钠中的一种或其混合物;分散剂的加入方式可直接在碳化反应后加入到整个反应体系、过滤后加入到金属碳酸盐和/或金属碱式碳酸盐湿饼中;分散剂的加入量通常不超过所得金属氧化物重量的5%。
上述两种气体的加入方式可以根据所欲制备的产品种类或结构的不同,选择加入金属盐溶液中或者底液中,或以其他原料同时并流加入。
上述步骤S1发生的化学反应式如下:
Mz++zNH3+z/2CO2+z/2H2O→M(CO3)z/2+zNH4+;或者为
2Mz++2zNH3+z/2CO2+3z/2H2O→M2(OH)z(CO3)z/2+2zNH4+;
其中,Mz+为金属阳离子。
上述步骤S3发生的化学反应式如下:
或者为
上述制备方法中对于含铵根离子的废水的回收处理步骤,通过加入碱性物质调节pH,经过反应热或外热,可汽提富集回收氨气。具体反应方程式如下:
xNH4++A(OH)x→xNH4OH+Ax+;或,2xNH4++A2Ox+x H2O→2xNH4OH+2Ax+;
其中,A(OH)x/A2O x为碱性物质,利用反应热和/或加热方式,使氢氧化铵溶液逸出氨气;
NH4OH→NH3↑+H2O。
上述步骤在回收氨气的同时会产生含盐浆液,此浆液可经固液分离后,分别对滤液和固体渣进行回收利用。
当处理不同浓度含铵离子废水时,回收的氨气浓度存在差异,当氨气浓度≥50%时均可用于碳化反应;同样,针对不同来源的二氧化碳气体,回收的浓度存在差异,当二氧化碳气体 浓度≥50%时均可用于碳化反应。此外,如图2所示,二氧化碳气体除了可以利用步骤S3产生的含二氧化碳的废气外,还可以利用其他金属碳酸盐沉淀气体、金属碳酸盐焙烧窑气、草酸盐焙烧窑气以及锅炉烟气中的一种或几种;还可以为直接购买来的工业级二氧化碳气体。工业级二氧化碳气体是指市售二氧化碳气体,其纯度大于99.8%,制备方法可以为高温加热石灰石分解得到二氧化碳气体,方程式为
上述由含铵根离子的废水回收氨气的步骤包括:向含铵根离子的废水中加入碱性物质调节pH值至3.0~6.0,得到氢氧化铵溶液;氢氧化铵溶液由反应热和/或外加热进行汽提富集,得到氨气。为防止含铵根离子的废水中还含有Fe、Al、Zn以及Cu等重金属杂离子,先将pH值控制在3.0~6.0范围内,能够将这些杂离子形成沉淀而除去;然后接着加碱性物质,使得相对纯净的废水中的铵根离子转化为氢氧化铵溶液,在碱性物质加入废水中所产生的反应热和/或者外加热的汽提富集作用下,得到氨气。
在本发明的上述制备方法中,金属盐溶液可以适用于单一金属盐溶液,也可以适用于多种金属盐溶液的混合溶液。
上述步骤S1中金属盐溶液、氨气、二氧化碳气体的混合方式可以为:①将氨气、二氧化碳气体通入金属盐溶液中;②三者以三股并流的方式加入到底液中;③采用塔式反应釜,金属盐溶液与氨气、二氧化碳气体从不同位置进料,气液两相以逆流方式进行混合。不论以哪种混合方式,气体流量及金属盐溶液的流量均是可调节的。若采取第二种方式,可以先控制将氨气和二氧化碳气体通入底液中合成复合沉淀剂,控制氨气和二氧化碳的不同流量,所合成的复合沉淀剂配比不同,则制备的沉淀颗粒组成及结构均有差异。
上述步骤S1的混合过程可以根据所欲制备的产品的种类和结构的不同而选择适当的混合方式,在本发明一种优选的实施例中,优选控制氨气与二氧化碳气体的质量比为1.2:1~1:4。
当对氨气和二氧化碳进行混合时,可以采用质量流量计通过控制氨气和二氧化碳气体的质量比来调控所制备的产物的形态结构。调节氨气与二氧化碳气体的相对质量,一方面有助于调控反应过程中的pH值,从而影响沉淀颗粒的组成、粒度及表面带电状态;另一方面可生成不同结构、组成的碳酸盐或碱式碳酸盐,从而调控氧化物的晶型、形貌;再一方面可生成核壳或多层结构组成的前驱体,经过高温分解可制备特殊孔道结构的氧化物粉体材料。所欲制备的金属碳酸盐和/或金属碱式碳酸盐产物的不同,氨气和二氧化碳气体质量比不同。而且对于某些金属离子,尤其是过渡金属离子,其金属碱式碳酸盐种类较多,如碱式碳酸锆可存在以下多种形式:Zr2(OH)2CO2·nH2O、ZrO2CO2·nH2O、Zr(OH)2CO2·nH2O以及ZrOCO3·nH2O。在连续混合过程中,控制氨气与二氧化碳气体的质量比为1.2:1~1:4能够满足制备大多数金属盐溶液对应的多种金属碳酸盐和/或金属碱式碳酸盐。对氨气和二氧化碳气体进行混合之前,还可以先通入其中一种气体,调整体系pH至金属碳酸盐和/或金属碱式碳酸盐沉淀所需pH。
上述金属盐溶液、氨气、二氧化碳气体的混合过程可以为连续混合,也可为间歇性混合。将金属盐溶液、氨气、二氧化碳气体进行间歇性混合,间歇性地混合为将氨气和二氧化碳气 体同时间歇性地通入混合体系中进行混合,或者,间歇性地混合为将氨气与二氧化碳气体相互交替性地通入混合体系中进行混合。
当将氨气和二氧化碳气体同时间歇性地通入混合体系中进行混合时;由于上述金属氧化物的制备方法属于气液两相反应,反应过程产生的沉淀离子存在于气相中,其扩散需要时间;同时,间歇性通入还能使先生成的沉淀颗粒有足够时间形核并长大到一定程度,起到晶种作用,诱导结晶,减少后续沉淀所需的形核能,继续通入气体时,沉淀可在先生成的晶粒表面发生,从而提高沉淀颗粒的结晶度。
由于在实际应用过程中,尤其是催化应用领域,往往对金属氧化物的孔结构、多层结构方面有特殊要求,但目前,这两种结构的金属氧化物的制备多采用模板法,生产成本高,对设备要求高、还会产生大量高COD废水。而通过将氨气与二氧化碳气体相互交替性地通入混合体系,可制备具有多孔结构或多层结构的金属氧化物。氨气与二氧化碳气体相互交替性地通入,通过控制间隔时间,使沉淀颗粒具有金属氢氧化物、金属碳酸盐和/或金属碱式碳酸盐的多层结构。进而在焙烧过程,根据金属氢氧化物、金属碳酸盐和/或金属碱式碳酸盐分解温度的差异性,以及金属碳酸盐和/或金属碱式碳酸盐分解释放的CO2气体起到的造孔作用,使金属氧化物具有多孔结构和/或多层结构。对于混合金属盐溶液体系,根据不同金属离子沉淀所需pH的差异,交替性地通入氨气与二氧化碳气体,也可制备得到具有多孔结构和/或多层结构的复合金属氧化物。
在本发明的上述制备方法中,步骤S1中对反应体系中的压强并无特殊要求,只要能够使金属盐溶液碳化形成金属碳酸盐和/或金属碱式碳酸盐即可。由于增大反应系统压强,有利于缩短碳化反应时间。同时,对于浓度较低的氨气或二氧化碳气体,可通过增大反应系统压强,促使反应快速进行。因而,为了进一步加快反应速度或者缩短碳化时间,在本发明又一优选的实施例中,上述步骤S1中,控制混合体系在压强为0.1~0.95MPa、温度为10~95℃的条件下持续0.5~4小时。反应温度对制备的沉淀颗粒的大小、表面带电状态有影响,可根据所需制备的金属氧化物性质来确定碳化反应温度。低温有利于生成小粒度沉淀颗粒,高温促进离子扩散,生成的沉淀颗粒粒度大,粒度分布均匀,并具有良好的固液分离效果。在上述温度范围内能够满足多种金属碳酸盐形成各种不同粒度的多样化需求。而反应时间受反应规模、氨气及二氧化碳气体流量、压强等因素影响较大。反应规模大、气体流量小、压强小,则反应时间长;反应规模小、气体流量大、压强大,则反应时间短;可根据反应规模确定气体流量及压强,使反应时间控制在0.5~4小时,既保证碳化反应充分进行,同时,不会因反应时间太长造成气体原料及能量浪费。
本发明的上述制备方法所适用的金属盐溶液包括但不限于碱金属盐溶液、碱土金属盐溶液、过渡金属盐溶液、镓盐溶液、锗盐溶液、锡盐溶液以及锑盐溶液中的任一种。更优选地,碱金属盐溶液包括钠盐溶液;碱土金属溶液包括钙盐溶液或镁盐溶液;过渡金属盐溶液包括稀土盐溶液、锆盐溶液、铪盐溶液、钴盐溶液、镍盐溶液、铜盐溶液以及锌盐溶液中的任一种。这些不同金属的盐溶液在工业上应用范围广,应用价值高,利用本发明的制备方法,能 够低成本地制备得到纯度高、粒度和形貌可控、分散性好、物理性能优越的金属氧化物,且制备过程流程短、铵封闭循环,原料成本低、低碳环保。
上述金属种类的盐溶液中,盐溶液的具体种类为氯化物溶液、硝酸盐溶液、硫酸盐溶液、醋酸盐溶液以及高氯酸盐溶液中任意一种或多种。
在本发明的上述制备方法中,步骤S1中所述二氧化碳气体为工业级二氧化碳气体或者由含二氧化碳气体的废气回收得到,所述含二氧化碳气体的废气为步骤S3中得到的二氧化碳气体和/或金属碳酸盐沉淀气体、金属碳酸盐焙烧窑气、草酸盐焙烧窑气以及锅炉烟气中的一种或几种。
本发明中所用的二氧化碳气体可以为从上述几种工艺过程中产生的气体为原料,通过压缩、净化或其他处理步骤后得到二氧化碳气体,既对上述工艺气进行了合理利用,低碳减排,符合环保要求;而且又实现了二氧化碳气体的有效应用。从原料成本、能耗的有效循环利用角度,使得本发明的上述工艺成为企业真正适用的高效且低能耗的金属氧化物制备工艺。
同理,上述制备方法中所需氨气由含铵根离子的废水经碱性物质回收处理得到,而含铵根离子的废水来源可以是多种,可以是上述步骤S1中产生的含铵根离子的废水,也可以是其它工业过程中产生(包括金属萃取分离过程和/或碳酸盐沉淀过程)的含铵根离子的废水,对废水中杂质离子种类、含量没有限定要求,均可利用上述回收处理步骤进行处理并回收氨气实现氨的循环利用。同时利用碱性物质调节pH,通过反应热和/或外部加热提取氨气,带有热量的氨气用于碳化反应时,能减少碳化反应过程中的能量供应,实现了整个循环步骤中的能量的有效利用,是一种低能耗、高效的金属氧化物制备工艺,适合企业大规模应用。
在上述含铵根离子的废水回收处理步骤中,用于对废水进行pH值调节的碱性物质的主要作用是调节含铵根离子废水体系的pH,使其生成氢氧化铵,通过反应热和/或外部加热,使氢氧化铵溶液中逸出氨气。任何能够实现上述目的的碱性物质均适用于本发明。从能量的合理利用及成本角度考虑,上述碱性物质可以是氢氧化钙、氧化钙、氧化镁、氢氧化镁、轻烧白云石、氢氧化钠、氢氧化钾中的一种或几种。优选地,碱性物质为氧化钙、氢氧化钠中的任一种。
向含铵根离子废水中加入碱性物质,具有以下优点:第一,会释放反应热,这有助于氨气的逸出,可减少能源消耗。同时考虑到生产成本问题,碱性物质优选氧化钙或氢氧化钠,这两种碱性物质成本低,且同时会放出大量反应热。第二,含铵根离子的废水中可能含有杂质金属离子如Fe、Al、Zn以及Cu等重金属杂离子,通过加入碱性物质调节体系pH值,可将上述杂质离子转化为沉淀,并通过固液分离去除;第三,通过上述方法制备的氨气,较市售氨水和碳酸氢铵等沉淀剂纯度高,将其直接用于碳化反应,可得到高纯金属氧化物产品;第四,通过反应热和/或外部加热的方式使氨气逸出,氨气自身带有一定温度,从而可降低碳化反应过程中的能源消耗。
在本发明的上述步骤S3中,针对不同的金属碳酸盐和/或金属碱式碳酸盐,其焙烧分解为氧化物的温度也不同;同时,根据所欲制备的金属氧化物的性质要求的不同,在保证充分分 解为氧化物的条件下,可通过调节其焙烧温度、气氛(空气气氛、氧气气氛、还原气氛、惰性气氛等)及焙烧时间(0.5~12小时)来实现。如对金属氧化物的焙烧逐减率有要求,可通过提高焙烧温度、延长焙烧时间使充分分解为金属氧化物,但焙烧温度太高、焙烧时间太长会提高能耗,从而增加生产成本。对于可变价的金属元素,可以调节其焙烧气氛,如空气气氛、氧气气氛、还原气氛。在空气气氛中,由于有氧气的存在,会将金属氧化,生成高价金属氧化物。
在本发明另一种优选的实施例中,上述步骤S3包括:将金属碳酸盐和/或金属碱式碳酸盐置于450℃~1100℃的高温下焙烧0.5~12小时,得到金属氧化物和二氧化碳气体。将焙烧的温度和时间控制在上述范围内,能够实现使几乎所有的金属碳酸盐和/或金属碱式碳酸盐完全分解为金属氧化物。此外,焙烧过程中产生的二氧化碳气体,可通过回收、净化返回用于碳化反应,不仅减少了温室气体排放,符合环保要求;而且实现了二氧化碳气体的有效应用。从原料成本、能源消耗、化工原料循环利用角度讲,均具有明显优势,使得本发明的上述工艺成为企业真正适用的高效且低能耗的金属氧化物制备工艺。
下面将结合具体的实施例进一步说明本发明的有益效果。
下列实施例中所用到的检测方法如下:
采用电感耦合等离子体质谱仪、电感耦合等离子体发射光谱仪及北京普析通用仪器有限责任公司F型原子吸收分光光度计对产物的常量和痕量元素进行测量;
产品粒度采用珠海欧美克仪器有限公司TopSizer欧美克激光粒度分析仪进行检测;
产品表面形貌采用日本日立公司TM3000扫描电镜进行测量。
产品比表面及孔径、孔容数据采用美国康塔公司Quadrasorb SI-KR/4MP自动比表面及孔径分布测试仪进行测量。
实施例1
配制浓度为1.2mol/L的氯化铈溶液(绝对纯度为99.5%)加入到沉淀反应器中,向沉淀反应器中通入氨气至体系pH达到6~7,然后按氨气和二氧化碳气体质量比为1:1.3速度向沉淀反应器中通入氨气和工业级二氧化碳气体(浓度为99.8%)进行碳化反应;碳化反应过程中反应系统为敞口常压,无需外部加热,但由于参与反应的氨气带有一定热量,所以反应体系温度为45℃左右,碳化反应持续2.5h结束后得到碳酸铈浆料,进行过滤、洗涤和甩干得到碳酸铈,同时过滤后回收过滤废液,即为氯化铵废水;将甩干的碳酸铈于700℃焙烧2小时,得到氧化铈粉体,同时焙烧过程中回收焙烧产生的二氧化碳气体。经测试该氧化铈粉体纯度为99.8%。
向上述回收的氯化铵的废水中加入适量的氧化钙。反应过程中控制反应温度在88~94℃之间,氨气持续逸出并收集,此氨气浓度为98%,将该氨气循环返回用于氯化铈溶液沉淀。
实施例2
配制浓度为0.5mol/L的氯化铈溶液加入到沉淀反应器中,向沉淀反应器中通入氨气至体系pH达到6~7,然后按氨气和二氧化碳气体质量比为1.2:1速度向沉淀反应器中通入氨气和工业级二氧化碳气体(二氧化碳浓度为99.8%)进行碳化反应;碳化反应过程中反应系统为敞口常压,无需外部加热,但由于参与反应的氨气带有一定热量,所以反应体系温度为65℃左右,碳化反应持续3h结束后得到碱式碳酸铈浆料,进行过滤、洗涤和甩干得到碱式碳酸铈,同时过滤后回收过滤废液,即为氯化铵废水;将甩干的碳酸铈于700℃焙烧2小时,得到氧化铈粉体,同时焙烧过程中回收焙烧产生的二氧化碳气体。经测试该氧化铈粉体粒度为3.365μm,粒度分布(D90-D10)/(2D50)为0.98。
向上述含氯化铵的废水中加入适量的氧化钙。反应过程中控制反应温度在68~72℃之间,氨气持续逸出并收集,此氨气浓度为90%,将该氨气循环返回用于氯化铈溶液沉淀。
实施例3
配制浓度为0.5mol/L的氯化铈溶液(绝对纯度为99.5%)加入到沉淀反应器中,向沉淀反应器中通入氨气至体系pH达到4.5~5.5,然后按氨气和二氧化碳气体质量比为1:2.5速度向沉淀反应器中通入氨气和工业级二氧化碳气体(二氧化碳浓度为99.8%)进行碳化反应;碳化反应过程中反应系统为敞口常压,加热使反应体系温度维持在95℃左右,碳化反应持续2h结束后得到碳酸铈浆料,进行过滤、洗涤和甩干得到碳酸铈,同时过滤后回收过滤废液,即为氯化铵废水;将甩干的碳酸铈于700℃焙烧2小时,得到氧化铈粉体,同时焙烧过程中回收焙烧产生的二氧化碳气体。经SEM观察,如图3所示,该氧化铈粉体一次粒径为100-120nm,一次颗粒之间以及一次颗粒团聚而成的二次颗粒之间存在大量孔道结构,经测试,其孔容可达0.38cc/g,平均孔径为17.89nm,绝对纯度为99.9%。
向上述含氯化铵的废水中加入适量氧化钙,反应过程中控制反应温度在65~75℃之间,氨气持续逸出并收集,将该氨气循环返回用于氯化铈溶液沉淀。
实施例4
取适量去离子水加入到沉淀反应器中,向沉淀反应器中通入氨气至体系pH达到6~7,然后分别向沉淀体系中加入氯化铈溶液(浓度为1mol/L)、氨气、二氧化碳气体,其中,氨气和二氧化碳气体质量比为1.1:1。碳化反应过程中反应系统为敞口常压,无需外部加热,但由于参与反应的氨气带有一定热量,所以反应体系温度为45℃左右,碳化反应持续4h结束后得到碳酸铈浆料,进行过滤、洗涤和甩干得到碳酸铈,同时回收过滤废液,即为氯化铵废水;将此碳酸铈于700℃焙烧2小时,得到氧化铈粉体。通过对合成的碳酸铈粉体形貌进行观察,如图4所示,呈现簇拥的短棒状,长度为600~800nm,直接约为300nm左右。如图5所示,焙烧后的氧化铈粉体呈较分散的短棒状。
向含氯化铵的废水中加入适量的氧化钙,反应过程中控制反应温度在88~94℃之间,氨气持续逸出并收集,将该氨气循环返回用于氯化铈溶液沉淀。
实施例5
配制浓度为1.5mol/L的氯化铜溶液加入到沉淀反应釜中,向沉淀反应釜中通入氨气至体系pH达到9~10,然后按氨气和二氧化碳气体质量比为1.2:1速度向沉淀反应器中通入氨气和二氧化碳气体进行碳化反应;碳化反应过程中反应系统为常压,反应体系温度为25℃左右,碳化反应持续3h结束后得到碱式碳酸铜浆料,进行过滤、洗涤和甩干得到碱式碳酸铜,同时过滤后回收过滤废液,即为氯化铵废水;将甩干的碱式碳酸铜于400℃焙烧5小时,得到氧化铜粉体,同时焙烧过程中回收焙烧产生的二氧化碳气体,将其回用于氯化铜溶液沉淀。
经测试该氧化铜粉体粒度为1.782μm,粒度分布(D90-D10)/(2D50)为0.73,颗粒均匀,粒度分布较窄。SEM微观形貌为类球形。该氧化铜粉体可用于玻璃、瓷器的着色剂,以及有机合成催化剂。
向上述过程得到的含氯化铵的废水中加入适量氢氧化钠,反应过程中控制反应温度在68~72℃之间,氨气持续逸出并收集,将该氨气循环返回用于氯化铜溶液沉淀。
实施例6
配制浓度为2.0mol/L的硝酸锌加入到沉淀反应釜中,向沉淀反应釜中通入氨气至体系pH达到6.0~6.5,然后按氨气和二氧化碳气体质量比为1:1速度向沉淀反应器中通入氨气和二氧化碳气体进行碳化反应;碳化反应过程中反应系统为敞口常压,反应体系温度为10℃左右,碳化反应持续2.5h结束后得到碱式碳酸锌浆料,进行过滤、洗涤和甩干得到碱式碳酸锌,同时过滤后回收过滤废液,即为硝酸铵废水;将甩干的碱式碳酸锌于400℃焙烧5小时,得到氧化锌粉体,同时焙烧过程中回收焙烧产生的二氧化碳气体,将其回用于硝酸锌溶液的沉淀。
经测试该氧化锌粉体粒度为0.982μm,粒度分布(D90-D10)/(2D50)为0.57,可用于天然橡胶、合成橡胶及胶乳的硫化活性剂和补强剂以及着色剂。
用氧化钙调节上述含硝酸铵废水的pH值,当pH=6.0时进行固液分离,除去废液中的Fe、Al、重金属离子等元素,杂质离子去除率约为99.9%。继续向含硝酸铵的废水中加入适量氧化钙,反应过程中控制反应温度在65~75℃之间,氨气持续逸出并收集,此氨气浓度为99%,将该氨气循环返回用于硝酸锌溶液的沉淀。
实施例7
配制浓度为1.5mol/L的氧氯化锆溶液加入到沉淀反应釜中,调节沉淀反应釜中体系pH达到2.0~3.0,然后按氨气和二氧化碳气体质量比为1:4速度向沉淀反应器中通入氨气和二氧化碳气体进行碳化反应;碳化反应过程中反应系统为敞口常压,反应体系温度为65℃左右,碳化反应持续4h结束后得到碱式碳酸锆浆料,进行过滤、洗涤和甩干得到碱式碳酸锆,同时过滤后回收过滤废液,即为氯化铵废水;将甩干的碱式碳酸锆于1000℃焙烧4小时,得到氧化锆粉体,同时焙烧过程中回收焙烧产生的二氧化碳气体,将其回用于氧氯化锆溶液的沉淀。
经测试该该碳化反应收率为99.85%,制备的氧化锆粉体呈立方相,一次粒径为100~150nm,颗粒分散性好,如图6所示,SEM微观形貌为类球形,该粉体可作为锆陶瓷的原料。
向上述过程产生的含氯化铵的废水中加入适量氢氧化钠,反应过程中控制反应温度在90~95℃之间,氨气持续逸出并收集,此氨气浓度为95%,将该氨气循环返回用于氧氯化锆溶液的沉淀。
实施例8
配制浓度为0.1mol/L的醋酸铈溶液加入到沉淀反应器中,调节沉淀反应器中体系pH达到5.5~6,然后按氨气和二氧化碳气体质量比为1:2速度向沉淀反应器中通入氨气和工业级二氧化碳气体(浓度为99.8%)进行碳化反应;碳化反应过程中反应系统的压强控制为0.5MPa,通过外部加热使反应体系温度为70℃左右,碳化反应持续1h结束后得到碳酸铈浆料,进行过滤、洗涤和甩干得到碳酸铈,同时过滤后回收过滤废液,即为含铵根离子的废水,继续采用上述步骤回收氨气;将甩干的碳酸铈于1000℃焙烧3小时,得到氧化铈粉体,同时焙烧过程中回收焙烧产生的二氧化碳气体。
经测试该氧化铈粉体粒度为3.721μm,粒度分布(D90-D10)/(2D50)为0.83,SEM观察其形貌属于花瓣状(未示出)。
用氧化钙调节上述沉淀过程产生的含铵根离子废水的pH值,当pH=4.0时进行固液分离,除去废液中的Fe、Al、重金属离子等元素,杂质离子去除率约为98.5%。继续向含铵根离子的废水中加入适量氧化钙,通入氨气蒸发浓缩塔中,保证塔顶温度为86~93℃,氨气持续逸出,将该氨气循环返回用于醋酸铈溶液的沉淀。
实施例9
配制浓度为1.5mol/L的铈锆混合氯化盐溶液加入到沉淀反应釜中,向沉淀反应釜中通入氨气至体系pH达到7~8,然后按氨气和二氧化碳气体质量比为1.1:1速度向沉淀反应器中通入氨气和二氧化碳气体进行碳化反应;碳化反应过程中反应系统的压强控制为0.95MPa,通过外部加热使反应体系温度为50℃左右,碳化反应持续0.5h结束后得到碳酸铈浆料,进行过滤、洗涤和甩干得到铈锆复合氧化物前驱体,同时过滤后回收过滤废液,即为氯化铵废水,继续采用上述步骤回收氨气;将甩干的铈锆复合氧化物前驱体于700℃焙烧3小时,得到铈锆复合氧化物粉体,同时焙烧过程中回收焙烧产生的二氧化碳气体,将其回用于铈锆混合氯化盐溶液的沉淀。
经测试碳化反应收率为99.91%,制备的铈锆复合氧化物粉体比表面达137m2/g,粒度为2.659μm,粒度分布(D90-D10)/(2D50)为0.76,SEM微观形貌为类球形(未示出),满足汽车尾气催化助剂的应用要求。
向上述含氯化铵的废水中加入适量氧化钙,通入氨气蒸发浓缩塔中,保证塔顶温度为86~93℃,氨气持续逸出,将该氨气循环返回用于铈锆混合氯化盐溶液的沉淀。
实施例10
配制浓度为1.2mol/L的氯化铈溶液(绝对纯度为99%),从塔式反应釜的上进口开始加料,同时从塔式反应釜的下进口通入氨气和二氧化碳气体,使三者以逆流的方式进行碳化反应。其中,氨气和二氧化碳气体质量比为1:1.3。碳化反应过程中反应系统压强为0.3MPa,反应体系温度为18℃,碳化反应持续4h结束后得到碳酸铈浆料,进行过滤、洗涤和甩干得到碳酸铈,同时过滤后回收过滤废液,即为氯化铵废水;将甩干的碳酸铈于隧道窑中1100℃焙烧12小时,得到氧化铈粉体,同时焙烧过程中回收焙烧产生的二氧化碳气体,将其回用于氯化铈溶液的沉淀。经测试该氧化铈粉体纯度为99.2%,碳化反应收率为99.8%。
向上述含氯化铵的废水中加入氧化钙,加入适量的氧化钙,反应过程中控制反应温度在88~94℃之间,氨气持续逸出并收集,此氨气浓度为90%,将此氨气回用于氯化铈溶液的沉淀。
对比例1
配制浓度为1.2mol/L的氯化铈溶液(绝对纯度为99.5%)加入到沉淀反应器中,调节沉淀反应器中体系pH达到6~7,然后向其中加入碳酸氢铵进行沉淀反应;沉淀反应过程中反应系统为敞口常压,反应体系温度为45℃左右,沉淀反应持续2.5h结束后得到碳酸铈浆料,进行过滤、洗涤和甩干得到碳酸铈,将甩干的碳酸铈于700℃焙烧2小时,得到氧化铈粉体。经测试该氧化铈粉体纯度为99.1%,粉体中杂质Fe含量增大,与原料中Fe含量相比增加了237ppm。
从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:
(1)采用本发明制备的金属氧化物的纯度高、粒度和形貌可控、分散性好、物理性能优越,可以满足高新材料对金属氧化物日益提高的特殊物性需求。如锆基陶瓷材料对氧化锆粉体具备大的一次粒径、铈锆助催化材料对铈锆复合氧化物高比表面,多孔道的要求。
(2)金属氧化物制备过程中的二氧化碳气体可以循环使用,实现了温室气体再利用,达到了低碳减排的效果。
(3)将行业普遍存在的含氨废水循环应用于碳化沉淀过程,有效减少氨氮排放,为行业绿色循环发展提供思路。
(4)本发明具有工艺简单,化工原料封闭循环利用,生产成本低等特点,适合于工业化规模生产。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种铁锰复合氧化物除砷材料及其制备和应用方法
- 一种铁铜双金属氧化物的制备装置的制造方法
- 含钾的钛基氧化物K<sub>2</sub>Ti<sub>8</sub>O<sub>17</sub>的制备方法及其产品和应用
- 具有含氮的氧化物薄膜的场效应晶体管器件及其制备方法
- 一种提升金属氧化物纳米材料气敏性能的制备方法
- 一种镁合金表面双羟基金属氧化物封闭膜层的制备方法
- 一种硫氧化物绿色荧光粉及其制备方法
- 钴氧化物、锂钴氧化物、制备它们的方法、和锂二次电池的制作方法
- 一种纳米氧化物Ti<sub>2</sub>Nb<sub>10</sub>O<sub>29</sub>的制备方法
- 一种去除水溶液中环丙沙星CMC稳定化的Fe?Mn氧化物复合材料及其制备方法