氧化*酚的方法与流程
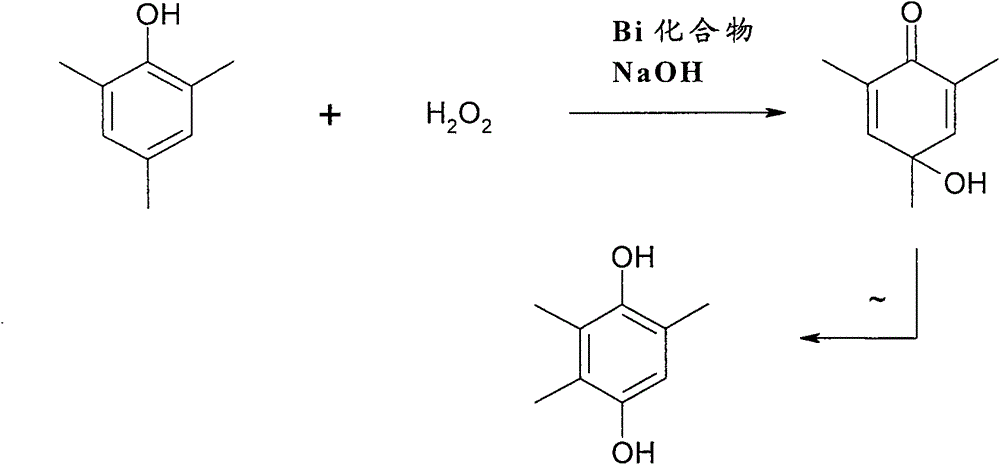
氧化*酚的方法本发明涉及一种根据权利要求1前序部分的用单线态氧来氧化酚的方法,一种如权利要求19的由其制备的产品以及如权利要求21和22的所述产品的用途。在近代,单线态氧1O2本身称之为各种双键体系的氧化剂。其通常通过光化学途径,由染料分子如曙红或亚甲蓝,被电磁辐射激发在恢复基态时向氧释放其激发能,并由此使其由三线态转化为单线态而获得。然而,产生单线态氧的该方法要求使用强光,由此昂贵且非常不适合用于大型化工厂。J.-M.Aubry,TetrahedronLetters43(2002)8731-8734进行产生单线态氧的另一方式,其中其借助钼化合物由碱性H2O2溶液释放单线态氧。然而,该程序存在许多缺点。例如,在存在过大量H2O2下,四过氧钼酸根阴离子由用作催化剂的钼化合物形成,并且不能由H2O2释放单线态氧1O2。而这要求氧代三过氧钼酸盐,但其仅存在于其中H2O2以低浓度存在的溶液中。然而,该低浓度仅在如下情况下实现:在反应期间仅添加同样多H2O2,通过释放单线态氧而再分解。因此,要求在反应期间非常精确计量H2O2,包括设备上更大的花费,更慢的反应速率和由此低的空时收率。或者,仅保留不连续地产生单线态氧的选择方案,即在间歇方法中,并且忍受更低的单线态氧收率以及更长的反应时间。根据Aubry,为了实现足够高的反应速率,要将钼酸根离子以0.1mol/l的浓度作为催化剂引入,即以非常大量引入(参见第8732页第1栏,1)。这增加了单线态氧1O2和用其氧化的次级产物的生产成本。此外,根据Aubry,单线态氧1O2的收率也取决于指定给催化反应的钼酸根离子的抗衡离子的类型。例如,用锂而不是钾作为抗衡离子实现特别好的收率(参见第8733页,第1栏,第2段)。然而,钼酸锂是非常昂贵的化合物,由此使得单线态氧的产生和由此一般化合物的氧化,尤其是酚的氧化更昂贵。此外,在H2O2存在下钼化合物仅有限地适用于与酚反应,因为要由此催化产生的单线态氧1O2将酚不仅氧化为醌醇,而且氧化为过醌醇(perquinol),两种化合物以比例1∶1形成(参见表2)。在进一步反应之前,该过醌醇需要首先被还原成醌醇,这导致额外花费。最后,Aubry能够确立在钼酸根离子存在下钼酸盐催化的H2O2歧化反应严重依赖温度并且高收率的单线态氧1O2仅在升高温度下以足够速率获得(参见第8733页,第2栏,第2段)。然而,在某些底物的情况下,高温可导致次级反应或H2O2的热分解。在关于释放单线态氧1O2用其他催化剂的研究中,Aubry在J.Am.Chem.Soc.(1985),107,5844-5849中已确定碱土金属Ca、Sr和Ba,来自元素周期表第3a、4a、5a和6a族的元素,锕系元素和镧系元素以及ClO-、BrO-、Au+、IO3-和IO4-。此处,其经由与四钾红荧烯-2,3,8,9-四羧酸盐反应,通过在碱性水溶液中产生的单线态氧来氧化所述红荧烯衍生物以得到相应内过氧化物,并通过光谱法确定其含量而检测单线态氧1O2。对于该文章表1中所列元素周期表的上述元素的各种氧化物,获得≥70%收率的内过氧化物。然而,关于用在表1中给出的单线态氧1O2用催化剂氧化红荧烯衍生物是选择性地进行还是导致不同化合物异构体没有予以说明。由此不清楚所得化合物是纯物质还是混合物。此外,也没有说明以什么量和什么温度使用催化剂和/或更大量H2O2是否阻碍单线态氧1O2的快速形成和由此降低内过氧化物的收率。最后,没有讨论表1中所列化合物是否也适用于酚的特定氧化,由于其空间位阻保护而显著更不易进行化学反应。因此,这给本领域熟练技术人员带来提供如下方法的任务:可在工业上用于产生单线态氧1O2和由其获得的次级产物而不再具有上述缺点。所述方法尤其应容易实施且成本有效,甚至在高H2O2浓度下以高收率产生单线态氧1O2,并且甚至在室温下也足够快地进行。所提供的方法在原料转化时还应尽可能选择性地产生氧化产物,即不形成或不完全形成大量次级产物。此外,需要提供一种具有的催化剂形成单线态氧1O2的趋势仅被抗衡离子最小程度影响或根本不影响的方法。本发明目的也在于排列本发明方法的各步骤使得实现单线态氧的非常高收率和同时就由所制备的单线态氧和原料获得的最终产物而言的高选择性。尤其需要提供一种其中环状体系如尤其是酚可被区域选择地或基本上区域选择地氧化的方法。此外,给本领域熟练技术人员带来借助本发明方法提供成本有效的产物,尤其是可用作合成维生素,尤其是维生素E的结构单元的那些产物的任务。本发明的主要特征可在权利要求1和19中找到。本发明用途为权利要求21和22的主题。在用由H2O2释放的单线态氧来氧化酚的方法中,本发明提供了该释放用铋化合物作为催化剂进行。如果铋化合物用于氧化酚,则不仅实现高的产物收率,而且反应产物的形成明显优先于副产物的形成,如下文实施例中所示。该结果是惊人的,因为在香茅醇与H2O2在铋化合物存在下的反应中获得显著更低的转化率、收率和选择性,同样如下文实施例中所示。因此,铋化合物仅在某些情况下能够产生高收率的单线态氧1O2,此外达到如下的反应条件:在所述反应条件下所述单线态氧1O2使底物分子转化成基本上或至少以大比例由单一异构体组成的氧化物质。此外,由Aubry,J.Am.Chem.Soc.(1985),107,5844-5849的关于评价各种金属氧化物、氯化物或硝酸盐就其释放单线态氧1O2而言的能力的上述文章明显可见,铋化合物在这方面是非常不合适的。在第5845页的表1中,如上文所述,所形成的单线态氧的量通过被单线态氧所氧化的红荧烯衍生物的光谱测定而量化。如果呈氧化铋形式的铋用作催化剂,则所得被氧化的红荧烯衍生物的收率低于10%。当铋酸钠NaBiO3用作催化剂时,实质上甚至根本不转化,即没有实现单线态氧1O2诱导的特定红荧烯衍生物的氧化。假定为具有3个甲基的环状体系的酚可被单线态氧至少以正好与上述红荧烯衍生物相同的难度氧化,由于上述的3个甲基带来的其严重的空间位阻保护而可能甚至更不易用单线态氧1O2氧化。因此,也与该背景相反,惊人的是不仅单线态氧1O2可大量地由H2O2释放,而且此外通过本发明方法实现酚向高收率2,4,6-三甲基醌醇的选择性氧化。也已发现当根据所述方法使用铋化合物时,反应溶液中的H2O2浓度对单线态氧1O2的形成和由此催化活性铋化合物的结构没有影响。过高的H2O2浓度尤其没有导致形成高度配位的铋络合物,其失去由H2O2释放单线态氧1O2的能力,如以钼氧基化合物有规律地观察到的那样。术语铋化合物应理解为是指下文列出的各种铋(III)化合物。术语铋化合物包含选自如下组的一个或多个代表:氧化乙酸铋(III)(CAS编号5142-76-7),碱式碳酸铋(III)(CAS编号5892-10-4),也称为氧化碳酸铋(III)或次碳酸铋(III),氯化铋(III)(CAS编号7787-60-2),2-乙基己酸铋(III)或铋(III)2-乙基己酸(CAS编号67874-71-9),氧化硝酸铋(III)(CAS编号10361-46-3),碱式硝酸铋(III)(CAS编号1304-85-4),也称为硝酸氢氧化铋(III),五水合硝酸铋(III)(CAS编号10035-06-0),氧化铋(III)(CAS编号1304-76-3),氯氧化铋(III)(CAS编号7787-59-9),次棓酸铋(III)(CAS编号99-26-3),次水杨酸铋(III)(CAS编号14882-18-9),硫酸铋(III)(CAS编号7787-68-0),三(2,2,6,6-四甲基-3,5-庚二酮)铋(III)(CAS编号142617-53-6),乙酸铋(III)(CAS编号22306-37-2),水合铝酸铋(III)(CAS编号308796-32-9),氧化铋铅锶钙铜(CAS编号116739-98-1),溴化铋(III)(CAS编号7787-58-8),柠檬酸铋(III)(CAS编号813-93-4),氟化铋(III)(CAS编号7787-61-3),碘化铋(III)(CAS编号7787-64-6),钼酸铋(III)(CAS编号13595-85-2),钼酸铋(CAS编号51898-99-8),氧化钼酸铋(CAS编号13565-96-3),碘化氧化铋(III)(CAS编号7787-63-5),水合高氯酸氧化铋(III)(CAS编号66172-93-8),磷酸铋(III)(CAS编号10049-01-1),硒化铋(III)(CAS编号12068-69-8),氧化铋锶钙铜(CAS编号114901-61-0),水合次硝酸铋(III)(CAS编号13595-83-0),硫化铋(III)(CAS编号1345-07-9),碲化铋(III)(CAS编号1304-82-1),钛酸铋(III)(CAS编号12048-51-0),钨酸铋(III)(CAS编号13595-86-3),氧化铋钴锌,具有式(Bi2O3)0.07(CoO)0.03(ZnO)0.90的Bi-Co-ZnO,三氟甲磺酸铋(III)(CAS编号88189-03-1)和锆酸铋(III)(CAS编号37306-42-6)。已证实特别优选的铋化合物为包含至少一个选自如下组的代表的那个:铋氧化物,铋硝酸盐,硝酸铋氧化物,具有式(Bi2O3)0.07(CoO)0.03(ZnO)0.90的氧化铋钴锌(Bi-Co-Zn-O)和柠檬酸铋(III),因为在酚和H2O2的反应中这些化合物各自以高选择性产生非常高收率的2,4,6-三甲基醌醇,如下文实施例所示。术语酚与术语2,4,6-三甲基苯酚同义。根据本发明,单线态氧应理解为是指其中存在两个未成对电子的任意类型分子氧,即单线态氧包含其中两个未成对电子在一个相同π*轨道(术语符号1Δg)以及两个不同π*轨道(术语符号1∑+g)中存在的两种氧分子物质。就本发明而言,取决于方法程序,H2O2在水中以5-60重量%的不同浓度使用。对于快速和均一的方法程序,方法原料酚作为初始进料引入水混溶性溶剂中。在本发明的另一实施方案中,原料酚作为初始进料引入水和水混溶性溶剂的混合物中。混合物中水的比例为0.01-90重量%,优选0.02-50重量%,在特别优选的实施方案中,为0.03-30重量%。特别是在强浓度反应混合物的情况下,必须确保水含量保持相当低,因为在由H2O2制备单线态氧1O2期间形成水。然而,过高水含量导致反应混合物中原料以显著更差程度溶解或根本不再溶解。其中酚作为初始进料引入的特别合适溶剂已证实为具有1-6个碳原子的低级醇。该醇选自一元、二元和/或三元醇。特别优选的三元醇选自甘油、三羟甲基丙烷或丁三醇。丁三醇应理解为是指1,2,4-三羟基丁烷以及1,2,3-三羟基丁烷两者。三元醇,尤其是所述三元醇是非常合适的,因为它们同样地具有极性和非极性特性并由此能够非常容易地溶解酚,但另一方面它们不是那么粘以致于原料酚仅非常缓慢地溶解。二元醇包含1,2-丁二醇、2,3-丁二醇、1,4-丁二醇、1,2-丙二醇、1,3-丙二醇、2,2-二甲基-1,3-丙二醇、3-甲基-2,4-戊二醇、1,2-乙二醇、1,5-戊二醇、1,2-戊二醇、二甘醇(与β,β’-二羟基二乙基醚同义)、三甘醇(与乙二醇二-β-羟基乙基醚同义)。此外,这些化合物具有优于三元醇的优点,在大多数情况下,它们具有更低粘度并由此使反应混合物更容易搅拌,结果是所述方法可更成本有效地安排。具有1-6个碳原子的低级一元醇包含一个或多个选自如下组的代表:甲醇,乙醇,2-丙醇,1-丙醇,2-丁醇,2-甲基-2-丁醇,2-氟丁醇,2-甲基-1-丙醇,3-甲基-2-丁醇,其呈所有异构体形式,3-戊醇,1-丁醇,2-戊醇,其呈所有异构体形式,3,3-二甲基-2-丁醇,2,3-二甲基-2-丁醇,3-甲基-3-戊醇,2-甲基-2-戊醇,2-乙氧基乙醇,其与乙二醇单甲基醚同义,2-甲基-3-戊醇,1-氯-2-丙醇,2-甲基-1-丁醇,2-氯乙醇,4-甲基-2-戊醇,其呈所有异构体形式,3-甲基-1-丁醇,2-氯-1-丙醇,其呈所有异构体形式,3-甲基-2-戊醇,2-乙氧基乙醇,其与乙二醇单乙基醚同义,3-己醇,2,2-二甲基-1-丁醇,1-戊醇,2-己醇,其呈所有异构体形式,环戊醇,2-异丙氧基乙醇,其与乙二醇单异丙基醚同义,2,3-二甲基-1-丁醇,3-甲氧基-2-丁醇,1-甲氧基-2-丙醇,2-甲基-1-戊醇,2-乙基丁醇,2-溴乙醇,2-正丙氧基乙醇,2,2,2-三氯乙醇,3-甲基-1-戊醇,4-甲基-1-戊醇,1-己醇,2-异丁氧基乙醇,2,6-丁氧基乙醇,2,4-二甲基-1-戊醇,3-氯-1-丙醇,4-羟基-4-甲基-2-戊醇,2-正丁氧基乙醇,2-氨基乙醇,四氢糠醇,3-溴-1-丙醇,2-甲基-1,2-丙二醇,2,2-二溴乙醇,2,3-丁二醇,2,3-二氯丙醇,1,2-丙二醇,2-(2-乙氧基)乙醇,其与二甘醇单乙基醚同义,环己醇,1-甲基环戊醇和2,3-二溴-1-丙醇。在这些一元醇中,乙醇和甲醇已证实特别有用,因为一方面它们具有低粘度,另一方面单线态氧1O2的收率极其高,最后这两种溶剂由于其本身的亲水和亲油特性而可以与许多其他溶剂直接混合,这也允许在极性-质子溶剂中本身不溶解的原料转化。使用甲醇或乙醇或其混合物作为溶剂由此提高所述方法的速率并使其更成本有效,因为搅拌反应混合物可能容易并且反应进行非常快。在本发明另一实施方案中,使用碱使包含酚的溶剂呈碱性。已试验各种碱并且已用碱金属或碱土金属氢氧化物的水溶液或醇溶液获得就2,4,6-三甲基醌醇的收率和选择性而言特别好的结果。用醇化物或氢化物的水溶液或碱性溶液实现同样好的结果。不同的碱也可以彼此的混合物使用并随后产生同样结果。碱金属或碱土金属氢氧化物应理解为是指可用元素周期表第1族的碱金属或元素周期表第2族的碱土金属制备的所有氢氧化物。除了已描述的碱金属或碱土金属氢氧化物的水溶液外,可使用的碱还为醇化物或氢化物。醇化物应理解为是指至少一种上文所列醇的去质子化形式,其与一价、二价、三价或四价金属阳离子配位。醇化物直接以浓缩形式存在,或溶解于醇中,但不溶解于水中。特别选择的醇化物包含选自如下组的一个或多个成员:锌二醇化物、钛二醇化物和钛四醇化物、碱土金属二醇化物和碱金属醇化物。醇化物的非常特别优选代表选自如下组:异丙醇锂、甲醇钠、乙醇钠、甲醇钾、乙醇钾、二甲醇镁、二乙醇镁、二异丙醇钙、二甲醇钙和二乙醇钙。本发明氢化物选自如下组:氢化钙、氢化二异丁基铝、氢化锂、氢化镁、氢化钾、氢化钠、氢化钛(II)或氢化钛(IV)、氢化三苯基锡和氢化锆(II)。由于其易获得性及其较低成本,特别优选氢化钠和/或氢化钙。还可以使用所述氢化物的混合物。在本发明方法操作过程中,也已发现如果原料酚作为初始进料引入水混溶性溶剂中,用碱使其呈碱性,然后仅与其他反应物如铋化合物和H2O2反应,则对其收率具有积极影响。然而,如果首先使以溶液起催化剂作用的铋化合物呈碱性,然后仅添加酚和H2O2作为反应物,则也形成2,4,6-三甲基醌醇,但不具有该相当高的收率,如可由实施例31所看出的那样。在本发明方法的一个实施方案中,使用碱使溶剂呈碱性,其中其他反应物仅在碱完全溶解之后添加。特别是当不希望尽可能快的工艺过程,但更可能高收率的2,4,6-三甲基醌醇时,使用该方案。这仅在碱完全溶解度的情况下实现。该实施方案的另一优点为由于依次添加碱和其他反应物,不会导致反应混合物的突然加热,突然加热与较低的酚氧化产物收率有关。然而,如果在溶解或掺入碱时首先释放热量,同时在铋化合物和H2O2存在下形成单线态氧1O2同样放热地进行,则观察到该加热。也已发现对于单线态氧和由此氧化的原料酚的高收率,酚量和碱量之比是决定性的。重要的是以相当于0.1-10倍摩尔量酚,优选0.2-5倍摩尔量,在特别优选的实施方案中,以0.5-1.5倍摩尔量的摩尔比添加碱。低于所述碱量导致单线态氧和由此最终产物2,4,6-三甲基醌醇的生产下降。如果用量大于上述那些,同样也不能获得单线态氧的高收率。因此,基于原料酚的碱量对于根据所述方法的本发明是显著重要的。可由下文实施例看出,如果碱基于酚以等摩尔或实质上等摩尔的量添加,则获得单线态氧和由此2,4,6-三甲基醌醇的特别高收率。实质上等摩尔的量是指酚和碱的摩尔量相差不大于3%。如上所述,本发明方法优选在室温下进行以致于不会由于可能局部显著加热而不利地影响产物收率。因此,本发明的一个方案提供通过使碱机械溶解而实现大致恒定的反应温度。“机械溶解”应理解为是指通过超声或通过搅拌机理,即不引入热而溶解碱。在本发明的一个实施方案中,将铋化合物添加至包含酚的碱性溶剂中。工艺步骤-原料酚作为初始进料引入水混溶性溶剂中-用碱使其呈碱性-和-随后添加铋化合物的组合不仅提高反应速率,而且导致副产物的形成降低。可由图3(条形图)看出,向反应混合物中快速添加铋化合物对于产物2,4,6-三甲基醌醇没有导致就收率和选择性而言值的降低。因此,一个基本方法实施方案在于在1分钟至10小时,优选2分钟至7小时内,在特别有利的变型中,在5分钟至1小时内将铋化合物添加至包含酚的碱性溶剂中。可看出在7小时内添加铋化合物相比于在1小时内添加的情况就收率和选择性而言甚至导致略微降低的值。因此,优选较快地添加,此外,这也加速本发明方法并由此使其更成本有效。作为钼化合物代表的钼酸二钠Na2MoO4不能实现该效果,因为在1小时内添加该化合物的情况下,就2,4,6-三甲基醌醇的收率和选择性而言的值相比于在7小时内将钼酸二钠Na2MoO4添加至反应混合物中降低约一半。在筛选上述铋化合物时,至少一种选自如下组的化合物已证实特别适用于产生单线态氧:铋氧化物和/或铋硝酸盐和/或硝酸铋氧化物和/或氧化铋钴锌(Bi-Co-Zn-O)和/或柠檬酸铋。在将酚氧化为2,4,6-三甲基醌醇的过程中,所有这些化合物均得到超过40%的收率和超过50%的选择性,如可参考实施例22-24(与实施例5、11和8同义)、26和28看出的那样。也来自该上述组,选自如下组的铋化合物是尤其显著的:氧化铋(III)(Bi2O3,CAS编号1304-76-3),五水合硝酸铋(III)(Bi(NO3)3*5H2O,CAS编号10035-06-0),次硝酸铋,也以名称氧化硝酸铋(III)(Bi(O)NO3,CAS编号10361-46-3)找到,和一水合次硝酸铋(III)(BiO(NO3)*H2O,CAS编号13595-83-0)或来自这些化合物中两种或更多种的混合物。当使用上述4种铋化合物时,同样可以获得超过40%的酚氧化产物收率,但此时具有≥55%的选择性。就氧化产物的选择性和收率而言,可在实施例4-6中看出,铋氧化物本身是尤其显著的。因此,在本发明方法的特别优异实施方案中,铋化合物选自铋氧化物。铋化合物尤其为氧化铋Bi2O3(CAS编号1304-76-3)。本发明方法另一实施方案确定碱以相当于1-20.4倍摩尔量铋化合物,优选5-15倍摩尔量,在特别优选的实施方案中,以相当于5-10.2倍摩尔量铋化合物的摩尔量添加。最后,在高度优选的实施方案中,碱以相当于10倍摩尔量铋化合物或大致10倍摩尔量的摩尔量添加。“大致10倍摩尔量”是指碱的摩尔量比铋化合物的摩尔量大9.8-10.2倍。基于铋化合物的量的碱量如何影响反应收率示于试验实施例16-21中,例如对于氧化铋(Bi2O3)。然而,这些结果不限于氧化铋本身,而以类似方式适用于上述其他铋化合物,尤其是铋氧化物、铋硝酸盐、硝酸铋氧化物、氧化铋钴锌(Bi-Co-Zn-O)和柠檬酸铋。此外,如果它们呈混合物形式或它们中一些呈混合物形式时,则它们对于后面描述的化合物也是有效的。本发明方法另一实施方案为每摩尔当量铋化合物使用1-50摩尔当量,优选5-20摩尔当量,在特别优选的实施方案中,5-10摩尔当量酚。在许多试验中,其中实施例4-15仅为一个选择,已发现就氧化产物2,4,6-三甲基醌醇的收率而言和就反应的选择性而言,每摩尔当量铋化合物应有1-50摩尔当量酚反应。当每摩尔当量催化活性铋化合物使用5-20摩尔当量酚时,实现满意的收率。最后,在铋化合物和酚的摩尔比为1∶10-1∶20下实现氧化酚的最高收率,其中每摩尔当量铋化合物为10倍摩尔过量酚明确得到最佳结果。因此,在本发明一个特别多产的实施方案中,每摩尔当量铋化合物使用10摩尔当量酚。本发明方法另一实施方案涉及将H2O2添加至包含酚和铋化合物的碱性溶液中。根据本发明,如果原料酚、铋化合物和碱性溶剂在添加过氧化氢(H2O2)之前已经存在,则对于所述方法程序是有利的。如果不采用该程序,而是将呈碱性的溶剂与过氧化氢和酚的混合物掺和,则所得产物2,4,6-三甲基醌醇的收率不如可在实施例31中看到的那样高。如已在上文确定,添加碱对于实施本发明方法是必要的。尤其可在实施例16-21中看出,在碱不存在下,酚转化率以及2,4,6-三甲基醌醇的收率以及获得它的选择性显著降低。假定所述碱可通过使原料化合物、铋化合物和/或H2O2中至少一种去质子化并由此使其更容易接近和/或更具反应性而具有催化作用。因此,碱∶H2O2之比对于本发明也是重要的。在所述方法的另一实施方案中,本发明由此涉及碱与H2O2的摩尔比为1∶4-1∶20,优选1∶8-1∶15,在特别优选的实施方案中,为1∶9-1∶12。可在实施例4-15中找到特别好的收率和选择性。因此,本发明方法高度优选的实施方案涉及碱与H2O2的摩尔比为1∶9.8-1∶10。在另一实施方案中,本发明方法的特征在于每摩尔当量酚,将2-70倍摩尔过量,优选5-40倍,在特别有利的实施方案中,10-30倍摩尔过量H2O2添加至碱性溶剂中。在本申请酚情况下,对于反应程序决定成本的因素为原料的量。因此,理想的是其尽可能用由H2O2产生的单线态氧1O2实施以得到相应的2,4,6-三甲基醌醇而反应。因此,使用过量过氧化氢。然而,出于成本原因,另一方面,也重要的是不使该H2O2过量太多。因此,基于酚为10-30倍摩尔过量H2O2已证实是特别有用的。由实施例4-15明显可见,每摩尔当量酚,特别优选将10倍摩尔过量H2O2添加至碱性溶剂中。此外,已惊人地发现单线态氧1O2的收率实质上与所用过氧化氢的浓度无关(就此而言参见实施例4-15)。出于成本原因,根据本发明使用的过氧化氢H2O2在水中具有5-60wt%,优选10-55wt%,在特别优选的实施方案中,30-50wt%的浓度。30-50%浓度过氧化氢溶液可在市场上以有利价格获得且可无问题地储存和加工,并由此优选地使用。与铋化合物相反,尤其是钼酸盐物质的反应对所用H2O2的浓度和量敏感。如上所述,如果H2O2浓度太高或如果H2O2太快添加至与催化剂化合物掺和的反应介质中,则它们可能失去其释放单线态氧1O2的能力。在本发明方法另一变型中,H2O2在一批中添加至包含酚和铋化合物的碱性溶剂中。通过在一批中添加H2O2,所述方法程序可更短且无需用于H2O2的额外控制体系。因此,如果少量酚要反应,则本发明该实施方案是特别成本有效的且可特别地使用。本发明方法的另一变型涉及在30分钟至14小时内,优选45分钟至7小时内,特别优选在1-7小时内将H2O2添加至包含酚和铋化合物的碱性溶剂中。取决于酚原料的量,使用相应量的H2O2导致在反应混合物中局部加热现象。特别是在大量酚的情况下(需要相应量的H2O2),和当使用50重量%浓度H2O2溶液时,观察到这些现象。所述局部加热促进副产物形成并降低就收率和选择性而言的值。该缺点可通过在上述时间范围内并以特别有利的方式在1-7小时内添加H2O2而克服。如果使用大量酚作为原料和50重量%浓度H2O2溶液,则出于上述原因,在本发明方法高度优选的变型中,合适的是在2-7小时内将H2O2添加至包含酚和铋化合物的碱性溶剂中。在较少量酚原料的情况下,特别是当使用具有30重量%浓度重量比例H2O2的H2O2溶液时,没有观察到反应混合物的局部加热,其要求在延长时间内连续添加H2O2。如上所述,H2O2浓度不影响铋化合物由H2O2释放单线态氧1O2和由此使2,4,6-三甲基醌醇的形成转向更小值的能力。对于铋化合物氧化铋Bi2O3(CAS编号1304-76-3,参见实施例5和13)和对于五水合硝酸铋Bi(NO3)3*5H2O(CAS编号10035-06-0,参见实施例8和14),这以特别显著的程度适用。因此,本发明另一实施方案涉及将H2O2连续添加至碱性溶剂中,这与时间和成本节约地实施本发明方法有关。与随着温度升高能够由过氧化氢溶液释放越来越大比例单线态氧1O2的钼化合物(参见TetrahedronLetters43(2002)8731-8734,第8731页,右侧栏,第2段)相反,本发明铋化合物能够与温度无关地由H2O2产生均匀量的单线态氧1O2。因此,本发明方法涉及另一实施方案,其中H2O2在0-90℃,优选5-50℃,特别优选10-30℃的溶剂温度下添加。因此,还可以在室温下实施反应,这由此是成本有效的,尽管如此也不耗时。通过保持基于H2O2量的催化活性铋化合物的比例非常低,尽管如此也获得高收率的产物,尤其是2,4,6-三甲基醌醇,也有助于成本有效地实施本发明方法。因此,另一本发明实施方案涉及铋化合物和H2O2的摩尔比为1∶20-1∶400,优选1∶50-1∶205,特别优选1∶50-1∶105。如果铋化合物和H2O2的摩尔比为1∶100-1∶100.7,则实现就2,4,6-三甲基醌醇的收率和选择性产生而言极其高的值。就本申请而言,收率(%)是指所得产物2,4,6-三甲基醌醇的摩尔数除以所用酚的量(同样以摩尔表示)乘以100。就本申请而言,重量百分数涉及wt%或重量%,两个术语同义使用。就本申请而言,选择性(%)应理解为是指产物2,4,6-三甲基醌醇的摩尔数除以酚转化量(同样以摩尔表示)乘以100。当实现高选择性时,实现本发明方法的优选实施,因为可专门地或实质上专门地回收未反应酚并且显然可再利用。因为从未反应酚中分离出产物2,4,6-三甲基醌醇涉及一定花费,当实现高收率时,由此当获得2,4,6-三甲基醌醇的高选择性以及同时酚的高转化率组合时,则尤其存在本发明方法的特别优选程序。本发明进一步提供一种可由上述方法获得的产物。产物应理解为是指至少一种如下的化合物:2,4,6-三甲基醌-4-醇(1),2,4,6-三甲基-4-过醌醇(2),2,4,6-三甲基醌-2-醇(3),2,4,6-三甲基-2-过醌醇(4),2,4,6-三甲基醌-2,4-二醇(5),2,4,6-三甲基-2-氢过氧醌-4-醇(6),2,4,6-三甲基-4-氢过氧醌-2-醇(7),2,4,6-三甲基-2,4-二氢过氧醌醇(8),2,4,6-三甲基醌-2,4,6-三醇(9),2,4,6-三甲基-6-过羟基醌-2,4-二醇(10),2,4,6-三甲基-2,6-二过羟基醌-4-醇(11)和2,4,6-三甲基-2,4.6-三氢过氧醌醇(12),如图VP所示,及其混合物。非常特别优选产物2,4,6-三甲基醌-4-醇,因为其根据所述方法以大量形成并代表合成其他天然物质的关键化合物。本发明另一开发的实施方案涉及所得产物在生产2,3,6-三甲基氢醌中的用途。所述分子通过在非酸性条件下在液体介质中在至少110℃的温度下加热2,4,6-三甲基醌醇使得pH不降至6以下而获得。该介质优选包括碱性化合物,其包含碱金属和/或碱土金属。此外,本发明涉及在本发明方法中制备的产物作为合成维生素E用前体的用途。该用途具有巨大技术优点,因为其使得规则用于该目的的用极具腐蚀性的基于氯化铜(II)的催化剂体系氧化前体2,3,6-三甲基苯酚变得多余。此外,相比于所述2,3,6-三甲基苯酚,酚明显更成本有效地获得。本发明的其他特征、细节和优点由权利要求书的措辞以及参照表和附图的如下实施例说明而得到。这些显示出:图VP:可通过本发明方法获得的产物图1:通过本发明方法氧化酚的反应方案和使用2,4,6-三甲基醌醇的实例显示出的随后重排反应。图2:用作催化剂的其他铋化合物。图3:在催化剂Na2MoO4或Bi2O3存在下,酚的转化率、2,4,6-三甲基醌醇的收率和相应选择性,以反应时间为函数。图4:获得2,4,6-三甲基醌醇(%)的选择性的函数曲线,以酚的转化率(%)为函数。表1:用铋化合物和H2O2在碱性环境中氧化各种不饱和原料以及转化率、收率和选择性值。表2:作为碱添加量函数的在H2O2和氧化铋Bi2O3存在下酚的氧化以及转化率、收率和选择性。表3:当使用图2中所述的铋化合物时,酚的转化率以及醌醇的收率和相关选择性。图1显示出在碱和作为催化剂的铋化合物存在下酚与H2O2反应而得到产物2,4,6-三甲基醌醇(1)的反应方案。如果在反应期间pH不降至6以下,则最后提及的化合物可在非酸性条件下在至少110℃的温度下重排而得到2,3,6-三甲基氢醌。这优选通过向反应混合物中添加碱性化合物而实现,所述碱性化合物包含碱金属或碱土金属或两种金属的化合物的混合物。对于实现酚的高转化率、2,4,6-三甲基醌醇的高收率和就该化合物而言高选择性,必要的是以特定方式一起添加原料。此外,催化活性铋化合物与其他原料接触多久也是重要的。在实施所述方法的典型实施例中,程序按如下进行:将5.00g(36.7mmol)酚作为初始进料引入60ml甲醇中并与1.5g(37.5mmol)NaOH掺和。在目标不在于时间而在于非常高收率的一个方法程序中,搅拌所得悬浮液直至氢氧化钠(NaOH)完全溶解(约10分钟)。如果快速反应程序是重要的,并且如果2,4,6-三甲基醌醇的收率有点低也不要紧,则可省却氢氧化钠的完全溶解。然而,必须确保原料酚作为初始进料引入水混溶性溶剂中,用碱使其呈碱性,然后仅与其他反应物如铋化合物和H2O2反应,以确保2,4,6-三甲基醌醇的收率和实现该收率的选择性不严重下降。在完全添加氢氧化钠(NaOH)之后或在完全溶解氢氧化钠(NaOH)之后,由此获得的反应混合物与作为催化剂的0.05-0.20摩尔当量铋化合物掺和。使反应混合物在整个时间内保持在室温下或在反应温度下。在添加NaOH期间以及在添加催化剂期间,为了仅借助搅拌实现碱,尤其是NaOH的溶解,要小心,以避免温度升高太多。然后在室温下在2-7小时内将25.0g(相当于367.7mmol)在水中浓度为50重量%的H2O2计量加入。然后在室温下再搅拌浅黄色悬浮液12小时。当该时间过去时,借助定量气相色谱法使用内标分析反应混合物。根据该方法方案进行的氧化反应和就酚的转化率、2,4,6-三甲基醌醇的收率和相关的反应选择性而言所获得的值列于表1的实施例4-12中。可看出用氧化铋(CAS编号1304-76-3)作为催化活性化合物获得就产物2,4,6-三甲基醌醇而言最佳收率和选择性。此外,在碱性条件下,在铋化合物和酚和H2O2的摩尔比为1∶10∶100下实现增加的收率。这里,此外明显看出如果碱和酚以等摩尔或大致等摩尔的量使用,则对于工艺结果同样是有利的。如果使用基于原料酚为10倍过量H2O2,则这也是适用的。在实施例13-15中,其最大部分地与实施例4、8和11一致,使用具有仅30重量%浓度含量H2O2的溶液,而不是50重量%浓度H2O2溶液。这里,用氧化铋(III)(CAS编号1304-76-3)也实现最佳收率和选择性,如实施例5中那样。因此,所用H2O2溶液中H2O2的浓度对于2,4,6-三甲基醌醇(1)的收率仅稍微影响,2,4,6-三甲基醌醇(1)与2,4,6-三甲基醌-4-醇(1)同义。相比于50重量%浓度H2O2,当使用30重量%浓度H2O2时,后者有时稍微提高。如上所述,添加碱影响酚的转化量、作为本发明产物的2,4,6-三甲基醌醇的收率和就该化合物而言的选择性。使用碱氢氧化钠(NaOH)的实施例,研究该影响并记录在下表2中。详细地,将5g(36.7mmol)酚作为初始进料引入60ml甲醇中并将该溶液与不同量的氢氧化钠(NaOH)掺和,其中基于酚用量,在不同试验中添加0-2摩尔当量NaOH。搅拌所得悬浮液直至氢氧化钠(NaOH)完全溶解(约10分钟)。然后将其与1.71g(3.67mmol,相当于0.1摩尔当量,基于酚用量)氧化铋Bi2O3(CAS编号1304-76-3)掺和,然后在室温下在7小时内添加25.0g(367.7mmol,相当于10摩尔当量,基于酚用量)呈50重量%浓度水溶液形式的H2O2。然后在室温下再搅拌浅黄色悬浮液12小时,当该时间过去之后,借助气相色谱法分析反应混合物。表2:碱量的变化:*所有实施例,在MeOH中,用基于酚为0.1当量Bi2O3、10当量H2O2(50重量%,在H2O中),在7小时内滴加。由上表2可看出,在碱(NaOH)不存在下,酚的转化率为7.8%,2,4,6-三甲基醌醇的收率为1.8%和就此而言实现的选择性为23%,显著落后于工业方法所要求的最小值。如果基于酚用量为0.1-10摩尔当量,尤其是0.1-2摩尔当量碱存在于反应混合物中,则2,4,6-三甲基醌醇的收率为24-68%,实现34-72%的选择性。因此,本发明方法的一个实施方案涉及将碱以相当于0.1-2倍摩尔量酚的摩尔比添加。虽然该实施方案由实施例推导出并涉及Bi2O3(CAS编号1304-76-3),然而,其不限于该铋化合物,而是本发明具体部分,且可由此直接用于上述铋化合物的一般描述中和任选用作本发明权利要求的主题。此外,由表2明显看出,当添加0.5-1.5摩尔当量NaOH/当量酚,尤其是0.5-1摩尔当量NaOH/当量酚时,实现79%和更大的酚转化率、高达68%的2,4,6-三甲基醌醇收率以及36%和更大的选择性。如果使用0.5-1摩尔当量NaOH/摩尔当量酚,甚至92%和更多的酚转化,获得55-68%的2,4,6-三甲基醌醇收率,这具有60-72%的选择性。因此,另一本发明实施方案涉及将碱以相当于0.5-1倍摩尔量酚的摩尔比添加。该实施方案也不限于所述实施例,而且也可用上述其他铋化合物实现,为本发明的具体部分,且可由此直接用于一般描述中和任选用作本发明权利要求的主题。除了表1中描述的化合物氧化铋(Bi2O3,CAS编号1304-76-3),五水合硝酸铋(III)(Bi(NO3)3*H2O,CAS编号10035-06-0)和硝酸氧化铋(III)(BiO(NO3)*H2O,CAS编号13595-83-0)外,研究了其他铋化合物关于借助由H2O2释放的单线态氧1O2将酚氧化成2,4,6-三甲基醌醇(1)的能力。这些化合物与上文在图2中描述的那些一起描述并根据如下方法程序反应。对于实施例22-30,将5.00g(36.7mmol,1摩尔当量)酚作为初始进料引入60ml甲醇中并与1.50g(37.5mmol)氢氧化钠(NaOH)掺和。搅拌所得悬浮液直至氢氧化钠(NaOH)完全溶解(需要约10分钟)。然后将反应混合物与0.1摩尔当量(或在实施例28b中为0.05)实施例22-30中描述的铋化合物之一掺和,其中0.1摩尔当量涉及酚用量。然后在室温下在7小时内计量加入25.0g(367.7mmol)呈50重量%浓度水溶液形式的H2O2。然后在室温下再搅拌浅黄色悬浮液12小时,借助气相色谱法分析随后得到的反应混合物。所得结果可在表3中找到。表3:表3表明除了已经研究过的化合物氧化铋(CAS编号1304-76-3),次硝酸铋以及硝酸氧化铋(III)(BiO(NO3),CAS编号10361-46-3)和五水合硝酸铋(III)(Bi(NO3)3*5H2O,CAS编号10035-06-0)外,化合物柠檬酸铋(IID(CAS编号813-93-4)和具有式(Bi2O3)0.07(coO)0.03(znO)0.90的氧化铋钴锌(Bi-Co-Zn-O)也得到超过80%的酚转化率、大于44%的收率和≥53%的选择性。铋化合物由此也优选作为借助由H2O2释放的单线态氧1O2来氧化酚的催化剂,因为它们在更短时间内得到更大量的产物2,4,6-三甲基醌醇,如可由图3看出。该惊人效果确保本发明方法相比于其中钼酸盐用作催化剂的类似方法而显著更快地进行。为了获得图3中结果,如实施例5那样制备含有氧化铋的混合物,但铋化合物在一种情况下在7小时内添加,在另一试验中,在1小时内添加。再进行相同试验,但作为催化活性化合物使用钼酸钠(Na2MoO4),而不是铋化合物。可看出,相比于使用钼酸盐催化剂,用氧化铋作为催化剂,2,4,6-三甲基醌醇的收率和获得该化合物的选择性提高。此外,值得注意的是,当使用钼酸钠(Na2MoO4)时,如果添加钼酸盐化合物在7小时内而不是1小时内进行,则收率和选择性提高。通过对比,对于铋化合物,尤其是对于氧化铋(Bi2O3,CAS编号1304-76-3),获得性能相反的结果,即当在1小时内添加铋化合物,尤其是氧化铋(Bi2O3)时,相比于当在7小时内添加所述铋化合物时,实现2,4,6-三甲基醌醇的更高收率和此外基于所有氧化产物的更高选择性。如果铋化合物,尤其是氧化铋(Bi2O3)作为催化剂在1小时内添加至反应混合物中,则2,4,6-三甲基醌醇的收率为70%,就该化合物而言的选择性为75%。然而,如果添加氧化铋(Bi2O3)在7小时内进行,则获得66%的2,4,6-三甲基醌醇收率和69%的选择性。通过对比,当使用Na2MoO4在1小时之后2,4,6-三甲基醌醇的收率仅为24%,选择性为36%。当在7小时内添加Na2MoO4时,2,4,6-三甲基醌醇的收率充其量为58%,选择性为60%。涉及图3的所有值来自相应反应混合物的气相色谱分析并以重量百分数表示。如上所述,所用H2O2的浓度对于所得2,4,6-三甲基醌醇的量和获得该化合物的选择性的作用最小。为了研究这,根据实施例13-15,将2.5g(18.4mmol)酚作为初始进料引入30ml甲醇中并与0.75g(18.8mmol)氢氧化钠(NaOH)掺和。搅拌所得悬浮液直至氢氧化钠(NaOH)完全溶解(需要约10分钟)。然后将所得溶液与0.1摩尔当量铋化合物掺和,其中摩尔当量基于酚原料。然后在室温下在1小时内添加21g(185.3mmol)H2O2至反应混合物中,但此时过氧化氢(H2O2)为30重量%浓度水溶液,而不是50重量%浓度水溶液。然后在室温下再搅拌浅黄色悬浮液12小时,借助气相色谱法分析反应混合物。对比实施例5和13以及8和14并且例如也在11和15中,可明显看出使用30重量%浓度的H2O2溶液如使用50重量%浓度溶液那样获得同样好的结果。因此,如上所述,所述方法程序基本上与H2O2浓度无关并由此明显优于使用钼和/或钼酸盐化合物。这是因为后者在高浓度H2O2溶液情况下或当添加大量H2O2时具有形成钼酸盐络合物的趋势,其不再能够由H2O2释放单线态氧1O2。实施例31最后,也研究了反应物的添加顺序对就产物2,4,6-三甲基醌醇而言的收率和选择性具有什么影响。为此,将5.00g(36.7mmol)酚溶解于10ml甲醇中并将该溶液吸入注射器中,然后将其填充另外甲醇至总体积23ml(溶液1)。在烧瓶中,将2.1g(37.43mmol)氢氧化钾(KOH)溶解于60ml甲醇中并添加1.71g(3.67mmol)氧化铋Bi2O3。搅拌该混合物5分钟,得到溶液2。然后借助注射泵在1小时内同时向其中滴加所制备的溶液1和25g(367.7mmol)50重量%浓度过氧化氢溶液,在此期间确保反应温度不超过32℃。然后在室温下过夜搅拌该混合物并借助气相色谱法分析反应混合物。在这些条件下,2,4,6-三甲基醌醇的收率为30%,就该化合物而言的选择性为46%。这表明收率和选择性相比于在表1中给出的值是下降的并表明反应物一起混合的顺序对本发明方法的收率有影响。在图4中,可看出用本发明铋化合物,可由H2O2释放大量单线态氧1O2,并且在与酚反应期间,它们导致原料的高转化率以及同时对于2,4,6-三甲基醌醇的高选择性组合。这里钼化合物和镧化合物明显是差的,因为虽然它们充其量导致酚的高转化率,但它们选择性差得多地产生化合物2,4,6-三甲基醌醇。然而,本发明方法不限于上述实施方案之一,而是可以各种方式改变。例如,根据所述方法,可以不仅氧化酚,而且可以氧化选自如下组的化合物:2-丁烯、异丁烯、2-甲基-1-丁烯、2-己烯、1,3-丁二烯、2,3-二甲基丁烯、Δ9,10-八氢化萘、2-苯二酰亚氨基-4-甲基-3-戊烯、2,3-二甲基-1,3-丁二烯、2,4-己二烯、2-氯-4-甲基-4-戊烯、2-溴-4-甲基-3-戊烯、1-三甲基甲硅烷基环己烯、2,3-二甲基-2-丁烯基对甲苯基砜、2,3-二甲基-2-丁烯基对甲苯基亚砜、N-环己烯基吗啉、2-甲基-2-降冰片烯、萜品醇、α-蒎烯、β-蒎烯、罗勒烯、香叶醇、法尼醇、萜品烯、柠檬烯、反-2,3-二甲基丙烯酸、α-萜品烯、异戊二烯、环戊二烯、1,4-三苯基丁二烯、2-乙氧基丁二烯、1,1’-二环己烯基、胆甾醇、麦角甾醇乙酸酯、5-氯-1,3-环己二烯、3-甲基-2-丁烯-1-醇、3,5,5-三甲基环己-2-烯-1-醇、苯酚、1,2,4-三甲氧基苯、2,3,6-三甲基苯酚、1,4-二甲基萘、呋喃、糠醇、糠醛、2,5-二甲基呋喃、异苯并呋喃、2,3-二甲基吲哚、亚硫酸二苄基酯、亚硫酸(2-甲基-5-叔丁基)苯基酯等。在用由过氧化氢释放的单线态氧来氧化酚的方法中,该释放在铋化合物作为催化剂存在下进行。这以高收率和选择性得到2,4,6-三甲基醌醇作为产物,其可在其他反应中用于合成维生素,尤其是维生素A和维生素E。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1