诊断和预示乳腺癌的标志物的制作方法与工艺
本发明属于生物技术和医学领域,更具体的,本发明涉及一种乳腺癌标志物及其用途,乳腺癌诊断、动态检测以及预后判断的试剂或试剂盒及其使用方法。
背景技术:
据世界卫生组织(WHO)统计,全世界每年约有120万妇女发生乳腺癌。我国每年有超过40万人罹患乳腺癌,发病率逐年上升。在北京、上海等大城市,乳腺癌已经升至女性恶性肿瘤的第一位。30年来,上海乳腺癌发病率已从17.7/10万上升至70/10万,居各类女性肿瘤发病之首,其发病率已由女性恶性肿瘤中的第2位跃至首位,死亡率高达40%以上。乳腺癌早期检出率和总体治愈率不断提高,但WHO2008年报告每年约有54万乳腺癌患者死亡,国内致死率每年还在以3%的速度增长。乳腺癌的防治仍存在大量亟待解决的问题,包括如何更早期发现、及时干预,如何实现疗效评估和监测,如何对术后患者做到实时准确的复发监控。发展具有高灵敏度、特异性强的乳腺癌诊断产品,是提高乳腺癌早期检出率、改善患者预后的关键之一。在肿瘤发生发展过程中,作为组织蛋白酶的天然抑制蛋白Cystatin基因家族与肿瘤的发生发展关系密切。在组织和体液中,Cystatin家族蛋白可逆性地结合半胱氨酸蛋白酶,防止组织蛋白酶的活性过度。CystatinC是组织蛋白酶B最强的抑制蛋白,但是在卵巢癌和头颈部癌症中,cystatinC的表达有不同水平的上升。而在非小细胞肺癌中,stefinA(cystatin家族成员)的表达水平有所增加;在脑膜瘤中,stefinB在mRNA水平上有明显降低;cystatinF(亦称为leukocystatin或CMAP)在多种肿瘤中的表达水平都有显著增加。研究结果显示,cystatin的几个家族成员在不同肿瘤中的表达水平有所上升,很可能是由于在肿瘤发生发展过程中需要组织蛋白酶的参与,先诱导其表达量增加,再激活机体本身的应激机制,导致cystatin的表达量上升以抑制过盛的蛋白酶活性。但cystatin的表达量并不与肿瘤的发展成正相关的关系,因为在胶质瘤中,cystatinC的低表达意味着疾病的晚期,病人的生存期较短,且易于复发,该结论在mRNA和蛋白水平上都得到了验证。本发明证实cystatin家族成员CST4及其剪切子的表达水平与乳腺肿瘤关系密切。CST4,又名cystatinS,是半胱氨酸蛋白酶抑制剂(cystatin)家族成员,含141个氨基酸,分布于多种体液和分泌物中,如眼泪、唾液、血清、血浆等。
技术实现要素:
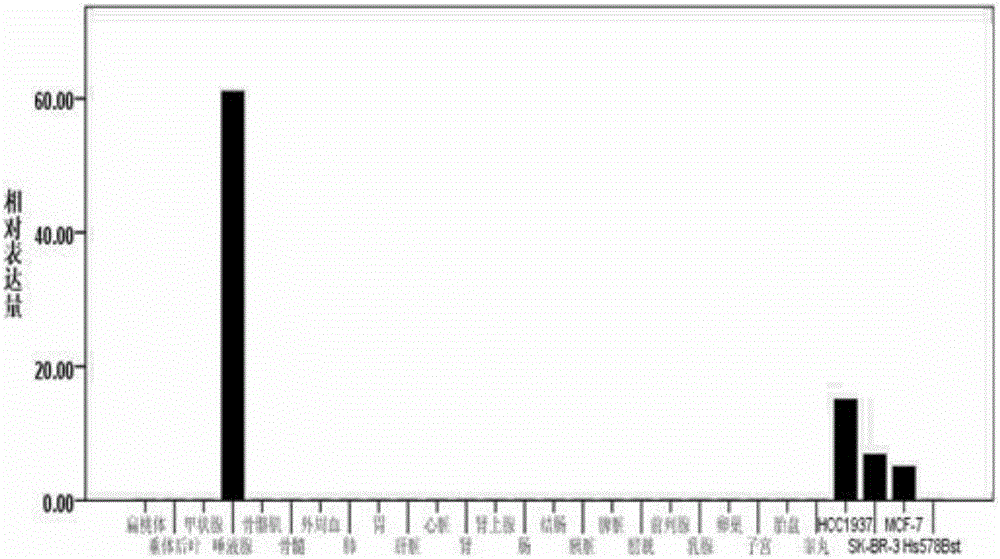
本发明的目的之一在于提供CST4基因、CST4基因的mRNA、CST4基因剪切子的cDNA、CST4特异性引物对应的扩增子、CST4基因编码的CYSTATINS蛋白和CYSTATINS蛋白的表位肽的新应用,该应用为乳腺癌的诊断提供了新思路。为实现上述目的,本发明的技术方案为:1.CST4基因、CST4基因的mRNA、CST4基因剪切子的cDNA、CST4特异性引物对应的扩增子、CST4基因编码的CYSTATINS蛋白和CYSTATINS蛋白的表位肽在制备诊断和预示乳腺癌标志物中的应用,所述CST4基因的核苷酸序列如SEQIDNo:42所示。优选的,CST4基因、CST4基因的mRNA、CST4基因剪切子的cDNA的探针如核苷酸序列如SEQIDNo:3所示。优选的,所述扩增子的特异性引物,其上游引物如SEQIDNo:1,4,6,8,10,12,14,16,18,20;所示,下游引物如SEQIDNo:2,5,7,9,11,13,15,17,19,21所示,上游引物SEQIDNo:1与下游引物如SEQIDNo:2配对;上游引物SEQIDNo:4与下游引物如SEQIDNo:5配对;上游引物SEQIDNo:6与下游引物如SEQIDNo:7配对;上游引物SEQIDNo:8与下游引物如SEQIDNo:9配对;上游引物SEQIDNo:10与下游引物如SEQIDNo:11配对;上游引物SEQIDNo:12与下游引物如SEQIDNo:13配对;上游引物SEQIDNo:14与下游引物如SEQIDNo:15配对;上游引物SEQIDNo:16与下游引物如SEQIDNo:17配对;上游引物SEQIDNo:18与下游引物如SEQIDNo:19配对;上游引物SEQIDNo:20与下游引物如SEQIDNo:21配对。优选的,所述CYSTATINS蛋白的表位肽的氨基酸序列如SEQIDNo:50所示。所述诊断和预示优选为:所述诊断和预示具体为:乳腺癌的转移、微转移、pTNM分期、治疗过程中的动态检测及预后判断。本发明的目的之二在于提供若干种捕获剂,其能和乳腺癌标志物特异性的结合。为实现上述目的,本发明的技术方案为:乳腺癌标志物的捕获剂,所述捕获剂为所述诊断和预示乳腺癌标志物的捕获剂,所述乳腺癌标志物为CST4基因、CST4基因的mRNA、CST4基因剪切子的cDNA、CST4特异性引物对应的扩增子、CST4基因编码的CYSTATINS蛋白和CYSTATINS蛋白的表位肽。所述3)中的所述引物的核苷酸序列如SEQIDNo:1-2所示。所述2)中的所述探针的核苷酸序列如SEQIDNo:3所示。所述3)中的所述扩增子的核苷酸序列如SEQIDNo:43所示。所述捕获剂为所述CYSTATINS蛋白或所述识别CYSTATINS蛋白的表位肽的特异性抗体。所述CYSTATINS表位肽的氨基酸序列如SEQIDNo:50所示。本发明的目的之三在于提供捕获剂的新应用及根据该应用原理制备的试剂盒及其使用方法;该应用和试剂盒为检测乳腺癌提供了新思路,其准确性高;该方法操作简单,适用于临床大规模使用。为实现上述目的,本发明的技术方案为:所述捕获剂在制备乳腺癌检测试剂或试剂盒中的应用。含有所述的捕获剂的诊断试剂盒。所述诊断试剂盒具体为:1)为基于Taqman水解探针法的CST4mRNA实时定量检测试剂盒,其上游引物如SEQIDNo:1,其下游引物SEQIDNo:2所示,所述探针的核苷酸序列如SEQIDNo:3所示;或2)为基于染料法的CST4mRNA实时定量检测试剂盒,其上游引物如SEQIDNo:1,其下游引物SEQIDNo:2所示;及以内参引物,所述内参引物的上游引物如SEQIDNo:30所示,下游引物如SEQIDNo:31所示;或3)为基于核酸序列扩增法的CST4mRNA定量检测试剂盒或基于转录介导的扩增的CST4mRNA定量检测试剂盒,两者均含有CST4引物和探针,所述CST4的上游引物如SEQIDNo:32所示,所述下游引物如SEQIDNo:2所示,所述探针如SEQIDNO:3所示;或4)为基于连接酶链反应的CST4mRNA定量检测试剂盒,其含有4条探针,所述探针的核苷酸序列分别如SEQIDNo:33-36的核苷酸序列所示;或5)为基于适温链置换扩增的CST4mRNA定量检测试剂盒,其含有引物和探针,所述引物如SEQIDNo:37-40所示,所述探针如SEQIDNo:41所示。所述诊断试剂盒可优选为:1)双抗夹心Elisa试剂盒,包括固相载体、固定在固相载体上的所述捕获剂、生物素标记的所述捕获剂及显色底物;固定在固相载体上的所述捕获剂为特异性单抗,生物素标记的所述捕获剂为多抗;或2)蛋白印迹试剂盒包括固相载体、捕获剂、酶标二抗及显色底物,捕获剂包括特异性单抗,生物素标记的所述捕获剂为特异性多抗;或3)竞争ELISA试剂盒包括固相载体、固定在固相载体上的抗原;生物素标记的捕获剂及显色底物;特异性单抗;生物素标记的所述捕获剂为特异性多抗。所述诊断试剂盒还包括阳性对照、阴性对照或/和空白对照。所述双抗夹心Elisa试剂盒中,所述特异性单抗为鼠单抗,抗-CYSTATINS蛋白,所述固相载体为酶标板,所述生物素标记的特异性多克隆抗体为加入生物素标记的兔抗-CYSTATINS蛋白的多抗。所述试剂盒为基于双抗夹心法的ELISA诊断试剂盒,所述固相载体为酶标板,所述固定在固相载体上的捕获剂为鼠抗-CYSTATINS蛋白单抗(R&D,MAB1296)(5ug/ml),生物素标记的捕获剂为兔抗-CYSTATINS蛋白的多抗(1:1000),显色底物为碱性磷酸酶;或所述试剂盒为基于竞争Elisa法的诊断试剂盒,所述固相载体为酶标板,所述CYSTATINS蛋白的浓度为5ug/ml,所述特异性单抗为鼠抗-CYSTATINS蛋白单抗(R&D,MAB1296,1:2000),所述酶标二抗为碱性磷酸酶标记的山羊抗-小鼠IgG,所述酶标二抗效价为1:2000(Jackson,1:2000,溶于TBS中的0.3%BSA中),所述显色底物为碱性磷酸酶底物,所述CYSTATINS蛋白、酶标二抗及显色底物的体积比为1:2;或所述试剂盒为基于免疫印记的诊断试剂盒,所述固相载体为硝酸纤维素膜,捕获剂为CYSTATINS鼠单抗(1:1000),酶标二抗为缀合至过氧化物酶(Jackson)的山羊抗-兔IgG,显色底物为商品化的TMB溶液(KirkegaardandPerryLaboratoriesInc.(Gaithersburg;MD))“TMBPeroxidaseSubstrate”solutionCat.No。50-76-01)。所述的试剂盒的使用方法,其特征在于,具体步骤包括:将CorningELISA平板孔用CYSTATINS(Abnova,cat.NoH00001472-P01)(5ug/ml)覆盖且用3%BSA封闭。将包含抗-CYSTATINS鼠单抗(R&D,cat.NoMAB1296)(1:2000)与8个倍比稀释的血清样品于4度温育过夜。随后加至覆盖的ELISA板中且37度温育1小时。每孔用TBS(溶于PH=7.5的10mMTris-HCl中的154mM的NaCl)洗涤且缀合至碱性磷酸酶中的山羊抗-小鼠IgG(Jackson,1:2000,溶于TBS中的0.3%BSA中)在37度反应1小时。加入碱性磷酸酶底物(KPL,100ul每孔,BluePhossolutioncat.No508805KirkegaardandPerryLaboratoriesInc.(Gaithersburg,MD)),利用ELISA读数器在405nm波长处定量OD。本发明的目的之四在于提供一种乳腺癌的体外诊断方法和体外诊断试剂盒,该方法操作简单,特异性和灵敏性高。为实现上述目的,本发明的技术方案为:运用所述的诊断试剂盒检测或预示乳腺癌的方法,用所述诊断试剂盒检测待测样品中所述乳腺癌标志物的含量或表达水平,将得到的含量或表达水平与正常人进行比较,判定所述待测样品是否为阳性;或直接判定所述含量或表达水平是否超过阈值,当超过阈值时,判定为阳性;所述阈值是通过对比正常人与乳腺癌患者体液或组织中标志物的含量或表达水平统计得到;所述待测样品为血液、尿液、骨髓、乳腺癌细胞株或乳腺癌及癌旁手术组织、淋巴结中的任一种或多种。如所述CYSTATINS蛋白的阈值为在3.434ng/ml。用于诊断和预示乳腺癌的试剂盒,所述试剂盒用于检测CYSTATINS蛋白水平,包括固相载体、固定在固相载体上的所述捕获剂、生物素标记的所述捕获剂及显色底物;固定在固相载体上的所述捕获剂为特异性单抗,生物素标记的所述捕获剂为特异性多抗;或所述试剂盒用于检测CYSTATINS蛋白的水平,所述试剂盒包括固相载体、包被于固相载体的CYSTATINS蛋白、CYSTATINS特异性鼠单抗、酶标二抗及显色底物;或所述试剂盒用于检测CYSTATINS蛋白水平,包括固相载体、捕获剂、酶标二抗及显色底物,捕获剂包括特异性单抗,生物素标记的所述捕获剂为特异性多抗。所述试剂盒为基于双抗夹心法的ELISA诊断试剂盒,其特征在于,所述固相载体为酶标板,所述固定在固相载体上的捕获剂为鼠抗-CYSTATINS蛋白单抗,生物素标记的捕获剂为效价为1:1000的兔抗-CYSTATINS蛋白的多抗,显色底物为碱性磷酸酶;或所述试剂盒为基于竞争Elisa法的诊断试剂盒,其特征在于,所述固相载体为酶标板,所述CYSTATINS蛋白的浓度为5ug/ml,所述特异性单抗为鼠抗-CYSTATINS蛋白单抗,其效价为1:2000,所述酶标二抗为碱性磷酸酶标记的山羊抗-小鼠IgG,所述酶标二抗效价为1:2000,所述显色底物为碱性磷酸酶底物,所述CYSTATINS蛋白、酶标二抗及显色底物的体积比为1:2;或所述试剂盒为基于免疫印记的诊断试剂盒,其特征在于,所述固相载体为硝酸纤维素膜,捕获剂为效价为1:1000的CYSTATINS鼠单抗,酶标二抗为缀合至过氧化物酶的山羊抗-兔IgG,显色底物为TMB溶液。本发明的主要优点在于:1)首次发现并证实CST4mRNA和蛋白表达水平与乳腺癌诊断、动态监测以及预后判断具有密切相关性,验证的样本量多,结果准确。该相关性的提出为乳腺癌诊断、动态监测以及预后判断提供了新的途径。2)开发了适合于乳腺癌诊断、动态监测以及预后判断的试剂或试剂盒,检测灵敏度良好。附图说明下面结合附图及实施例对本发明作进一步描述:图1为CST4与Pmd18-T重组质粒图谱;图2为CST4在人体正常组织中的表达情况(芯片),所述组织包括扁桃体、垂体后叶、甲状腺、唾液腺、骨骼肌、骨髓、除去红细胞和血小板的外周血、肺、胃、肝脏、心脏、肾、肾上腺、肠、结肠、胰脏脾脏、膀胱、前列腺、卵巢、子宫、胎盘、睾丸以及乳腺癌细胞株HCC1937,SK-BR-3,MCF-7,人正常乳腺细胞株Hs578Bst;图3为染料法实时定量PCR给出的CST124;CST1;CST2;CST4在20对乳腺癌和癌旁组织中的表达量差异;图4为Real-timePCR绝对定量法给出的CST4在100例乳腺癌和癌旁组织中的表达量分布;图5为Real-timePCR绝对定量法给出的CST4在40例乳腺癌以及40例穿刺活检标本的表达量分布;图6为Real-timePCR绝对定量法给出的CST4在30枚乳腺癌病理阳性淋巴结,30枚病理阴性淋巴结中表达量分布;图7为通过Real-timePCR绝对定量法检测外周血游离乳腺癌细胞的准确度与细胞学检测的对比;图8为通过Real-timePCR绝对定量法检测乳腺癌骨髓转移的准确度与细胞学检测的对比;图9为乳腺癌病人血浆Cell-freeRNA中CST4量与炎/正常人的差异分析图,A为通过Real-timePCR绝对定量法,乳腺癌病人(50例)血浆Cell-freeRNA中CST4量与炎(30例)/正常人(30例)的差异;B为通过Real-timePCR绝对定量法获得的ROC曲线,区分乳腺癌/炎/正常的敏感性和特异性;图10为通过连接酶链反应(Ligasechainreaction,LCR)方法,乳腺癌病人(50例)血浆Cell-freeRNA中CST4量与炎(30例)/正常人(30例)的差异;图11为通过适温链置换反应(reversetranscriptionstranddisplacementamplification,rtSDA)方法,乳腺癌病人(50例)血浆Cell-freeRNA中CST4量与炎(30例)/正常人(30例)的差异;图12为通过核酸序列扩增法(NucleicAcidbasedAmplificatin,NASBA),30例乳腺癌,20例乳腺炎,20例正常人尿样中CST4的表达差异。图13为通过转录介导的扩增(Transcription-mediatedamplification,TMA),检测80例乳腺癌(pTNM分期,I+II30例,III+IV50例)不同分期CST4表达量的差异。图14显示了CYSTATINS在乳腺癌细胞株培养上清和正常人血清中的表达情况。图15显示了CYSTATINS在乳腺癌细胞株及正常人血清中的表达情况。图16显示了应用单克隆抗体竞争法ELISA检测20例正常人、30例乳腺癌患者血清中CYSTATINS的表达情况。图17显示了ELISA方法检测乳腺癌CYSTATINS蛋白和CEA的在灵敏性和特异性方面的比较。图18显示了乳腺癌患者经治疗后高于CYSTATINS蛋白表达水平中位数组及低于该中位数组的无病生存曲线。具体实施方式第一部分分子检测就分子生物学领域中,下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中为注明具体条件的实验方法,通常按照常规条件如Sambrook等人,分子克隆:实验室指南(NewYork:ColdSpringHarborLaboratoryPress,1989)中所述的条件,或按照制造商所建议的条件。除非另外说明,否则百分比和份数按重量计算。材料和方法:实施例中所用标本均与病人签署知情同意书后按医院规定途径获取,来源于北京友谊医院。穿刺活检获取的病理部位标本和非病理部位样本作为对比,也可是手术中获取的淋巴结等样本应立即提取RNA或置于液氮或RNAlater(Ambion公司产品)中保存。外周血、骨髓或尿液样本首先通过离心机4000rpm,4℃,离心20分钟,取上清,13000rpm,4℃,离心10分钟,分离上清和沉淀,立即提取RNA或置于-20℃至-80℃保存。TaqMan水解探针的Real-timePCR法:上述样本用商业化的核酸抽提方法进行,一个常用的非限制性例子是酚/氯仿抽提方法,如用Invitrogen公司生产的Trizol方法抽提总RNA,并进行RNA质量鉴定,相关方法可参照《分子生物学实验》等参考书描述。mRNA的逆转录过程采用商业化逆转录试剂盒并按操作说明书进行,所得cDNA按比例稀释成需要的工作浓度。所用特异性引物经优化设计,CST4的上下游引物设计在外显子1上。制备包含CST4扩增子的重组质粒,所需的质粒为商业化的Pegm-T(promega)(图1),上下游引物设计在外显子1,3上。采用基于TaqMan水解探针的Real-timePCR法进行CST4扩增。针对CST4的引物和探针,最优的如下:上游引物:gctctcaccctcctctcctg(SEQIDNo:1)下游引物:tatcctattctcctccttgg(SEQIDNo:2)探针:5'-fam-ctccagctttgtgctctgcctctg-tamra-3'(SEQIDNo:3)扩增长度为142bp。针对制备包含CST4扩增子的重组质粒的引物,最优的如下:上游引物:tgcctcgggctctcaccctcctct(SEQIDNo:22)下游引物:tgggtggtggtcggtgtgactggc(SEQIDNo:23)实验组,阳性对照组,阴性对照组与重组质粒标准品一起扩增。依据重组质粒浓度梯度和扩增后对应的CP(crosspoint)作标准曲线。依据该标准曲线给出实验组、阳性对照组和阴性对照组的拷贝数。染料法实时定量PCR:样本处理同TaqMan水解探针的Real-timePCR法,CST1,2,4(可以同时扩增CST1,CST2,CST4的引物)引物,上游引物:agtcccagcccaacttgga(SEQIDNo:24),下游引物:gggaacttcgtagatctggaaaga(SEQIDNo:25);CST4上游引物:agtacaacaaggccaccgaagat(SEQIDNo:4),下游引物:agaagcaagaaggaaggagggag(SEQIDNo:5)或CST4上游引物:tacaacaaggccaccgaagatga(SEQIDNo:6),下游引物:agaagcaagaaggaaggagggag(SEQIDNo:7)或CST4上游引物:tgctactcctgatggctaccctg(SEQIDNo:8),下游引物:gtggccttgttgtactcgctgat(SEQIDNo:9)或CST4上游引物:agtacaacaaggccaccgaagat(SEQIDNo:10),下游引物:taccaggtctattagaagcaagaagga(SEQIDNo:11)或CST4上游引物:tgctactcctgatggctaccctg(SEQIDNo:12),下游引物:catcttcggtggccttgttgtac(SEQIDNo:13)或CST4上游引物:tgctactcctgatggctaccctg(SEQIDNo:14),下游引物:tactcatcttcggtggccttgtt(SEQIDNo:15)或CST4上游引物:tgggattatcctattctcctccttg(SEQIDNo:16),下游引物:ctccagctttgtgctctgcctct(SEQIDNo:17)或CST4上游引物:tgctactcctgatggctaccctg(SEQIDNo:18),下游引物:ctcatcttcggtggccttgttgt(SEQIDNo:19)或CST4上游引物:tacagtgggtgggagtgggtggt(SEQIDNo:20),下游引物:gagtgggtacagcgtgcccttca(SEQIDNo:21);CST2引物,上游引物:cagaagaaacagttgtgctc(SEQIDNo:26)下游引物:ggagtaggaggtggtcag(SEQIDNo:27)CST1引物,上游引物:tctcaccctcctctcctg(SEQIDNo:28)下游引物:ttatcctatcctcctccttgg(SEQIDNo:29),内参基因β-actin,上游引物:aagatcattgctcctcctg(SEQIDNo:30),下游引物:cgtcatactcctgcttgc(SEQIDNo:31)。癌和癌旁组织目的基因和内参基因一起扩增,通过2(癌组织目的基因ct-癌组织内参基因的ct)/2(癌旁组织目的基因ct-癌旁组织内参基因的ct),ct为荧光定量PCR反应孔信号刚刚突破背景时的循环数。公式计算目的基因在癌和癌旁组织中的相对表达量。荧光染料如SYBRGreen,EveGreen,LCGreen等。核酸序列扩增法(NucleicAcidbasedAmplificatin,NASBA)的体外RNA扩增技术:T7RNA聚合酶,RNaseH,禽骨髓白血病病毒(AMV)逆转录酶,核糖核苷酸(NTP),脱氧核糖核苷酸(dNTP),CST4上下游引物同TaqMan水解探针的Real-timePCR法,RNA荧光染料(Ribo-Greenfluorescentdye)。42度,2小时,可将RNA模板扩增2(9-12),反应产物放入荧光检测仪内检测荧光强度(U),从而反应初始模板量。实施例1.CST4与CST家族其他成员的表达差异1.人体不同组织中CST4的表达差异所用人体组织标本除正常乳腺组织为发明人从北京友谊医院收集外,其它各组织均从商业化机构购买。采用Affymetrix的核苷酸芯片HG-U95Av进行各正常组织CST4mRNA表达比较,操作过程参照产品说明书。本实验的相对表达量的值是通过管家基因β-actin荧光值进行归一化处理后的标准化信号值。结果如图2所示,除唾液腺中CST4表达量较高外,其它组织中CST4不表达,说明CST4mRNA表达在正常组织中的背景值很低,这对CST4用于病理条件下检测极为有利。在结乳腺癌细胞株HCC1937,SK-BR-3,MCF-7中过表达,在人正常乳腺细胞Hs578Bst不表达,说明CST4可作为乳腺癌分子诊断的Marker。2.乳腺癌及癌旁手术组织样本CST4与CST124,CST1,CST2mRNA表达量比较通过比较20对编号C1-C20的乳腺癌及癌旁组织中CST124,CST1,CST2,CST4mRNA表达量,发现CST4mRNA在乳腺癌和癌旁组织中表达量差异较大,仅次于CST1。结果见图3。上述标本均通过病理证明,采用染料法实时定量PCR,阳性样本正常扩增,阴性样本未扩增。基于染料法的CST4mRNA实时定量检测试剂盒试剂盒中含有:(1)CST4引物,包括:上游引物:agtacaacaaggccaccgaagat(SEQIDNo:4)下游引物:agaagcaagaaggaaggagggag(SEQIDNo:5)或上游引物:tacaacaaggccaccgaagatga(SEQIDNo:6)下游引物:agaagcaagaaggaaggagggag(SEQIDNo:7)或上游引物:tgctactcctgatggctaccctg(SEQIDNo:8)下游引物:gtggccttgttgtactcgctgat(SEQIDNo:9)或上游引物:agtacaacaaggccaccgaagat(SEQIDNo:10)下游引物:taccaggtctattagaagcaagaagga(SEQIDNo:11)或上游引物:tgctactcctgatggctaccctg(SEQIDNo:12)下游引物:catcttcggtggccttgttgtac(SEQIDNo:13)或上游引物:tgctactcctgatggctaccctg(SEQIDNo:14)下游引物:tactcatcttcggtggccttgtt(SEQIDNo:15)或上游引物:tgggattatcctattctcctccttg(SEQIDNo:16)下游引物:ctccagctttgtgctctgcctct(SEQIDNo:17)或上游引物:tgctactcctgatggctaccctg(SEQIDNo:18)下游引物:ctcatcttcggtggccttgttgt(SEQIDNo:19)或上游引物:tacagtgggtgggagtgggtggt(SEQIDNo:20)下游引物:gagtgggtacagcgtgcccttca(SEQIDNo:21)β-actin:上游引物:aagatcattgctcctcctg(SEQIDNo:30)下游引物:cgtcatactcctgcttgc(SEQIDNo:31)(2)常规的核酸抽提液及逆转录试剂,SYBRGreen染料,dNTP,Taq酶,无RNA酶的水(RNase-freeH2O)、标准品、阳性对照品、阴性对照品10*Buffer,Mgcl2。实施例2CST4在不同部位与组织的表达差异1乳腺癌及癌旁手术组织样本CST4表达差异使用Taqman水解探针法的CST4mRNA实时定量检测试剂盒制备试剂盒,所述的试剂盒中含有:(1)引物,探针,包括:上游引物:gctctcaccctcctctcctg(SEQIDNo:1)下游引物:tatcctattctcctccttgg(SEQIDNo:2)探针:5'-fam-ctccagctttgtgctctgcctctg-tamra-3'(SEQIDNo:3)(2)常规的核酸抽提液及逆转录试剂,dNTP、Taq酶,无RNA酶的水(Rnase-freeH2O)、CST4重组质粒标准品、阳性对照品、阴性对照品,10*Buffer,Mgcl2。通过手术取样的样本均经病理验证后才进行RNA抽提和逆转录cDNA,Real-timePCR绝对定量法鉴定CST4在乳腺癌和癌旁组织中的表达差异,测试样本数为100对,标准曲线线性、扩增效率符合要求,阳性样本检测阳性,阴性样本检测阴性,无模板对照未扩增。图4的结果表明,乳腺恶性病理条件下特异性高表达CST4mRNA,而癌旁组织低表达。癌拷贝的中位数是癌旁拷贝中位数的约7.08倍,提示CST4mRNA可作为良好的乳腺癌分子标志物。在264.92拷贝处划线,可将癌与正常区分开来,因此264.92拷贝可作为乳腺癌临床诊断的一个参考值。2穿刺活检取样的乳腺癌、乳腺炎中CST4的表达差异。穿刺活检取样与手术取样的样本具有较大差别,主要表现在取样组织中乳腺癌细胞的比例变动很大,有时可能仅占到整块组织的很小一部分,有的甚至没有。因此本发明人统计比较了40例乳腺癌以及40例乳腺炎病人穿刺活检取样标本中CST4的表达差异,癌标本拷贝数的中位数是炎标本拷贝数中位数约9.15倍,如果在113.795拷贝处划线,可以将癌和炎区分开来,可为穿刺活检取样乳腺癌诊断提供参考。结果见图5,方法同样采用Real-timePCR绝对定量的方法,标准曲线线性、扩增效率符合要求,阳性样本检测阳性,阴性样本检测阴性,无模板对照未扩增。3CST4在乳腺癌转移阳性淋巴结和阴性淋巴结中的表达差异手术中获得的经病理证明为乳腺癌转移阳性的淋巴结30枚,且转移灶大小不等。病理阴性淋巴结30枚主要取自早期乳腺癌病人,原因是尽可能减少病理诊断阴性但实际有微转移存在的淋巴结,以避免实验误差。实验采用Real-timePCR检测方法,具体材料和过程同实施例2,标准曲线线性、扩增效率符合要求,阳性样本检测阳性,阴性样本检测阴性,无模板对照未扩增。图6的结果表明,CST4在转移阳性淋巴结中高表达,而在阴性淋巴结中只有较低表达。转移阳性淋巴结CST4mRNA表达量是阴性淋巴结中的8.458倍。如果从120.66拷贝处划线,基本可区分乳腺癌转移阳性和阴性淋巴结。病理阴性淋巴结中有两例检出CST4弱阳性的淋巴结,经病理医师连续切片细致观察,鉴定有微转移的存在。因此,从CST4mRNA表达程度划分不仅100%区分了细胞学检测结果,而且能检测细胞学不能检出的有微转移存在的淋巴结,相比细胞学检测该检测方法具有更高的灵敏度。4定量PCR检测外周血中游离乳腺癌细胞的准确度与细胞学检测对比除去红细胞和血小板的外周血有核细胞提取RNA,经Real-timePCR方法定量检测CST4mRNA表达水平,通过和乳腺炎病人和正常人表达量的对比,判断乳腺癌患者的外周血中是否有游离乳腺癌细胞的存在,并和细胞学检测比对。图7的结果表明,本发明的检测方法100%确认细胞学鉴定的阳性结果,同时可检测出细胞学鉴定阴性的病例中有部分转移病例,说明该方法比细胞学检测具有更高的灵敏度,能检测到细胞学无法检测的微转移的存在。5定量PCR方法检测乳腺癌骨髓转移与细胞学检查结果对比穿刺等方法获得的乳腺癌患者骨髓经Real-timePCR方法定量检测CST4mRNA表达水平,通过和正常骨髓的比较判断CST4mRNA是否高表达,确认骨髓是否存在转移和微转移,并与细胞学结果进行了比较。图8的结果表明,本发明的检测方法可95%确认细胞学阳性结果,同时阳性率高于细胞学结果,表明敏感性比细胞学检测方法要高。实施例3CST4量与炎/正常人的差异1乳腺癌病人血浆Cell-freeRNA中CST4量与炎/正常人的差异应用商品化的试剂盒,抽提血浆中Cell-freeRNA,Real-timePCR检测乳腺癌病人(50例)血浆Cell-freeRNA中CST4量与炎(30例),正常人(30例)的差异。结果如图9所示,图9-A显示CST4在癌中拷贝数的中位数是炎的约8.87倍,正常的25.62,在拷贝数71.218处划线,可将癌和炎/正常区分开来。图9-B的ROC曲线显示基于CST4表达量诊断乳腺癌的方法具有较高的灵敏度和特异性(曲线下面积0.987),因此CST4可作为非侵入性的血浆样本乳腺癌诊断的特异性分子标记。2连接酶链反应(Ligasechainreation,LCR)方法检测乳腺癌病人血样Cell-freeRNA中CST4量与炎/正常人的差异基于连接酶链反应(Ligasechainreation,LCR)的CST4mRNA定量检测试剂盒所述的试剂盒中含有:(1)探针4条(半抗原标记)gggctctggcctcgagctccaagga(SEQIDNo:33);ataggataatcccaggtggcatctatgatg(SEQIDNo:34);tctcctccttggagctcgaggccagagccc(SEQIDNo:35);catcatagatgccacctgggattatcctat(SEQIDNo:36);(2)商业化的核酸提取试剂、逆转录试剂,其它试剂同AbbottLaboratories(LCX)应用商品化的试剂盒,抽提血浆中Cell-freeRNA,LCR检测乳腺癌病人(50例)血浆Cell-freeRNA中CST4表达量与炎(30例),正常人(30例)的差异。结果如图10所示,CST4在癌中相对荧光强度(relativelightunits,RLU)的中位数是炎的10.881倍、正常的35.286倍,在相对荧光强度17.458RLU处划线,可将癌和炎/正常区分开来。3适温链置换扩增(reversetranscriptionstranddisplacementamplification,rtSDA)方法检测乳腺癌病人血样Cell-freeRNA中CST4量与炎/正常人的差异适温链置换扩增(thermophilicstranddisplacementamplification,tSDA)的CST4mRNA定量检测试剂盒(1)试剂盒中含有:CST4B1引物:cccggcctctgtgtaccctgcta(SEQIDNo:37)CST4S1引物:gaa-ctcgagctaccctggctggggctctgg(SEQIDNo:38)CST4B2引物:ggtggccttgttgtactcgctgat(SEQIDNo:39)CST4S2引物:gct-ctcgagagtgaagggcacgctgtac(SEQIDNo:40)检测探针:5’-32P-ttactcgagctccaaggaggagaatagga-3’(SEQIDNo:41)(2)常规的核酸抽提液及逆转录试剂,dCTPαS,dATP,dGTP,dTTP,BsobI酶,exo-Bca酶。应用商品化的试剂盒,抽提血浆中Cell-freeRNA,rtSDA检测乳腺癌病人(50例)血浆Cell-freeRNA中CST4量与炎(30例),正常人(30例)的差异。结果见图11,CST4在癌中相对荧光强度(relativelightunits,RLU)的中位数是炎的34.58倍,正常的35.89倍,在相对荧光强度24.095RLU处划线,其作为阈值可将癌和炎/正常区分开来。4乳腺癌病人尿样Cell-freeRNA中CST4量与炎/正常人的差异核酸序列扩增法(NucleicAcidbasedAmplificatin,NASBA)法的CST4mRNA定量检测试剂盒试剂盒中含有:(1)CST4引物,探针,包括:上游引物:aattctaatacgactcactataggg-gctctcaccctcctctcctg(SEQIDNo:32)下游引物:tatcctattctcctccttgg(SEQIDNo:2)分子信标探针:5’-FAM-gcggcctccagctttgtgctctgcctctggccgc-dabsyl-3’(SEQIDNO:3)常规的核酸抽提液及逆转录试剂,T7RNA聚合酶,RNaseH,禽骨髓白血病病毒(AMV)逆转录酶,核糖核苷酸(NTP),脱氧核糖核苷酸(dNTP),RNA荧光染料(Ribo-Greenfluorescentdye)。应用商品化的试剂盒,抽提尿液中Cell-freeRNA,核酸序列扩增法(NucleicAcidbasedAmplificatin,NASBA)检测乳腺癌病人(30例)尿样Cell-freeRNA中CST4量与炎(20例),正常人(20例)的差异。结果如图12所示,CST4在癌中荧光强度的中位数是炎的约15.86倍,正常的约38.35倍,在拷贝数30.92处划线,可将癌和炎/正常区分开来,即可作为非侵入性的尿液样本乳腺癌诊断的参考值。实施例4CST4作为pTNM分期、治疗过程中动态监测及预后判断中的应用转录介导的扩增(Transcription-mediatedamplification,TMA)的CST4mRNA定量检测试剂盒。制备试剂盒,所述的试剂盒中含有:(1)引物,探针,包括:上游引物:aattctaatacgactcactataggg-gctctcaccctcctctcctg(SEQIDNo:32)下游引物:tatcctattctcctccttgg(SEQIDNo:2)分子信标探针:5’-FAM-gcggcctccagctttgtgctctgcctctggccgc-dabsyl-3’(SEQIDNO:3)(2)其它反应试剂为Gen-probeTMAassay中除引物和探针之外的试剂。1.CST4表达量与乳腺癌pTNM分期的关系应用商品化的试剂盒,抽提血浆中Cell-freeRNA,应用Gen-probe转录介导的扩增(Transcription-Mediatedamplification,TMA)方法,检测80例乳腺癌(pTNM分期,I+II30例,III+IV50例)不同分期CST4表达量的差异。结果见图13,CST4在乳腺癌III+IV中相对荧光强度(relativelightunits,RLU)的中位数是I+II的7.2倍,因此CST4表达量可用于乳腺癌pTNM分期。2CST4表达量用于乳腺癌治疗过程中动态监测应用实时定量PCR方法,通过检测病人血液中CST4表达量,实时监测乳腺癌化疗病人6人,放疗病人4人,治疗效果。结果见表1,治疗有效的病人CST4表达量随着疗程的增加逐渐降低,影像学结果也显示,肿块逐渐减小;而治疗无效的病人CST4表达量随着疗程的增加逐渐增加,影像学结果显示,肿块有变大的趋势。因此,CST4可作为乳腺癌患者治疗过程中一个动态监测的指标。表1为通过实时定量PCR检测放化疗过程中乳腺癌患者血液中CST4的量3CST4表达量与乳腺癌患者预后判断的关系基于实时定量PCR技术,分别在术后或放化疗后的1个月、3个月、1年,跟踪随访了5个乳腺癌患者血液中CST4表达量的情况。结果如表2所示,一年后复发的2个病人,CST4表达量随着时间的延长逐渐增高,当达到1000个拷贝左右时才被影像学发现确诊;而1年内没有复发的病人,CST4表达量并无明显变化,影像学也无异常。因此,CST4表达量变化可作为乳腺癌患者预后判断的一个指标。表2为通过实时定量PCR检测手术后或放化疗后1个月、3个月、1年,乳腺癌患者血液中CST4的量。表2为通过实时定量PCR检测随访过程中乳腺癌患者血液中CST4的量第二部分蛋白质部分就蛋白质领域中,本发明涉及用于乳腺疾病诊断和监控以及治疗效果评价的非侵入性标记的抗体、试剂盒、测定法及其使用方法。本发明CYSTATINS重组蛋白购自Abnova(浓度0.06ug/ul,货号H00001472-P01);CYSTATINS鼠单克隆抗体购自R&D(效价为1:2000,货号MAB1296);CYSTATINS兔多克隆抗体购自Abcam(效价为1:800,货号为ab58515)。本发明提供了诊断受试者样品中乳腺状况的测定法及是否转移或复发;此外,还提供了根据受试者样品来评价治疗是否有效的测定法。该测定法优选检测患者样品中至少一种所选蛋白,优选CYSTATINS蛋白,更优选该测定法是定量或至少半定量地检测患者样品中CYSTATINS水平。虽然任意类型的报道分子都可用于检测蛋白,但优选该报道分子为CYSTATINS特异性抗体或其片段。任选地,本发明的方法、测定法和试剂盒可用于发现早期处于无症状前或无症状的人。测定法任选和优选利用至少一种,且优选多种特异性结合至少一种CYSTATINS表位肽的抗体或其片段,用于检测受试者样品中对CYSTATINS的免疫反应的存在。抗体可以是多克隆抗体或单克隆抗体。优选该单克隆抗体可结合至SEQIDNO:50,和/或可由任意一个该序列得到。更优选CYSTATINS的量是确定的。因此,本发明还提供了通过利用至少一种上述抗体定量样品中对CYSTATINS的免疫反应的水平而定量样品中CYSTATINS的水平的测定法。任选和优选受试者为人,且检测的免疫反应以抗体和人多肽为特征。该免疫反应可任选地通过利用任何合适的测定法而检测,所述测定法包括但不限于ELISA(酶联免疫吸附测定)或免疫印迹如蛋白印迹或其组合。优选利用竞争性ELISA和双抗夹心ELISA。根据优选的实施方案,乳腺状况的诊断或监控、乳腺疾病治疗效果的监控或监控受到检测的免疫反应定量的影响,其代表样品中标记的多肽(CYSTATINS)的量。在其它任选实施方案中,本发明还涉及检测样品中标记蛋白的检测试剂盒。由此能诊断或监控乳腺状况、监控乳腺疾病的治疗效果或评价是否转移复发,其中检测试剂盒包含本发明的至少一种抗体或其片段,其能与存在与所检查流体中的标记多肽(CYSTATINS)反应,以及包含至少一种报告组分,其能检测由抗体或其片段和标记蛋白组成的复合物。如上所述,抗体可以任选为多克隆抗体或单克隆抗体的。优选检测试剂盒,报告组分可以是抗体,其试剂盒中所用的抗体或其片段,且显示标记。在这里,报告组分优选为合适的IgG抗体或合适的IgM抗体。标记任选和优选为能催化显色反应的酶,例如过氧化物酶,以及更优选能共价结合至第二抗体。或者,标记可以是荧光部分,或比色抗体。本发明优选的实施方案中,检测试剂盒为ELISA检测试剂盒。在本发明特别优选的实施方案中,该ELISA检测试剂盒为如下所列实施例部分所述的竞争性ELISA试剂盒和双抗夹心ELISA试剂盒。优选至少一种抗体或其片段与所检查的样品预温育。优选该抗体为单克隆抗体。用于生产抗-CYSTATINS抗体的蛋白与用作示例性固相物质的微量滴定板(此处也称为基质)偶联,且预温育的样品随后灌注平板且之前未与血清中存在的表位结合的抗体可与平板上的蛋白结合。报告组分由合适的免疫球蛋白组成,尤其是抗-IgG抗体和/或抗-IgM抗体,其可检测结合至平板的抗体,且与催化显示的酶和/或荧光标记偶联。在本发明又一优选实施方案中,该检测试剂盒为免疫印迹,也称为蛋白印迹(Westernblot)。在该特点的检测试剂盒中,样品中的蛋白利用电泳凝胶,例如聚丙烯酰胺凝胶转移至固相基质上(例如硝酸纤维素膜)。转移可例如利用电转移进行。随后存在于基质上的蛋白和抗该蛋白的抗体间发生免疫反应。优选利用单克隆抗体或其片段。免疫反应可随后通过合适的方法检测,例如利用酶标记的和/或荧光标记的抗-抗体的抗体。在本发明的又一个优选实施方案中,该检测试剂盒用于流通测定法。在具有该特点的用于测定法的试剂盒中,抗体或其片段结合于柱上,待测样品经过所述柱进行灌注。如上所述抗体可以是多克隆或单克隆的,且优选所用的单克隆抗体包括本发明提及的上述特异性抗体。将待测样品灌注到柱中,且流过所述柱。如果样品包含特异性结合柱上的抗体或抗体级分的蛋白,则其将在柱中截留而不再流过。优选一旦所有样品流体流过该柱。结合至柱的蛋白通过竞争性抗体流过或通过改变缓冲液条件而洗下。优选如果不同的蛋白结合至柱上,则将其在不同的时期洗下。随后测量从洗涤柱获得的或在柱洗涤特定时期发现的蛋白的量。纯化的可溶性蛋白定量的技术为本领域所熟知,例如通过测量包含蛋白的流体的光密度。在本发明进一步优选的实施方案中,提供了测定取自受试者样品中CYSTATINS水平的检测试剂盒,其中双指示剂指示CYSTATINS水平处于正常水平还是高于正常水平。优选取自受试者的样品为流体样品。该检测试剂盒优选包括容纳样品流体的容器、特异性抗体或其片段以及指示剂。优选该抗体为单克隆的,且更优选为本发明如上所述的单克隆抗体。任选和优选该试剂盒进一步包括进行检测所需的溶液和缓冲液,以及任选包含进行检测和解释结果的说明书的印刷品。该检测试剂盒可由本领域技术人员使用,且可用于任何实际场所,包括但不限于医院、诊所和私人住宅。本发明试剂盒所针对的受试者可以为乳腺部不适就医者,且检测包括对受试者进行筛查以检测乳腺癌。本发明试剂盒所针对的受试者可以为乳腺炎患者,且检测包括对受试者进行筛查以检测乳腺癌。本发明试剂盒所针对的受试者可以为有家族性乳腺癌者,且检测包括对受试者进行筛查以检测乳腺癌。本发明所针对的样品包括但不限于血清样品、血浆样品、尿样或血样。血样可包括全血样品或血液级分样品。如上述,本发明知道的抗体可用于乳腺疾病诊断或乳腺癌是否转移复发的评估。本领域技术人员熟知的一些方法可用来应用该指导,如利用此处所述缀合至可检测部分(例如荧光部分)的抗体试剂盒可用于评估获自检测个体的血清,血浆,尿液样品中的CYSTATINS标记水平,并且由此确定疾病的存在/不存在或者甚至是状态。在参阅下列并不意欲限制的实施例后,本发明另外的目的,优点,和新的特征对本领域技术人员将是显而易见的,另外,上文所述以及权利要求部分请求保护的本说明的各个实施方案和方面的每一个都将在下列实施例中找到实验性的支持。材料和方法CYSTATINS重组蛋白:购自Abnova(浓度0.06ug/ul,货号H00001472-P01);抗体:CYSTATINS兔多克隆抗体,购自Abcam(效价为1:800,货号为ab58515);CYSTATINS鼠单克隆抗体购自R&D(效价为1:2000,货号MAB1296)。免疫沉淀法:直接通过添加2mMPMSF,A蛋白-琼脂糖凝胶和抗-CYSTATINS抗体进行细胞上清液(60mm皿的1.5mL)的免疫沉淀,随即在4度旋转过夜。利用通过庚二亚氨酸二甲脂(dimethlpimelimidate)偶联至A蛋白-琼脂糖凝胶的抗-Cystatin抗体,以类似的方法进行血清样品(200ul)的免疫沉淀。如早期研究所述进行免疫沉淀物的洗涤,免疫沉淀物用N-糖苷酶F的处理和SDS-PAGE。简而言之,为了用N-糖苷酶处理,洗涤免疫沉淀物且随后在10ul用于PH=6.0的50mM柠檬酸钠中的0.5%SDS中煮沸,随后加入10ul包含200mMPH=8.0的磷酸钠,PH=8.0的40mMEDTA,3%N-辛基葡糖苷的溶液连同40毫单位N-聚糖酶,且在37度温育过夜,加入20ul样品缓冲液且上样进行SDS-PAGE前煮沸样品。除非另外说明,在15%聚丙烯酰胺(Laemmligel)上进行SDS-PAGE。凝胶通过利用20%2,5-二苯基噁唑的荧光自自显影进行分析且通过之前所述的光密度测定法进行定量。蛋白电转和免疫印迹:将蛋白点转入硝酸纤维素膜上。用溶于PBS中的5%脱脂奶粉和0.1%Brij-35在室温下进行2小时的封闭。封闭后用CYSTATINS兔多克隆抗体4度温育过夜。在包含0.1%Brij-35的PBS中洗涤印迹三次,且用0.27ul的缀合至过氧化物酶(Jackson)的山羊抗-兔IgG在37度下温育1小时,印迹用溶于PBS中的0.1%Brij-35洗涤4次,且用PBS洗涤一次,之后用商品化的TMB溶液(KirkegaardandPerryLaboratoriesInc.(Gaithersburg;MD))“TMBPeroxidaseSubstrate”solutionCat.No。50-76-01和”PeroxidaseSolutionB”Cat.No.50-65-00)进行检测,并且对印迹照相。或者通过ECL方法进行检测,其中利用溶于PH=8.5的100mMTris-HCl中的5.4mM双氧水混合的用于PH=8.5的100mMTris-HCl中的2.5nM鲁米诺,400mM对香豆酸的新鲜制备液,且曝光于AgfaCP-BU膜。竞争法ELISA:将CorningELISA平板孔用CYSTATINS(5ug/ml)覆盖且用3%BSA封闭。将包含CYSTATINS鼠多克隆抗体(1:1000)与8个二重稀释的血清样品于4度温育过夜。随后加至覆盖的ELISA板中且37度温育1小时。每孔用TBS(溶于PH=7.5的10mMTris-HCl中的154mM的NaCl)洗涤且缀合至碱性磷酸酶中的山羊抗-小鼠IgG(Jackson,1:2000,溶于TBS中的0.3%BSA中)在37度反应1小时。加入碱性磷酸酶底物(KPL,100ul每孔,BluePhossolutioncat.No508805KirkegaardandPerryLaboratoriesInc.(Gaithersburg,MD)),利用ELISA读数器在405nm波长处定量OD。双抗夹心ELISA:将CorningELISA平板孔用鼠单抗抗-CYSTATINS蛋白(5ug/ml)覆盖且用3%BSA封闭,将8个二重稀释的血清样品加至覆盖的ELISA板中且37度温育1小时,每孔用TBS(溶于PH=7.5的10mMTris-HCl中的154mM的NaCl)洗涤,加入生物素标记的兔抗-CYSTATINS蛋白的多抗(1:1000(实验前已用生物素标记好并纯化)),37度温育1小时。每孔用TBS(溶于PH=7.5的10mMTris-HCl中的154mM的NaCl)洗涤,加入亲合素-生物素-过氧化物酶复合物(ABC复合物),37度温育1小时。每孔用TBS(溶于PH=7.5的10mMTris-HCl中的154mM的NaCl)洗涤。加入碱性磷酸酶底物(KPL,100ul每孔,BluePhossolutioncat.No508805KirkegaardandPerryLaboratoriesInc.(Gaithersburg,MD)),利用ELISA读数器在405nm波长处定量OD。实施例11乳腺癌细胞株培养上清液中CYSTATINS检测从第一部分可以得出,CST4mRNA在乳腺癌中异常高表达,而CYSTATINS为分泌蛋白,分布于多种体液和分泌物中,为了确定CYSTATINS是否可作为乳腺癌血液检测的标记,取CST4mRNA高表达的乳腺癌细胞株HCC1973,如图14所示中泳道1-2的细胞上清液,1个供体(S1,泳道3-4)的正常人血清,且进行15%的SDS-PAGE。蛋白随后转入硝酸纤维素膜且印迹与抗CYSTATINS抗体反应,随后与山羊抗兔过氧化物酶反应。利用TMB膜过氧化物酶底物(3,3’,5,5’-四甲联苯胺)进行条带的检测。所有方法基本上如上述材料和方法部分中所述的进行。结果如图14所示,下方为内参β-actin蛋白的条带。在泳道1,2中,其分别代表乳腺癌细胞株培养上清,检测到约16Kda条带的存在。泳道3,4,则代表正常血清样本,仅检测到淡淡的16Kda条带的存在。2乳腺癌病人血清中CYSTATINS检测方法同“1”,结果如图15所示,下方为内参β-actin蛋白的条带。泳道3,4代表正常血清样本,仅有很淡的条带;泳道1,2代表乳腺癌病人血清样本均有较明显的条带。3利用单克隆抗体定量检测CYSTATINS血清水平的ELISA测定法实验方法:将5μg/mlCYSTATINS肽加入ELISA平板,4度过夜;正常人血清(20例)、乳腺癌患者血清(30例)与抗CYSTATINS单克隆抗体(1:2000,溶于TBS(溶于PH7.5的10mMTris-HCl中的154mMNaCl)中的0.3%BSA中)预温育,4度过夜。随后将与单克隆抗体温育后的样本加入包被了CYSTATINS肽的ELISA平板,室温孵育1小时。随后与溶于TBS中的0.3%BSA中的0.08μg/ml缀合至AP的山羊抗兔抗体温育,且与磷酸对硝基苯酯(p-NPP)(CHEMICONInternational)反应。显影的颜色随后在ELISA读数器分光光度计中定量。实验结果,如图16所示,正常人血清CYSTATINS浓度中位数为1.35ng/ml,乳腺癌患者血清CYSTATINS浓度中位数为2.95ng/ml,在3.105ng/ml处划线基本可以将癌和正常区分开来,因此可作为乳腺癌临床诊断的一个参考值。4血清/血浆中CYSTATINS和CEA(癌胚抗原)检测灵敏度和特异性比较CYSTATINS蛋白检测方法同“3”,CEA检测应用商品化的试剂盒(德国DRG,货号EIA5071),按照其说明书操作。结果如图17及表3所示,CYSTATINS曲线下面积为0.832大于CEA,即ELISA方法检测血清/血浆中CYSTATINS比检测CEA在灵敏性和特异性方面更具有优越性。表3曲线下面积检验的变量:CYSTATINS,CEA在实际阳性组与实际阴性组之间有至少一个交叉的话,统计可能会有偏差。a.根据非参数假设b.无效假设面积=0.55测定法、试剂盒和其使用方法该实施例提供了本发明的许多关于测定法、试剂盒和其使用方法的非限制性、例证性的实施方案。检测乳腺疾病的方法包括:将可溶性蛋白CYSTATINS抗原固定至支持物上,使用R&D抗体(MAB1296),洗涤,添加标记的第二抗体(碱性磷酸酯酶标记的山羊抗兔IgG,碧云天,货号A0239),洗涤且直接或间接检测和/或测量标记,其反应了结合至抗体的检测的目的蛋白的量。支持物的实例包括但不限于乳胶颗粒、纤维素材料例如纤维素片、塑料测定平板和颗粒等等。所用的抗原可任选例如通过共价结合或物理吸附固定在支持物上。待测样品为人血清等等。任选和优选支持物的表面在样品添加之前通过与牛血清血蛋白(BSA)等等预温育而“封闭”,以至少降低样品中其他抗体非特异性结合支持物的可能性。随后支持物用合适的缓冲液,例如包含表面活性剂的磷酸盐缓冲液等等进行洗涤。标记的第二抗体的非限制性实例为标记的抗-小鼠多克隆抗体。有效的标记包括但不限于各种类型的酶如碱性磷酸酶、荧光素酶、过氧化物酶、β-半乳糖苷酶等等以及各种荧光化合物如荧光素等等。化合物如生物素、抗生物素蛋白、链霉抗生物素蛋白、洋地黄苷等等可插入抗体和标记之间。当标记为酶时,其存在可任选通过添加底物并且检测和/或测量由于酶的催化作用而发生的发光或显色和/或通过测量光吸收的变化而检测和/或测量。当标记为荧光化合物时,可任选通过用紫外光照射该反应体系并且检测和/或测量发射的荧光而检测和/或测量。如果需要可使用感光剂。利用本发明的结合该标记的至少一个表位(SEQIDNO:50)的抗体检测和/或测量标记蛋白CYSTATINS的试剂优选包括抗体或其片段,必要量的第二抗体或基质(如果需要的话),以及任选一种或多种“支持”试剂,其为之前所述试剂作用所必需。这些试剂任选和优选提供于试剂盒中。上述试剂可用作诊断乳腺癌症、分期乳腺癌症、评估是否转移、评估治疗效果的试剂。例如,试剂盒优选以特异性抗体或其片段为特征。任选和更优选该试剂盒还以能检测到受试者样品中标记蛋白存在的报告组分为特征。该报告组分优选为合适第二抗体,任选和优选还包括检测第二抗体的标记(如果需要)。该试剂盒还可任选和优选以一种或多种缓冲液,如和基质预温育以封闭与基质和/或固定其上的蛋白的非特异性反应的“封闭”缓冲液;以及一种或多种用于样品、第二抗体、基质和/或用于在与之前所述的试剂温育之间洗涤基质的缓冲液。当然,还可酌情任选其它试剂。任选地,该试剂盒提供用于竞争测定法,其中对照蛋白结合固相物质。在这种情况下,抗体或其片段与血清样品预温育,随后加于平板。通过报告组分检测抗体与平板的结合,据此本领域技术人员可确定抗体是否结合来自血清的表位,且优选确定结合血清中表位的抗体的量,以及由此确定样品中标记蛋白的量。任选地,该试剂盒提供用于双抗夹心测定法,其中抗CYSTATINS抗体结合固相物质,随后标准品CYSTATINS和处理过的待测样品血清分别加入平板,通过含报告组分的抗CYSTATINS多克隆抗体与平板的结合,据此本领域技术人员可确定抗体是否结合来自血清的表位,且优选确定结合血清中表位的抗体的量,以及由此确定样品中标记蛋白的量。试剂和/或试剂盒的类型,和/或对除该试剂盒之外的其他类型设备和/或与该试剂盒组合的其他类型设备的需求,其每个都取决于使用该试剂盒进行的测定法的类型。如前所述,上述测定法非限制性的实例包括ELISA、蛋白印迹或流式细胞术。用于进行ELISA测定法的实例性方法如上所述。蛋白印迹常常比ELISA更精确但操作需要更多的时间和/或设备。6、例证性的试剂盒及其使用方法标本的采集及保存:血清:全血标本请于室温放置2小时或4℃过夜后于1000xg离心20分钟,取上清即可检测,或将标本放于-20℃或-80℃保存,但应避免反复冻融;血浆:可用EDTA或肝素作为抗凝剂,标本采集后30分钟内于2-8℃1000xg离心15分钟,或将标本放于-20℃或-80℃保存,但应避免反复冻融。样本处理:血清或血浆标本推荐稀释10倍,如:稀释10倍,取100uL血清或血浆加入900uLPBS。标本使用0.1M的PBS稀释(PH=7.0-7.2)。试剂盒中包含以下内容:1)酶联板,覆膜。2)标准品:浓度为100ng/mlCYSTATINS,先用1%BSA的PBST稀释至10ng/mlCYSTATINS,再做系列倍比稀释后,分别稀释成10ng/mlCYSTATINS,5ng/mlCYSTATINS,2.5ng/mlCYSTATINS,1ng/mLCYSTATINS,0.5ng/mlCYSTATINS,0.25ng/ml的CYSTATINS,样品稀释液直接作为标准浓度0ng/mlCYSTATINS,临用前15分钟内配制。如配制4ng/mlCYSTATINS标准品:取0.5ml(不要少于0.5ml)8ng/mlCYSTATINS的上述标准品加入含有0.5ml样品稀释液的Eppendorf管中,混匀即可,其余浓度以此类推。3)3%BSA的PBST封闭液。4)包被抗体5μg/ml鼠抗人CYSTATINS单抗,包被抗体稀释液0.05MPH=9.0NaHCO3。5)生物素标记的兔抗人CYSTATINS多抗(1:200),1%BSA的PBST抗体稀释液。6)ABC(亲合素-生物素-过氧化物酶复合物)。7)TMB显色液。8)PBST(0.05%Tween-20inPBS)。9)终止液:2NH2SO4。具体步骤包括:1)包被:用0.05MPH9,碳酸氢钠包被缓冲液将鼠抗人CYSTATINS单抗稀释至蛋白质含量为5μg/ml,在每个聚苯乙烯板的反应孔中加0.1ml,4℃过夜。次日,弃去孔内溶液,用洗涤缓冲液洗3次,每次3分钟。2)封闭:每孔加200ul含3%BSA的PBST,37度1h或4度过夜。弃去孔内溶液,用洗涤缓冲液洗3次,每次3分钟3)加样:分别设空白孔、标准孔、待测样品孔。空白孔加样品稀释液100μl,余孔分别加标准品或待测样品100μl,注意不要有气泡,加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀,酶标板加上盖或覆膜,37℃反应120分钟。为保证实验结果有效性,每次实验请使用新的标准品溶液。4)弃去液体,甩干,不用洗涤。每孔加生物素标记的兔抗人CYSTATINS多抗100ul(在使用前用1%BSA的PBST1:200稀),酶标板加上覆膜,37℃反应60分钟。5)温育60分钟后,弃去孔内液体,甩干,洗板3次,每次浸泡1-2分钟,大约300μl/每孔,甩干(也可轻拍将孔内液体拍干)。6)每孔加ABC100μL,酶标板加上覆膜37℃反应60分钟。7)温育60分钟后,弃去孔内液体,甩干,洗板5次,每次浸泡1-2分钟,300μL/每孔,甩干(也可轻拍将孔内液体拍干)。8)依序每孔加底物溶液50μL,酶标板加上覆膜37℃避光显色(15分钟内,此时肉眼可标准品的前4-5孔有明显的梯度兰色,后4-5孔梯度不明显,即可终止)。9)依序每孔加终止溶液50μL,终止反应,此时蓝色立转黄色。终止液的加入顺序应尽量与底物液的加入顺序相同。为了保证实验结果的准确性,底物反应时间到后应尽快加入终止液。10)用酶联仪在405nm波长依序测量各孔的光密度(OD值)。在加终止液后立即进行检测。结果计算:根据标准品浓度和对应的OD值绘制散点曲线,标出R平方和曲线方程式。如R平方大于等于0.95,则将待测样品的OD值代入曲线方程式中,算出待测样品浓度。7.CYSTATINS蛋白表达水平用于乳腺癌pTNM分期实验方法同上述“7”,病理确诊的乳腺癌T期病人20人,N期病人30人,M期病人30,结果如表4所示,随着病程的进展,CYSTATINS蛋白表达水平亦随之提高,提示,CYSTATINS蛋白表达水平可用于乳腺癌pTNM分期表4不同病理分期的乳腺癌患者CYSTATINS蛋白表达水平8.CYSTATINS蛋白表达水平用于评估乳腺癌是否转移实验方法同上述“7”,病理确诊的乳腺癌未转移病人20人,转移病人30人结果如表5所示,转移患者CYSTATINS蛋白表达水平高于未转移者,提示CYSTATINS蛋白表达水平可用于指示乳腺癌是否转移。表5转移与未转移乳腺癌患者CYSTATINS蛋白表达水平9.CYSTATINS蛋白表达水平用于评估乳腺癌辅助内分泌治疗联合化疗治疗效果实验方法同上述“7”,研究共纳入2885例N0-1期乳腺癌患者,行4个周期的AC(多柔比星+环磷酰胺)或AT(多柔比星+紫杉醇)方案化疗,再根据激素受体(HR)状况选择是否行辅助内分泌治疗,随访时间为76个月。检测治疗周期结束后CYSTATINS蛋白表达水平,有效数据776例,CYSTATINS蛋白表达中位数3.96ng/ml。结果如图18所示,高于该中位数的患者无病生存49%(Disease-freesurvival,DFS),低于该中位数的患者无病生存64%。可以理解的是本发明为了清楚而在上下文各个实施例中描述的某些特征,也可组合提供于单个实施方案中。反之,本发明为了简便起见而在上下文单个实施方案中所述的不同特征也可单独或以任何的亚组合形式提供。虽然本发明结合其具体实施方案进行了描述,但显然许多替换、修饰、和改变对于本领域技术人员都是显而易见的。因此,其试图包括所有这样的替换、修饰、和改变,其落入附加权利要求的精神和较宽的范围内。说明书提及的所有出版物、专利和专利申请均此处整体引入说明书作为参考,其程度就如每个单独的出版物、专利或专利申请此处具体和单独地引入作为参考一样。此外,该申请中任何参考文献的引用或鉴定将不会被理解为承认所述参考文献可作为发明的现有技术。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1