环状胺衍生物及其药物用途的制造方法与工艺
本发明涉及环状胺衍生物及其药物用途。
背景技术:
疼痛是指在引起组织的损伤时或有此可能性时产生的伴有不快的感觉、不快的情绪的体验。疼痛根据其原因主要分为侵害感受性疼痛、神经障碍性疼痛或心因性疼痛。另外,作为原因不明的疼痛,已知纤维肌痛症。神经障碍性疼痛是指由于末梢或中枢神经系统的功能异常引起的病理性的疼痛,即使侵害感受器未收到侵害刺激,也因神经组织的直接的损伤、压迫等而产生疼痛。作为神经障碍性疼痛的治疗药,可使用抗痉挛药、抗抑郁药、抗焦虑药或加巴喷丁或普瑞巴林等抗癫痫药。纤维肌痛症是指以全身的疼痛为主症状、精神神经症状、自律神经系统的症状为副症状的疾病。作为纤维肌痛症的治疗药,主要使用在美国及日本被批准的普瑞巴林、在美国被批准的度洛西汀和米那普仑,也使用作为纤维肌痛症的治疗药未被批准的非甾体性抗炎症药、阿片类化合物、抗抑郁药、抗痉挛药及抗癫痫药。但是,非甾体性抗炎症药及阿片类化合物的治疗效果一般低(非专利文献1)。另一方面,在专利文献1公开某种取代哌啶类具有强心活性,专利文献2中公开咪唑衍生物显示出FXa抑制作用,在专利文献3中暗示了取代哌啶类对超体重或肥胖具有药效的可能性。现有技术文献[专利文献][专利文献1]法国专利发明第2567885号说明书[专利文献2]日本特开2006-008664号公报[专利文献3]国际公开第2003/031432号[非专利文献][非专利文献1]Recla、JournalofPainResearch、2010年、第3卷、p.89-103。
技术实现要素:
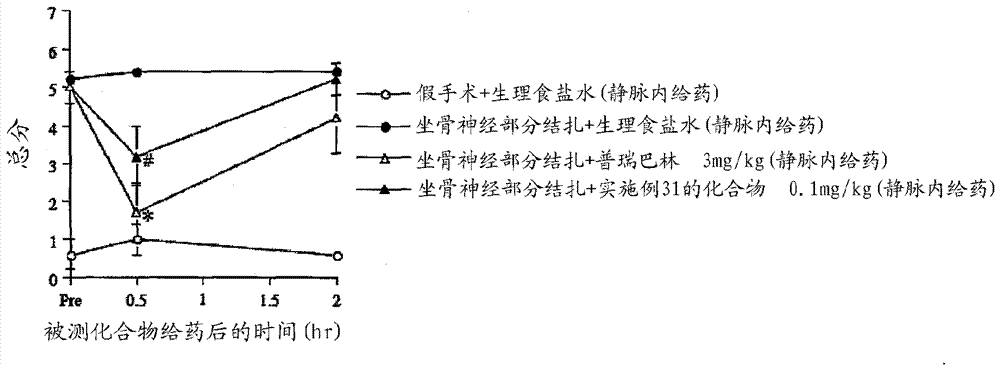
发明要解决的问题但是,在以往的利用神经障碍性疼痛的治疗药的治疗中,由于伴随高频率的眩晕、恶心或呕吐等中枢性的副作用,长期给药变得困难,因此期待新的神经障碍性疼痛治疗药的开发。另外,作为纤维肌痛症的治疗药已知的普瑞巴林、度洛西汀及米那普仑,其对纤维肌痛症的治疗效果在临床上均不能得到满足,在患者中的药效差也大,因此迫切期望发挥充分治疗效果的新的纤维肌痛症治疗药的开发。需要说明的是,对于专利文献1所述的取代哌啶类,暗示了对偏头痛的有效性的内容,但完全没有暗示本申请的具有明显镇痛作用的化合物本身的公开、镇痛作用与化学结构的关联性,对于专利文献2所述的咪唑衍生物及专利文献3所述的取代哌啶类,既没有公开也没有暗示具有镇痛作用的可能性。因此,本发明目的在于提供对疼痛、特别是神经障碍性疼痛和/或纤维肌痛症显示出强的镇痛作用的化合物。解决问题的方法本发明人为了解决上述课题而进行了认真研究,结果发现对疼痛、特别是神经障碍性疼痛和/或纤维肌痛症具有强镇痛作用的环状胺衍生物。即,本发明提供下述通式(I)所示的环状胺衍生物或其药理学上可接受的盐。[化1][式中,A表示通式(IIa)、(IIb)或(IIc)所示的基团,[化2]A表示通式(IIa)或(IIb)所示的基团时,R1表示可以被卤素原子、羟基、氨基或羧基取代的碳原子数1~6的烷基,R2表示氢原子或卤素原子,R3表示氢原子或碳原子数1~6的烷基,R4表示氢原子或碳原子数2~6的烷基羰基、或可以被碳原子数2~6的烷基羰基氨基取代的碳原子数1~6的烷基,n表示1或2,此时,R3及R4分别独立地表示碳原子数1~6的烷基时,R1表示被羟基、氨基或羧基取代的碳原子数1~6的烷基,A表示通式(IIc)所示的基团时,R1表示被羧基取代的碳原子数1~6的烷基,R2表示氢原子或卤素原子,X表示CH2、O或-NR5,R5表示碳原子数1~6的烷基]。上述的环状胺衍生物优选A为通式(IIa)或(IIb),此时,R3更优选氢原子、甲基或乙基,进一步优选R2为氢原子或氯原子,R3为氢原子或甲基,且R4氢原子或甲基羰基、或可以被甲基羰基氨基取代的碳原子数1~6的烷基。更具体而言,例如优选以下通式(Ia)或(Ib)所示的环状胺衍生物或其药理学上可接受的盐,R2为氢原子或氯原子,R3为氢原子或甲基,R4为氢原子或甲基羰基、或可以被甲基羰基氨基取代的碳原子数1~6的烷基,R3及R4共同为甲基时,R1特别优选被羟基、氨基或羧基取代的碳原子数1~6的烷基。[化3][式中,R1表示可以被卤素原子、羟基、氨基或羧基取代的碳原子数1~6的烷基,R2表示氢原子或卤素原子,R3表示氢原子或碳原子数1~6的烷基,R4表示氢原子或碳原子数2~6的烷基羰基、或可以被碳原子数2~6的烷基羰基氨基取代的碳原子数1~6的烷基,R3及R4分别独立地表示碳原子数1~6的烷基时,R1表示被羟基、氨基或羧基取代的碳原子数1~6的烷基]。[化4][式中,R1表示可以被卤素原子、羟基、氨基或羧基取代的碳原子数1~6的烷基,R2表示氢原子或卤素原子,R3表示氢原子或碳原子数1~6的烷基,R4表示氢原子或碳原子数2~6的烷基羰基、或可以被碳原子数2~6的烷基羰基氨基取代的碳原子数1~6的烷基,R3及R4分别独立地表示碳原子数1~6的烷基时,R1表示被羟基、氨基或羧基取代的碳原子数1~6的烷基]。通过限定为这些,可以提高镇痛作用。而且,上述环状胺衍生物优选A为通式(IIc),更优选R2为氢原子或氯原子,R5为甲基。更具体而言,例如优选以下通式(Ic)所示的环状胺衍生物或其药理学上可接受的盐,更优选R2为氢原子或氯原子,R5为甲基。[化5][式中,R1表示被羧基取代的碳原子数1~6的烷基,R2表示氢原子或卤素原子,X表示CH2、O或-NR5,R5表示碳原子数1~6的烷基]。通过限定为这些,可以提高镇痛作用。另外,本发明提供上述环状胺衍生物的前药或其药理学上可接受的盐。该前药优选上述环状胺衍生物的羧基被酯化了的前药。通过限定为这些,可期待对大鼠口服给药而带来的优异的药物动力学。另外,本发明提供含有上述通式(I)所示的环状胺衍生物、该环状胺衍生物的前药或它们的药理学上可接受的盐作为有效成分的药物。上述药物优选为镇痛药,特别更优选为神经障碍性疼痛治疗药或纤维肌痛症治疗药。发明效果本发明的环状胺衍生物或其前药或其药理学上可接受的盐对疼痛、特别是神经障碍性疼痛及纤维肌痛症显示出强镇痛作用,可期待减轻中枢性的副作用,可用作能长给药的镇痛药、特别是神经障碍性疼痛治疗药或纤维肌痛症治疗药。附图说明[图1]显示针对小鼠坐骨神经部分结扎模型的实施例8的化合物的效果的图(口服给药)。[图2]显示针对小鼠坐骨神经部分结扎模型的实施例2的化合物的效果的图(静脉内给药)。[图3]显示针对小鼠坐骨神经部分结扎模型的实施例4的化合物的效果的图(静脉内给药)。[图4]显示针对小鼠坐骨神经部分结扎模型的实施例2的化合物的效果的图(脑室内给药)。[图5]显示针对小鼠坐骨神经部分结扎模型的实施例4的化合物的效果的图(脑室内给药)。[图6]显示针对小鼠坐骨神经部分结扎模型的实施例6的化合物的效果的图(脑室内给药)。[图7]显示针对小鼠坐骨神经部分结扎模型的实施例10的化合物的效果的图(脑室内给药)。[图8]显示针对小鼠坐骨神经部分结扎模型的实施例12的化合物的效果的图(脑室内给药)。[图9]显示针对小鼠坐骨神经部分结扎模型的实施例13的化合物的效果的图(脑室内给药)。[图10]显示针对小鼠坐骨神经部分结扎模型的实施例15的化合物的效果的图(脑室内给药)。[图11]显示针对小鼠坐骨神经部分结扎模型的实施例38的化合物的效果的图(口服给药)。[图12]显示针对小鼠坐骨神经部分结扎模型的实施例13的化合物的效果的图(静脉内给药)。[图13]显示针对小鼠坐骨神经部分结扎模型的实施例18的化合物的效果的图(静脉内给药)。[图14]显示针对小鼠坐骨神经部分结扎模型的实施例22的化合物的效果的图(静脉内给药)。[图15]显示针对小鼠坐骨神经部分结扎模型的实施例25的化合物的效果的图(静脉内给药)。[图16]显示针对小鼠坐骨神经部分结扎模型的实施例27的化合物的效果的图(静脉内给药)。[图17]显示针对小鼠坐骨神经部分结扎模型的实施例29的化合物的效果的图(静脉内给药)。[图18]显示针对小鼠坐骨神经部分结扎模型的实施例31的化合物的效果的图(静脉内给药)。[图19]显示针对小鼠坐骨神经部分结扎模型的实施例33的化合物的效果的图(静脉内给药)。[图20]显示针对小鼠坐骨神经部分结扎模型的实施例66的化合物的效果的图(静脉内给药)。[图21]显示针对小鼠坐骨神经部分结扎模型的实施例68的化合物的效果的图(静脉内给药)。[图22]显示针对小鼠坐骨神经部分结扎模型的实施例70的化合物的效果的图(静脉内给药)。[图23]显示针对大鼠纤维肌痛症模型的实施例13的化合物的效果的图(静脉内给药)。[图24]显示针对大鼠纤维肌痛症模型的实施例38的化合物的效果的图(口服给药)。具体实施方式本说明书中使用的下述术语,只要没有特别说明,如下述定义所示。本发明的环状胺衍生物特征在于由下述通式(I)所表示。[化6][式中,A表示通式(IIa)、(IIb)或(IIc)所示的基团,[化7]A表示通式(IIa)或(IIb)所示的基团时,R1表示可以被卤素原子、羟基、氨基或羧基取代的碳原子数1~6的烷基,R2表示氢原子或卤素原子,R3表示氢原子或碳原子数1~6的烷基,R4表示氢原子或碳原子数2~6的烷基羰基、或可以被碳原子数2~6的烷基羰基氨基取代的碳原子数1~6的烷基,n表示1或2,此时,R3及R4分别独立地表示碳原子数1~6的烷基时,R1表示被羟基、氨基或羧基取代的碳原子数1~6的烷基,A表示通式(IIc)所示的基团时,R1表示被羧基取代的碳原子数1~6的烷基,R2表示氢原子或卤素原子,X表示CH2、O或-NR5,R5表示碳原子数1~6的烷基]。上述的环状胺衍生物优选A为通式(IIa)或(IIb),R3为氢原子、甲基或乙基;更优选R2为氢原子或氯原子、R3为氢原子或甲基、R4为氢原子或甲基羰基、或可以被甲基羰基氨基取代的碳原子数1~6的烷基。另外,上述的环状胺衍生物优选A为通式(IIc)、R2为氢原子或氯原子、R5为甲基。“卤素原子”是指氟原子、氯原子、溴原子或碘原子。“碳原子数1~6的烷基”是指碳原子数1~6的直链状、支链状或环状的饱和烃基,例如可列举甲基、乙基、正丙基、异丙基、环丙基、环丙基甲基、正丁基、仲丁基、叔丁基、正戊基、异戊基、正己基、异己基或环己基。“可以被卤素原子、羟基、氨基或羧基取代的碳原子数1~6的烷基”是指氢原子可以分别独立地被上述卤素原子或羟基、氨基或羧基取代的上述碳原子数1~6的烷基,例如可列举甲基、乙基、正丙基、异丙基、环丙基、环丙基甲基、正丁基、仲丁基、叔丁基、正戊基、异戊基、正己基、异己基或环己基或2-氯乙基、2,2-二氟乙基、2,2,2-三氟乙基、2-羟基乙基、3-羟基丙基、2-氨基乙基、3-氨基丙基、1-羧基甲基或2-羧基乙基。“碳原子数2~6的烷基羰基”是指碳原子数1~5的直链状、支链状或环状的饱和烃基键合于羰基的基团,例如可列举乙酰基、正丙酰基、正丁酰基或异丁酰基。“碳原子数2~6的烷基羰基氨基”是指上述碳原子数2~6的烷基羰基键合于氨基的基团,例如可列举甲基羰基氨基、乙基羰基氨基、正丙基羰基氨基或异丙基羰基氨基。“可以被碳原子数2~6的烷基羰基氨基取代的碳原子数1~6的烷基”是指可以被上述碳原子数2~6的烷基羰基氨基取代的上述碳原子数1~6的烷基,例如可列举甲基、乙基、正丙基、异丙基、环丙基、环丙基甲基、正丁基、仲丁基、叔丁基、正戊基、异戊基、正己基、异己基或环己基或2-(甲基羰基氨基)乙基、2-(乙基羰基氨基)乙基、2-(正丙基羰基氨基)乙基、2-(异丙基羰基氨基)乙基、3-(甲基羰基氨基)丙基或4-(甲基羰基氨基)丁基。上述的通式(I)所示的环状胺衍生物(以下为环状胺衍生物(I))的优选化合物的具体例示于表1-1~表1-3,但本发明不限定于它们。[表1-1][表1-2][表1-3]需要说明的是,环状胺衍生物(I)中存在不对称碳时,包含所有的对映异构体及它们的混合物,存在立体异构体时,包含所有的立体异构体及它们的混合物。另外,本发明包含环状胺衍生物(I)的前药或其药理学上可接受的盐。环状胺衍生物(I)的前药是指在生体内可经酶或化学性地转化为环状胺衍生物(I)的化合物。环状胺衍生物(I)的前药的活性本体为环状胺衍生物(I),环状胺衍生物(I)的前药也可以具有活性。作为环状胺衍生物(I)的前药,例如可列举环状胺衍生物(I)的羟基或氨基被酰化、烷基化、磷酸化或硼酸化了的化合物、或者羧基被酯化或酰胺化了的化合物,优选羧基被酯化了的化合物。这些化合物可根据公知的方法由环状胺衍生物(I)合成。作为环状胺衍生物(I)的羧基被酯化了的化合物,可列举甲基酯化、乙基酯化、正丙基酯化、异丙基酯化、环丙基酯化、正丁基酯化、异丁基酯化、仲丁基酯化、叔丁基酯化、环丙基甲基酯化、正戊基酯化、异戊基酯化、环戊基酯化、正己基酯化、异己基酯化、环己基酯化、正庚基酯化、正辛基酯化、(5-甲基-2-氧代-1,3-二氧杂环戊烯-4-基)甲基酯化、乙酰基氧基甲基酯化、1-乙酰基氧基乙基酯化、丙酰基氧基甲基酯化、1-丙酰基氧基乙基酯化、戊酰基氧基甲基酯化、1-戊酰基氧基乙基酯化、异丁酰基氧基甲基酯化、1-异丁酰基氧基乙基酯化、特戊酰基氧基甲基酯化、1-特戊酰基氧基乙基酯化、乙氧基羰基氧基甲基酯化、1-((乙氧基羰基)氧基)乙基酯化、1-((乙氧基羰基)氧基)异丁基酯化、环己基氧基羰基甲基酯化、1-((环己基)羰基)氧基乙基酯化、2-(二甲基氨基)-2-氧代乙基酯化、邻苯二甲酯化或二氢化茚酯化等化合物,优选甲基酯化、乙基酯化、正丙基酯化、异丙基酯化、环丙基酯化、正丁基酯化、异丁基酯化、仲丁基酯化、叔丁基酯化、环丙基甲基酯化、正辛基酯化、(5-甲基-2-氧代-1,3-二氧杂环戊烯-4-基)甲基酯化、特戊酰基氧基甲基酯化、2-(二甲基氨基)-2-氧代乙基酯化、邻苯二甲酯化或二氢化茚酯化了的化合物。环状胺衍生物(I)的前药的优选化合物的具体例示于表2-1及表2-2,本发明不限定于它们。[表2-1][表2-2]另外,环状胺衍生物(I)的前药可在公知文献(“药物品的开发”、广川书店、1990年、第7卷、p.163~198及Prog.Med.5、1985年、p.2157~2161)记载的生理条件下变化为环状胺衍生物(I)。环状胺衍生物(I)或其前药可以以放射性同位元素标记,作为被标记的放射性同位元素例如可列举3H、14C和/或125I。进而,环状胺衍生物(I)或其前药可以为氘转换体。作为环状胺衍生物(I)的药理学上可接受的盐,可列举例如盐酸盐、硫酸盐、磷酸盐或氢溴酸盐等无机酸盐、或草酸盐、丙二酸盐、柠檬酸盐、富马酸盐、乳酸盐、苹果酸盐、琥珀酸盐、酒石酸盐、乙酸盐、三氟乙酸盐、马来酸盐、葡萄糖酸盐、苯甲酸盐、水杨酸盐、羟萘甲酸盐、双羟萘酸盐、抗坏血酸盐、己二酸盐、甲磺酸盐、对甲苯磺酸盐或肉桂酸盐等有机酸盐。进而这些盐可以形成水合物、溶剂合物或结晶多型。环状胺衍生物(I)或其前药可以根据以下记载的制造方法来合成。需要说明的是,利用以下的制造方法得到的环状胺衍生物(I)或其前药跟利用公知的手段、例如溶剂萃取、再结晶和/或色谱法进行分离纯化,可利用公知的方法或基于其的方法转化为目标盐,环状胺衍生物(I)或其前药以盐的状态得到时,可利用公知的方法或基于其的方法转化为环状胺衍生物(I)或其前药或作为目标的其它盐。在以下记载的制造方法的各反应中,原料化合物具有羟基、氨基或羧基时,可以向这些基团导入保护基,反应后根据需要对保护基进行去保护,由此可得到目标化合物。另外,在以下记载的制造方法的各反应中,原料化合物具有羟基、氨基或羧基时,不对向这些基团导入的保护基进行去保护,也可以得到环状胺衍生物(I)的前药。作为羟基的保护基,例如可列举三苯甲基、碳原子数7~10的芳烷基(例如苄基)或取代甲硅烷基(例如三甲基甲硅烷基、三乙基甲硅烷基或叔丁基二甲基甲硅烷基)。作为氨基的保护基,例如可列举碳原子数2~6的烷基羰基(例如,乙酰基)、苯甲酰基、碳原子数1~6的烷基氧基羰基(例如,叔丁氧基羰基或苄基氧基羰基)、碳原子数7~10的芳烷基(例如,苄基)或邻苯二甲酰基。作为羧基的保护基,例如可列举碳原子数1~6的烷基(例如甲基、乙基或叔丁基)或碳原子数7~10芳烷基(例如苄基)。保护基的去保护根据保护基的种类而不同,可根据公知的方法(例如,Greene,T.W.、“Greene’sProtectiveGroupsinOrganicSynthesis”、Wiley-Interscience公司)或基于其的方法进行。1.化合物(Ia)可根据以下记载的制造方法来合成。1-1.化合物(Ia-a)的制造方法:[化8][式中,M表示氢原子或碱金属,作为碱金属,例如可列举锂或钠。R4a表示可以被碳原子数2~6的烷基羰基氨基取代的碳原子数1~6的烷基,其它各符号与上述定义相同]。环状胺衍生物(I)中,A表示通式(IIa)所示的基团,并且,R4表示可以被碳原子数2~6的烷基羰基氨基取代的碳原子数1~6的烷基的化合物(Ia-a),例如,可通过在碱存在下或非存在下,使用缩合剂,使化合物(IIa-a)与化合物(III)进行缩合反应而得到。缩合反应中,可使用化合物(IIa-a)及其盐。作为此时的盐,例如可列举与上述的药理学上可接受的盐相同的盐。缩合反应中使用的化合物(IIa-a)及化合物(III)可以直接使用市售品,例如可通过以下记载的制造方法来合成。作为缩合反应所使用的碱,可列举例如吡啶或二甲基吡啶等芳香族胺类或三乙基胺、三异丙基胺、三丁基胺、环己基二甲基胺、4-二甲基氨基吡啶、N,N-二甲基苯胺、N-甲基哌啶、N-甲基吡咯烷、N-甲基吗啉或二异丙基乙基胺(DIEA)等叔胺类。缩合反应中的碱的使用量相对于1摩尔的化合物(IIa-a)优选为0.5~10摩尔,更优选0.8~5.0摩尔。作为缩合反应中使用的缩合剂,例如可列举O-(苯并三唑-1-基)-N,N,N’,N’-四甲基脲六氟磷酸盐(HBTU)、环己基碳二亚胺(DCC)、N-(3-二甲基氨基丙基)-N’-乙基碳二亚胺(EDC)或其盐酸盐、2-乙氧基-1-乙氧基羰基-1,2-二羟基喹啉(EEDQ)、羰基二咪唑(CDI)、氰代磷酸二乙酯、苯并三唑-1-基氧基三吡咯烷基鏻六氟磷酸盐(PyBOP)、叠氮磷酸二苯基酯(DPPA)、4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基氯化吗啉鎓(DMTMM)、氯甲酸异丁基酯、二乙基乙酰基氯或氯化三甲基乙酰基氯。这些缩合剂可单独使用或组合N-羟基丁二酰亚胺(HONSu)、羟基苯并三唑(HOBT)、3-羟基-4-氧代-3,4-二氢-1,2,3-苯并三嗪(HOOBT)或4-二甲基氨基吡啶(DMAP)等添加剂而使用。缩合反应中的缩合剂的使用量相对于1摩尔的化合物(IIa-a)优选为0.5~10摩尔,更优选0.8~5.0摩尔。缩合反应中的化合物(III)的使用量相对于1摩尔的化合物(IIa-a)优选为0.5~3摩尔,更优选0.8~1.5摩尔。缩合反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如吡啶等芳香族胺类、二氯甲烷、氯仿或1,2-二氯乙烷等卤化烃类、四氢呋喃或1,4-二噁烷等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类、甲醇、乙醇或2-丙醇等醇类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。选择吡啶等芳香族胺类作为溶剂时,也可以在不存在碱的情况下进行缩合反应。缩合反应中的反应温度优选-20℃~150℃,更优选0~100℃。缩合反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。1-2.化合物(Ia-b)、(Ia-c)及(Ia-d)的制造方法:[化9][式中,PG表示保护基,R4b表示氢原子,R4c表示碳原子数2~6的烷基羰基,其它各符号与上述定义相同]。(工序1)化合物(Ia-b)通过例如在碱存在下或非存在下、使用缩合剂使化合物(IIa-b)与化合物(III)进行缩合反应而得到。缩合反应中可以使用化合物(IIa-b)及其盐。作为此时的盐,例如,可列举与上述药理学上可接受的盐相同的盐。缩合反应中使用的化合物(IIa-b)及化合物(III)可以直接使用市售品,例如,可以按照以下记载的制造方法来合成。作为缩合反应中使用的碱,例如,可列举吡啶或二甲基吡啶等芳香族胺类或三乙基胺、三异丙基胺、三丁基胺、环己基二甲基胺、4-二甲基氨基吡啶、N,N-二甲基苯胺、N-甲基哌啶、N-甲基吡咯烷、N-甲基吗啉或二异丙基乙基胺(DIEA)等叔胺类。缩合反应中的碱的使用量相对于1摩尔的化合物(IIa-b)优选0.5~10摩尔,更优选0.8~5.0摩尔。作为缩合反应中使用的缩合剂,例如,可列举O-(苯并三唑-1-基)-N,N,N’,N’-四甲基脲六氟磷酸盐(HBTU)、环己基碳二亚胺(DCC)、N-(3-二甲基氨基丙基)-N’-乙基碳二亚胺(EDC)或其盐酸盐、2-乙氧基-1-乙氧基羰基-1,2-二羟基喹啉(EEDQ)、羰基二咪唑(CDI)、氰代磷酸二乙酯、苯并三唑-1-基氧基三吡咯烷基鏻六氟磷酸盐(PyBOP)、叠氮磷酸二苯基酯(DPPA)、4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基氯化吗啉鎓(DMTMM)、氯甲酸异丁基酯、二乙基乙酰基氯或氯化三甲基乙酰基氯。这些缩合剂可以单独使用或组合N-羟基丁二酰亚胺(HONSu)、羟基苯并三唑(HOBT)、3-羟基-4-氧代-3,4-二氢-1,2,3-苯并三嗪(HOOBT)或4-二甲基氨基吡啶(DMAP)等添加剂而使用。缩合反应中的缩合剂的使用量相对于1摩尔的化合物(IIa-b)优选0.5~10摩尔,更优选0.8~5.0摩尔。缩合反应中的化合物(III)的使用量相对于1摩尔的化合物(IIa-b)优选0.5~3摩尔,更优选0.8~1.5摩尔。缩合反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如吡啶等芳香族胺类、二氯甲烷、氯仿或1,2-二氯乙烷等卤化烃类、四氢呋喃或1,4-二噁烷等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类、甲醇、乙醇或2-丙醇等醇类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。选择吡啶等芳香族胺类作为溶剂时,也可以在不存在碱的情况下进行缩合反应。缩合反应中的反应温度优选-20℃~150℃,更优选0~100℃。缩合反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。(工序2)环状胺衍生物(I)中,A为通式(IIa)所示的基团、且R4为氢原子的化合物(Ia-c)利用化合物(Ia-b)的去保护而得到。保护基的去保护根据保护基的种类而异,可利用公知的方法(例如,Greene,T.W.、“Greene’sProtectiveGroupsinOrganicSynthesis”、Wiley-Interscience社)或基于其的方法进行。(工序3)环状胺衍生物(I)中,A为通式(IIa)所示的基团、且R4为碳原子数2~6的烷基羰基的化合物(Ia-d),例如可通过在碱存在下、使化合物(Ia-c)与碳原子数2~6的羧酸卤化物或酸酐等酰化剂反应而得到。酰化反应可使用化合物(Ia-c)及其盐。作为此时的盐,例如,可列举与上述药理学上可接受的盐相同的盐。作为酰化反应中使用的碱,例如,可列举吡啶、三乙基胺、二异丙基乙基胺或N,N-二甲基氨基吡啶。酰化反应中的碱的使用量相对于1摩尔的化合物(Ia-c)优选0.5~10摩尔,更优选0.8~5.0摩尔。酰化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如吡啶等芳香族胺类、二氯甲烷、氯仿或1,2-二氯乙烷等卤化烃类、四氢呋喃或1,4-二噁烷等醚类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。选择吡啶等芳香族胺类作为溶剂时,也可以在不存在碱的情况下进行酰化反应。1-3.化合物(Ia-a)、(Ia-b)、(Ia-c)及(Ia-d)的盐化工序:化合物(Ia-a)、(Ia-b)、(Ia-c)及(Ia-d)的药理学上可接受的盐例如可通过使化合物(Ia-a)、(Ia-b)、(Ia-c)或(Ia-d)与酸混合利用盐化反应而得到。作为盐化反应中使用的酸,例如,可列举盐酸、硫酸、磷酸或氢溴酸等无机酸或草酸、丙二酸、柠檬酸、富马酸、乳酸、苹果酸、琥珀酸、酒石酸、乙酸、三氟乙酸、马来酸、葡萄糖酸、苯甲酸、水杨酸、1-羟基-2-萘甲酸、双羟萘酸、抗坏血酸、己二酸、甲磺酸、对甲苯磺酸或肉桂酸等有机酸。盐化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如甲醇、乙醇或异丙醇等脂肪族醇类、二乙醚、四氢呋喃、1,4-二噁烷或乙二醇二甲基醚等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类、二甲基亚砜等亚砜类、乙腈或丙腈等脂肪族腈类、丙酮或2-丁酮等酮类、乙酸乙酯、乙酸甲酯或乙酸正丁基酯等酯类或水,也可以使用它们的混合溶剂。2.化合物(IIa)可以按照以下记载的制造方法来合成。2-1.化合物(IIa-a)的制造方法:[化10][式中,各符号与上述定义相同]。(工序4)化合物(VIA)可利用化合物(IVA)与化合物(VA)的还原性氨基化反应得到。还原性氨基化反应中使用的化合物(VA)可以直接使用市售品。还原性氨基化反应可以按照公知的方法(例如,JournalofOrganicChemistry、2003年、68卷、p.770-779)或基于其的方法进行。(工序5)化合物(IIa-a)利用化合物(VIA)的去保护而得到。保护基的去保护根据保护基的种类而异,可根据公知的方法(例如,Greene,T.W.、“Greene’sProtectiveGroupsinOrganicSynthesis”、Wiley-Interscience社)或基于其的方法进行。2-2.化合物(IIa-b)的制造方法:[化11][式中,各符号与上述定义相同]。(工序6)化合物(VIIIA)可利用化合物(IVA)与化合物(VIIA)的还原性氨基化反应而得到。还原性氨基化反应中使用的化合物(VIIA)可以直接使用市售品。还原性氨基化反应可以按照公知的方法(例如,JournalofOrganicChemistry、2003年、68卷、p.770-779)或基于其的方法进行。(工序7)化合物(IIa-b)可利用化合物(VIIIA)的去保护而得到。保护基的去保护根据保护基的种类而异,可根据公知的方法(例如,Greene,T.W.、“Greene’sProtectiveGroupsinOrganicSynthesis”、Wiley-Interscience社)或基于其的方法进行。3.化合物(IIIa)的制造方法:[化12][式中,L表示离去基团,例如,可列举氯原子、溴原子或碘原子。R6表示碳原子数1~6的烷基或碳原子数7~10芳烷基,例如,可列举甲基、乙基、正丙基、正丁基或苄基。其它各符号与上述定义相同]。(工序8)化合物(X)可利用在基于化合物(IX)的碱的去质子化后使烷基化试剂(LI)作用的烷基化反应而得到。烷基化反应中使用的化合物(IX)可以利用市售的化合物。作为烷基化反应中使用的碱,例如,可列举氢化钠或氢化钾等碱金属氢化物类或正丁基锂、仲丁基锂或叔丁基锂等丁基锂类。烷基化反应中的碱的使用量相对于1摩尔的化合物(IX)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。烷基化反应中使用的烷基化试剂(LI)可以利用市售的化合物。烷基化反应中的烷基化试剂(LI)的使用量相对于1摩尔的化合物(IX)优选0.5~10.0摩尔,更优选0.8~5.0摩尔。烷基化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如庚烷或己烷等脂肪族烃类或四氢呋喃、二乙醚或1,4-二噁烷等醚类,也可以使用它们的混合溶剂。烷基化反应中的反应温度优选-20℃~150℃,更优选0~100℃。烷基化反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。(工序9)化合物(XI)可利用在基于化合物(X)的碱的去质子化后使甲酰基导入试剂作用的甲酰化反应而得到。作为甲酰化反应中使用的碱,例如,可列举正丁基锂、仲丁基锂或叔丁基锂。甲酰化反应中的碱的使用量相对于1摩尔的化合物(X)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。作为甲酰化反应中使用的甲酰基导入试剂,例如,可列举N,N-二甲基甲酰胺。N,N-二甲基甲酰胺可以利用市售的化合物。甲酰化反应中的甲酰基导入试剂的使用量相对于1摩尔的化合物(X)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。甲酰化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如庚烷或己烷等脂肪族烃类或四氢呋喃、二乙醚或1,4-二噁烷等醚类,也可以使用它们的混合溶剂。甲酰化反应的去质子化中的反应温度优选-100~0℃,更优选-80~-20℃。另外,甲酰化反应的甲酰化中的反应温度优选-20℃~150℃,更优选0~100℃。甲酰化反应的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。(工序10)化合物(XI)可利用在基于化合物(XII)的碱的去质子化后使烷基化试剂(LI)作用的烷基化反应而得到。烷基化反应中使用的化合物(XII)可以利用市售的化合物。作为烷基化反应中使用的碱,例如,可列举碳酸钠、碳酸钾或碳酸铯等金属碳酸盐类或氢氧化钠或氢氧化钾等碱金属氢氧化物类。烷基化反应中的碱的使用量相对于1摩尔的化合物(XII)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。烷基化反应中的烷基化试剂(LI)的使用量相对于1摩尔的化合物(XII)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。烷基化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如四氢呋喃或1,4-二噁烷等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。烷基化反应中的反应温度优选-20℃~150℃,更优选0~100℃。烷基化反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。(工序11)化合物(XIII)可利用化合物(XI)的烯烃化反应而得到。作为烯烃化反应中使用的试剂,例如,可列举2-(三苯基膦烯基)乙酸甲酯等Wittig试剂或二乙基膦酰基乙酸乙酯等Horner-Emmons试剂。Wittig试剂或Horner-Emmons试剂可以直接使用市售品。烯烃化反应中的Wittig试剂或Horner-Emmons试剂的使用量相对于1摩尔的化合物(XI)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。烯烃化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如甲苯、氯苯或二甲苯等芳香族烃类、四氢呋喃或1,4-二噁烷等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。烯烃化反应中的反应温度优选-20℃~150℃,更优选0~100℃。烯烃化反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。(工序12)化合物(XIV)可通过对化合物(XIII)在氢气氛下使用过渡金属催化剂进行还原反应而得到。作为还原反应中使用的过渡金属催化剂,例如,可列举钯-碳。还原反应中的过渡金属催化剂的使用量相对于化合物(XIII)优选0.1~100重量%,更优选1~50重量%。还原反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如庚烷或己烷等脂肪族烃类或甲醇、乙醇或丙醇等脂肪族醇类,也可以使用它们的混合溶剂。还原反应中的反应温度优选0~80℃,更优选10~40℃。还原反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。(工序13)化合物(III)中,R2为氢原子的化合物(IIIa)可利用化合物(XIV)的水解反应而得到。作为水解反应中使用的碱,例如,可列举氢氧化锂、氢氧化钾或氢氧化钠。水解反应中的碱的使用量相对于1摩尔的化合物(XIV)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。水解反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如甲醇、乙醇或丙醇等脂肪族醇类或水,也可以使用它们的混合溶剂。水解反应中的反应温度优选-20℃~150℃,更优选0~100℃。水解反应的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。4.化合物(III)的制造方法:[化13][式中,各符号与上述定义相同]。(工序14)化合物(XVI)可利用基于化合物(XV)的碱的去质子化后与烷基化试剂(LI)作用的烷基化反应而得到。烷基化反应中使用的化合物(XV)可以直接使用市售品。作为烷基化反应中使用的碱,例如,可列举碳酸钠、碳酸钾或碳酸铯等金属碳酸盐类或氢氧化钠或氢氧化钾等碱金属氢氧化物类。烷基化反应中的碱的使用量相对于1摩尔的化合物(XV)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。烷基化反应中的烷基化试剂(LI)的使用量相对于1摩尔的化合物(XV)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。烷基化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如四氢呋喃或1,4-二噁烷等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。烷基化反应中的反应温度优选-20℃~150℃,更优选0~100℃。烷基化反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。(工序15)化合物(XVI)可利用化合物(XVII)的氧化反应而得到。氧化反应中使用的化合物(XVII)可以直接使用市售品,也可以用本领域技术人员一般的方法合成。作为氧化反应中使用的氧化剂,例如,可列举三氧化硫-吡啶、活化二甲基亚砜或Dess-Martin试剂。氧化反应中的氧化剂的使用量相对于1摩尔的化合物(XVII)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。氧化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如吡啶等芳香族胺类、二氯甲烷、氯仿或1,2-二氯乙烷等卤化烃类、四氢呋喃或1,4-二噁烷等醚类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。氧化反应中的反应温度优选-78℃~100℃,更优选-78℃~40℃。氧化反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。(工序16)化合物(XVIII)可利用化合物(XVI)的烯烃化反应而得到。作为烯烃化反应中使用的试剂,例如,可列举2-(三苯基膦烯基)乙酸甲酯等Wittig试剂或二乙基膦酰基乙酸乙酯等Horner-Emmons试剂。Wittig试剂或Horner-Emmons试剂可以直接使用市售品。烯烃化反应中的Wittig试剂或Horner-Emmons试剂的使用量相对于1摩尔的化合物(XVI)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。烯烃化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如甲苯、氯苯或二甲苯等芳香族烃类、四氢呋喃或1,4-二噁烷等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。烯烃化反应中的反应温度优选-20℃~150℃,更优选0~100℃。烯烃化反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。(工序17)化合物(XIX)可以对化合物(XVIII)在氢气氛下通过使用过渡金属催化剂的还原反应而得到。作为还原反应中使用的过渡金属催化剂,例如,可列举钯-碳。还原反应中的过渡金属催化剂的使用量相对于化合物(XVIII)优选0.1~100重量%,更优选1~50重量%。还原反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如庚烷或己烷等脂肪族烃类或甲醇、乙醇或丙醇等脂肪族醇类,也可以使用它们的混合溶剂。还原反应中的反应温度优选0~80℃,更优选10~40℃。还原反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。(工序18)化合物(III)可利用化合物(XIX)的水解反应而得到。作为水解反应中使用的碱,例如,可列举氢氧化锂、氢氧化钾或氢氧化钠。水解反应中的碱的使用量相对于1摩尔的化合物(XIX)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。水解反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如甲醇、乙醇或丙醇等脂肪族醇类或水,也可以使用它们的混合溶剂。水解反应中的反应温度优选-20℃~150℃,更优选0~100℃。水解反应的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。5.化合物(XIII)的制造方法:[化14][式中,各符号与上述定义相同]。(工序19)化合物(XX)可利用化合物(XII)的烯烃化反应而得到。作为烯烃化反应中使用的试剂,例如,可列举2-(三苯基膦烯基)乙酸甲酯等Wittig试剂或二乙基膦酰基乙酸乙酯等Horner-Emmons试剂。Wittig试剂或Horner-Emmons试剂可以直接使用市售品。烯烃化反应中的Wittig试剂或Horner-Emmons试剂的使用量相对于1摩尔的化合物(XII)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。烯烃化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如甲苯、氯苯或二甲苯等芳香族烃类、四氢呋喃或1,4-二噁烷等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。烯烃化反应中的反应温度优选-20℃~150℃,更优选0~100℃。烯烃化反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。(工序20)化合物(XIII)可利用在基于化合物(XX)的碱的去质子化后使烷基化试剂(LI)作用的烷基化反应而得到。作为烷基化反应中使用的碱,例如,可列举碳酸钠、碳酸钾或碳酸铯等金属碳酸盐类或氢氧化钠或氢氧化钾等碱金属氢氧化物类。烷基化反应中的碱的使用量相对于1摩尔的化合物(XX)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。烷基化反应中的烷基化试剂(LI)的使用量相对于1摩尔的化合物(XX)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。烷基化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如四氢呋喃或1,4-二噁烷等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。烷基化反应中的反应温度优选-20℃~150℃,更优选0~100℃。烷基化反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。6.化合物(XVIII)的制造方法:[化15][式中,各符号与上述定义相同]。(工序21)化合物(XXII)可利用化合物(XXI)的氧化反应而得到。氧化反应中使用的化合物(XXI)可以直接使用市售品,也可以用本领域技术人员一般的方法合成。作为氧化反应中使用的氧化剂,例如,可列举三氧化硫-吡啶、活化二甲基亚砜或Dess-Martin试剂。氧化反应中的氧化剂的使用量相对于1摩尔的化合物(XXI)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。氧化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如吡啶等芳香族胺类、二氯甲烷、氯仿或1,2-二氯乙烷等卤化烃类、四氢呋喃或1,4-二噁烷等醚类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。氧化反应中的反应温度优选-78℃~100℃,更优选-78℃~40℃。氧化反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。(工序22)化合物(XXIII)可利用化合物(XXII)的烯烃化反应而得到。作为烯烃化反应中使用的试剂,例如,可列举2-(三苯基膦烯基)乙酸甲酯等Wittig试剂或二乙基膦酰基乙酸乙酯等Horner-Emmons试剂。Wittig试剂或Horner-Emmons试剂可以直接使用市售品。烯烃化反应中的Wittig试剂或Horner-Emmons试剂的使用量相对于1摩尔的化合物(XXII)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。烯烃化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如甲苯、氯苯或二甲苯等芳香族烃类、四氢呋喃或1,4-二噁烷等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。烯烃化反应中的反应温度优选-20℃~150℃,更优选0~100℃。烯烃化反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。(工序23)化合物(XVIII)可利用在基于化合物(XXIII)的碱的去质子化后使烷基化试剂(LI)作用的烷基化反应而得到。作为烷基化反应中使用的碱,例如,可列举碳酸钠、碳酸钾或碳酸铯等金属碳酸盐类或氢氧化钠或氢氧化钾等碱金属氢氧化物类。烷基化反应中的碱的使用量相对于1摩尔的化合物(XXIII)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。烷基化反应中的烷基化试剂(LI)的使用量相对于1摩尔的化合物(XXIII)优选0.5~3.0摩尔,更优选0.8~2.0摩尔。烷基化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如四氢呋喃或1,4-二噁烷等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。烷基化反应中的反应温度优选-20℃~150℃,更优选0~100℃。烷基化反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。7.化合物(Ib)可以按照以下记载的制造方法来合成。7-1.化合物(Ib-a)的制造方法:[化16][式中,各符号与上述定义相同]。环状胺衍生物(I)中,A表示通式(IIb)所示的基团、且R4表示可以被碳原子数2~6的烷基羰基氨基取代的碳原子数1~6的烷基的化合物(Ib-a)可通过例如在碱存在下或非存在下、使用缩合剂使化合物(IIb-a)与化合物(III)进行缩合反应而得到。缩合反应可使用化合物(IIb-a)及其盐。作为此时的盐,例如,可列举与上述药理学上可接受的盐相同的盐。缩合反应中使用的化合物(IIb-a)及化合物(III)可以直接使用市售品,例如,化合物(IIb-a)可根据以下记载的制造方法合成,化合物(III)可根据上述制造方法合成。作为缩合反应中使用的碱,例如,可列举吡啶或二甲基吡啶等芳香族胺类或三乙基胺、三异丙基胺、三丁基胺、环己基二甲基胺、4-二甲基氨基吡啶、N,N-二甲基苯胺、N-甲基哌啶、N-甲基吡咯烷、N-甲基吗啉或二异丙基乙基胺(DIEA)等叔胺类。缩合反应中的碱的使用量相对于1摩尔的化合物(IIb-a)优选0.5~10摩尔,更优选0.8~5.0摩尔。作为缩合反应中使用的缩合剂,例如,可列举O-(苯并三唑-1-基)-N,N,N’,N’-四甲基脲六氟磷酸盐(HBTU)、环己基碳二亚胺(DCC)、N-(3-二甲基氨基丙基)-N’-乙基碳二亚胺(EDC)或其盐酸盐、2-乙氧基-1-乙氧基羰基-1,2-二羟基喹啉(EEDQ)、羰基二咪唑(CDI)、氰代磷酸二乙酯、苯并三唑-1-基氧基三吡咯烷基鏻六氟磷酸盐(PyBOP)、叠氮磷酸二苯基酯(DPPA)、4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基氯化吗啉鎓(DMTMM)、氯甲酸异丁基酯、二乙基乙酰基氯或氯化三甲基乙酰基氯。这些缩合剂可以单独使用或组合N-羟基丁二酰亚胺(HONSu)、羟基苯并三唑(HOBT)、3-羟基-4-氧代-3,4-二氢-1,2,3-苯并三嗪(HOOBT)或4-二甲基氨基吡啶(DMAP)等添加剂而使用。缩合反应中的缩合剂的使用量相对于1摩尔的化合物(IIb-a)优选0.5~10摩尔,更优选0.8~5.0摩尔。缩合反应中的化合物(III)的使用量相对于1摩尔的化合物(IIb-a)优选0.5~3摩尔,更优选0.8~1.5摩尔。缩合反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如吡啶等芳香族胺类、二氯甲烷、氯仿或1,2-二氯乙烷等卤化烃类、四氢呋喃或1,4-二噁烷等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类、甲醇、乙醇或2-丙醇等醇类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。选择吡啶等芳香族胺类作为溶剂时,也可以在不存在碱的情况下进行缩合反应。缩合反应中的反应温度优选-20℃~150℃,更优选0~100℃。缩合反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。7-2.化合物(Ib-b)、(Ib-c)及(Ib-d)的制造方法:[化17][式中,各符号与上述定义相同]。(工序24)化合物(Ib-b)可通过例如在碱存在下或非存在下、使用缩合剂使化合物(IIb-b)与化合物(III)进行缩合反应而得到。缩合反应可以使用化合物(IIb-b)及其盐。作为此时的盐,例如,可列举与上述药理学上可接受的盐相同的盐。缩合反应中使用的化合物(IIb-b)及化合物(III)可以直接使用市售品,例如,化合物(IIb-b)可根据以下记载的制造方法合成,化合物(III)可根据上述制造方法合成。作为缩合反应中使用的碱,例如,可列举吡啶或二甲基吡啶等芳香族胺类或三乙基胺、三异丙基胺、三丁基胺、环己基二甲基胺、4-二甲基氨基吡啶、N,N-二甲基苯胺、N-甲基哌啶、N-甲基吡咯烷、N-甲基吗啉或二异丙基乙基胺(DIEA)等叔胺类。缩合反应中的碱的使用量相对于1摩尔的化合物(IIb-b)优选0.5~10摩尔,更优选0.8~5.0摩尔。作为缩合反应中使用的缩合剂,例如,可列举O-(苯并三唑-1-基)-N,N,N’,N’-四甲基脲六氟磷酸盐(HBTU)、环己基碳二亚胺(DCC)、N-(3-二甲基氨基丙基)-N’-乙基碳二亚胺(EDC)或其盐酸盐、2-乙氧基-1-乙氧基羰基-1,2-二羟基喹啉(EEDQ)、羰基二咪唑(CDI)、氰代磷酸二乙酯、苯并三唑-1-基氧基三吡咯烷基鏻六氟磷酸盐(PyBOP)、叠氮磷酸二苯基酯(DPPA)、4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基氯化吗啉鎓(DMTMM)、氯甲酸异丁基酯、二乙基乙酰基氯或氯化三甲基乙酰基氯。这些缩合剂可以单独使用或组合N-羟基丁二酰亚胺(HONSu)、羟基苯并三唑(HOBT)、3-羟基-4-氧代-3,4-二氢-1,2,3-苯并三嗪(HOOBT)或4-二甲基氨基吡啶(DMAP)等添加剂而使用。缩合反应中的缩合剂的使用量相对于1摩尔的化合物(IIb-b)优选0.5~10摩尔,更优选0.8~5.0摩尔。缩合反应中的化合物(III)的使用量相对于1摩尔的化合物(IIb-b)优选0.5~3摩尔,更优选0.8~1.5摩尔。缩合反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如吡啶等芳香族胺类、二氯甲烷、氯仿或1,2-二氯乙烷等卤化烃类、四氢呋喃或1,4-二噁烷等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类、甲醇、乙醇或2-丙醇等醇类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。选择吡啶等芳香族胺类作为溶剂时,也可以在不存在碱的情况下进行缩合反应。缩合反应中的反应温度优选-20℃~150℃,更优选0~100℃。缩合反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。(工序25)环状胺衍生物(I)中,A为通式(IIb)所示的基团、且R4为氢原子的化合物(Ib-c)可利用化合物(Ib-b)的去保护而得到。保护基的去保护根据保护基的种类而异,可根据公知的方法(例如,Greene,T.W.、“Greene’sProtectiveGroupsinOrganicSynthesis”、Wiley-Interscience社)或基于其的方法进行。(工序26)环状胺衍生物(I)中,A为通式(IIb)所示的基团、且R4为碳原子数2~6的烷基羰基的化合物(Ib-d)可以通过例如在碱存在下、使化合物(Ib-c)与碳原子数2~6的羧酸卤化物或酸酐等酰化剂反应而得到。酰化反应可使用化合物(Ib-c)及其盐。作为此时的盐,例如,可列举与上述药理学上可接受的盐相同的盐。作为酰化反应中使用的碱,例如,可列举吡啶、三乙基胺、二异丙基乙基胺或N,N-二甲基氨基吡啶。酰化反应中的碱的使用量相对于1摩尔的化合物(Ib-c)优选0.5~10摩尔,更优选0.8~5.0摩尔。酰化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如吡啶等芳香族胺类、二氯甲烷、氯仿或1,2-二氯乙烷等卤化烃类、四氢呋喃或1,4-二噁烷等醚类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。选择吡啶等芳香族胺类作为溶剂时,也可以在不存在碱的情况下进行酰化反应。7-3.化合物(Ib-a)、(Ib-b)、(Ib-c)及(Ib-d)的盐化工序:化合物(Ib-a)、(Ib-b)、(Ib-c)及(Ib-d)の药理学上可接受的盐可通过例如使化合物(Ib-a)、(Ib-b)、(Ib-c)或(Ib-d)与酸混合利用盐化反应而得到。作为盐化反应中使用的酸,例如,可列举盐酸、硫酸、磷酸或氢溴酸等无机酸或草酸、丙二酸、柠檬酸、富马酸、乳酸、苹果酸、琥珀酸、酒石酸、乙酸、三氟乙酸、马来酸、葡萄糖酸、苯甲酸、水杨酸、羟萘甲酸、双羟萘酸、抗坏血酸、己二酸、甲磺酸、对甲苯磺酸或肉桂酸等有机酸。盐化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如甲醇、乙醇或异丙醇等脂肪族醇类、二乙醚、四氢呋喃、1,4-二噁烷或乙二醇二甲基醚等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类、二甲基亚砜等亚砜类、乙腈或丙腈等脂肪族腈类、丙酮或2-丁酮等酮类、乙酸乙酯、乙酸甲酯或乙酸正丁基酯等酯类或水,也可以使用它们的混合溶剂。8.化合物(IIb)可以按照以下记载的制造方法来合成。8-1.化合物(IIb-a)的制造方法:[化18][式中,各符号与上述定义相同]。(工序27)化合物(VIB)可利用化合物(IVB)与化合物(VB)的还原性氨基化反应而得到。还原性氨基化反应中使用的化合物(VB)可以直接使用市售品。还原性氨基化反应可以按照公知的方法(例如,JournalofOrganicChemistry、2003年、68卷、p.770-779)或基于其的方法进行。(工序28)化合物(IIb-a)可利用化合物(VIB)的去保护而得到。保护基的去保护根据保护基的种类而异,可根据公知的方法(例如,Greene,T.W.、“Greene’sProtectiveGroupsinOrganicSynthesis”、Wiley-Interscience社)或基于其的方法进行。(工序29)化合物(XXV1)可利用化合物(XXIV)与化合物(XXV)的还原性氨基化反应而得到。还原性氨基化反应中使用的化合物(XXV)可以直接使用市售品。还原性氨基化反应可以按照公知的方法(例如,JournalofOrganicChemistry、2003年、68卷、p.770-779)或基于其的方法进行。(工序30)化合物(VIB)可利用化合物(XXVI)与化合物(XXVII)的还原性氨基化反应而得到。还原性氨基化反应中使用的化合物(XXVII)可以直接使用市售品。还原性氨基化反应可以按照公知的方法(例如,JournalofOrganicChemistry、2003年、68卷、p.770-779)或基于其的方法进行。8-2.化合物(IIb-b)的制造方法:[化19][式中,各符号与上述定义相同]。(工序31)化合物(VIIIB)可利用化合物(IVB)与化合物(VIIB)的还原性氨基化反应而得到。还原性氨基化反应中使用的化合物(VIIB)可以直接使用市售品。还原性氨基化反应可以按照公知的方法(例如,JournalofOrganicChemistry、2003年、68卷、p.770-779)或基于其的方法进行。(工序32)化合物(IIb-b)可利用化合物(VIIIB)的去保护而得到。保护基的去保护根据保护基的种类而异,可根据公知的方法(例如,Greene,T.W.、“Greene’sProtectiveGroupsinOrganicSynthesis”、Wiley-Interscience社)或基于其的方法进行。9.化合物(Ic)可以按照以下记载的制造方法来合成。9-1.化合物(Ic)的制造方法:[化20][式中,各符号与上述定义相同]。环状胺衍生物(I)中,A表示通式(IIc)所示的基团的化合物(Ic)可通过例如在碱存在下或非存在下、使用缩合剂使化合物(IIc-a)与化合物(III)进行缩合反应而得到。缩合反应可使用化合物(IIc-a)及其盐。作为此时的盐,例如,可列举与上述药理学上可接受的盐相同的盐。缩合反应中使用的化合物(IIc-a)及化合物(III)可以直接使用市售品,例如,化合物(IIc-a)可根据以下记载的制造方法合成,化合物(III)可根据上述制造方法合成。作为缩合反应中使用的碱,例如,可列举吡啶或二甲基吡啶等芳香族胺类或三乙基胺、三异丙基胺、三丁基胺、环己基二甲基胺、4-二甲基氨基吡啶、N,N-二甲基苯胺、N-甲基哌啶、N-甲基吡咯烷、N-甲基吗啉或二异丙基乙基胺(DIEA)等叔胺类。缩合反应中的碱的使用量相对于1摩尔的化合物(IIc-a)优选0.5~10摩尔,更优选0.8~5.0摩尔。作为缩合反应中使用的缩合剂,例如,可列举O-(苯并三唑-1-基)-N,N,N’,N’-四甲基脲六氟磷酸盐(HBTU)、环己基碳二亚胺(DCC)、N-(3-二甲基氨基丙基)-N’-乙基碳二亚胺(EDC)或其盐酸盐、2-乙氧基-1-乙氧基羰基-1,2-二羟基喹啉(EEDQ)、羰基二咪唑(CDI)、氰代磷酸二乙酯、苯并三唑-1-基氧基三吡咯烷基鏻六氟磷酸盐(PyBOP)、叠氮磷酸二苯基酯(DPPA)、4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基氯化吗啉鎓(DMTMM)、氯甲酸异丁基酯、二乙基乙酰基氯或氯化三甲基乙酰基氯。这些缩合剂可以单独使用或组合N-羟基丁二酰亚胺(HONSu)、羟基苯并三唑(HOBT)、3-羟基-4-氧代-3,4-二氢-1,2,3-苯并三嗪(HOOBT)或4-二甲基氨基吡啶(DMAP)等添加剂而使用。缩合反应中的缩合剂的使用量相对于1摩尔的化合物(IIc-a)优选0.5~10摩尔,更优选0.8~5.0摩尔。缩合反应中的化合物(III)的使用量相对于1摩尔的化合物(IIc-a)优选0.5~3摩尔,更优选0.8~1.5摩尔。缩合反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如吡啶等芳香族胺类、二氯甲烷、氯仿或1,2-二氯乙烷等卤化烃类、四氢呋喃或1,4-二噁烷等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类、甲醇、乙醇或2-丙醇等醇类或乙腈或丙腈等脂肪族腈类,也可以使用它们的混合溶剂。选择吡啶等芳香族胺类作为溶剂时,也可以在不存在碱的情况下进行缩合反应。缩合反应中的反应温度优选-20℃~150℃,更优选0~100℃。缩合反应中的反应时间根据反应条件而异,优选5分钟~72小时,更优选30分钟~48小时。9-2.化合物(Ic)的盐化工序:化合物(Ic)的药理学上可接受的盐可利用例如通过使化合物(Ic)与酸混合的盐化反应而得到。作为盐化反应中使用的酸,例如,可列举盐酸、硫酸、磷酸或氢溴酸等无机酸或草酸、丙二酸、柠檬酸、富马酸、乳酸、苹果酸、琥珀酸、酒石酸、乙酸、三氟乙酸、马来酸、葡萄糖酸、苯甲酸、水杨酸、羟萘甲酸、双羟耐酸、抗坏血酸、己二酸、甲磺酸、对甲苯磺酸或肉桂酸等有机酸。盐化反应一般在溶剂中进行,优选不阻碍反应的溶剂。作为这样的溶剂,可列举例如甲醇、乙醇或异丙醇等脂肪族醇类、二乙醚、四氢呋喃、1,4-二噁烷或乙二醇二甲基醚等醚类、N,N-二甲基甲酰胺或N-甲基吡咯烷酮等酰胺类、二甲基亚砜等亚砜类、乙腈或丙腈等脂肪族腈类、丙酮或2-丁酮等酮类、乙酸乙酯、乙酸甲酯或乙酸正丁基酯等酯类或水,也可以使用它们的混合溶剂。10.化合物(IIc-a)的制造方法:[化21][式中,各符号与上述定义相同]。(工序33)化合物(VIC)可利用化合物(IVA)与化合物(VC)的还原性氨基化反应而得到。还原性氨基化反应中使用的化合物(VC)可以直接使用市售品。还原性氨基化反应可以按照公知的方法(例如,JournalofOrganicChemistry、2003年、68卷、p.770-779)或基于其的方法进行。(工序34)化合物(IIc-a)可利用化合物(VIC)的去保护而得到。保护基的去保护根据保护基的种类而异,可利用公知的方法(例如,Greene,T.W.、“Greene’sProtectiveGroupsinOrganicSynthesis”、Wiley-Interscience社)或基于其的方法进行。环状胺衍生物(I)或其前药或其药理学上可接受的盐的镇痛作用、特别是神经障碍性疼痛及纤维肌痛症的治疗效果可以使用适当的动物模型进行评价。作为神经障碍性疼痛的适当的动物模型,例如,可列举小鼠或大鼠的坐骨神经部分结扎模型(Malmberg等、Pain、1998年、第76卷、p.215-222)或小鼠或大鼠的脊髓神经结扎模型(Kim等、Pain、1992年、第50卷、p.355-363),作为纤维肌痛症的适当的动物模型,例如,可列举大鼠的纤维肌痛症模型(Sluka等、JournalofPharmacologyandExperimentalTherapeutics、2002年、第302卷、p.1146-50;Nagakura等、Pain、2009年、第146卷、p.26-33;Sluka等、Pain、2009年、第146卷、p.3-4)。环状胺衍生物(I)或其前药或其药理学上可接受的盐具有优异的镇痛作用、特别是具有神经障碍性疼痛或纤维肌痛症的治疗效果,因此可用作药物,优选用作镇痛药,特别优选用作神经障碍性疼痛治疗药或纤维肌痛症治疗药。需要说明的是,环状胺衍生物(I)的前药在生体内转换为环状胺衍生物(I)可发挥其优异的镇痛作用,环状胺衍生物(I)的前药可具有镇痛作用。作为所谓的神经障碍性疼痛,例如,可列举癌性疼痛、带状疱疹痛、带状疱疹后神经痛、艾滋病相关神经痛、糖尿病性神经障害痛或三叉神经痛。“纤维肌痛症”是指专业医生诊断为纤维肌痛症的症状。专业医生的诊断一般参考美国风湿病学会的分类基准进行。环状胺衍生物(I)或其前药或其药理学上可接受的盐对急性及慢性疼痛的治疗有用。急性疼痛通常为短时间,例如,可列举术后疼痛、拔牙后疼痛或三叉神经痛。慢性疼痛通常定义为持续3~6个月的疼痛,并且,包括体因性疼痛及心因性疼痛,例如,可列举慢性关节风湿、变形性关节症或带状疱疹后神经痛。含有环状胺衍生物(I)或其前药或其药理学上可接受的盐作为有效成分的药物对哺乳动物(例如,小鼠、大鼠、仓鼠、兔子、猫、狗、牛、羊、猴或人类)、特别是人类给药时,发挥优异的镇痛作用、特别是对神经障碍性疼痛或纤维肌痛症发挥治疗效果。使用环状胺衍生物(I)或其前药或其药理学上可接受的盐作为药物时,可将环状胺衍生物(I)或其前药或其药理学上可接受的盐直接或作为药物配合可接受的载体地口服或非口服地给药。使用环状胺衍生物(I)的前药或其药理学上可接受的盐作为药物时,优选口服给药。作为将含有环状胺衍生物(I)或其前药或其药理学上可接受的盐作为有效成分的药物进行口服给药时的剂型,例如,可列举片剂(包括糖衣片及膜包衣片)、丸剂、颗粒剂、散剂、胶囊剂(包括软胶囊剂及微囊剂)、糖浆剂、乳剂或悬浮剂。另外,作为将含有环状胺衍生物(I)或其前药或其药理学上可接受的盐作为有效成分的药物进行非口服给药时的剂型,例如,可列举注射剂、注入剂、滴剂、栓剂、涂布剂或贴剂。进而,与适当的基剂(例如,丁酸的聚合物、羟基乙酸的聚合物、丁酸-羟基乙酸的共聚物、丁酸的聚合物与羟基乙酸的聚合物的混合物或聚甘油脂肪酸酯)组合制成缓释性制剂也有效。上述剂型的制剂的制备可根据制剂领域中一般使用的公知的制造方法进行。此时,根据必要,可含有制剂领域中一般使用的赋形剂、结合剂、润滑剂、崩解剂、甜味剂、表面活性剂、悬浮化剂或乳化剂等进行制造。片剂的制备例如可含有赋形剂、结合剂、崩解剂或润滑剂进行,丸剂及颗粒剂的制备例如可含有赋形剂、结合剂或崩解剂进行。另外,散剂及胶囊剂的制备例如可含有赋形剂进行,糖浆剂的制备例如可含有甜味剂进行,乳剂或悬浮剂的制备例如可含有表面活性剂、悬浮化剂或乳化剂进行。作为赋形剂,可列举例如乳糖、葡萄糖、淀粉、蔗糖、微晶纤维素、甘草粉、甘露醇、碳酸氢钠、磷酸钙或硫酸钙。作为结合剂,可列举例如淀粉胶液、阿拉伯胶液、明胶液、黄芪胶液、羧基甲基纤维素液、海藻酸钠液或甘油。作为崩解剂,可列举例如淀粉或碳酸钙。作为润滑剂,可列举例如硬脂酸镁、硬脂酸、硬脂酸钙或纯化滑石。作为甜味剂,可列举例如葡萄糖、果糖、转化糖、山梨醇、木糖醇、甘油或单糖浆。作为表面活性剂,可列举例如月桂基硫酸钠、聚山梨醇酯80、脱水山梨醇单脂肪酸酯或硬脂酸聚氧乙烯40。作为悬浮化剂,可列举例如阿拉伯胶、海藻酸钠、羧基甲基纤维素钠、甲基纤维素或膨润土。作为乳化剂,可列举例如阿拉伯胶、黄芪胶、明胶或聚山梨醇酯80。进而,将含有环状胺衍生物(I)或其前药或其药理学上可接受的盐作为有效成分的药物制备为上述剂型时,可以添加在制剂领域一般使用的着色剂、保存剂、芳香剂、矫味剂、稳定剂或粘稠剂等。含有环状胺衍生物(I)或其前药或其药理学上可接受的盐作为有效成分的药物的每天的给药量根据患者的状态或体重、化合物的种类或给药途径等而不同,例如,对成人(体重约60kg)口服给药时,将环状胺衍生物(I)或其前药或其药理学上可接受的盐以有效成分量计为1~1000mg的范围、分1~3次给药,更优选对成人(体重约60kg)非口服给药时,注射剂的情况下,优选将环状胺衍生物(I)或其前药或其药理学上可接受的盐以有效成分量计每1kg体重在0.01~100mg的范围,经静脉注射给药。环状胺衍生物(I)或其前药或其药理学上可接受的盐为了补充或增强治疗或预防效果、或者降低给药量,也可以适量配合或并用其它药剂。作为这种情况下的其它药剂,例如,可列举阿米替林、米那普仑或度洛西汀等抗抑郁药、阿普唑仑等抗焦虑药、卡马西平等抗痉挛药、利多卡因等局部麻醉药、肾上腺素等交感神经激动剂、氯胺酮等NMDA受体拮抗剂、丙戊酸钠等GABA转氨酶抑制剂、普瑞巴林等钙通道阻滞剂、利培酮等血清素受体拮抗剂、地西泮等GABA受体功能促进剂或双氯芬酸等抗炎症药。实施例以下,使用实施例及参考例详细地说明本发明,本发明不限定于它们。在以下的记载中,NMR数据中显示的的溶剂名表示在测定中使用的溶剂。另外,400MHzNMR波谱使用JNM-AL400型核磁共振装置(日本电子社)进行测定。化学位移以四甲基硅烷为基准计,以δ(单位:ppm)表示,信号分别用s(一重谱线)、d(二重谱线)、t(三重谱线)、q(四重谱线)、quint(五重谱线)、sept(七重谱线)、m(多重谱线)、br(宽)、dd(二重二重谱线)、dt(二重三重谱线)、ddd(二重二重二重谱线)、dq(二重四重谱线)、td(三重二重谱线)、tt(三重三重谱线)表示。ESI-MS波谱使用AgilentTechnologies1200Series、G6130A(AgilentTechnology制)进行测定。溶剂完全使用市售的溶剂。快速色谱法使用YFLCW-prep2XY(山善社)。环状胺衍生物(I)及其前药的原料及中间体使用以下的参考例记载的方法来合成。需要说明的是,对于没有利用参考例化合物的合成中使用的化合物的合成法的记载的情况下,使用市售化合物。(参考例1)4-((2-((叔丁氧基羰基)氨基)乙基)(甲基)氨基)哌啶-1-甲酸苄基酯的合成:[化22]在0℃下向4-氧代哌啶-1-甲酸苄基酯(0.500g、2.14mmol)的二氯甲烷(3.0mL)溶液中加入叔丁基(2-(甲基氨基)乙基)氨基甲酸酯盐酸盐(0.564g、2.68mmol)及三乙酰氧基硼氢化钠(0.681g、3.22mmol),在室温下进行16小时搅拌。将反应液冷却至0℃。向反应液中加入饱和碳酸氢钠水溶液,用氯仿萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速色谱法(硅胶、己烷/乙酸乙酯)纯化,以白色固体的形式得到4-((2-((叔丁氧基羰基)氨基)乙基)(甲基)氨基)哌啶-1-甲酸苄基酯(0.590g、1.51mmol、70%)。(参考例2)粗(2-(甲基(哌啶-4-基)氨基)乙基)氨基甲酸叔丁基酯的合成:[化23]在室温下向4-((2-((叔丁氧基羰基)氨基)乙基)(甲基)氨基)哌啶-1-甲酸苄基酯(0.300g、0.766mmol)的甲醇(4.0mL)溶液中加入钯/碳(10%wet、0.0815g、0.0766mmol),在氢气氛下,搅拌16小时。对反应液进行硅藻土过滤,将滤液减压浓缩,得到(2-(甲基(哌啶-4-基)氨基)乙基)氨基甲酸叔丁基酯的粗产物。(参考例3)4-(N-苄基-N-甲基氨基)哌啶-1-甲酸叔丁基酯的合成:[化24]在0℃下向4-氧代哌啶-1-甲酸叔丁基酯(3.00g、15.1mmol)的二氯甲烷(20.0mL)溶液中加入N-苄基-N-甲基胺(2.43mL、18.8mmol)、乙酸(0.0860mL、1.51mmol)及三乙酰氧基硼氢化钠(1.20g、5.66mmol)。将反应液在相同的温度下搅拌30分钟后,在0℃下加入三乙酰氧基硼氢化钠(1.20g、5.66mmol)。将反应液在相同的温度下搅拌30分钟后,在0℃下加入三乙酰氧基硼氢化钠(2.40g、11.3mmol),在室温下进行16小时搅拌。将反应液冷却至0℃。向反应液中加入饱和碳酸氢钠水溶液,用氯仿萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速色谱法(硅胶、己烷/乙酸乙酯)纯化,以白色固体的形式得到4-(N-苄基-N-甲基氨基)哌啶-1-甲酸叔丁基酯(4.49g、14.7mmol、98%)。(参考例4)N-苄基-N-甲基哌啶-4-胺的合成:[化25]在室温下向4-(N-苄基-N-甲基氨基)哌啶-1-甲酸叔丁基酯(1.00g、3.28mmol)的1,4-二噁烷/甲醇(1/1、8.0mL)混合溶液中加入氯化氢的1,4-二噁烷溶液(4.0N、3.28mL、13.1mmol),将反应液在相同的温度下搅拌6小时。将反应液减压浓缩,加入饱和碳酸氢钠水溶液,用氯仿萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速色谱法(硅胶、氯仿/甲醇)纯化,以无色油状物形式得到N-苄基-N-甲基哌啶-4-胺(0.650g、0.318mmol、97%)。(参考例5)1-(2-((叔丁基二甲基甲硅烷基)氧基)乙基)-1H-咪唑的合成:[化26]在0℃下向2-(1H-咪唑-1-基)乙醇(1.90g、16.94mmol)的二氯甲烷(56.5mL)溶液加入二异丙基乙基胺(3.55mL、20.33mmol)、叔丁基二甲基氯硅烷(2.81g、18.64mmol),升温至室温后搅拌1小时。向反应液加入水,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速色谱法(NH硅胶、正己烷/乙酸乙酯)纯化,以无色油状物的形式得到1-(2-((叔丁基二甲基甲硅烷基)氧基)乙基)-1H-咪唑(3.62g、15.99mmol、94%)。(参考例6)1-(2-((叔丁基二甲基甲硅烷基)氧基)乙基)-1H-咪唑-2-甲醛的合成:[化27]在-78℃下向1-(2-((叔丁基二甲基甲硅烷基)氧基)乙基)-1H-咪唑(3.60g、15.90mmol)的四氢呋喃(31.8mL)溶液滴加正丁基锂的正己烷溶液(1.62M、10.80mL、17.49mmol),在相同温度下搅拌1小时。向反应液在相同温度下加入DMF(1.46mL、19.08mmol),1小时搅拌后升温至室温。向反应液中加入饱和氯化铵水溶液、乙酸乙酯,用乙酸乙酯萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用柱色谱法(硅胶、正己烷/乙酸乙酯)纯化,以无色油状物的形式得到1-(2-((叔丁基二甲基甲硅烷基)氧基)乙基)-1H-咪唑-2-甲醛(3.96g、15.67mmol、98%)。(参考例7)2-(2-甲酰基-1H-咪唑-1-基)乙酸叔丁基酯的合成:[化28]在室温下向1H-咪唑-2-甲醛(1.00g、10.41mmol)的N,N-二甲基甲酰胺(52.0mL)溶液中加入碳酸钾(1.73g、12.49mmol)及2-溴乙酸叔丁基酯(1.83mL、12.49mmol),在相同的温度下进行18小时搅拌。向反应液中加入乙酸乙酯及蒸馏水,用乙酸乙酯萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用柱色谱法(硅胶、正己烷/乙酸乙酯)纯化,以黄色油状物的形式得到2-(2-甲酰基-1H-咪唑-1-基)乙酸叔丁基酯(1.05g、0.733mmol、48%)。(参考例8)3-(1-(2-((叔丁基二甲基甲硅烷基)氧基)乙基)-1H-咪唑-2-基)丙烯酸(E)-乙基酯的合成:[化29]向氢化钠(0.702g、16.10mmol、55%)的四氢呋喃(40.0mL)悬浮液中在0℃下加入二乙基膦酰基乙酸乙酯(2.76mL、13.80mmol)。在相同温度下搅拌1小时后,加入1-(2-((叔丁基二甲基甲硅烷基)氧基)乙基)-1H-咪唑-2-甲醛(3.90g、15.33mmol)的四氢呋喃(36.7mL)溶液,室温升温后搅拌1小时。向反应液中加入饱和氯化铵水溶液,用乙酸乙酯萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用柱色谱法(NH硅胶、正己烷/乙酸乙酯)纯化,以无色油状物的形式3-(1-(2-((叔丁基二甲基甲硅烷基)氧基)乙基)-1H-咪唑-2-基)丙烯酸(E)-乙基酯(3.42g、10.54mmol、69%)。(参考例9)3-(1-(2-(叔丁氧基)-2-氧代乙基)-1H-咪唑-2-基)丙烯酸(E)-苄基酯的合成:[化30]向氢化钠(0.125g、2.85mmol、55%)的四氢呋喃(3.5mL)悬浮液中在0℃下加入二甲基膦酰基乙酸苄基酯(0.700g、2.71mmol)的四氢呋喃(3.0mL)溶液。在相同温度下搅拌30分钟后,加入2-(2-甲酰基-1H-咪唑-1-基)乙酸叔丁基酯(0.600g、2.85mmol)的四氢呋喃(3.0mL)溶液,室温升温后搅拌15小时。向反应液中加入饱和氯化铵水溶液,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用柱色谱法(NH硅胶、正己烷/乙酸乙酯)纯化,以黄色油状物的形式得到3-(1-(2-(叔丁氧基)-2-氧代乙基)-1H-咪唑-2-基)丙烯酸(E)-苄基酯(0.82g、2.39mmol、82%)。(参考例10)粗3-(1-(2-((叔丁基二甲基甲硅烷基)氧基)乙基)-1H-咪唑-2-基)丙烷酸的合成:[化31]在室温下向3-(1-(2-((叔丁基二甲基甲硅烷基)氧基)乙基)-1H-咪唑-2-基)丙烯酸(E)-乙基酯(3.42g、10.54mmol)的甲醇(42.2mL)溶液中加入钯-碳(10%wet、342mg),在氢气氛下,搅拌18小时。对反应液进行硅藻土过滤,将滤液减压浓缩。在室温下向得到的残渣中加入甲醇(21.0mL),使其溶解。冷却至0℃后,在相同的温度下向反应液中加入氢氧化钠水溶液(1.0N、11.59mL、11.59mmol),升温至室温搅拌5小时。在室温下向反应液中加入氢氧化钠水溶液(1.0N、5.80mL、5.80mmol),搅拌1小时。冷却至0℃后,向反应液中加入盐酸(1.0N、17.4mL)中和后,减压浓缩。用甲苯共沸,加入乙醇。对析出物进行硅藻土过滤,将滤液减压浓缩,以无色油状物的形式3-(1-(2-((叔丁基二甲基甲硅烷基)氧基)乙基)-1H-咪唑-2-基)丙烷酸的粗产物(3.30g)。(参考例11)粗3-(1-(2-(叔丁氧基)-2-氧代乙基)-1H-咪唑-2-基)丙烷酸的合成:[化32]在室温下向3-(1-(2-(叔丁氧基)-2-氧代乙基)-1H-咪唑-2-基)丙烯酸(E)-苄基酯(0.818g、2.39mmol)的甲醇(9.6mL)溶液中加入钯-碳(10%wet、81.8mg),在氢气氛下,搅拌16小时。对反应液进行硅藻土过滤后,将滤液减压浓缩,得到3-(1-(2-(叔丁氧基)-2-氧代乙基)-1H-咪唑-2-基)丙烷酸的粗产物(0.590g)。(参考例12)1-(4-苄基(甲基)氨基哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙烷-1-酮的合成:[化33]在室温下向3-(1-甲基-1H-咪唑-2-基)丙酸(0.300g、1.95mmol)的氯仿(17.0mL)溶液中加入二异丙基乙基胺(0.892mL、5.11mmol)、HBTU(0.969g、2.55mmol)及N-苄基-N-甲基哌啶-4-胺(0.348g、1.70mmol),将反应液在相同的温度下搅拌60小时。向反应液中加入甲醇,减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式1-(4-苄基(甲基)氨基哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙烷-1-酮(0.204g、0.599mmol、35%)。(参考例13)3-(1-(2-((叔丁基二甲基甲硅烷基)氧基)乙基)-1H-咪唑-2-基)-1-(4-(二甲基氨基)哌啶-1-基)丙烷-1-酮的合成:[化34]在室温下向3-(1-(2-((叔丁基二甲基甲硅烷基)氧基)乙基)-1H-咪唑-2-基)丙烷酸粗产物(3.15g)的氯仿(56.5mL)溶液中加入二异丙基乙基胺(2.76mL、15.81mmol)、HBTU(4.80g、12.65mmol)及4-(二甲基氨基)哌啶(1.12mL、10.01mmol),将反应液在相同的温度下搅拌12小时。向反应液中加入饱和碳酸钾水溶液、10%氯化钠水溶液,用氯仿萃取。将有机层用无水硫酸钠干燥后,过滤,将滤液减压浓缩。将残渣用柱色谱法(NH硅胶、氯仿/甲醇)纯化,以白色固体的形式得到3-(1-(2-((叔丁基二甲基甲硅烷基)氧基)乙基)-1H-咪唑-2-基)-1-(4-(二甲基氨基)哌啶-1-基)丙烷-1-酮(2.88g、7.05mmol、70%)。(参考例14)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸叔丁基酯的合成:[化35]在室温下向3-(1-(2-(叔丁氧基)-2-氧代乙基)-1H-咪唑-2-基)丙烷酸粗产物(0.380g)的氯仿(15.0mL)溶液中加入二异丙基乙基胺(0.392mL、2.24mmol)、HBTU(0.680g、1.79mmol)及4-(二甲基氨基)哌啶(0.167mL、1.42mmol),将反应液在相同的温度下搅拌12小时。向反应液中加入饱和碳酸钾水溶液、10%氯化钠水溶液,用氯仿萃取。将有机层用无水硫酸钠干燥后,过滤,将滤液减压浓缩。将残渣用柱色谱法(NH硅胶、氯仿/乙酸乙酯)纯化,以无色油状物的形式2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸叔丁基酯(0.349g、0.957mmol、62%)。(参考例15)(2-(甲基(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)氨基)乙基)氨基甲酸叔丁基酯的合成:[化36]在室温下向3-(1-甲基-1H-咪唑-2-基)丙酸(0.118g,0.765mmol)的氯仿(8.0mL)溶液中加入二异丙基乙基胺(0.401mL、2.30mmol)、HBTU(0.348g、0.919mmol)及粗(2-(甲基(哌啶-4-基)氨基)乙基)氨基甲酸叔丁基酯(0.197g、0.765mmol),将反应液在相同的温度下搅拌16小时。向反应液中加入甲醇,减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式(2-(甲基(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)氨基)乙基)氨基甲酸叔丁基酯(0.260g、0.661mmol、86%)。(参考例16)1-(4-((2-氨基乙基)(甲基)氨基)哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙烷-1-酮的合成:[化37]在室温下向(2-(甲基(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)氨基)乙基)氨基甲酸叔丁基酯(0.100g、0.254mmol)的1,4-二噁烷(3.0mL)溶液中加入氯化氢的1,4-二噁烷溶液(4.0N、0.762mL、3.05mmol),在相同的温度下搅拌16小时。向反应液中加入饱和碳酸氢钠水溶液,用乙酸乙酯萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式1-(4-((2-氨基乙基)(甲基)氨基)哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙烷-1-酮(0.0498g、0.170mmol、67%)。(参考例17)粗4-乙基甲基氨基哌啶的合成:[化38]在0℃下向4-氧代哌啶-1-甲酸苄基酯(0.500g、2.14mmol)的二氯甲烷(12.0mL)溶液中加入乙基甲基胺(0.230mL、2.68mmol)、乙酸(0.0120mL、0.214mmol)及三乙酰氧基硼氢化钠(0.681g、3.22mmol),将反应液在室温下进行16小时搅拌。将反应液冷却至0℃。向反应液中加入饱和碳酸氢钠水溶液,用氯仿萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速色谱法(硅胶、氯仿/甲醇)纯化。使得到的粗纯化物溶于甲醇(8.0mL),在室温下加入钯/碳(10%wet、0.185g、0.174mmol),在氢气氛下,搅拌16小时。对反应液进行硅藻土过滤,将滤液减压浓缩,得到4-乙基甲基氨基哌啶的粗产物。(参考例18)粗4-二乙基氨基哌啶的合成:[化39]在0℃下向4-氧代哌啶-1-甲酸苄基酯(0.500g、2.14mmol)的二氯甲烷(12.0mL)溶液中加入二乙基胺(0.276mL、2.68mmol)、乙酸(0.0120mL、0.214mmol)及三乙酰氧基硼氢化钠(0.681g、3.22mmol),将反应液在室温下进行16小时搅拌。将反应液冷却至0℃。向反应液中加入饱和碳酸氢钠水溶液,用氯仿萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速色谱法(硅胶、氯仿/甲醇)纯化。将得到的粗纯化物溶于甲醇(8.0mL),在室温下加入钯/碳(10%wet、0.180g、0.169mmol),在氢气氛下,搅拌16小时。对反应液进行硅藻土过滤,将滤液减压浓缩,得到4-二乙基氨基哌啶的粗产物。(参考例19)4-(哌啶-1-基)哌啶的合成:[化40]在0℃下向1-叔丁氧基羰基-4-哌啶酮(3.02g、15.2mmol)的二氯甲烷(25.0mL)溶液中加入哌啶(1.549g、18.19mmol)、三乙酰氧基硼氢化钠(3.85g、19.2mmol)及乙酸(0.0910g、1.52mmol),在室温下进行16小时搅拌。将反应液冷却至0℃。向反应液中加入饱和碳酸氢钠水溶液,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣溶于盐酸(1.0N),用乙酸乙酯萃取。向水层加入48%氢氧化钠水溶液形成碱性后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣溶于甲醇(25.0mL),加入浓盐酸(5.0mL)后在40℃下搅拌12小时。使反应液浓缩干固后溶于蒸馏水。加入48%氢氧化钠水溶液而成为碱性后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩,以白色固体的形式得到4-(哌啶-1-基)哌啶(2.04g、12.1mmol、80%)。(参考例20)4-(吗啉-4-基)哌啶的合成:[化41]在0℃下向1-叔丁氧基羰基-4-哌啶酮(1.51g、7.58mmol)的二氯甲烷(25.0mL)溶液中加入吗啉(0.792g、9.09mmol)、三乙酰氧基硼氢化钠(1.93g、9.09mmol)及乙酸(0.0460g、0.758mmol),在室温下进行16小时搅拌。将反应液冷却至0℃。向反应液中加入饱和碳酸氢钠水溶液,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣溶于盐酸(1.0N),用乙酸乙酯萃取。向水层加入48%氢氧化钠水溶液而成为碱性后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣溶于甲醇(25.0mL),加入浓盐酸(5.0mL)后在40℃下搅拌12小时。使反应液浓缩干固后溶于蒸馏水。加入48%氢氧化钠水溶液而成为碱性后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。以黄色固体的形式得到4-(吗啉-4-基)哌啶(1.52g、5.63mmol、74%)。(参考例21)4-(1-甲基哌嗪-4-基)哌啶的合成:[化42]在0℃下向1-叔丁氧基羰基-4-哌啶酮(1.50g、7.53mmol)的二氯甲烷(25.0mL)溶液中加入1-甲基哌嗪(0.905g、9.03mmol)、三乙酰氧基硼氢化钠(1.92g、9.03mmol)及乙酸(0.497g、8.28mmol),在室温下进行16小时搅拌。将反应液冷却至0℃。向反应液中加入饱和碳酸氢钠水溶液,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣溶于盐酸(1.0N),用乙酸乙酯萃取。向水层加入48%氢氧化钠水溶液而成为碱性后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣溶于甲醇(25.0mL),加入浓盐酸(5.0mL)后在40℃下搅拌12小时。使反应液浓缩干固后溶于蒸馏水。加入48%氢氧化钠水溶液而成为碱性后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。以白色固体的形式得到4-(1-甲基哌嗪-4-基)哌啶(0.826g、4.51mmol、60%)。(参考例22)(R)-3-二甲基氨基哌啶的合成:[化43]在0℃下向(R)-3-氨基-1-叔丁氧基羰基哌啶(1.00g、4.99mmol)的二氯甲烷(10.0mL)溶液中加入福尔马林水溶液(36-38wt%、2.08g、25.0mmol)、三乙酰氧基硼氢化钠(2.12g、9.99mmol)及乙酸(0.0300g、0.500mmol),在室温下进行16小时搅拌。将反应液冷却至0℃。向反应液中加入饱和碳酸氢钠水溶液,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣溶于盐酸(1.0N),用乙酸乙酯萃取。向水层加入48%氢氧化钠水溶液而成为碱性后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣溶于甲醇(25.0mL),加入浓盐酸(5.0mL)后在40℃下搅拌12小时。使反应液浓缩干固后溶于蒸馏水。加入48%氢氧化钠水溶液而成为碱性后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。以无色油状物的形式(R)-3-二甲基氨基哌啶(0.384g、3.00mmol、60%)。(参考例23)(S)-3-二甲基氨基哌啶的合成:[化44]在0℃下向(S)-3-氨基-1-叔丁氧基羰基哌啶(1.00g、4.99mmol)的二氯甲烷(10.0mL)溶液中加入福尔马林水溶液(36-38wt%、2.10g、25.2mmol)、三乙酰氧基硼氢化钠(2.13g、10.0mmol)及乙酸(0.0300g、0.500mmol),在室温下进行16小时搅拌。将反应液冷却至0℃。向反应液中加入饱和碳酸氢钠水溶液,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣溶于盐酸(1.0N),用乙酸乙酯萃取。向水层加入48%氢氧化钠水溶液而成为碱性后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣溶解于甲醇(25.0mL),加入浓盐酸(5.0mL)后在40℃下搅拌12小时。使反应液浓缩干固后溶于蒸馏水。加入48%氢氧化钠水溶液而成为碱性后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。以无色油状物的形式(S)-3-二甲基氨基哌啶(0.351g、2.74mmol、55%)。(参考例24)粗环丙醇的合成:[化45]在0℃下向环丙基硼酸(0.300g、3.49mmol)中加入氢氧化钠水溶液(10%、1.29mL、3.49mmol)及过氧化氢水溶液(30%、9.90mL、87.0mmol),将反应液在相同的温度下搅拌1小时。向反应液加入饱和硫代硫酸钠水溶液,用二乙醚萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩,得到环丙醇的粗产物。(参考例25)粗4-(羟基甲基)-5-甲基-1,3-二氧杂环戊烯-2酮的合成:[化46]在0℃下向4-(氯甲基)-5-甲基-1,3-二氧杂环戊烯-2酮(1.00g、6.73mmol)的乙腈(10.0mL)溶液中加入甲酸(0.750mL、19.6mmol)及三乙基胺(2.62mL、18.8mmol),将反应液升温至65℃进行3小时搅拌。对析出物进行硅藻土过滤,将滤液减压浓缩。向残渣加入蒸馏水,用乙酸乙酯萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。在室温下向得到的残渣中加入甲醇(10.0mL),使其溶解。在室温下向反应液中加入蒸馏水(3.0mL)及浓盐酸(0.120mL、3.95mmol),在相同的温度下搅拌3小时。向反应液加入蒸馏水,减压浓缩。向残渣加入蒸馏水,用乙酸乙酯萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩,得到4-(羟基甲基)-5-甲基-1,3-二氧杂环戊烯-2酮的粗产物。(参考例26)2-羟基-N,N-二甲基乙酰胺的合成:[化47]在室温下向2-(苄基氧基)乙酸(1.00g、6.02mmol)的氯仿(30.0mL)溶液中加入二异丙基乙基胺(2.10mL、12.0mmol)、HBTU(2.74g、7.22mmol)及二甲基胺的THF溶液(2.0M、3.61mL、7.22mmol),将反应液在相同的温度下搅拌16小时。将反应液减压浓缩。将残渣用快速色谱法(硅胶、氯仿/甲醇)纯化。得到的将残渣溶于甲醇(30.0mL),在室温下加入钯-碳(10%wet、0.640g、0.602mmol),在氢气氛下,在相同的温度下搅拌16小时。对反应液进行硅藻土过滤,将滤液减压浓缩。将残渣用快速色谱法(硅胶、氯仿/甲醇)纯化,以无色油状物的形式得到2-羟基-N,N-二甲基乙酰胺(0.255g、2.47mmol、41%)。(参考例27)2-(2-甲酰基-1H-咪唑-1-基)乙酸乙酯的合成:[化48]在室温下向1H-咪唑-2-甲醛(0.500g、5.20mmol)的N,N-二甲基甲酰胺(10.0mL)溶液中加入碳酸钾(1.44g、10.4mmol)、氯乙酸乙酯(0.585mL、5.46mmol)、碘化钾(0.864g、5.20mmol),将反应液升温至90℃搅拌4小时。向反应液加入蒸馏水,用乙酸乙酯萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速色谱法(硅胶、氯仿/甲醇)纯化,以黄色油状物的形式得到2-(2-甲酰基-1H-咪唑-1-基)乙酸乙酯(0.269g、1.48mmol、28%)。(参考例28)3-(1-(2-乙氧基-2-氧代乙基)-1H-咪唑-2-基)丙烯酸(E)-苄基酯的合成:[化49]在0℃下向氢化钠(55%、0.958g、22.0mmol)的四氢呋喃(30.0mL)悬浮液中加入二甲基膦酰基乙酸苄基酯(4.61mL、22.0mmol),在相同的温度下搅拌1小时。向反应液中加入2-(2-甲酰基-1H-咪唑-1-基)乙酸乙酯(4.00g、22.0mmol),将反应液在室温下搅拌3小时。向反应液加入饱和氯化铵水溶液,用乙酸乙酯萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速色谱法(硅胶、正己烷/乙酸乙酯)纯化,以白色固体的形式得到3-(1-(2-乙氧基-2-氧代乙基)-1H-咪唑-2-基)丙烯酸(E)-苄基酯(4.31g、13.7mmol、62%)。(参考例29)粗3-(1-(2-乙氧基-2-氧代乙基)-1H-咪唑-2-基)丙烷酸的合成:[化50]在室温下向3-(1-(2-乙氧基-2-氧代乙基)-1H-咪唑-2-基)丙烯酸(E)-苄基酯(4.31g、13.7mmol)的乙醇(80.0mL)溶液中加入钯-碳(10%wet、1.46g、1.37mmol),在氢气氛下,将反应液在相同的温度下搅拌24小时。将反应液升温至40℃,搅拌1小时。对反应液进行硅藻土过滤,将滤液减压浓缩,得到3-(1-(2-乙氧基-2-氧代乙基)-1H-咪唑-2-基)丙烷酸的粗产物。(参考例30)3-(1H-咪唑-2-基)丙烯酸(E)-苄基酯的合成:[化51]在0℃下向氢化钠(55%、1.12g、25.6mmol)的四氢呋喃(40.0mL)悬浮液中加入二甲基膦酰基乙酸苄基酯(5.12mL、24.4mmol),将反应液在相同的温度下搅拌1小时。在0℃下向反应液中加入1H-咪唑-2-甲醛(2.46g、25.6mmol),将反应液在室温下搅拌60小时。向反应液加入饱和氯化铵水溶液,用乙酸乙酯萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速色谱法(硅胶、氯仿/甲醇)纯化,以白色固体的形式得到3-(1H-咪唑-2-基)丙烯酸(E)-苄基酯(0.380g、1.66mmol、7%)。(参考例31)3-(1-(3-乙氧基-3-氧代丙基)-1H-咪唑-2-基)丙烯酸(E)-苄基酯的合成:[化52]在室温下向3-(1H-咪唑-2-基)丙烯酸(E)-苄基酯(0.500g、2.19mmol)的DMF(7.3mL)溶液中加入碳酸钾(0.606g、4.38mmol)、3-溴丙酸乙酯(0.419mL、3.29mmol)、碘化钾(0.364g、2.19mmol),将反应液升温至90℃,搅拌4小时。向反应液中加入蒸馏水,用乙酸乙酯萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速色谱法(硅胶、正己烷/乙酸乙酯)纯化,以黄色油状物的形式得到3-(1-(3-乙氧基-3-氧代丙基)-1H-咪唑-2-基)丙烯酸(E)-苄基酯(0.520g、1.59mmol、72%)。(参考例32)粗3-(1-(3-乙氧基-3-氧代丙基)-1H-咪唑-2-基)丙烷酸的合成:[化53]在室温下向3-(1-(3-乙氧基-3-氧代丙基)-1H-咪唑-2-基)丙烯酸(E)-苄基酯(0.520g、1.59mmol)的乙醇(9.0mL)溶液中加入钯-碳(10%wet、0.169g、0.159mmol),在氢气氛下,将反应液在相同的温度下搅拌16小时。对反应液进行硅藻土过滤,将滤液减压浓缩,得到3-(1-(3-乙氧基-3-氧代丙基)-1H-咪唑-2-基)丙烷酸的粗产物。(实施例1)3-(1-甲基-1H-咪唑-2-基)-1-(4-(甲基氨基)哌啶-1-基)丙烷-1-酮的合成:[化54]在室温下向1-(4-苄基(甲基)氨基哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙烷-1-酮(0.200g、0.587mmol)的乙醇(2.0mL)溶液中加入氢氧化钯/碳(10%wet、0.0820g、0.0587mmol),在氢气氛下,搅拌3小时搅拌。对反应液进行硅藻土过滤,将滤液减压浓缩。将残渣用硅胶柱色谱法(氯仿/甲醇)纯化,以无色油状物的形式得到3-(1-甲基-1H-咪唑-2-基)-1-(4-(甲基氨基)哌啶-1-基)丙烷-1-酮(0.131g、0.523mmol、89%)(以下为实施例1的化合物)。(实施例2)3-(1-甲基-1H-咪唑-2-基)-1-(4-(甲基氨基)哌啶-1-基)丙烷-1-酮盐酸盐的合成:[化55]在0℃向3-(1-甲基-1H-咪唑-2-基)-1-(4-甲基氨基哌啶-1-基)丙烷-1-酮(0.131g、0.523mmol)的二乙醚(5.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.675mL、1.35mmol)。将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(19.5mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到3-(1-甲基-1H-咪唑-2-基)-1-(4-(甲基氨基)哌啶-1-基)丙烷-1-酮盐酸盐(0.0635g、0.196mmol、38%)(以下为实施例2的化合物)。ESI-MS:3-(1-甲基-1H-咪唑-2-基)-1-(4-(甲基氨基)哌啶-1-基)丙烷-1-酮:m/z=251(M+H)+。(实施例3)N-甲基-N-(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)乙酰胺的合成:[化56]在室温下向3-(1-甲基-1H-咪唑-2-基)-1-(4-甲基氨基哌啶-1-基)丙烷-1-酮(0.0500g、0.200mmol)的二氯甲烷(1.0mL)溶液中加入三乙基胺(0.0842mL、0.599mmol)、乙酸酐(0.0565mL、0.599mmol),将反应液在相同的温度下搅拌16小时。向反应液中加入饱和碳酸氢钠水溶液,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式N-甲基-N-(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)乙酰胺(0.0499g、0.171mmol、85%)(以下为实施例3的化合物)。(实施例4)N-甲基-N-(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)乙酰胺盐酸盐的合成:[化57]在0℃下向N-甲基-N-(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)乙酰胺(0.0499g、0.171mmol)的二乙醚(2.0mL)溶液加入氯化氢的二乙醚溶液(2.0N、0.111mL、0.222mmol)。将反应液在相同的温度下搅拌1小时后,在室温下搅拌30分钟。滤取析出的白色固体,用二乙醚(6.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到N-甲基-N-(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)乙酰胺盐酸盐(0.0397g、0.121mmol、71%)(以下为实施例4的化合物)。ESI-MS:N-甲基-N-(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)乙酰胺:m/z=293(M+H)+。(实施例5)N-(2-(甲基(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)氨基)乙基)乙酰胺的合成:[化58]在室温下向1-(4-((2-氨基乙基)(甲基)氨基)哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙烷-1-酮(0.0500g、0.170mmol)的二氯甲烷(2.0mL)溶液中加入吡啶(0.0410mL、0.511mmol)、乙酸酐(0.0480mL、0.511mmol),将反应液在相同的温度下搅拌16小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式N-(2-(甲基(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)氨基)乙基)乙酰胺(0.0451g、0.134mmol、79%)(以下为实施例5的化合物)。(实施例6)N-(2-(甲基(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)氨基)乙基)乙酰胺盐酸盐的合成:[化59]在0℃下向N-(2-(甲基(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)氨基)乙基)乙酰胺(0.0451g、0.134mmol)的二乙醚(2.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.174mL、0.349mmol),在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(6.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到N-(2-(甲基(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)氨基)乙基)乙酰胺盐酸盐(0.0211g、0.0517mmol、39%)(以下为实施例6的化合物)。ESI-MS:N-(2-(甲基(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)氨基)乙基)乙酰胺:m/z=336(M+H)+。(实施例7)1-(4-氨基哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙烷-1-酮的合成:[化60]在室温下向3-(1-甲基-1H-咪唑-2-基)丙酸(0.160g、1.04mmol)的氯仿(6.0mL)溶液中加入二异丙基乙基胺(0.544mL、3.11mmol)、HBTU(0.472g、1.25mmol)及哌啶-4-基氨基甲酸叔丁基酯(0.208g、1.04mmol),将反应液在相同的温度下搅拌60小时。向反应液中加入甲醇,减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化。在室温下向得到的残渣中加入1,4-二噁烷(11.0mL),使其溶解。在室温下向反应液中加入氯化氢的1,4-二噁烷溶液(4.0N、3.11mL、12.5mmol),在相同的温度下搅拌16小时。向反应液中加入1.0N氢氧化钠水溶液,减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式1-(4-氨基哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙烷-1-酮(0.231g、0.978mmol、94%)(以下为实施例7的化合物)。(实施例8)1-(4-氨基哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙烷-1-酮盐酸盐的合成:[化61]在0℃下向1-(4-氨基哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙烷-1-酮(0.0430g、0.182mmol)的二乙醚(2.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.227mL、0.455mmol)。将反应液在相同的温度下搅拌30分钟后,在室温搅拌1小时。滤取析出的白色固体,用二乙醚洗涤,在室温下干燥后,以白色固体的形式得到1-(4-氨基哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙烷-1-酮盐酸盐(0.0420g、0.136mmol、75%)(以下为实施例8的化合物)。ESI-MS:1-(4-氨基哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙烷-1-酮:m/z=237(M+H)+。(实施例9)N-(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)乙酰胺的合成:[化62]在室温下向1-(4-氨基哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙烷-1-酮(0.0500g、0.212mmol)的二氯甲烷(2.0mL)溶液中加入吡啶(0.0510mL、0.635mmol)、乙酸酐(0.0600mL、0.635mmol),将反应液在相同的温度下搅拌3小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式N-(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)乙酰胺(0.0510g、0.183mmol、86%)(以下为实施例9的化合物)。(实施例10)N-(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)乙酰胺盐酸盐的合成:[化63]在0℃下向N-(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)乙酰胺(0.0510g、0.183mmol)的二乙醚(2.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.119mL、0.238mmol)。将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(6.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到N-(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)乙酰胺盐酸盐(0.0344g、0.109mmol、60%)(以下为实施例10的化合物)。ESI-MS:N-(1-(3-(1-甲基-1H-咪唑-2-基)丙酰基)哌啶-4-基)乙酰胺:m/z=279(M+H)+。(实施例11)1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(2-羟基乙基)-1H-咪唑-2-基)丙烷-1-酮的合成:[化64]在0℃下向3-(1-(2-((叔丁基二甲基甲硅烷基)氧基)乙基)-1H-咪唑-2-基)-1-(4-(二甲基氨基)哌啶-1-基)丙烷-1-酮(1.00g、2.45mmol)的四氢呋喃(12.2mL)溶液中加入四丁基氟化铵的四氢呋喃溶液(1.0M、3.06mL、3.06mmol),升温至室温后搅拌2小时。将反应液减压浓缩后,将残渣用柱色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(2-羟基乙基)-1H-咪唑-2-基)丙烷-1-酮(0.605g、2.06mmol、84%)(以下为实施例11的化合物)。(实施例12)1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(2-羟基乙基)-1H-咪唑-2-基)丙烷-1-酮盐酸盐的合成:[化65]在0℃下向1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(2-羟基乙基)-1H-咪唑-2-基)丙烷-1-酮(37.7mg、0.128mmol)的二乙醚(2.5mL)-二氯甲烷溶液中加入氯化氢的二乙醚溶液(2.0N、0.16mL、0.32mmol)。将反应液在相同的温度下搅拌1小时后,升温至室温搅拌1小时。滤取析出的白色固体,用二乙醚洗涤,在室温下干燥后,以白色固体的形式得到1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(2-羟基乙基)-1H-咪唑-2-基)丙烷-1-酮盐酸盐(43.1mg、0.117mmol、92%)(以下为实施例12的化合物)。ESI-MS:1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(2-羟基乙基)-1H-咪唑-2-基)丙烷-1-酮:m/z=295(M+H)+。(实施例13)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐的合成:[化66]在0℃下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸叔丁基酯(0.104g、0.287mmol)的1,4-二噁烷(1.0mL)溶液中加入氯化氢的1,4-二噁烷溶液(4.0N、0.861mL、3.45mmol)。将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,以白色固体的形式得到2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐(quant.)(以下为实施例13的化合物)。ESI-MS:2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸:m/z=307(M-H)-。(实施例14)3-(1-(2-氨基乙基)-1H-咪唑-2-基)-1-(4-(二甲基氨基)哌啶-1-基)丙烷-1-酮的合成:[化67]在0℃下向1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(2-羟基乙基)-1H-咪唑-2-基)丙烷-1-酮(0.660g、2.24mmol)的二氯甲烷(11.0mL)溶液中加入三乙基胺(0.342mL、2.47mmol)、甲磺酰氯(0.191mL、2.47mmol),升温至室温搅拌1小时。向反应液中加入饱和碳酸钾水溶液,用二氯甲烷萃取。将有机层用无水硫酸钠干燥后,过滤,将滤液减压浓缩。向得到的残渣中加入乙腈(10.8mL),使其溶解。在室温下加入邻苯二甲酰亚胺钾(0.452g、2.44mmol),进行3小时加热回流。将反应液减压浓缩后,向残渣加入二氯甲烷、饱和碳酸钾水溶液,用二氯甲烷萃取。将有机层用无水硫酸钠干燥后,过滤,将滤液减压浓缩。向得到的残渣中加入甲醇(10.8mL),使其溶解。在室温下加入肼水合物(0.158mL、3.25mmol),加热回流1小时。将反应液恢复至室温,过滤后,将滤液减压浓缩。向残渣中加入二氯甲烷、盐酸水溶液(1.0N、8.0mL),将水层用二氯甲烷洗涤。向水层加入氢氧化钠水溶液(1N、8.0mL),减压浓缩。将残渣用柱色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式3-(1-(2-氨基乙基)-1H-咪唑-2-基)-1-(4-(二甲基氨基)哌啶-1-基)丙烷-1-酮(0.338g、1.15mmol、51%)(以下为实施例14的化合物)。(实施例15)3-(1-(2-氨基乙基)-1H-咪唑-2-基)-1-(4-(二甲基氨基)哌啶-1-基)丙烷-1-酮盐酸盐的合成:[化68]在0℃下向3-(1-(2-氨基乙基)-1H-咪唑-2-基)-1-(4-(二甲基氨基)哌啶-1-基)丙烷-1-酮(0.0576g、0.196mmol)的二乙醚(3.9mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.245mL、0.491mmol)。将反应液在相同的温度下搅拌1小时后,升温至室温搅拌1小时。滤取析出的白色固体,用二乙醚洗涤,在室温下干燥后,以白色固体的形式得到3-(1-(2-氨基乙基)-1H-咪唑-2-基)-1-(4-(二甲基氨基)哌啶-1-基)丙烷-1-酮盐酸盐(0.0633g、0.173mmol、88%)(以下为实施例15的化合物)。ESI-MS:3-(1-(2-(氨基乙基)-1H-咪唑-2-基)-1-(4-(二甲基氨基)哌啶-1-基)丙烷-1-酮:m/z=294(M+H)+。(实施例16)2-(2-(3-(4-(乙基甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯的合成:[化69]在室温下向粗3-(1-(2-乙氧基-2-氧代乙基)-1H-咪唑-2-基)丙烷酸(0.0500g、0.221mmol)的氯仿(2.0mL)溶液中加入二异丙基乙基胺(0.116mL、0.663mmol)、HBTU(0.126g、0.332mmol)及粗4-乙基甲基氨基哌啶(0.0310g、0.221mmol),将反应液在相同的温度下搅拌16小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式2-(2-(3-(4-(乙基甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.0250g、0.0713mmol、32%)(以下为实施例16的化合物)。(实施例17)2-(2-(3-(4-(乙基甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸的合成:[化70]在室温下向2-(2-(3-(4-(乙基甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.180g、0.514mmol)的乙醇(3.0mL)溶液中加入氢氧化钠水溶液(1.0N、0.565mL、0.565mmol),将反应液在相同的温度下搅拌4小时。冷却至0℃后,向反应液加入盐酸(1.0N)中和后,减压浓缩。用甲苯共沸,加入乙醇。对析出物进行硅藻土过滤,将滤液减压浓缩,以白色固体的形式得到2-(2-(3-(4-(乙基甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.161g、0.499mmol、97%)(以下为实施例17的化合物)。(实施例18)2-(2-(3-(4-(乙基甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐的合成:[化71]在0℃下向2-(2-(3-(4-(乙基甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.161g、0.499mmol)的水(1.0mL)溶液中加入盐酸(1.0N、0.354mL、0.354mmol),将反应液在相同的温度下搅拌2小时。将反应液减压浓缩,滤取析出的白色固体,以白色固体的形式得到2-(2-(3-(4-(乙基甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐(0.160g、0.446mmol、89%)(以下为实施例18的化合物)。ESI-MS:2-(2-(3-(4-(乙基甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸:m/z=323(M+H)+。(实施例19)2-(2-(3-(4-(二乙基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯的合成:[化72]在室温下向粗3-(1-(2-乙氧基-2-氧代乙基)-1H-咪唑-2-基)丙烷酸(0.0500g、0.221mmol)的氯仿(2.0mL)溶液中加入二异丙基乙基胺(0.116mL、0.663mmol)、HBTU(0.126g、0.332mmol)及粗4-二乙基氨基哌啶(0.0350g、0.221mmol),将反应液在相同的温度下搅拌16小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式2-(2-(3-(4-(二乙基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.0700g、0.192mmol、87%)(以下为实施例19的化合物)。(实施例20)2-(2-(3-(4-(二乙基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯盐酸盐的合成:[化73]在0℃下向2-(2-(3-(4-(二乙基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.0350g、0.0960mmol)的二乙醚(1.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.106mL、0.211mmol),将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(4.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到2-(2-(3-(4-(二乙基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯盐酸盐(0.0217g、0.0496mmol、24%)(以下为实施例20的化合物)。ESI-MS:2-(2-(3-(4-(二乙基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯:m/z=365(M+H)+。(实施例21)2-(2-(3-(4-(二乙基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸的合成:[化74]在室温下向2-(2-(3-(4-(二乙基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.150g、0.412mmol)的乙醇(2.0mL)溶液中加入氢氧化钠水溶液(1.0N、0.452mL、0.452mmol),将反应液在相同的温度下搅拌4小时。冷却至0℃后,向反应液中加入盐酸(1.0N)中和后,减压浓缩。用甲苯共沸,加入乙醇。对析出物进行硅藻土过滤,将滤液减压浓缩,以白色固体的形式得到2-(2-(3-(4-(二乙基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.124g、0.369mmol、89%)(以下为实施例21的化合物)。(实施例22)2-(2-(3-(4-(二乙基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐的合成:[化75]在0℃下向2-(2-(3-(4-(二乙基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.124g、0.369mmol)的水(1.0mL)溶液中加入盐酸(1.0N、0.785mL、0.785mmol),将反应液在相同的温度下搅拌2小时。将反应液减压浓缩,滤取析出的白色固体,以白色固体的形式得到2-(2-(3-(4-(二乙基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐(0.104g、0.278mmol、75%)(以下为实施例22的化合物)。ESI-MS:2-(2-(3-(4-(二乙基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸:m/z=337(M+H)+。(实施例23)2-(2-(3-(4-(哌啶-1-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯的合成:[化76]在室温下向粗3-(1-(2-乙氧基-2-氧代乙基)-1H-咪唑-2-基)丙烷酸(0.200g、0.884mmol)的二氯甲烷(10.0mL)溶液中加入二异丙基乙基胺(0.171g、1.33mmol)、HBTU(0.402g、1.06mmol)及4-(哌啶-1-基)哌啶(0.149g、0.884mmol),将反应液在相同的温度下搅拌12小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、己烷/乙酸乙酯及氯仿/甲醇)纯化,以红褐色油状物的形式得到2-(2-(3-(4-(哌啶-1-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.266g、0.708mmol、80%)(以下为实施例23的化合物)。(实施例24)2-(2-(3-(4-(哌啶-1-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸的合成:[化77]将2-(2-(3-(4-(哌啶-1-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.0550g、0.146mmol)的水(5.0mL)溶液加热至40℃,在相同的温度下搅拌12小时。使反应液浓缩干固后,减压干燥,由此得到红褐色固体2-(2-(3-(4-(哌啶-1-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.0510g、0.146mmol、100%)(以下为实施例24的化合物)。(实施例25)2-(2-(3-(4-(哌啶-1-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐的合成:[化78]在0℃下向2-(2-(3-(4-(哌啶-1-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.0650g、0.173mmol)的水(5.0mL)溶液中加入氢氧化钠水溶液(1.0N、0.345mL、0.345mmol)。将反应液在相同的温度下搅拌1小时。加入盐酸(1.0N、0.518mL、0.518mmol),浓缩干固。将得到的固体用乙醇洗涤,过滤后,将滤液浓缩干固。再度将得到的固体用乙醇洗涤,过滤后,将滤液浓缩干固。减压干燥后,以白色固体的形式得到2-(2-(3-(4-(哌啶-1-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐(0.0510g、0.133mmol、77%)(以下为实施例25的化合物)。ESI-MS:2-(2-(3-(4-(哌啶-1-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸:349(M+H)+。(实施例26)2-(2-(3-(4-(吗啉-1-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯的合成:[化79]在室温下向粗3-(1-(2-乙氧基-2-氧代乙基)-1H-咪唑-2-基)丙烷酸(0.200g、0.884mmol)的二氯甲烷(10.0mL)溶液中加入二异丙基乙基胺(0.171g、1.33mmol)、HBTU(0.402g、1.06mmol)及4-(吗啉-4-基)哌啶(0.151g、0.884mmol),将反应液在相同的温度下搅拌12小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、己烷/乙酸乙酯及氯仿/甲醇)纯化,以白色固体的形式得到2-(2-(3-(4-(吗啉-1-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.265g、0.700mmol、79%)(以下为实施例26的化合物)。(实施例27)2-(2-(3-(4-(吗啉-4-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐的合成:[化80]在0℃下向2-(2-(3-(4-(吗啉-4-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.080g、0.211mmol)的水(5.0mL)溶液中加入氢氧化钠水溶液(1.0N、0.423mL、0.423mmol)。将反应液在相同的温度下搅拌1小时。加入盐酸(1.0N、0.634mL、0.634mmol),浓缩干固。将得到的固体用乙醇洗涤,过滤后浓缩干固。再将得到的固体用乙醇洗涤,过滤后浓缩干固。减压干燥后,以白色固体的形式得到2-(2-(3-(4-(吗啉-4-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐(0.0580g、0.150mmol、71%)(以下为实施例27的化合物)。ESI-MS:2-(2-(3-(4-(吗啉-4-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸:351(M+H)+。(实施例28)2-(2-(3-(4-(1-甲基哌嗪-4-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯的合成:[化81]在室温下向粗3-(1-(2-乙氧基-2-氧代乙基)-1H-咪唑-2-基)丙烷酸(0.200g、0.884mmol)的二氯甲烷(10.0mL)溶液中加入二异丙基乙基胺(0.171g、1.33mmol)、HBTU(0.402g、1.06mmol)及4-(1-甲基哌嗪-4-基)哌啶(0.162g、0.884mmol),将反应液在相同的温度下搅拌12小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、己烷/乙酸乙酯及氯仿/甲醇)纯化,以淡黄色油状物的形式得到2-(2-(3-(4-(1-甲基哌嗪-4-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.280g、0.715mmol、81%)(以下为实施例28的化合物)。(实施例29)2-(2-(3-(4-(1-甲基哌嗪-4-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐的合成:[化82]在0℃下向2-(2-(3-(4-(1-甲基哌嗪-4-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.118g、0.303mmol)的水(5.0mL)溶液中加入氢氧化钠水溶液(1.0N、0.605mL、0.605mmol)。将反应液在相同的温度下搅拌1小时。加入盐酸(1.0N、0.910mL、0.910mmol),浓缩干固。将得到的固体用乙醇洗涤,过滤后浓缩干固。再度将得到的固体用乙醇洗涤,过滤后浓缩干固。以白色固体的形式得到减压干燥后,2-(2-(3-(4-(1-甲基哌嗪-4-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐(0.0850g、0.213mmol、70%)(以下为实施例29的化合物)。ESI-MS:2-(2-(3-(4-(1-甲基哌嗪-4-基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸:364(M+H)+。(实施例30)2-(2-(3-((R)-3-二甲基氨基哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯的合成:[化83]在室温下向粗3-(1-(2-乙氧基-2-氧代乙基)-1H-咪唑-2-基)丙烷酸(0.300g、1.33mmol)的二氯甲烷(15.0mL)溶液中加入二异丙基乙基胺(0.257g、1.99mmol)、HBTU(0.603g、1.59mmol)及(R)-3-二甲基氨基哌啶(0.149g、0.880mmol),将反应液在相同的温度下搅拌12小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、己烷/乙酸乙酯及氯仿/甲醇)纯化,以黄色油状物的形式得到2-(2-(3-((R)-3-二甲基氨基哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.325g、0.966mmol、73%)(以下为实施例30的化合物)。(实施例31)2-(2-(3-((R)-3-二甲基氨基哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐的合成:[化84]在0℃下向2-(2-(3-((R)-3-二甲基氨基哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.0550g、0.165mmol)的水(5.0mL)溶液中加入氢氧化钠水溶液(1.0N、0.329mL、0.329mmol)。将反应液在相同的温度下搅拌1小时。加入盐酸(1.0N、0.494mL、0.494mmol),浓缩干固。将得到的固体用乙醇洗涤,过滤后浓缩干固。再度将得到的固体用乙醇洗涤,过滤后浓缩干固。减压干燥后,以白色固体的形式得到2-(2-(3-((R)-3-二甲基氨基哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐(0.0400g、0.116mmol、70%)(以下为实施例31的化合物)。ESI-MS:2-(2-(3-((R)-3-二甲基氨基哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸:309(M+H)+。(实施例32)(S)-2-(2-(3-(3-(二甲基氨基)吡咯烷-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯的合成:[化85]在室温下向粗3-(1-(2-乙氧基-2-氧代乙基)-1H-咪唑-2-基)丙烷酸(0.150g、0.663mmol)的二氯甲烷(3.0mL)溶液中加入二异丙基乙基胺(0.174mL、0.995mmol)、HBTU(0.302g、0.796mmol)及(S)-3-(二甲基氨基)吡咯烷(0.0840mL、0.663mmol),将反应液在相同的温度下搅拌3小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以黄色油状物的形式得到(S)-2-(2-(3-(3-(二甲基氨基)吡咯烷-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.200g、0.620mmol、93%)(以下为实施例32的化合物)。(实施例33)(S)-2-(2-(3-(3-(二甲基氨基)吡咯烷-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐的合成:[化86]在室温下向(S)-2-(2-(3-(3-(二甲基氨基)吡咯烷-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.160g、0.496mmol)中加入氢氧化钠水溶液(1.0N、0.744mL、0.744mmol),将反应液在室温下搅拌4小时。在室温下向反应液中加入盐酸(1.0N、0.744mL、0.744mmol),将反应液在相同的温度下搅拌5分钟。将反应液减压浓缩。将得到的残渣用乙醇(5.0mL)洗涤。过滤后,将滤液减压浓缩。将得到的残渣再用乙醇(5.0mL)洗涤。过滤后,将滤液减压浓缩。在室温下向得到的残渣中加入盐酸(1.0N、0.595mL、0.595mmol),将反应液在相同的温度下搅拌1小时。将反应液减压浓缩,在室温下干燥后,以红色固体的形式得到(S)-2-(2-(3-(3-(二甲基氨基)吡咯烷-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸盐酸盐(0.120g、0.363mmol、73%)(以下为实施例33的化合物)。(实施例34)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸叔丁基酯盐酸盐的合成:[化87]在0℃下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸叔丁基酯(0.100g、0.274mmol)的二乙醚(5.4mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.302mL、0.604mmol),将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(20.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸叔丁基酯盐酸盐(0.111g、0.254mmol、93%)(以下为实施例34的化合物)。ESI-MS:2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸叔丁基酯:m/z=365(M+H)+。(实施例35)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸甲酯的合成:[化88]在室温下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸叔丁基酯(105mg、0.287mmol)的1,4-二噁烷(3.0mL)-甲醇(3.0mL)溶液中加入氯化氢的1,4-二噁烷溶液(4.0N、0.718mL、2.87mmol),在相同的温度下搅拌12小时。将反应液升温至60℃,搅拌1小时。向反应液中加入饱和碳酸钾水溶液,用氯仿萃取。用无水硫酸钠干燥后,过滤,将滤液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以白色固体的形式得到2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸甲酯(0.0370g、0.113mmol、39%)(以下为实施例35的化合物)。(实施例36)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸甲酯盐酸盐的合成:[化89]在0℃下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸甲酯(36.0mg、0.112mmol)的二乙醚(2.2mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.140mL、0.279mmol),将反应液在相同的温度下搅拌1小时。将反应液升温至室温,搅拌1小时。滤取析出的白色固体,二乙醚洗涤,在室温下干燥后,以白色固体的形式得到2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸甲酯盐酸盐(34.7mg、0.0880mmol、78%)(以下为实施例36的化合物)。ESI-MS:2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸甲酯:m/z=323(M+H)+。(实施例37)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯的合成:[化90]在室温下向粗3-(1-(2-乙氧基-2-氧代乙基)-1H-咪唑-2-基)丙烷酸(1.20g、5.30mmol)的氯仿(24.0mL)溶液中加入二异丙基乙基胺(1.39mL、7.96mmol)、HBTU(2.41g、6.37mmol)及4-二甲基氨基哌啶(0.624mL、5.30mmol),将反应液在相同的温度下搅拌16小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.630g、1.87mmol、35%)(以下为实施例37的化合物)。(实施例38)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯盐酸盐的合成:[化91]在0℃下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.182g、0.541mmol)的二乙醚(10.8mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.595mL、1.19mmol),将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(40.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯盐酸盐(0.182g、0.445mmol、82%)(以下为实施例38的化合物)。ESI-MS:2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯:m/z=337(M+H)+。(实施例39)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸的合成:[化92]在室温下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸乙酯(0.510g、1.52mmol)的乙醇(3.0mL)溶液中加入氢氧化钠水溶液(1.0N、3.03mL、3.03mmol),将反应液在相同的温度下搅拌3小时。冷却至0℃后,向反应液中加入盐酸(1.0N)中和后,减压浓缩。用甲苯共沸,加入乙醇。对析出物进行硅藻土过滤,将滤液减压浓缩,以白色固体的形式得到2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.430g、1.39mmol、92%)(以下为实施例39的化合物)。(实施例40)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸丙基酯的合成:[化93]在室温下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.0500g、0.162mmol)的氯仿(3.0mL)溶液中加入二异丙基乙基胺(0.0710mL、0.405mmol)、HBTU(0.0920g、0.243mmol)及丙烷-1-醇(0.0300mL、0.405mmol),将反应液在相同的温度下搅拌16小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸丙基酯(0.0499g、0.142mmol、88%)(以下为实施例40的化合物)。(实施例41)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸丙基酯盐酸盐的合成:[化94]在0℃下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸丙基酯(0.0499g、0.142mmol)的二乙醚(1.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.157mL、0.314mmol),将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(4.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸丙基酯盐酸盐(0.0552g、0.130mmol、91%)(以下为实施例41的化合物)。ESI-MS:2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸丙基酯:m/z=351(M+H)+。(实施例42)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸异丙基酯的合成:[化95]在室温下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.100g、0.324mmol)的氯仿(6.0mL)溶液中加入二异丙基乙基胺(0.142mL、0.811mmol)、HBTU(0.184g、0.486mmol)及丙烷-2-醇(0.0620mL、0.811mmol),将反应液在相同的温度下搅拌16小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸异丙基酯(0.0610g、0.174mmol、54%)(以下为实施例42的化合物)。(实施例43)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸异丙基酯盐酸盐的合成:[化96]在0℃下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸异丙基酯(0.0600g、0.171mmol)的二乙醚(1.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.188mL、0.376mmol),将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(4.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸异丙基酯盐酸盐(0.0359g、0.0928mmol、54%)(以下为实施例43的化合物)。ESI-MS:2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸异丙基酯:m/z=351(M+H)+。(实施例44)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸环丙基酯的合成:[化97]在室温下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.100g、0.324mmol)的氯仿(6.0mL)溶液中加入二异丙基乙基胺(0.142mL、0.811mmol)、HBTU(0.184g、0.486mmol)及粗环丙醇(0.0470g、0.811mmol),将反应液在相同的温度下搅拌16小时。向反应液中加入盐酸(1.0N),进行反萃取。向得到的水层加入饱和碳酸氢钠水溶液中和后,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩,以无色油状物的形式2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸环丙基酯(0.0610g、0.175mmol、54%)(以下为实施例44的化合物)。(实施例45)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸环丙基酯盐酸盐的合成:[化98]在0℃下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸环丙基酯(0.0610g、0.175mmol)的二乙醚(1.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.189mL、0.378mmol),将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(4.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸环丙基酯盐酸盐(0.0540g、0.128mmol、73%)(以下为实施例45的化合物)。ESI-MS:2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸环丙基酯:m/z=349(M+H)+。(实施例46)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸丁基酯的合成:[化99]在室温下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.0500g、0.162mmol)的氯仿(3.0mL)溶液中加入二异丙基乙基胺(0.0710mL、0.405mmol)、HBTU(0.0920g、0.243mmol)及丁烷-1-醇(0.0370mL、0.405mmol),将反应液在相同的温度下搅拌16小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸丁基酯(0.0314g、0.0861mmol、53%)(以下为实施例46的化合物)。(实施例47)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸丁基酯盐酸盐的合成:[化100]在0℃下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸丁基酯(0.0600g、0.165mmol)的二乙醚(2.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.182mL、0.364mmol),将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(8.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸丁基酯盐酸盐(0.0554g、0.127mmol、77%)(以下为实施例47的化合物)。ESI-MS:2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸丁基酯:m/z=365(M+H)+。(实施例48)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸异丁基酯的合成:[化101]在室温下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.100g、0.324mmol)的氯仿(6.0mL)溶液中加入二异丙基乙基胺(0.142mL、0.811mmol)、HBTU(0.184g、0.486mmol)及2-甲基丙烷-1-醇(0.0760mL、0.811mmol),将反应液在相同的温度下搅拌16小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸异丁基酯(0.101g、0.277mmol、86%)(以下为实施例48的化合物)。(实施例49)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸异丁基酯盐酸盐的合成:[化102]在0℃下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸异丁基酯(0.100g、0.274mmol)的二乙醚(1.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.302mL、0.604mmol),将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(4.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸异丁基酯盐酸盐(0.0709g、0.177mmol、65%)(以下为实施例49的化合物)。ESI-MS:2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸异丁基酯:m/z=365(M+H)+。(实施例50)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸环丙基甲基酯的合成:[化103]在室温下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.100g、0.324mmol)的氯仿(6.0mL)溶液中加入二异丙基乙基胺(0.142mL、0.811mmol)、HBTU(0.184g、0.486mmol)及环丙基甲醇(0.0580g、0.811mmol),将反应液在相同的温度下搅拌16小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸环丙基甲基酯(0.0720g、0.199mmol、61%)(以下为实施例50的化合物)。(实施例51)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸环丙基甲基酯盐酸盐的合成:[化104]在0℃下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸环丙基甲基酯(0.0720g、0.199mmol)的二乙醚(1.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.218mL、0.436mmol),将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(4.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸环丙基甲基酯盐酸盐(0.0652g、0.180mmol、90%)(以下为实施例51的化合物)。ESI-MS:2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸环丙基甲基酯:m/z=363(M+H)+。(实施例52)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸仲丁基酯的合成:[化105]在室温下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.100g、0.324mmol)的氯仿(6.0mL)溶液中加入二异丙基乙基胺(0.142mL、0.811mmol)、HBTU(0.184g、0.486mmol)及丁烷-2-醇(0.0740mL、0.811mmol),将反应液在相同的温度下搅拌60小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸仲丁基酯(0.0700g、0.192mmol、59%)(以下为实施例52的化合物)。(实施例53)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸仲丁基酯盐酸盐的合成:[化106]在0℃下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸仲丁基酯(0.0700g、0.192mmol)的二乙醚(1.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.211mL、0.423mmol),将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(4.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸仲丁基酯盐酸盐(0.0582g、0.133mmol、69%)(以下为实施例53的化合物)。ESI-MS:2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸仲丁基酯:m/z=365(M+H)+。(实施例54)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸辛基酯的合成:[化107]在室温下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.100g、0.324mmol)的氯仿(3.0mL)溶液中加入二异丙基乙基胺(0.113mL、0.649mmol)、HBTU(0.184g、0.486mmol)及辛烷-1-醇(0.103mL、0.649mmol),将反应液在相同的温度下搅拌16小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸辛基酯(0.0602g、0.143mmol、44%)(以下为实施例54的化合物)。(实施例55)2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸辛基酯盐酸盐的合成:[化108]在0℃下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸辛基酯(0.0400g、0.0950mmol)的二乙醚(2.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.105mL、0.209mmol),将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(8.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸辛基酯盐酸盐(0.0109g、0.0221mmol、23%)(以下为实施例55的化合物)。ESI-MS:2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸辛基酯:m/z=421(M+H)+。(实施例56)2,3-二氢-1H-茚-5-基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯的合成:[化109]在室温下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.100g、0.324mmol)的氯仿(3.0mL)溶液中加入二异丙基乙基胺(0.113mL、0.649mmol)、HBTU(0.184g、0.486mmol)及2,3-二氢-1H-茚-5-醇(0.0870g、0.649mmol),将反应液在相同的温度下搅拌16小时。向反应液中加入盐酸(1.0N),进行反萃取。向得到的水层中加入饱和碳酸氢钠水溶液中和后,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩,以无色油状物的形式2,3-二氢-1H-茚-5-基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯(0.0644g、0.152mmol、47%)(以下为实施例56的化合物)。(实施例57)2,3-二氢-1H-茚-5-基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯盐酸盐的合成:[化110]在0℃下向2,3-二氢-1H-茚-5-基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯(0.0500g、0.118mmol)的二乙醚(2.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.130mL、0.259mmol),将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(8.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到2,3-二氢-1H-茚-5-基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯盐酸盐(0.0475g、0.0955mmol、81%)(以下为实施例57的化合物)。ESI-MS:2,3-二氢-1H-茚-5-基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯:m/z=425(M+H)+。(实施例58)(2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酰氧基)甲基新戊酸的合成:[化111]在室温下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.0980g、0.276mmol)的DMF(2.0mL)溶液中加入碳酸钾(0.0760g、0.553mmol)、氯甲基新戊酸(0.0400mL、0.276mmol)及碘化钠(0.0414g、0.276mmol),将反应液在相同的温度下搅拌12小时。向反应液中阿哥加入乙酸乙酯,对析出物进行硅藻土过滤,将滤液减压浓缩。向残渣中加入乙酸乙酯,对析出物进行硅藻土过滤,将滤液减压浓缩。向残渣加入氯仿,对析出物进行硅藻土过滤,将滤液减压浓缩,以无色油状物的形式(2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酰氧基)甲基新戊酸(0.0300g、0.0710mmol、26%)(以下为实施例58的化合物)。(实施例59)(5-甲基-2-氧代-1,3-二氧杂环戊烯-4-基)甲基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯的合成:[化112]在室温下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.100g、0.324mmol)的氯仿(3.0mL)溶液中加入二异丙基乙基胺(0.113mL、0.649mmol)、HBTU(0.184g、0.486mmol)及粗4-(羟基甲基)-5-甲基-1,3-二氧杂环戊烯-2酮(0.0840g、0.649mmol),将反应液在相同的温度下搅拌16小时。向反应液中加入盐酸(1.0N),进行反萃取。向得到的水层中加入饱和碳酸氢钠水溶液中和后,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩,以无色油状物的形式(5-甲基-2-氧代-1,3-二氧杂环戊烯-4-基)甲基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯(0.0501g、0.119mmol、37%)(以下为实施例59的化合物)。(实施例60)2-(二甲基氨基)-2-氧代乙基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯的合成:[化113]在室温下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.100g、0.324mmol)的氯仿(6.0mL)溶液中加入二异丙基乙基胺(0.142mL、0.811mmol)、HBTU(0.184g、0.486mmol)及粗2-羟基-N,N-二甲基乙酰胺(0.0500g、0.486mmol),将反应液在相同的温度下搅拌16小时。向反应液中加入盐酸(1.0N),进行反萃取。向得到的水层中加入饱和碳酸氢钠水溶液中和后,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩,以无色油状物的形式2-(二甲基氨基)-2-氧代乙基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯(0.100g、0.254mmol、78%)(以下为实施例60的化合物)。(实施例61)2-(二甲基氨基)-2-氧代乙基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯盐酸盐的合成:[化114]在0℃下向2-(二甲基氨基)-2-氧代乙基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯(0.100g、0.254mmol)的二乙醚(1.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.188mL、0.376mmol),将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(4.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到2-(二甲基氨基)-2-氧代乙基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯盐酸盐(0.0455g、0.0976mmol、38%)(以下为实施例61的化合物)。ESI-MS:2-(二甲基氨基)-2-氧代乙基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯:m/z=394(M+H)+.(实施例62)3-氧代-2,3-二氢异苯并呋喃-2-基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯的合成:[化115]在室温下向2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸(0.100g、0.324mmol)的DMF(3.2mL)溶液中加入碳酸钾(0.0900g、0.649mmol)、3-溴苯酞(0.0691g、0.324mmol)及碘化钠(0.0486g、0.324mmol),将反应液在相同的温度下搅拌14小时。向反应液加入乙酸乙酯,对析出物进行硅藻土过滤,将滤液减压浓缩。向残渣加入乙酸乙酯,滤取析出物,以褐色固体的形式得到3-氧代-2,3-二氢异苯并呋喃-2-基2-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)乙酸酯(0.0320g、0.0726mmol、22%)(以下为实施例62的化合物)。(实施例63)3-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸乙基酯的合成:[化116]在室温下向粗3-(1-(3-乙氧基-3-氧代丙基)-1H-咪唑-2-基)丙烷酸(0.330g、0.931mmol)的氯仿(10.0mL)溶液中加入二异丙基乙基胺(0.651mL、3.73mmol)、HBTU(0.883g、2.33mmol)及4-二甲基氨基哌啶(0.208mL、1.77mmol),将反应液在相同的温度下搅拌16小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以无色油状物的形式3-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸乙基酯(0.172g、0.491mmol、53%)(以下为实施例63的化合物)。(实施例64)3-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸乙基酯盐酸盐的合成:[化117]在0℃下向3-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸乙基酯(0.0500g、0.143mmol)的二乙醚(1.0mL)溶液中加入氯化氢的二乙醚溶液(2.0N、0.214mL、0.428mmol),将反应液在相同的温度下搅拌30分钟。滤取析出的白色固体,用二乙醚(4.0mL)洗涤,在室温下36小时干燥后,以白色固体的形式得到3-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸乙基酯盐酸盐(0.0541g、0.128mmol、89%)(以下为实施例64的化合物)。ESI-MS:3-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸乙基酯:m/z=351(M+H)+。(实施例65)3-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸的合成:[化118]在室温下向3-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸乙基酯(0.120g、0.342mmol)的乙醇(3.0mL)溶液中加入氢氧化钠水溶液(1.0N、0.377mL、0.377mmol),将反应液在相同的温度下搅拌4小时。冷却至0℃后,向反应液中加入盐酸(1.0N)中和后,减压浓缩。用甲苯共沸,加入乙醇。对析出物进行硅藻土过滤,将滤液减压浓缩,以白色固体的形式得到3-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸(0.105g、0.326mmol、95%)(以下为实施例65的化合物)。(实施例66)3-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸盐酸盐的合成:[化119]在0℃下向3-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸(0.105g、0.326mmol)的水(1.0mL)溶液中加入盐酸(1.0N、1.02mL、1.02mmol),将反应液在相同的温度下搅拌2小时。将反应液减压浓缩,滤取析出的白色固体,以白色固体的形式得到3-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸盐酸盐(0.0418g、0.116mmol、36%)(以下为实施例66的化合物)。ESI-MS:3-(2-(3-(4-(二甲基氨基)哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸:m/z=323(M+H)+。(实施例67)3-(2-(3-((S)-3-二甲基氨基哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸乙基酯的合成:[化120]在室温下向粗3-(1-(3-乙氧基-3-氧代丙基)-1H-咪唑-2-基)丙烷酸(0.100g、0.420mmol)的二氯甲烷(10.0mL)溶液中加入二异丙基乙基胺(0.0810g、0.620mmol)、HBTU(0.189g、0.500mmol)及(S)-3-二甲基氨基哌啶(0.0530g、0.420mmol),将反应液在相同的温度下搅拌12小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、己烷/乙酸乙酯及氯仿/甲醇)纯化,以黄色油状物的形式得到3-(2-(3-((S)-3-二甲基氨基哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸乙基酯(0.120g、0.340mmol、82%)(以下为实施例67的化合物)。(实施例68)3-(2-(3-((S)-3-二甲基氨基哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸盐酸盐的合成:[化121]在0℃下向3-(2-(3-((S)-3-二甲基氨基哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸乙基酯(0.062g、0.175mmol)的水(5.0mL)溶液中加入氢氧化钠水溶液(1.0N、0.351mL、0.351mmol)。将反应液在相同的温度下搅拌2小时。加入盐酸(1.0N、0.526mL、0.526mmol),浓缩干固。将得到的固体用乙醇洗涤,过滤后浓缩干固。再度将得到的固体用乙醇洗涤,过滤后浓缩干固。减压干燥后,以白色固体的形式得到3-(2-(3-((S)-3-二甲基氨基哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸盐酸盐(0.0430g、0.120mmol、68%)(以下为实施例68的化合物)。ESI-MS:3-(2-(3-((S)-3-二甲基氨基哌啶-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸:323(M+H)+。(实施例69)(S)-3-(2-(3-(3-(二甲基氨基)吡咯烷-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸乙基酯的合成:[化122]在室温下向粗3-(1-(3-乙氧基-3-氧代丙基)-1H-咪唑-2-基)丙烷酸(0.0800g、0.333mmol)的二氯甲烷(1.6mL)溶液中加入二异丙基乙基胺(0.0870mL、0.499mmol)、HBTU(0.152g、0.400mmol)及(S)-3-(二甲基氨基)吡咯烷(0.0420mL、0.333mmol),将反应液在相同的温度下搅拌5小时。将反应液减压浓缩。将残渣用快速色谱法(NH硅胶、氯仿/甲醇)纯化,以红褐色油状物的形式得到(S)-3-(2-(3-(3-(二甲基氨基)吡咯烷-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸乙基酯(0.103g、0.306mmol、92%)(以下为实施例69的化合物)。(实施例70)(S)-3-(2-(3-(3-(二甲基氨基)吡咯烷-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸盐酸盐的合成:[化123]在室温下向(S)-3-(2-(3-(3-(二甲基氨基)吡咯烷-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷酸乙基酯(0.100g、0.297mmol)中加入氢氧化钠水溶液(1.0N、0.446mL、0.446mmol),将反应液在相同的温度下搅拌4小时。在室温下向反应液中加入盐酸(1.0N、0.446mL、0.446mmol),将反应液在相同的温度下搅拌5分钟。将反应液减压浓缩。将得到的残渣用乙醇(5.0mL)洗涤。过滤后,将滤液减压浓缩。将得到的残渣再用乙醇(5.0mL)洗涤。过滤后,将滤液减压浓缩。在室温下向得到的残渣中加入盐酸(1.0N、0.358mL、0.358mmol),将反应液在相同的温度下搅拌1小时。将反应液减压浓缩,在室温下干燥后,以褐色固体形式得到(S)-2-(2-(3-(3-(二甲基氨基)吡咯烷-1-基)-3-氧代丙基)-1H-咪唑-1-基)丙烷盐酸盐(0.0900g、0.259mmol、87%)(以下为实施例70的化合物)。(实施例71)对小鼠坐骨神经部分结扎模型的效果:使用可评价神经障碍性疼痛的小鼠坐骨神经部分结扎模型(Seltzer模型),研究环状胺衍生物(I)或其前药或其药理学上可接受的盐的镇痛作用。作为环状胺衍生物(I)或其药理学上可接受的盐,使用实施例2、4、6、8、10、12、13、15、18、22、25、27、29、31、33、66、68或70的化合物进行评价。作为环状胺衍生物(I)的前药或其药理学上可接受的盐,使用实施例38的化合物进行评价。实施例38的化合物为实施例39的化合物的羧基被乙基酯化了的前药的盐酸盐。1.实验方法小鼠坐骨神经部分结扎模型根据Seltzer等的方法(Malmberg等、Pain、1998年、第76卷、p.215-222)制作。将Slc:ICR小鼠(5周龄、雄性;日本エスエルシー)或Crl:CD1(ICR)小鼠(5周龄、雄性;日本チャールスリバー)用戊巴比妥钠(70mg/kg、腹腔内给药)麻醉,露出右侧后肢大腿部的坐骨神经,将在立体显微镜下用8-0的丝绸(夏目制作所)仅以半周强度对坐骨神经进行三重结扎的组作为坐骨神经部分结扎组,将仅露出坐骨神经且没有结扎的组作为假手术组。神经障碍性疼痛的评价(以下为vonFrey试验)为:在网上设置的测定用丙烯酸制笼子(夏目制作所)内驯化小鼠最低2小时后,使用施加0.16g的压力的细丝(NorthCoastMedical或neuroscience),对右侧后肢的足底按压细丝3秒钟的机械触觉刺激,间隔3秒钟重复进行3次,对施加机械触觉刺激时的逃避行为的强度进行分数化(0:无反应,1:对刺激有缓慢且微小的逃避行为、2:不伴有退缩(快速连续地振动爪子的行为)、舔舐(舔爪子行为)的对刺激快速的逃避行为、3:伴有退缩或舔舐的快速逃避行为),将其3次的分数的合计值(以下为总分)作为疼痛的指标。(1)口服给药坐骨神经结扎手术7天后,针对坐骨神经部分结扎组的小鼠,将实施例8的化合物(实施例8的化合物为10mg/kg)或作为阳性对照的普瑞巴林(10mg/kg;BoscheScientific)溶于蒸馏水进行口服给药。对于坐骨神经部分结扎组的小鼠,将给药实施例8的化合物的组作为“坐骨神经部分结扎+实施例8的化合物”组,将给药普瑞巴林的组作为“坐骨神经部分结扎+普瑞巴林”组。另外,将对坐骨神经部分结扎组的小鼠口服给予蒸馏水的组作为“坐骨神经部分结扎+蒸馏水”组,将对假手术组的小鼠口服给予蒸馏水的组作为“假手术+蒸馏水”组。在坐骨神经结扎手术8天后,针对坐骨神经部分结扎组的小鼠,将实施例38的化合物(实施例38的化合物为0.1~10mg/kg)或作为阳性对照的普瑞巴林(10mg/kg;KEMPROTEC)溶于蒸馏水进行口服给药。对于坐骨神经部分结扎组的小鼠,将给药实施例38的化合物的组作为“坐骨神经部分结扎+实施例38的化合物”组,将给药普瑞巴林的组作为“坐骨神经部分结扎+普瑞巴林”组。另外,将对坐骨神经部分结扎组的小鼠口服给予蒸馏水的组作为“坐骨神经部分结扎+蒸馏水”组,将对假手术组的小鼠口服给予蒸馏水的组作为“假手术+蒸馏水”组。vonFrey试验在被测化合物的口服给药前(pre值)、口服给药1小时后、2小时后及3小时后实施。(2)静脉内给药在坐骨神经结扎手术7天后,针对坐骨神经部分结扎组的小鼠,将实施例2、4、13、18、22、25、27、29、31、33、66、68或70的化合物(实施例2及4的化合物分别为0.1~10mg/kg、实施例13的化合物为0.01~1mg/kg、实施例18及22的化合物分别为0.1及1mg/kg、实施例25、27、29、31、33、66、68及70的化合物分别为0.1mg/kg)或作为阳性对照的普瑞巴林(1mg/kg;BoscheScientific或3mg/kg;KEMPROTEC)溶于生理食盐液通过尾静脉给药。对于坐骨神经部分结扎组的小鼠,将给药实施例2、4、13、18、22、25、27、29、31、33、66、68或70的化合物的组分别作为“坐骨神经部分结扎+实施例2的化合物”组、“坐骨神经部分结扎+实施例4的化合物”组、“坐骨神经部分结扎+实施例13的化合物”组、“坐骨神经部分结扎+实施例18的化合物”组、“坐骨神经部分结扎+实施例22的化合物”组、“坐骨神经部分结扎+实施例25的化合物”组、“坐骨神经部分结扎+实施例27的化合物”组、“坐骨神经部分结扎+实施例29的化合物”组、“坐骨神经部分结扎+实施例31的化合物”组、“坐骨神经部分结扎+实施例33的化合物”组、“坐骨神经部分结扎+实施例66的化合物”组、“坐骨神经部分结扎+实施例68的化合物”组、“坐骨神经部分结扎+实施例70的化合物”组,将给药普瑞巴林的组作为“坐骨神经部分结扎+普瑞巴林”组。另外,将对坐骨神经部分结扎组的小鼠静脉内给予生理食盐液的组作为“坐骨神经部分结扎+生理食盐液”组,将对假手术组的小鼠静脉内给予生理食盐液的组作为“假手术+生理食盐液”组。vonFrey试验针对实施例2或4的化合物在被测化合物的静脉内给药前(pre值)、静脉内给药30分后及60分后实施,针对实施例13、18、22、25、27、29、31、33、66、68或70的化合物,在被测化合物的静脉内给药前(pre值)、静脉内给药30分钟后及2小时后实施。(3)脑室内给药在坐骨神经结扎手术7日后,针对坐骨神经部分结扎组的小鼠,将实施例2、4、6、10、12、13或15的化合物(10μg/site)溶于生理食盐液进行脑室内给药。对于坐骨神经部分结扎组的小鼠将给药实施例2、4、6、10、12、13或15的化合物的组分别作为“坐骨神经部分结扎+实施例2的化合物”组、“坐骨神经部分结扎+实施例4的化合物”组、“坐骨神经部分结扎+实施例6的化合物”组、“坐骨神经部分结扎+实施例10的化合物”组、“坐骨神经部分结扎+实施例12的化合物”组、“坐骨神经部分结扎+实施例13的化合物”组、“坐骨神经部分结扎+实施例15的化合物”组。另外,将对坐骨神经部分结扎组的小鼠脑室内给药生理食盐液的组作为“坐骨神经部分结扎+生理食盐液”组,将对假手术组的小鼠脑室内给药生理食盐液的组作为“假手术+生理食盐液”组。vonFrey试验在被测化合物的脑室内给药前(pre值)、脑室内给药15分钟后、30分钟后及60分钟后实施。2.结果(1)口服给药结果示于图1及图11。在图中,纵轴表示vonFrey试验的总分(平均值±标准偏差;图1为n=5、图11为n=4~5。),数值越高表示疼痛越强。横轴表示被测化合物给药后的时间(hr)。药效评价以单位测定时间的“坐骨神经部分结扎+蒸馏水”组(图中的“坐骨神经部分结扎+蒸馏水”)作为对照,通过非配对的2组t检验或Welch检验、(图1)、或多组非配对t检验(利用Dunnett修正)(图11)进行统计处理。图中的*印表示与“坐骨神经部分结扎+蒸馏水”组在比较上具有统计学意义(p<0.05)。根据vonFrey试验的结果,实施例8或38的化合物的口服给药(图中的“坐骨神经部分结扎+实施例8的化合物”)或“坐骨神经部分结扎+实施例38的化合物”)与作为阳性对照的普瑞巴林(图中的“坐骨神经部分结扎+普瑞巴林”)同样显示在统计学上有意义的镇痛作用。(2)静脉内给药结果示于图2、图3及图12~22。在图中,纵轴表示vonFrey试验的总分(平均值±标准偏差;图2及图3为n=5~6。图12~22为n=4~7),数值越高表示疼痛越强。横轴表示被测化合物给药后的时间(min或hr)。药效评价针对给药普瑞巴林的组(图中的“坐骨神经部分结扎+普瑞巴林”)以单位测定时间的“坐骨神经部分结扎+生理食盐液”组(图中的“坐骨神经部分结扎+生理食盐液”)为非对照,通过非配对的2组的t检验或Welch检验进行统计处理。另一方面,针对给药实施例2或4的化合物的组(图中的“坐骨神经部分结扎+实施例2的化合物”或“坐骨神经部分结扎+实施例4的化合物”),以单位测定时间的“坐骨神经部分结扎+生理食盐液”组(图中的“坐骨神经部分结扎+生理食盐液”)为非对照,通过Williams检验或Shirley-Williams检验进行统计处理。另外,针对给药实施例13、18、22、25、27、29、31、33、66、68或70的化合物的组(图中的“坐骨神经部分结扎+实施例13、18、22、25、27、29、31、33、66、68或70的化合物”),以单位测定时间的“坐骨神经部分结扎+生理食盐液”组(图中的“坐骨神经部分结扎+生理食盐液”)为非对照,通过Shirley-Williams检验或Welch检验进行统计处理。图中的*印表示与“坐骨神经部分结扎+生理食盐液”组的比较在统计学上有意义(p<0.05)(非配对的2组的t检验或Welch检验)。图中的#印表示与“坐骨神经部分结扎+生理食盐液”组的比较在统计学上有意义(Williams检验或Shirley-Williams检验(p<0.025)或Welch检验(p<0.05))。根据vonFrey试验的结果,实施例2、4、13、18、22、25、27、29、31、33、66、68或70的化合物的静脉内给药(图中的“坐骨神经部分结扎+实施例2、4、13、18、22、25、27、29、31、33、66、68或70的化合物”)与作为阳性对照的普瑞巴林(图中的“坐骨神经部分结扎+普瑞巴林”)同样显示在统计学上有意义的镇痛作用。(3)脑室内给药结果示于图4~10。在图中,纵轴表示vonFrey试验的总分(平均值±标准偏差;图4~10为n=4~5。),数值越高表示疼痛越强。横轴表示被测化合物给药后的时间(min)。药效评价以单位测定时间的“坐骨神经部分结扎+生理食盐液”组(图中的“坐骨神经部分结扎+生理食盐液”)为非对照,通过非配对的2组的t检验或Welch检验进行统计处理。图中的*印表示与“坐骨神经部分结扎+生理食盐液”组的比较在统计学上有意义(p<0.05)。根据vonFrey试验的结果,实施例2、4、6、10、12、13或15的化合物的口服给药(图中的“坐骨神经部分结扎+实施例2、4、6、10、12、13或15的化合物”)显示在统计学上有意义的镇痛作用。由该结果明显可知,环状胺衍生物(I)或其前药或其药理学上可接受的盐对神经障碍性疼痛显示出强的镇痛作用。(实施例72)对大鼠纤维肌痛症模型的效果:使用能评价纤维肌痛症的大鼠纤维肌痛症模型,研究环状胺衍生物(I)或其前药或其药理学上可接受的盐的镇痛作用。作为环状胺衍生物(I)或其药理学上可接受的盐,使用实施例13的化合物进行评价。作为环状胺衍生物(I)的前药或其药理学上可接受的盐,使用实施例38的化合物进行评价。实施例38的化合物为实施例39的化合物的羧基被乙基酯化了的前药的盐酸盐。1.实验方法为了制作纤维肌痛症的基础研究中一般广泛使用的纤维肌痛症模型大鼠(Sluka等、JournalofPharmacologyandExperimentalTherapeutics、2002年、第302卷、p.1146-50;Nagakura等、Pain、2009年、第146卷、p.26-33;Sluka等、Pain、2009年、第146卷、p.3-4),将调整为pH4.0的酸性生理食盐液100μL对持续吸入异氟醚麻醉下的Crl:CD(SD)大鼠(6~7周龄、雄性;日本チャールスリバー)的右侧后肢腓肠腹肌肌肉内注射2次(酸性生理食盐液的初次给药日作为第1天,第1天和第6天分别各1次),在调节至室内温度21~25℃、室内湿度40~70%的饲养室中自由饮食饮水进行饲养。另外,代替酸性生理食盐液,同样肌肉内注射生理食盐液进行饲养的未发生纤维肌痛症的大鼠(图23及图24的“生理食盐液-溶剂”组)也用于实验。在酸性生理食盐液的初次给药日至第7天测定各大鼠的异常性疼痛(allodynia),选择50%反应阈值(右侧后肢和左侧后肢的平均值)为2g以上6g以下的大鼠作为发生纤维肌痛症的纤维肌痛症模型大鼠,用于以下的给药实验。需要说明的是,异常性疼痛的测定根据公知文献(Chaplan等、JournalofNeuroscienceMethods、1994年、第53卷、p.55-63)记载的方法使用vonFrey细丝(NorthCoastMedical)进行。上述得到的纤维肌痛症模型大鼠以50%反应阈值(右侧后肢和左侧后肢的平均值)在组间均等地分组,在酸性生理食盐液的初次给药日至第7天对纤维肌痛症模型大鼠给药被测化合物。将实施例13的化合物(3及10mg/kg)溶于生理食盐液对纤维肌痛症模型大鼠通过尾静脉进行给药(静脉内给药)(图23中的“酸性生理食盐液-实施例13的化合物”)。将作为阳性对照的普瑞巴林(10mg/kg;KEMPROTEC)溶于生理食盐液进行静脉内给药(图23中的“酸性生理食盐液-普瑞巴林”)。作为非对照,对纤维肌痛症模型大鼠将生理食盐液进行静脉内给药(图23中的“酸性生理食盐液-溶剂”)。另外,对未发生纤维肌痛症的大鼠将生理食盐液进行静脉内给药(图23中的“生理食盐液-溶剂”)。在静脉内给药30分钟后通过测定各大鼠的异常性疼痛来评价镇痛作用。将实施例38的化合物(10mg/kg)溶于蒸馏水对纤维肌痛症模型大鼠进行口服给药(图24中的“酸性生理食盐液-实施例38的化合物”)。将作为阳性对照的普瑞巴林(10mg/kg;KEMPROTEC)溶于蒸馏水进行口服给药(图24中的“酸性生理食盐液-普瑞巴林”)。作为非对照,对纤维肌痛症模型大鼠口服给予蒸馏水(图24中的“酸性生理食盐液-溶剂”)。另外,对未发生纤维肌痛症的大鼠口服给予蒸馏水(图24中的“生理食盐液-溶剂”)。在口服给药1小时后及3小时后通过测定各大鼠的异常性疼痛来测定镇痛作用。此时,将自酸性生理食盐液的初次给药日至第7天的被测化合物的口服给药前的异常性疼痛测定中的50%反应阈值的值作为pre值。2.结果结果示于图23及图24。在图中,纵轴表示50%反应阈值(右侧后肢和左侧后肢的平均值)(g)(平均值±标准偏差、n=5~6),数值越高表示纤维肌痛症模型大鼠中表现的异常性疼痛越得到改善。图23表示实施例13的化合物的静脉内给药30分钟后的结果。图中的$印表示以“生理食盐液-溶剂”组(图中的“生理食盐液-溶剂”)作为非对照,进行非配对的2组的t检验结果具有统计学意义($:p<0.05)。图中的#印表示以“酸性生理食盐液-溶剂”组(图中的“酸性生理食盐液-溶剂”)作为非对照,进行Shirley-Williams检验的结果具有统计学意义(#:p<0.025)。图中的*印表示以“酸性生理食盐液-溶剂”组(图中的“酸性生理食盐液-溶剂”)作为非对照,进行Welch检验的结果具有统计学意义(*:p<0.05)。图24表示实施例38的化合物的口服给药的结果。图的横轴表示实施例38的化合物的口服给药前(pre值)及自口服给药的经过时间(hr)。图中的*印表示以单位测定时间的“酸性生理食盐液-溶剂”组(图中的“酸性生理食盐液-溶剂”)作为非对照,进行多组非配对t检验(利用Dunnett修正)的结果具有统计学意义(*:p<0.05)。静脉内给药实施例13的化合物的组(图23中的“酸性生理食盐液-实施例13的化合物”)、口服给药实施例38的化合物的组(图24中的“酸性生理食盐液-实施例38的化合物”与静脉内给药或口服给药作为阳性对照的普瑞巴林的组(图23及图24中的“酸性生理食盐液-普瑞巴林”)同样地,在纤维肌痛症模型大鼠中表现的异常性疼痛与“酸性生理食盐液-溶剂”组比较在统计学上发生了有意义的改善。由上述结果明显可知,环状胺衍生物(I)或其前药或其药理学上可接受的盐对纤维肌痛症有效。(实施例73)环状胺衍生物(I)的前药或其药理学上可接受的盐的大鼠中的药物动力学:对大鼠口服给药环状胺衍生物(I)的羧基被酯化了的前药的药理学上可接受的盐即实施例38的化合物,对血浆进行LC/MS/MS分析。其结果确认了实施例38的化合物在大鼠体内转换为环状胺衍生物(I)即实施例39的化合物。[工业适用性]本发明的环状胺衍生物或其药理学上可接受的盐对疼痛、特别是神经障碍性疼痛或纤维肌痛症可发挥镇痛作用,因此可用作应对疼痛症状的药物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1