一种热启动解旋酶依赖扩增方法及体系与流程
本发明涉及分子生物学领域,尤其涉及一种热启动解旋酶依赖扩增方法及体系。
背景技术:
解旋酶依赖扩增(HDA)(Vincent等.(2004),EMBO reports 5(8):795-800)是一种在体外模拟复制叉,并在恒温条件下进行体外核酸扩增的方法。该方法的具体原理是:在ATP提供能量的情况下,解旋酶使得双链DNA解链成为单链DNA,然后在单链结合蛋白的作用下,使得所形成的单链DNA稳定在单链状态,特异引物与单链DNA互补配对,并在DNA聚合酶的作用下合成新链,或者利用耐热的解旋酶,在较高温度,且没有单链结合蛋白的情况下,使得双链DNA解链成为单链DNA,进行新链的合成。
由于具有能在恒温条件下进行体外核酸扩增的能力,HDA不依赖较复杂的热循环仪器,较适合在病人医疗点旁边、小诊所、药店、或其它紧急事件现场进行核酸扩增检测,即所谓即时检验(point-of-care testing)。但是,在现场检测中,实验条件或实验设备有限,往往缺乏保温设施为反应前的体系组合物提供低温条件,HDA试剂需要在常温条件下放置一段时间,而普通的DNA聚合酶在常温条件下仍具有较高活性,这可能会导致引物二聚体或错配,从而影响最终HDA扩增的效率。
技术实现要素:
针对现有技术中的不足,本发明解决的技术问题在于提供一种热启动解旋酶依赖扩增方法,利用冷敏感的水生栖热菌Ⅰ类DNA聚合酶,对核酸模板进行解旋酶依赖扩增,从而有效地避免或降低扩增前常温放置所带来的负面影响。
本发明解决的技术问题还在于提供一种热启动解旋酶依赖扩增方法,利用冷敏感的水生栖热菌Ⅰ类DNA聚合酶,对核酸模板进行解旋酶依赖扩增,并结 合耐热解旋酶的使用,克服了实验条件的限制,提高HDA扩增的效率。
为了解决上述技术问题,本发明实施例提供的热启动解旋酶依赖扩增方法,利用冷敏感的水生栖热菌Ⅰ类DNA聚合酶,对核酸模板进行解旋酶依赖扩增。
优选地,所述冷敏感的水生栖热菌Ⅰ类DNA聚合酶为N端缺失了280个氨基酸残基的水生栖热菌Ⅰ类DNA聚合酶的突变型。
其中,所述冷敏感的水生栖热菌Ⅰ类DNA聚合酶为第626个氨基酸残基由谷氨酸突变为赖氨酸,或第707个氨基酸残基由异亮氨酸突变为亮氨酸,或前述两种突变同时存在的水生栖热菌Ⅰ类DNA聚合酶。
本发明所采用的水生栖热菌Ⅰ类DNA聚合酶,在较低温度或者常温条件下,其DNA聚合活性降到非常低的水平,只有当温度恢复到较高温度时(热启动),酶的活性才能恢复,利用冷敏感的DNA聚合酶进行HDA扩增,可以避免或降低扩增前常温放置带来的负面影响,提高HDA扩增的效率。需要说明的是,本发明的方案中,水生栖热菌Ⅰ类DNA聚合酶野生型如Seq.NO.1所示,本发明所用到水生栖热菌Ⅰ类DNA聚合酶为N端缺失了280个氨基酸残基的水生栖热菌Ⅰ类DNA聚合酶(Seq.NO.2)的突变型,具体为第626个氨基酸残基由谷氨酸突变为赖氨酸(Seq.NO.3),或第707个氨基酸残基由异亮氨酸突变为亮氨酸(Seq.NO.4),或前述两种突变同时存在的水生栖热菌Ⅰ类DNA聚合酶(Seq.NO.5)。
优选地,该方法中所用解旋酶为耐热解旋酶。更优地,解旋酶为水生栖热菌来源的UvrD。本发明的方法利用冷敏感的水生栖热菌Ⅰ类DNA聚合酶,对核酸模板进行解旋酶依赖扩增,并结合耐热解旋酶的使用,将反应温度维持在DNA双链的解链状态,无需单链结合蛋白,即可使得双链DNA解链成为单链DNA,进行新链的合成,从而克服了实验条件的限制,提高HDA扩增的效率。
另外,本发明还提供了热启动解旋酶依赖扩增体系,该体系包含冷敏感的水生栖热菌Ⅰ类DNA聚合酶。
优选地,所述冷敏感的水生栖热菌Ⅰ类DNA聚合酶为N端缺失了280个氨基酸残基的水生栖热菌Ⅰ类DNA聚合酶突变型。
优选地,所述冷敏感的水生栖热菌Ⅰ类DNA聚合酶为第626个氨基酸残基由谷氨酸突变为赖氨酸,或第707个氨基酸残基由异亮氨酸突变为亮氨酸,或前述两种突变同时存在的水生栖热菌Ⅰ类DNA聚合酶。
优选地,该热启动解旋酶依赖扩增体系还包含:
耐热解旋酶,ATP,
dATP,dTTP,dGTP,dCTP,
Tris,
硫酸镁和/或氯化镁,
氯化钠和/或氯化钾。
优选地,解旋酶为水生栖热菌来源的UvrD。
本发明实施例提供的热启动解旋酶依赖扩增方法及其扩增体系,具有如下有益效果:
本发明实施例提供的热启动解旋酶依赖扩增方法,利用冷敏感的水生栖热菌Ⅰ类DNA聚合酶,对核酸模板进行解旋酶依赖扩增。该水生栖热菌Ⅰ类DNA聚合酶,在较低温度或者常温条件下,其DNA聚合活性降到非常低的水平,只有当温度恢复到较高温度时(热启动),酶的活性才能恢复,利用冷敏感的DNA聚合酶进行HDA扩增,可以避免或降低扩增前常温放置带来的负面影响,提高HDA扩增的效率。本发明的方法利用冷敏感的水生栖热菌Ⅰ类DNA聚合酶,对核酸模板进行解旋酶依赖扩增,并结合耐热解旋酶的使用,将反应温度维持在DNA双链的解链状态,无需单链结合蛋白,即可使得双链DNA解链成为单链DNA,进行新链的合成,从而克服了实验条件的限制,提高HDA扩增的效率。
附图说明
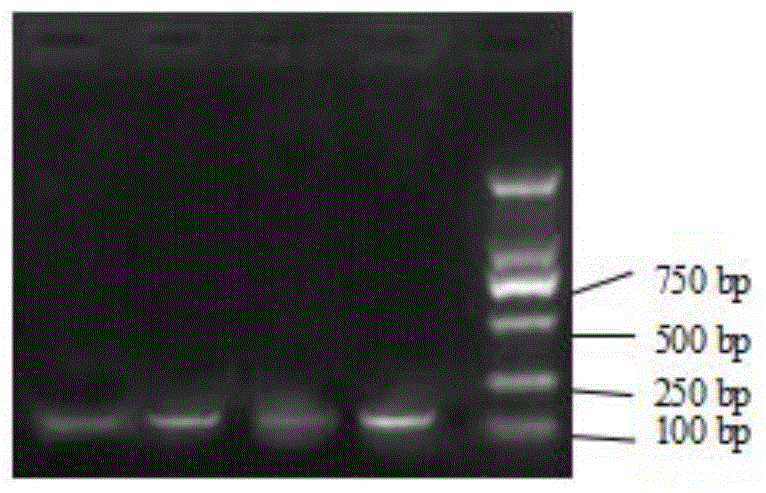
图1示出了实施例1热启动解旋酶依赖扩增产物琼脂糖凝胶电泳图。其中第1、3条带为100拷贝质粒DNA扩增产物,第2、4条带1000拷贝质粒DNA扩增产物,第1、2条带为扩增前25℃处理的试剂扩增产物,第3、4条带为扩增前冰上处理的试剂扩增产物,第5条带为双链DNA Marker。
图2示出了实施例2热启动解旋酶依赖扩增产物琼脂糖凝胶电泳图。从左到右依次为1-5条带,其中第1、3条带为100拷贝质粒DNA扩增产物,第2、4条带1000拷贝质粒DNA扩增产物,第1、2条带为扩增前25℃处理的试剂扩增产物,第3、4条带为扩增前冰上处理的试剂扩增产物,第5条带为双链DNA Marker。
图3示出了实施例3热启动解旋酶依赖扩增产物琼脂糖凝胶电泳图。从左到右依次为1-5条带,其中第1、3条带为100拷贝质粒DNA扩增产物,第2、4条带1000拷贝质粒DNA扩增产物,第1、2条带为扩增前25℃处理的试剂扩增产物,第3、4条带为扩增前冰上处理的试剂扩增产物,第5条带为双链DNA Marker。
图4示出了参比实施例1非热启动解旋酶依赖扩增产物琼脂糖凝胶电泳图。从右到左依次为1-5条带,其中第1、3条带为100拷贝质粒DNA扩增产物,第2、4条带1000拷贝质粒DNA扩增产物,第1、2条带为扩增前25℃处理的试剂扩增产物,第3、4条带为扩增前冰上处理的试剂扩增产物,第5条带为双链DNA Marker。
具体实施方式
本发明实施例提供的热启动解旋酶依赖扩增方法,利用冷敏感的水生栖热菌Ⅰ类DNA聚合酶,对核酸模板进行解旋酶依赖扩增。
其中,所述冷敏感的水生栖热菌Ⅰ类DNA聚合酶为N端缺失了280个氨基酸残基的水生栖热菌Ⅰ类DNA聚合酶的突变型。
其中,所述冷敏感的水生栖热菌Ⅰ类DNA聚合酶为第626个氨基酸残基由谷氨酸突变为赖氨酸,或第707个氨基酸残基由异亮氨酸突变为亮氨酸,或前述两种突变同时存在的水生栖热菌Ⅰ类DNA聚合酶。
本发明所采用的水生栖热菌Ⅰ类DNA聚合酶,在较低温度或者常温条件下,其DNA聚合活性降到非常低的水平,只有当温度恢复到较高温度时(热启动),酶的活性才能恢复,利用冷敏感的DNA聚合酶进行HDA扩增,可以避免或降低扩增前常温放置带来的负面影响,提高HDA扩增的效率。需要说明的是, 本发明的方案中,水生栖热菌Ⅰ类DNA聚合酶野生型如Seq.NO.1所示,本发明所用到水生栖热菌Ⅰ类DNA聚合酶为N端缺失了280个氨基酸残基的水生栖热菌Ⅰ类DNA聚合酶(Seq.NO.2)的突变型,具体为第626个氨基酸残基由谷氨酸突变为赖氨酸(Seq.NO.3),或第707个氨基酸残基由异亮氨酸突变为亮氨酸(Seq.NO.4),或前述两种突变同时存在的水生栖热菌Ⅰ类DNA聚合酶(Seq.NO.5)。
其中,该方法中所用解旋酶为耐热解旋酶。更优地,解旋酶为水生栖热菌来源的UvrD。本发明的方法利用冷敏感的水生栖热菌Ⅰ类DNA聚合酶,对核酸模板进行解旋酶依赖扩增,并结合耐热解旋酶的使用,将反应温度维持在DNA双链的解链状态,无需单链结合蛋白,即可使得双链DNA解链成为单链DNA,进行新链的合成,从而克服了实验条件的限制,提高HDA扩增的效率。
另外,本发明还提供了热启动解旋酶依赖扩增体系,该体系包含冷敏感的水生栖热菌Ⅰ类DNA聚合酶。
其中,所述冷敏感的水生栖热菌Ⅰ类DNA聚合酶为N端缺失了280个氨基酸残基的水生栖热菌Ⅰ类DNA聚合酶突变型。
其中,所述冷敏感的水生栖热菌Ⅰ类DNA聚合酶为第626个氨基酸残基由谷氨酸突变为赖氨酸,或第707个氨基酸残基由异亮氨酸突变为亮氨酸,或前述两种突变同时存在的水生栖热菌Ⅰ类DNA聚合酶。
该热启动解旋酶依赖扩增体系还包含:
耐热解旋酶,ATP,
dATP,dTTP,dGTP,dCTP,
Tris,
硫酸镁和/或氯化镁,
氯化钠和/或氯化钾。
优选地,解旋酶为水生栖热菌来源的UvrD。
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是 全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
下面实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等分子克隆实施手册中所述的条件。
实施例1:本发明方法和体系对核酸模板进行解旋酶依赖扩增。
在本实施例中,使用本发明方法对含金黄色葡萄球菌基因组的FemA基因序列5’-tggtgccttt acagatagca tgccatacag tcatttcacg caaactgttg gccactatga gttaaagctt gctgaaggtt atgaaacaca tttagtggga ataaaaaaca ataataacga ggtcattgca gctt-3’(Seq.NO.6)的pMD-18T质粒(购自大连宝生物公司)DNA进行扩增。实施例2、3和比较例一种也采用相同的模板。
(1)引物序列
上游引物序列:5'-TGGTGCCTTTACAGATAG-3'(Seq.NO.7)
下游引物序列:5'-AAGCTGCAATGACCTCGT-3'(Seq.NO.8)
(2)质粒DNA模板的准备
紫外分光光度法测定质粒的浓度,根据质粒DNA的分子量,计算得每微升溶液中质粒DNA的拷贝数,用TE缓冲液(10mmol/l Tris-HCl,1mmol/l EDTA,pH7.5)稀释至每微升溶液含109拷贝质粒DNA,然后用TE缓冲液10倍梯度稀释,连续稀释7个梯度。
(3)HDA反应体系
-5U冷敏感的水生栖热菌Ⅰ类DNA聚合酶(Seq.NO.3),
-6mmol/l MgSO4,
-50mmol/l KCl,
-30mmol/l Tris-HCl(pH8.8),
-0.1%Triton X-100(v/v),
-0.8mmol/l dNTPs,
-10μmol/l引物,
-1.5mmol/l ATP,
-Taq UvrD解旋酶,
-1μl质粒DNA模板,
-反应液总体积25μl。
(4)HDA反应
HDA反应试剂准备完成后,按如下说明加入上述步骤(3)中所描述的模板量:
A组:
A1为100拷贝质粒DNA,
A2为1000拷贝质粒DNA,
将A组包括试剂于冰上放置10分钟再进行HDA反应试剂。
B组:
B1为100拷贝质粒DNA,
B2为1000拷贝质粒DNA,
将A组包括试剂于25℃放置10分钟再进行HDA反应。
HDA反应为65℃恒温金属浴中保温1小时。
(5)琼脂糖凝胶电泳分析
1%琼脂糖凝胶于1×TAE缓冲液中,在4v/cm场强条件下对扩增产物进行分析,电泳结束后用4×SYBR GreenⅠ染料染色20分钟,然后观察电泳结果如图1所示。其中第1、3条带为100拷贝质粒DNA扩增产物,第2、4条带1000拷贝质粒DNA扩增产物,第1、2条带为扩增前25℃处理的试剂扩增产物,第3、4条带为扩增前冰上处理的试剂扩增产物,第5条带为双链DNA Marker。从图中可以看出,在常温下放置反应体系一段时间,并不会有明显的负面影响。
实施例2:本发明方法和体系对核酸模板进行解旋酶依赖扩增。
(1)引物序列
上游引物序列:5'-TGGTGCCTTTACAGATAG-3'(Seq.NO.7)
下游引物序列:5'-AAGCTGCAATGACCTCGT-3'(Seq.NO.8)
(2)质粒DNA模板的准备
紫外分光光度法测定质粒的浓度,根据质粒DNA的分子量,计算得每微升溶液中质粒DNA的拷贝数,用TE缓冲液(10mmol/l Tris-HCl,1mmol/l EDTA,pH7.5)稀释至每微升溶液含109拷贝质粒DNA,然后用TE缓冲液10倍梯度稀释,连续稀释7个梯度。
(3)HDA反应体系
-5U冷敏感的水生栖热菌Ⅰ类DNA聚合酶(Seq.NO.4),
-6mmol/l MgSO4,
-50mmol/l KCl,
-30mmol/l Tris-HCl(pH8.8),
-0.1%Triton X-100(v/v),
-0.8mmol/l dNTPs,
-10μmol/l引物,
-1.5mmol/l ATP,
-Taq UvrD解旋酶,
-1μl质粒DNA模板,
-反应液总体积25μl。
(4)HDA反应
HDA反应试剂准备完成后,按如下说明加入上述步骤(3)中所描述的模板量:
A组:
A1为100拷贝质粒DNA,
A2为1000拷贝质粒DNA,
将A组包括试剂于冰上放置10分钟再进行HDA反应试剂。
B组:
B1为100拷贝质粒DNA,
B2为1000拷贝质粒DNA,
将A组包括试剂于25℃放置10分钟再进行HDA反应。
HDA反应为65℃恒温金属浴中保温1小时。
(5)琼脂糖凝胶电泳分析
1%琼脂糖凝胶于1×TAE缓冲液中,在4v/cm场强条件下对扩增产物进行分析,电泳结束后用4×SYBR GreenⅠ染料染色20分钟,然后观察电泳结果如图2所示。其中第1、3条带为100拷贝质粒DNA扩增产物,第2、4条带1000拷贝质粒DNA扩增产物,第1、2条带为扩增前25℃处理的试剂扩增产物,第3、4条带为扩增前冰上处理的试剂扩增产物,第5条带为双链DNA Marker。从图中可以看出,在常温下放置反应体系一段时间,并不会有明显的负面影响。
实施例3:本发明方法和体系对核酸模板进行解旋酶依赖扩增。
(1)引物序列
上游引物序列:5'-TGGTGCCTTTACAGATAG-3'(Seq.NO.7)
下游引物序列:5'-AAGCTGCAATGACCTCGT-3'(Seq.NO.8)
(2)质粒DNA模板的准备
紫外分光光度法测定质粒的浓度,根据质粒DNA的分子量,计算得每微升溶液中质粒DNA的拷贝数,用TE缓冲液(10mmol/l Tris-HCl,1mmol/l EDTA,pH7.5)稀释至每微升溶液含109拷贝质粒DNA,然后用TE缓冲液10倍梯度稀释,连续稀释7个梯度。
(3)HDA反应体系
-5U冷敏感的水生栖热菌Ⅰ类DNA聚合酶(Seq.NO.5),
-6mmol/l MgSO4,
-50mmol/l KCl,
-30mmol/l Tris-HCl(pH8.8),
-0.1%Triton X-100(v/v),
-0.8mmol/l dNTPs,
-10μmol/l引物,
-1.5mmol/l ATP,
-Taq UvrD解旋酶,
-1μl质粒DNA模板,
-反应液总体积25μl。
(4)HDA反应
HDA反应试剂准备完成后,按如下说明加入上述步骤(3)中所描述的模板量:
A组:
A1为100拷贝质粒DNA,
A2为1000拷贝质粒DNA,
将A组包括试剂于冰上放置10分钟再进行HDA反应试剂。
B组:
B1为100拷贝质粒DNA,
B2为1000拷贝质粒DNA,
将A组包括试剂于25℃放置10分钟再进行HDA反应。
HDA反应为65℃恒温金属浴中保温1小时。
(5)琼脂糖凝胶电泳分析
1%琼脂糖凝胶于1×TAE缓冲液中,在4v/cm场强条件下对扩增产物进行分析,电泳结束后用4×SYBR GreenⅠ染料染色20分钟,然后观察电泳结果如图2所示。其中第1、3条带为100拷贝质粒DNA扩增产物,第2、4条带1000拷贝质粒DNA扩增产物,第1、2条带为扩增前25℃处理的试剂扩增产物,第3、4条带为扩增前冰上处理的试剂扩增产物,第5条带为双链DNA Marker。从图中可以看出,在常温下放置反应体系一段时间,并不会有明显的负面影响。
比较例1:利用水生栖热菌Ⅰ类DNA聚合酶大片段进行解旋酶依赖扩增。
在本比较例中,使用非冷敏感型水生栖热菌Ⅰ类DNA聚合酶(Seq.NO.2)进行解旋酶依赖扩增。也还是对含金黄色葡萄球菌基因组的FemA基因序列5’-tggtgccttt acagatagca tgccatacag tcatttcacg caaactgttg gccactatga gttaaagctt gctgaaggtt atgaaacaca tttagtggga ataaaaaaca ataataacga ggtcattgca gctt-3’(Seq.NO.6)的pMD-18T质粒(购自大连宝生物公司)DNA进行扩增。
(1)引物序列
上游引物序列:5'-TGGTGCCTTTACAGATAG-3'(Seq.NO.7)
下游引物序列:5'-AAGCTGCAATGACCTCGT-3'(Seq.NO.8)
(2)质粒DNA模板的准备
紫外分光光度法测定质粒的浓度,根据质粒DNA的分子量,计算得每微升溶液中质粒DNA的拷贝数,用TE缓冲液(10mmol/l Tris-HCl,1mmol/l EDTA,pH7.5)稀释至每微升溶液含109拷贝质粒DNA,然后用TE缓冲液10倍梯度稀释,连续稀释7个梯度。
(3)HDA反应体系
-非冷敏感的水生栖热菌Ⅰ类DNA聚合酶(Seq.NO.2),
-6mmol/l MgSO4,
-50mmol/l KCl,
-30mmol/l Tris-HCl(pH8.8),
-0.1%Triton X-100(v/v),
-0.8mmol/l dNTPs,
-10μmol/l引物,
-1.5mmol/l ATP,
-Taq UvrD解旋酶,
-1μl质粒DNA模板,
-反应液总体积25μl。
(4)HDA反应
HDA反应试剂准备完成后,按如下说明加入上述步骤(3)中所描述的模板量:
A组:
A1为100拷贝质粒DNA,
A2为1000拷贝质粒DNA,
将A组包括试剂于冰上放置10分钟再进行HDA反应试剂。
B组:
B1为100拷贝质粒DNA,
B2为1000拷贝质粒DNA,
将A组包括试剂于25℃放置10分钟再进行HDA反应。
HDA反应为65℃恒温金属浴中保温1小时。
(5)琼脂糖凝胶电泳分析
1%琼脂糖凝胶于1×TAE缓冲液中,在4v/cm场强条件下对扩增产物进行分析,电泳结束后用4×SYBR GreenⅠ染料染色20分钟,然后观察电泳结果如图2所示。其中第1、3条带为100拷贝质粒DNA扩增产物,第2、4条带1000拷贝质粒DNA扩增产物,第1、2条带为扩增前25℃处理的试剂扩增产物,第3、4条带为扩增前冰上处理的试剂扩增产物,第5条带为双链DNA Marker。从图中可以看出,在常温下放置反应体系一段时间,会有明显的负面影响。结合上述实施例1-3的实验结果可以看出,采用本发明的方法和体系对核酸模板进行解旋酶依赖扩增,从而有效地避免或降低扩增前常温放置所带来的负面影响。
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种新的多肽——人rna解旋酶9.13和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人核糖核酸解旋酶48.4和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人rna解旋酶10和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人rna解旋酶13和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人rna解旋酶9和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人rna解旋酶12和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人rna解旋酶105和编码这种多肽的多核苷酸的制作方法
- Hcv ns-3丝氨酸蛋白酶抑制剂的制作方法
- 丙型肝炎病毒ns3解旋酶atp结合位点单克隆抗体识别表位的制作方法
- 一个编码冰缘植物冷诱导蛋白的基因及其在抗寒转基因烟草中的应用的制作方法