苯并吲唑类衍生物及其制备方法、应用与流程
本发明涉及药物化学
技术领域:
,具体地说,是苯并吲唑类衍生物及其制备方法、应用。
背景技术:
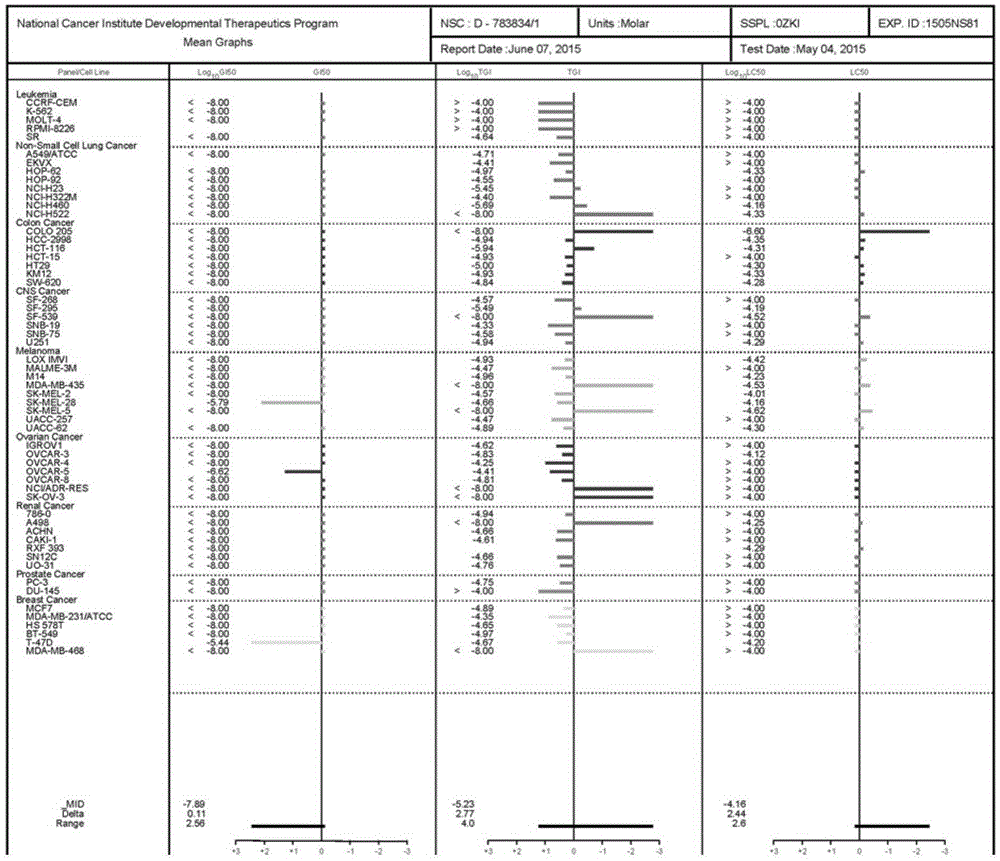
:肿瘤,特别是恶性肿瘤,已严重威胁人类的健康。世界卫生组织(WHO)的发布的《全球癌症报告2014》显示,非洲、亚洲和中南美洲的发展中国家癌症发病形势最为严峻。2012年全世界共新增1400万癌症病例并有820万人死亡。其中,中国新增307万癌症患者并造成约220万人死亡,分别占全球总量的21.9%和26.8%。该报告预测全球癌症病例将呈现迅猛增长态势,由2012年的1400万人,逐年递增至2025年的1900万人,到2035年将达到2400万人。尽管抗肿瘤药物为延长患者的生存时间以及改善其生命质量做出了很大贡献,但大多数药物均为细胞毒药物,其缺乏选择性会伤害大量的正常细胞,并且容易出现耐药性,所以,肿瘤血管靶向药物成为了研究热点。微管由微管蛋白和微管结合蛋白构成,是构成细胞骨架的主要成分。微管有聚合和解聚的动力学特性,在保持细胞形态、细胞的分裂增殖、细胞器的组成与运输及信号物质的传导方面发挥重要作用。以微管为靶点的抗肿瘤药物就是利用其动力学特性,或促进其解聚或抑制其聚合,从而达到直接影响细胞的有丝分裂,影响细胞的诸多正常生理功能,使细胞分裂停止于M期。研究表明微管存在3个不同的药物结合位点:紫杉醇位点、长春新碱位点和秋水仙碱位点。由于秋水仙碱位点空腔体积较小且相应抑制剂的结构较为简单,因而近年来关于其抑制剂的研究也备受关注。该位点最初发现的抑制剂秋水仙碱治疗窗较窄,限制了其临床应用。而二苯乙烯类天然产物抑制剂combretastatins的发现引起了研究者的极大关注,代表化合物CombretastatinA-4(CA-4),表现出很高的微管聚合抑制作用和抗肿瘤活性,还表现出肿瘤血管阻断作用。研究者对CA-4进行了大量的结构改造,目前有多个类似物进入临床研究,显示出良好的发展前景。其中CA-4P在2013年7月欧洲药品管理局授予其治疗卵巢癌的孤儿药地位,目前CA-4P在未分化甲状腺癌、神经内分泌瘤和卵巢癌上开展了临床研究。中国专利文献CN201510064131.0公开了一种取代苯亚甲基四氢萘酮类衍 生物,化学结构式为:其中,X表示CHOH或C=O,R表示H、OH、F、Cl、CN、CONH2、NO2、CH3、OCH3、NH2中的任一种。但是关于本发明的苯并吲唑类衍生物及其制备方法、应用目前还未见报道。技术实现要素:本发明的目的是针对现有技术中的不足,提供一种苯并吲唑类衍生物。本发明的再一的目的是,提供一种苯并吲唑类衍生物的应用。本发明的另一的目的是,提供一种苯并吲唑类衍生物的制备方法。为实现上述目的,本发明采取的技术方案是:式(I)所示的苯并吲唑类衍生物及其药学上可接受的盐,其中,R1选自氢、烷氧基、卤素、硝基、氨基、氧取代物,取代基相同或不同,为单取代或多取代;R2选自氢、烷氧基,为单取代或多取代;R3选自氢、直链烷基、取代烷基、芳香基、羧酸、羧酸酯。优选地,R1选自氢、甲氧基、卤素、硝基、氨基、羟基。优选地,R2为甲氧基。优选地,R3选自氢、直链烷基、取代烷基、芳香基、羧酸、羧酸酯。优选地,R1、R2、R3表示的基团如下所示:序号R1R2R3SC-13,4,5-三甲氧基7-甲氧基-HSC-23,4,5-三甲氧基7-甲氧基-CH3SC-33,4,5-三甲氧基7-甲氧基-CH2CH2OHSC-43,4,5-三甲氧基7-甲氧基-PhSC-53,4,5-三甲氧基7-甲氧基-CH2COOC2H5TCa-14-甲氧基6,7,8-三甲氧基-HTCa-24-甲氧基6,7,8-三甲氧基-CH3TCb-13-氟-4-甲氧基6,7,8-三甲氧基-HTCb-33-氟-4-甲氧基6,7,8-三甲氧基-CH2CH2OHTCb-43-氟-4-甲氧基6,7,8-三甲氧基-PhTCc-13-硝基-4-甲氧基6,7,8-三甲氧基-PhTCd-13-氨基-4-甲氧基6,7,8-三甲氧基-Ph优选地,所述的苯并吲唑类衍生物为7-甲氧基-1-(3,4,5-三甲氧基苯基)-4,5-二氢-2H-苯并[e]吲唑。为实现上述第二个目的,本发明采取的技术方案是:所述的苯并吲唑类衍生物及其药学上可接受的盐在制备微管蛋白聚合抑制剂中的应用。所述的苯并吲唑类衍生物及其药学上可接受的盐在制备治疗肿瘤疾病药物中的应用。所述的肿瘤疾病为白血病、非小细胞肺癌、结肠癌、中枢神经系统肿瘤、黑色素瘤、卵巢癌、肾癌、前列腺癌或乳腺癌。为实现上述第三个目的,本发明采取的技术方案是:所述的苯并吲唑类衍生物的制备方法的合成路线为:其中,R1选自氢、直链烷基、取代烷基、芳香基、羧酸、羧酸酯。本发明优点在于:1、本发明中的苯并吲唑类结构彻底解决了之前专利中化合物具有双键结构,存在顺反异构化而导致的化合物不稳定的问题。2、本发明中的化合物具有更广的抗瘤谱,其中SC1在美国国家癌症研究所测试的60个细胞株筛选中都有非常高的活性,平均IC50值达到10nM级别。3、本发明中化合物TCd-1在初步的筛选中表现出比SC1更高的活性,达到pM级别。其取代基R2为氨基时,可以做成盐酸盐等,具有更好的水溶性和口服生物利用度。并可以进一步做成前药形式,具备更好的成药性。具备进一步开发的价值。附图说明附图1是化合物SC1在美国国家癌症研究所测试的60个细胞株筛选结果。具体实施方式下面结合实施例对本发明提供的具体实施方式作详细说明。本发明的化合物的合成通式如下:本发明的化合物的具体合成路线如下:试剂和条件:(a)LDA,3位取代的对甲氧基苯甲酰氯,无水四氢呋喃,-15℃;(b)R1-NH-NH2,乙醇,室温;(c)NaOH,甲醇,室温;(d)铁粉,醋酸,70%乙醇,回流。相关化合物的合成方法如下:原料6-甲氧基-3,4-二氢萘-2(1H)-酮(1)的合成参见文献JMedChem2012,55,5720-5733.。原料5,6,7-三甲氧基-3,4-二氢萘-2-酮(2)的合成参见专利《取代苯亚甲基四氢萘酮类衍生物及制备方法、应用》(申请号:201510064131.0)。实施例1:6-甲氧基-1-(3,4,5-三甲氧基苯基)-3,4-二氢萘-2(1H)-酮(S-dk)将原料6-甲氧基-3,4-二氢萘-2(1H)-酮(1)(5.68mmol,1.0equiv)溶入20mL无水THF中,氮气保护,加冰盐浴,缓慢滴加LDA(6.24mmol,1.1equiv),搅拌4小时后加入3,4,5-三甲氧基苯甲酰氯的THF溶液(6.24mmol,1.1equiv),缓慢升至室温搅拌,TLC监测。反应完毕后冰浴下加入饱和氯化铵水溶液淬灭。反应液用乙酸乙酯萃取(2×100mL),合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩后用硅胶柱层析纯化(乙酸乙酯/石油醚洗脱)得产物为黄色固体,产率61%。1HNMR(600MHz,CDCl3)δ6.77(s,2H),6.72(d,J=2.3Hz,1H),6.66(d,J=8.6Hz,1H),6.47(dd,J=8.6,2.5Hz,1H),3.92(d,J=6.2Hz,1H),3.88(s,3H),3.75(s,3H),3.69(s,6H),2.93(t,J=6.8Hz,2H),2.68–2.52(m,2H).HRMS(ES+)m/zfound371.1486(M+H+);C21H23O6(M+H+)requires371.1489.实施例2:7-甲氧基-1-(3,4,5-三甲氧基苯基)-4,5-二氢-2H-苯并[e]吲唑(SC1)在100mL烧瓶中依次加入乙醇、中间体S-dk和等当量的水合肼,搅拌过夜,浓缩后分离纯化得SC1为白色固体。熔点172–173℃,1HNMR(600MHz,CDCl3)δ7.35(d,J=8.5Hz,1H),6.84(s,2H),6.82(d,J=2.5Hz,1H),6.64(dd,J=8.5,2.7Hz,1H),3.92(s,3H),3.83(s,6H),3.79(s,3H),2.99(t,J=7.2Hz,2H),2.83(t,J=7.2Hz,2H),13CNMR(150MHz,CDCl3)δ157.92,153.57,148.74,140.29,138.47,136.92,126.69,124.28,123.15,114.38,113.61,111.66,105.49,61.01,56.28,55.28,30.46,21.81.HRMS(ES+)m/zfound367.1653(M+H+);C21H23N2O4(M+H+)requires367.1652.实施例3:7-甲氧基-2-甲基-1-(3,4,5-三甲氧基苯基)-4,5-二氢-2H-苯并[e]吲唑(SC2)参照实施例2,将中间体S-dk和甲基肼反应得SC2为白色固体。熔点157 –158℃,1HNMR(600MHz,CDCl3)δ7.33(d,J=8.5Hz,1H),6.89(s,2H),6.81(d,J=2.4Hz,1H),6.55(dd,J=8.5,2.6Hz,1H),3.95(s,3H),3.90(s,3H),3.84(s,6H),3.78(s,3H),3.03(t,J=7.5Hz,2H),2.89(t,J=7.3Hz,2H).13CNMR(151MHz,CDCl3)δ157.84,153.78,138.74,136.76,125.73,123.66,114.42,111.74,106.95,61.05,56.37,55.26,36.66,30.34,21.92.HRMS(ES+)m/zfound381.1821(M+H+);C22H25N2O4(M+H+)requires381.1809.实施例4:7-甲氧基-2-羟基乙基-1-(3,4,5-三甲氧基苯基)-4,5-二氢-2H-苯并[e]吲唑(SC3)参照实施例2,将中间体S-dk和羟基乙基肼反应得SC3为白色固体。熔点143–144℃,1HNMR(600MHz,CDCl3)δ6.86(d,J=8.5Hz,1H),6.78(d,J=2.6Hz,1H),6.63(s,2H),6.55(dd,J=8.5,2.7Hz,1H),4.07–4.04(m,2H),3.97(d,J=5.1Hz,2H),3.95(s,3H),3.84(s,6H),3.77(s,3H),3.01(t,J=7.2Hz,2H),2.89(t,J=7.2Hz,2H).13CNMR(150MHz,CDCl3)δ157.72,153.73,149.38,138.61,138.08,136.80,125.94,123.71,123.16,114.81,114.39,111.69,107.20,62.17,61.03,56.34,55.24,50.31,30.46,22.19.HRMS(ES+)m/zfound411.1910(M+H+);C23H27N2O5(M+H+)requires411.1914.实施例5:7-甲氧基-2-苯基-1-(3,4,5-三甲氧基苯基)-4,5-二氢-2H-苯并[e]吲唑(SC4)参照实施例2,将中间体S-dk和苯基肼反应得SC4为灰色固体。熔点142–143℃,1HNMR(600MHz,CDCl3)δ7.30–7.20(m,5H),7.08(d,J=8.5Hz,1H),6.83(d,J=2.6Hz,1H),6.60(dd,J=8.6,2.7Hz,1H),6.52(s,2H),3.92(s,3H),3.79(s,3H),3.66(s,6H),3.06(t,J=7.1Hz,2H),3.00–2.94(m,2H).HRMS(ES+)m/zfound443.1969(M+H+);C27H27N2O4(M+H+)requires443.1965.实施例6:2-(7-甲氧基-1-(3,4,5-三甲氧基苯基)-4,5-二氢-2H-苯并[e]吲唑-2-)乙酸乙酯(SC5)参照实施例2,将中间体S-dk和2-肼基乙酸乙酯反应得SC4为灰色固体。熔点118–119℃,1HNMR(600MHz,CDCl3)δ6.90(d,J=8.5Hz,1H),6.79(d,J=2.6Hz,1H),6.66(s,2H),6.56(dd,J=8.5,2.7Hz,1H),4.70(s,2H),4.20(q,J=7.1Hz,2H),3.95(s,3H),3.81(s,6H),3.77(s,3H),3.02(t,J=7.2Hz,2H),2.91(t,J=7.2Hz,2H),1.26(t,J=7.1Hz,3H).13CNMR(151MHz,CDCl3)δ168.71,157.77,153.67,150.06,138.62,138.38,136.94,125.80,123.78,123.19,115.21, 114.33,111.72,106.98,102.71,61.68,61.01,56.25,55.24,50.62,42.65,30.44,25.62,23.07,22.21,14.16,14.02.HRMS(ES+)m/zfound453.2023(M+H+);C25H29N2O6(M+H+)requires453.2020.实施例7:2-(7-甲氧基-1-(3,4,5-三甲氧基苯基)-4,5-二氢-2H-苯并[e]吲唑-2-)乙酸(SC6)将2-(7-甲氧基-1-(3,4,5-三甲氧基苯基)-4,5-二氢-2H-苯并[e]吲唑-2-)乙酸乙酯(SC5)溶于乙醇中,加入5倍当量的NaOH水溶液,搅拌过夜,稀盐酸中和至pH<7后用二氯甲烷萃取,有机层浓缩后薄层色谱制备得SC6为白色固体。1HNMR(600MHz,CDCl3)δ6.90(d,J=8.5Hz,1H),6.78(d,J=2.6Hz,1H),6.63(s,2H),6.57(dd,J=8.5,2.7Hz,1H),4.74(s,2H),3.95(s,3H),3.82(s,6H),3.77(s,3H),3.12(m,2H),2.96(m,2H).HRMS(ES+)m/zfound425.1699(M+H+);C23H25N2O6(M+H+)requires425.1707.实施例8:5,6,7-三甲氧基-1-(4-甲氧基苯基)-3,4-二氢萘-2(1H)-酮(T-dk-a)参照实施例1,以原料5,6,7-三甲氧基-3,4-二氢萘-2-酮(2)和4-甲氧基苯甲酰氯反应制备得T-dk-a为黄色固体。熔点86–87℃,1HNMR(600MHz,CDCl3)δ7.51(d,J=8.8Hz,2H),6.85(d,J=8.8Hz,2H),6.06(s,1H),3.88(s,3H),3.88(s,1H),3.85(s,3H),3.83(s,3H),3.29(s,3H),2.92(t,J=6.9Hz,2H),2.61–2.53(m,2H).HRMS(ES+)m/zfound371.1481(M+H+);C21H23O6(M+H+)requires371.1489.实施例9:5,6,7-三甲氧基-1-(3-氟-4-甲氧基苯基)-3,4-二氢萘-2(1H)-酮(T-dk-b)参照实施例1,以原料5,6,7-三甲氧基-3,4-二氢萘-2-酮(2)和3-氟-4-甲氧基苯甲酰氯反应制备得T-dk-b为黄色固体。1HNMR(600MHz,CDCl3)δ7.32(dd,J=11.7,1.9Hz,1H),7.30(d,J=9.2Hz,1H),6.89(t,J=8.4Hz,1H),6.05(s,1H),3.91(s,3H),3.89(s,3H),3.85(s,3H),3.33(s,3H),2.93(t,J=6.9Hz,2H),2.61–2.52(m,2H).13CNMR(150MHz,CDCl3)δ197.21,180.59,152.02,150.51,150.38,149.72,149.65,139.64,128.69,128.66,127.86,125.91,120.28,116.75,116.62,111.92,108.89,107.78,60.72,60.52,55.86,55.09,33.81,19.47.实施例10:5,6,7-三甲氧基-1-(3-硝基-4-甲氧基苯基)-3,4-二氢萘-2(1H)-酮(T-dk-c)参照实施例1,以原料5,6,7-三甲氧基-3,4-二氢萘-2-酮(2)和3-硝基-4- 甲氧基苯甲酰氯反应制备得T-dk-c为黄色固体。1HNMR(600MHz,CDCl3)δ8.10(d,J=2.2Hz,1H),7.71(dd,J=8.8,2.2Hz,1H),7.02(d,J=8.8Hz,1H),6.04(s,1H),3.99(s,3H),3.90(s,3H),3.86(s,3H),3.36(s,3H),3.00–2.89(m,2H),2.64–2.54(m,2H).实施例11:6,7,8-三甲氧基-1-(4-甲氧基苯基)-4,5-二氢-2H-苯并[e]吲唑(TCa-1)参照实施例2,将中间体T-dk-a和水合肼反应得TCa-1为棕色固体。熔点105–106℃,1HNMR(600MHz,CDCl3)δ7.55(d,J=8.5Hz,2H),6.99(d,J=8.5Hz,2H),6.70(s,1H),3.88(s,3H),3.86(s,6H),3.54(s,3H),3.00(t,J=7.2Hz,2H),2.82(t,J=7.2Hz,2H);13CNMR(150MHz,CDCl3)δ160.13,151.63,151.43,140.45,129.88,126.55,123.49,121.13,114.20,113.39,103.08,60.98,60.95,55.75,55.41,22.10,21.73.HRMS(ES+)m/zfound367.1652(M+H+);C21H23O6(M+H+)requires367.1662.实施例12:6,7,8-三甲氧基-1-(4-甲氧基苯基)-2-甲基-4,5-二氢-2H-苯并[e]吲唑(TCa-2)参照实施例2,将中间体T-dk-a和甲基肼反应得TCa-2为棕色固体。熔点126–127℃,1HNMR(600MHz,CDCl3)δ7.37(d,J=8.5Hz,2H),7.05(d,J=8.5Hz,2H),6.30(s,1H),3.88(s,3H),3.86(s,4H),3.83(s,3H),3.70(s,3H),3.42(s,3H),3.00(t,J=7.4Hz,2H),2.85(t,J=7.4Hz,2H).13CNMR(151MHz,CDCl3)δ160.18,151.51,151.39,149.28,140.16,138.11,131.43,130.14,126.65,123.03,120.90,114.81,114.37,113.71,102.43,60.94,60.88,55.43,36.47,29.70,22.14,21.74.HRMS(ES+)m/zfound381.1805(M+H+);C21H23O6(M+H+)requires381.1809.实施例13:6,7,8-三甲氧基-1-(3-氟-4-甲氧基苯基)-4,5-二氢-2H-苯并[e]吲唑(TCb-1)参照实施例2,将中间体T-dk-b和水合肼反应得TCb-1为紫色固体。熔点147–148℃,1HNMR(600MHz,CDCl3)δ7.38(dd,J=11.8,2.0Hz,1H),7.35–7.30(m,1H),6.97(t,J=8.5Hz,1H),6.70(s,1H),3.93(s,3H),3.88(s,3H),3.87(s,3H),3.57(s,3H),3.01–2.92(m,2H),2.79–2.70(m,2H);13CNMR(150MHz,CDCl3)δ152.93,151.67,151.44,151.30,147.98,147.91,140.48,126.34,124.70,120.92,116.47,116.34,113.56,113.28,103.11,61.00,60.98,56.28,55.77, 21.98,21.28.HRMS(ES+)m/zfound385.1564(M+H+);C21H23O6(M+H+)requires385.1558.实施例14:6,7,8-三甲氧基-1-(3-氟-4-甲氧基苯基)-2-羟基乙基-4,5-二氢-2H-苯并[e]吲唑(TCb-3)参照实施例2,将中间体T-dk-b和羟基乙基肼反应得TCb-3为棕色固体。熔点150–151℃,1HNMR(600MHz,CDCl3)δ7.22(dd,J=11.4,2.0Hz,1H),7.20–7.16(m,1H),7.11(t,J=8.4Hz,1H),6.25(s,1H),4.06–4.01(m,2H),3.97(s,3H),3.95(dd,J=9.1,4.5Hz,2H),3.86(s,3H),3.84(s,3H),3.45(s,3H),2.99(t,J=7.4Hz,2H),2.84(t,J=7.4Hz,2H).13CNMR(151MHz,CDCl3)δ153.17,151.69,151.49,149.42,148.73,148.66,140.75,137.58,126.76,125.39,122.39,122.34,121.07,118.20,118.08,115.35,113.79,102.68,61.77,60.95,60.90,56.42,55.50,50.35,21.77,21.45.HRMS(ES+)m/zfound429.1830(M+H+);C21H23O6(M+H+)requires429.1820.实施例15:6,7,8-三甲氧基-1-(3-氟-4-甲氧基苯基)-2-苯基-4,5-二氢-2H-苯并[e]吲唑(TCb-4)参照实施例2,将中间体T-dk-b和苯肼反应得TCb-4为棕色固体。熔点159–160℃,1HNMR(600MHz,CDCl3)δ7.32–7.28(m,2H),7.26–7.22(m,3H),7.13(dd,J=11.6,2.0Hz,1H),7.09–7.05(m,1H),6.98(t,J=8.5Hz,1H),6.40(s,1H),3.92(s,3H),3.89(s,3H),3.87(s,3H),3.48(s,3H),3.05(t,J=7.3Hz,2H),2.93(t,J=7.2Hz,2H).13CNMR(151MHz,CDCl3)δ153.04,151.72,151.51,151.39,151.05,148.34,148.27,140.96,138.93,136.30,128.97,127.48,126.88,125.36,125.10,122.98,121.68,120.65,118.21,118.09,116.67,115.32,113.48,103.06,60.98,56.29,55.57,21.84,21.63.HRMS(ES+)m/zfound461.1870(M+H+);C21H23O6(M+H+)requires461.1871.实施例16:6,7,8-三甲氧基-1-(3-硝基-4-甲氧基苯基)-2-苯基-4,5-二氢-2H-苯并[e]吲唑(TCc-1)参照实施例2,将中间体T-dk-c和水合肼反应得TCc-1为棕色固体。熔点108–109℃,1HNMR(600MHz,CDCl3)δ8.16(d,J=2.2Hz,1H),7.84(dd,J=8.6,2.2Hz,1H),7.16(d,J=8.7Hz,1H),6.65(s,1H),4.02(s,3H),3.89(s,3H),3.88(s,3H),3.60(s,3H),3.01(t,J=7.4Hz,2H),2.87–2.80(m,2H).13CNMR(151MHz,CDCl3)δ152.68,151.90,151.59,140.81,139.68,134.04,125.87, 125.43,124.97,120.86,114.05,113.62,102.98,61.00,56.70,55.89,21.89,21.04.实施例17:6,7,8-三甲氧基-1-(3-氨基-4-甲氧基苯基)-2-苯基-4,5-二氢-2H-苯并[e]吲唑(TCd-1)在10mL75%乙醇中加入醋酸,调至PH=3~4,搅拌下加入铁粉(90mg,1.6mmol),加热至90℃搅拌一小时。再加入化合物TCc-1(66mg,0.16mmol),继续搅拌30分钟,反应完毕。反应液用无水碳酸钾中和至PH≈8,硅藻土过滤,用乙酸乙酯洗涤。滤液用乙酸乙酯萃取,食盐水洗涤,有机相用无水硫酸钠干燥,浓缩并硅胶柱层析得黄色粉末TCd-1(41mg,67%yield)。1HNMR(600MHz,CDCl3)δ6.95(t,J=5.4Hz,2H),6.84(s,1H),6.83(d,J=8.1Hz,1H),4.19(s,2H),3.89(s,3H),3.87(s,3H),3.86(s,3H),3.58(s,3H),3.48(s,1H),3.02–2.92(m,2H),2.83–2.73(m,2H).13CNMR(150MHz,CDCl3)δ151.56,151.33,150.26,147.71,140.29,140.10,136.49,126.72,123.68,121.09,118.61,114.63,113.04,110.30,103.27,60.99,60.95,55.79,55.61,22.10,21.72.实施例18:目标物SC1-SC6对K562、HCT116细胞株的细胞毒作用.一、实验材料和方法:1、实验材料(一)实验细胞株本实验采用了人白血病细胞、人结肠癌细胞的细胞株作为筛选对象,该癌细胞株均由上海医药工业研究院药理研究室提供。1)K562(人白血病细胞)2)HT116(人肠癌细胞)(二)培养液为DMEM+10%FBS+双抗,所用全自动酶标仪型号为:VarioskanFlash,生产厂商:Thermoscientific。进口96孔培养板等。2、试验方法体外抗肿瘤活性采用MTT法。样品配制:用DMSO(Merck)溶解成10mM后,加入PBS(-)配成1000μM的溶液或均匀的混悬液,然后用含DMSO的PBS(-)稀释。实验步骤如下:96孔板每孔加入浓度为4-5×104个/ml的细胞悬液100μl,置37℃,5%CO2培养箱内。二、实验结果:表1化合物SC1—SC6的肿瘤细胞增殖实验注:该化合物为专利CN103130632A中的化合物1实施例19:目标物对Colo205细胞株的细胞毒作用.一、实验材料和方法:1、实验材料(一)实验细胞株本实验采用了人结肠癌细胞Colo205作为筛选对象,该癌细胞株均由上海医药工业研究院药理研究室提供。(二)培养液为DMEM+10%FBS+双抗,所用全自动酶标仪型号为:VarioskanFlash,生产厂商:Thermoscientific。进口96孔培养板等。2、试验方法体外抗肿瘤活性采用MTT法。MTT法。96孔板每孔加入浓度为5×104个/ml的细胞悬液100μl,置37℃,5%CO2培养箱内。24h后,加入样品液,10μl/孔,设三复孔,37℃,5%CO2作用72h。每孔加入5mg/ml的MTT溶液20μl,作用4h后加入溶解液,100μl/孔,置培养箱内,溶解后用全波长多功能酶标仪测570nmOD值。二、实验结果:表2目标化合物对人结肠癌细胞Colo205的体外增殖抑制作用注:该化合物为专利CN103130632A中的化合物1实验例20:化合物SC1在美国国家癌症研究所测试的60个细胞株筛选测试结果表明化合物SC1对白血病、非小细胞肺癌、结肠癌、中枢神经系统肿瘤、黑色素瘤、卵巢癌、肾癌、前列腺癌以及乳腺癌都有非常好的效果,对所测的60个细胞株平均IC50值达到12.88nM。实验例21:抑制微管蛋白聚合实验一、实验材料和方法:1、实验材料(一)微管蛋白本实验采用了牛微管蛋白作为筛选对象,生产厂家:Cytoskeleton。(二)缓冲液GeneralTubulinBuffer:80mMPIPESpH=6.9,2mMMgCl2,0.5mMEGTA,生产厂家:Cytoskeleton。TubulinGlycerolBuffer:60%glycerol,生产厂家:Cytoskeleton。GTP:100mM,生产厂家:Cytoskeleton所用全自动酶标仪型号为:Synergy4,生产厂商:BioTek。进口96孔半面积培养板等。2、试验方法采用文献方法(CellBiochemistryandBiophysics,2003,38:1-21),及微管蛋白试剂盒方法(CytoDYNAMIXScreen03)。样品配制:用DMSO(Merck)溶解后,加入缓冲液配成相应浓度的溶液或均匀的混悬液,然后用缓冲液稀释。实验步骤如下:在96孔培养板中每孔加入相应浓度为待测化合物10μl,置37℃酶标仪中,2min后,加入3mg/ml的微管蛋白液,100μl/孔,设双复孔,37℃,作用1h,每分钟测340nmOD值。二、实验结果表3部分化合物抑制微管蛋白聚合的作用实验结果表明,上述化合物均具有优异的抑制微管蛋白聚合的作用,其中化合物SC1、SC2、Tca-1、Tcb-1和Tcd-1的活性与阳性对照药CA-4相当,SC1、Tcd-1的微管蛋白抑制聚合活性甚至好于CA-4,值得作为抗肿瘤药物进行深入研究。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 苯并双(噻二唑)衍生物、包含其的油墨、以及使用了其的有机电子装置的制造方法
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 一种苯并噻咯类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并二氮杂*衍生物的2-萘磺酸盐及晶型和它们的制备方法与制造工艺
- 靛红杂合喹唑啉类化合物合成的靛红衍生物及其在制备抗肿瘤药物中的应用的制造方法与工艺
- 一种杂环衍生物及使用该杂环衍生物的有机发光器件的制造方法与工艺
- 一种二氰基甲烯基苯并四氢呋喃衍生物及其制备方法与制造工艺
- 一种含氮杂环衍生物及使用该含氮杂环衍生物的有机发光器件的制造方法与工艺
- 苯并二氮杂*衍生物的2-萘磺酸盐及晶型和它们的制备方法与制造工艺
- 一种二氰基甲烯基苯并四氢呋喃衍生物及其制备方法与制造工艺
- 苯并吲唑类衍生物及其制备方法、应用与制造工艺
- 一种二苯并环庚烷衍生物的制备方法与制造工艺
- Atropurpuran的苯并咪唑基和吗啉基衍生物组合物用于防治胰腺纤维化的制造方法与工艺
- 一种苯并咪唑衍生物镉配合物及其制备方法和应用
- 一种咪唑并吡啶巯乙酸类衍生物及其制备方法与应用
- Artalbic acid的O?(苯并咪唑基)乙基与O?(二羟乙胺基)乙基衍生物的组合物在抗病毒 ...的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗骨质疏松药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备防治胰腺纤维化药物的制作方法
- 一种具有抗氧化活性的芳基苯并呋喃类化合物及其制备方法和应用与流程
- 一种含苯并双环酮与乙氧磺隆的除草组合物及其应用的制造方法与工艺
- 一种6‑氯呋喃[3,2‑B]吡啶的合成方法与流程
- 一类苯并吡喃类化合物及其应用的制造方法与工艺
- 一种以二苯并环庚烯为核心的化合物及其在有机电致发光器件上的应用的制造方法与工艺
- 一种含苯并双环酮与乙草胺的除草组合物及其应用的制造方法与工艺
- 一种含苯并双环酮与噁草酮的除草组合物及其应用的制造方法与工艺
- 分解二噁英前体的催化剂筛选系统及其使用方法与流程
- 一种无卤热固性树脂组合物以及含有它的预浸料、层压板和印制电路板的制造方法与工艺
- 一种以二联二苯并五元杂环为骨架的有机化合物及其在OLED上的应用的制造方法与工艺
- 6,7,8,9‑四氢‑5H‑苯并[7]轮烯‑2‑烷基胺类化合物及其用途的制造方法与工艺
- 用于PHOLED的具有氮杂‑二苯并噻吩或氮杂‑二苯并呋喃核的新材料的制造方法与工艺
- 多孔ZSM‑5沸石与γ‑Al2O3复合材料的合成及制备加氢脱硫催化剂的制造方法与工艺
- 一种含有氟噻虫砜和五氟虫腙的杀虫组合物的制造方法与工艺
- 苯并双(噻二唑)衍生物、包含其的油墨、以及使用了其的有机电子装置的制造方法
- 苯并噻二唑胺的制造方法与工艺
- 用于有机电致发光器件的材料的制造方法与工艺
- 用于有机电致发光器件的材料的制造方法与工艺
- 一种苯并噻咯类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件与制造工艺