适于酵母中的异源基因表达的启动子的制作方法
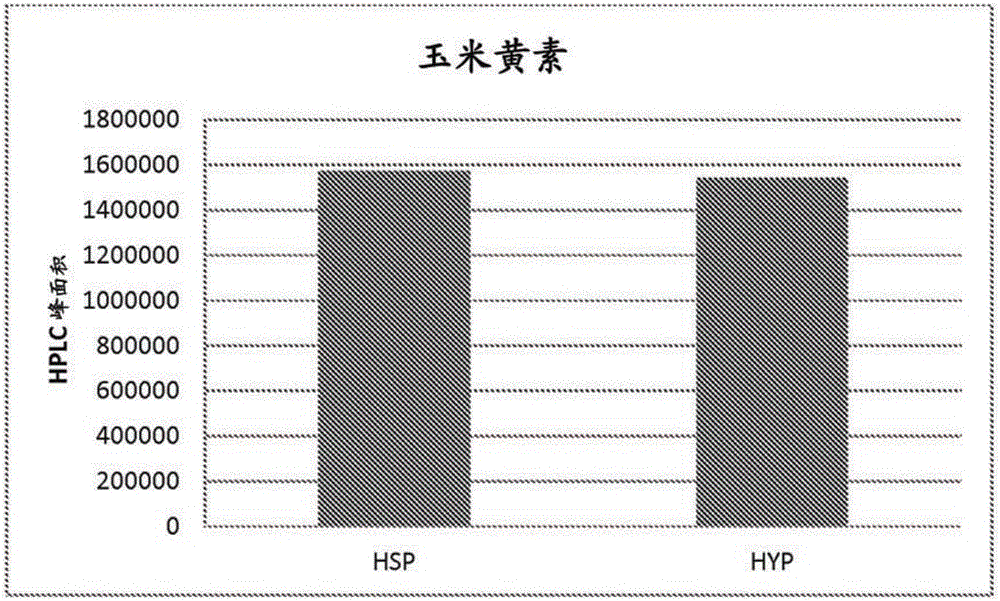
本申请要求申请日为2014年1月31日的美国临时专利申请No.61/933,979的申请日权益,其公开内容通过提述在此并入本文。发明领域本发明涉及新的启动子用于异源基因表达的用途,优选为用于耶氏酵母属(genusYarrowia)的生物中基因表达的用途,涉及经遗传修饰的耶氏酵母属生物,并涉及用于通过培养所述经遗传修饰的生物来生产生物合成产物的方法。发明背景细胞中天然代谢过程产生多种生物合成产物,例如精细化学品,例如尤其是氨基酸、维生素、类胡萝卜素,其用于多种工业分支中,包括人与动物食品、化妆品、以及制药工业。其大规模生产是部分通过生物技术方法用微生物来进行的,所述微生物经过开发以产生和分泌大量具体所需的物质。例如,类胡萝卜素是在细菌、藻类和真菌中从头合成的。近年来,越来越多地尝试利用油质(oleaginous)酵母和真菌作为生产精细化学品,尤其是生产维生素和类胡萝卜素的生物。类胡萝卜素(如叶黄素、玉米黄素、虾青素和β胡萝卜素)作为所谓的油性树脂提取自例如耶氏酵母属。这些油性树脂既用作膳食补充剂的成分,也用于饲料行业(sector)中。酮式类胡萝卜素(ketocarotenoids),意即包含至少一个酮基的类胡萝卜素,例如虾青素、角黄素、海胆酮、3-羟基海胆酮、3’-羟基海胆酮、金盏花红素(adonirubin)和金盏花黄素(adonixanthin),是天然抗氧化剂和色素,其由一些藻类、生物和微生物作为次级代谢物产生。这些分子在能生产其的生物(如酵母和细菌)中的生物合成已得到了详细表征(Weinheim等,(1996)Ullmann'sEncyclopediaofIndustrialChemistry, "Vitamins",Vol.A27,pp.443-613;BiochemicalPathways:AnAtlasofBiochemistryandMolecularBiology,JohnWiley&Sons,Michal,G.Ed.(1999);Ong,A.S.,Niki,E.和Packer,L.,(1995)"Nutrition,Lipids,HealthandDisease"ProceedingsoftheUNESCO/ConfederationofScientificandTechnologicalAssociationsinMalaysiaandtheSocietyforRreeRadicalResearch-Asia,举办于1994年9月1-3日,于Penang,Malaysia,AOCSPress,Champaign,ILX,374S)。具体而言,类胡萝卜素在耶氏酵母中的生物合成描述于WO2006/102342中。由于酮式类胡萝卜素的着色特性,将其与特别是虾青素用作家畜营养中(尤其是在鳟鱼、鲑鱼和虾的养殖中)的着色剂。因此,用于生产天然生物合成产物(并且尤其是类胡萝卜素)的经济的生物技术方法是非常重要的。WO2008/042338公开了多个用于在耶氏酵母中过表达类胡萝卜素生物合成基因的启动子。EP0220864A中公开了一种的启动子。该文献描述了解脂耶氏酵母(Yarrowialipolytica)启动子XPR2。该XPR2酵母启动子在缺乏偏好的碳和氮源的培养基上仅在pH6.0以上有活性,并且完全诱导需要在培养基中高水平的蛋白胨(Ogrydziak,D.M.,Demain,A.L.,和Tannenbaum,S.R.,(1977)Biochim.Biophys.Acta.497:525-538.;Ogrydziak,D.M.和Scharf,S.J.,(1982)Gen.Microbiol.128:1225-1234.)。用于在酵母(例如耶氏酵母)中表达基因的另一种启动子,描述于WO1997/044470中。然而,迄今为止使用的启动子无法完全满足在耶氏酵母中进行高表达的需求。因此需要提供更好地满足这些需求的启动子。因此,本发明的目的是提供新的改进的酵母启动子,尤其用于在酵母中克隆表达,而且用于在选择的表达系统中异源表达上述合意的精细化学品。发明概述本发明涉及一种重组核酸分子,其包含:a)与SEQIDNO:1(在此称为HSP)或SEQIDNO:2(在此称为HYP)的多核苷酸序列具有至少90%同一性的多核苷酸序列,或b)在严格条件下与核酸序列SEQIDNO:1或SEQIDNO:2杂交的核酸序列,或c)a)或b)的序列的功能上等同的片段。在一个方面,本发明涉及一种重组核酸分子,其包含与SEQIDNO:1或SEQIDNO:2的多核苷酸序列具有至少95%序列同一性的多核苷酸序列。在本发明的一个具体方面,所述重组核酸分子作为启动子发挥功能。所述重组核酸分子用于在酵母中调控基因的表达。在一个实施方案中,所述酵母是耶氏酵母属的生物。在一个实施方案中,所述酵母是解脂耶氏酵母的菌株。在另一个实施方案中,所述被调控的基因对于耶氏酵母属的生物体是异源的。在一个实施方案中,所述重组核酸分子与编码蛋白的基因是功能上相连的(functionallylinked)。在一个实施方案中,所述基因与一个或多个其他调控信号是功能上相连的。在一个具体实施方案中,所述功能上相连的基因选自编码蛋白的核酸的组,所述蛋白来自:a)有机酸的生物合成途径,或b)脂质和脂肪酸的生物合成途径,或c)二醇的生物合成途径,或d)芳香族化合物的生物合成途径,或e)维生素的生物合成途径,或f)类胡萝卜素,特别是酮式类胡萝卜素的生物合成途径。在一个实施方案中,本发明所述的重组核酸分子是载体。本发明还涉及经遗传修饰的微生物,其包含上述的重组核酸分子。在一个实施方案中,所述微生物是耶氏酵母属的成员。在另一个实施方案中,上述的重组核酸分子用于在宿主微生物中表达一个或多个基因,其中至少一个或多个基因的表达速率(expressionrate)与野生型相比是提高的。在一个具体实施方案中,所述基因在宿主微生物中的表达调控通过如下实现:a)将一个或多个上述重组核酸分子引入宿主微生物的基因组中,从而使宿主微生物一个或多个内源基因的表达在引入的重组核酸分子控制下发生;b)将一个或多个基因引入所述微生物的基因组中,从而使所述一个或多个引入的基因的表达在上述重组核酸分子控制下发生,所述重组核酸分子对于宿主微生物是内源的;或c)将一个或多个核酸构建体引入宿主微生物中,其中所述一个或多个核酸构建体包含至少一个上述重组核酸分子,且所述重组核酸分子与一个或多个要表达的基因是功能上相连的。本发明还涉及生产生物合成产物的方法,包括如下步骤:a)在培养基中培养耶氏酵母属的经遗传修饰的微生物,其中所述经遗传修饰的微生物包含上述的重组核酸分子,其中所述重组核酸分子与编码蛋白的基因是功能上相连的;及b)生产步骤a)中制成的生物合成产物。在一些实施方案中,所述生物合成产物分泌至培养基中。在一些实施方案中,所述生物合成产物在微生 物中积累。在一些实施方案中,将所述生物合成产物从分离的微生物生物质回收。在一些实施方案中,所述生物合成产物是类胡萝卜素。附图简述图1和图2分别显示了摇瓶实验中测试的两个启动子的平均玉米黄素和虾青素水平,以HPLC峰面积表示(对于玉米黄素:10个具有HSP启动子的转化体取平均值,以及5个具有HYP启动子的转化体取平均值。对于虾青素生产:12个具有HSP启动子的转化体取平均值,以及12个具有HYP启动子的转化体取平均值)。图3显示了在发酵罐中测试的来自两个启动子的crtZ表达的水平。在分析的不同发酵时间点处(y轴)的所述水平以产生的虾青素的量来描绘,以HPLC峰面积表示。图4显示了相比于强组成型表达的内源基因,发酵罐中表达的crtZmRNA的水平。图5显示了由携带lacZ基因的6个不同转化体分别在HSP和HYP启动子控制下产生的β-半乳糖苷酶单位。序列表所附的序列表中列出的核酸序列以37C.F.R.§1.822中定义的核苷酸碱基的标准字母缩写表示。每个核酸序列仅显示一条链,但通过对所展示的链的任意提述,视为已包括了其互补链。在所附的序列表中:SEQIDNO:1显示了来自解脂耶氏酵母的HSP启动子:SEQIDNO:2显示了来自解脂耶氏酵母的HYP启动子:发明详述本发明涉及新的重组核酸分子,其为启动子。本发明的启动子是指导相关编码区(基因)转录的DNA区。根据本发明,所述重组核酸分子包含a)与SEQIDNO:1或SEQIDNO:2的多核苷酸序列具有至少90%同一性的多核苷酸序列,或b)在严格条件下与 核酸序列SEQIDNO:1或SEQIDNO:2杂交的核酸序列,或c)a)或b)的序列的功能上等同的片段。尤其优选的重组核酸分子与SEQIDNO:1或2各自的核酸序列具有至少70%,优选至少80%,至少85%,至少90%,至少92%,至少95%,至少96%,至少97%,至少98%,尤其优选至少99%的同一性。可以在SEQIDNO:1或SEQIDNO:2的核酸序列的至少100,至少200,至少300,至少400,至少500,至少800个核苷酸,或其完整序列找到百分比同一性。在一些实施方案中,上述SEQIDNO:1或SEQIDNO:2的同源物(homologue)通过核苷酸取代、插入或缺失而源自SEQIDNO:1或SEQIDNO:2的多核苷酸序列。本发明还涉及包含核酸序列的重组核酸分子,所述核酸序列在严格条件下与SEQIDNO:1或SEQIDNO:2的核酸序列杂交。在一个方面,本发明涉及如SEQIDNO:1或SEQIDNO:2所示的重组核酸分子,或在严格条件下与核酸序列SEQIDNO:1或SEQIDNO:2杂交的核酸序列,或上述序列的功能上等同的片段,其中重组核酸分子作为启动子发挥功能。核酸序列SEQIDNO:1和SEQIDNO:2各代表克隆自解脂耶氏酵母的启动子序列。在一些实施方案中,启动子能用于在酵母中调控基因的表达,所述酵母包括但不限于耶氏酵母。在一个具体实施方案中,所述启动子能用于在解脂耶氏酵母的菌株中调控基因的表达。本发明的启动子能至少在酵母中具有启动子活性,并且包括全长启动子序列及其功能片段,融合序列,以及天然存在的启动子的同源物。可以用限制性内切酶来消化本发明的核酸分子,然后进行适当的测定法以确定启动子活性所需的最小序列。此类片段自身各自代表本发明的实施方案。启动子的同源物与天然存在的启动子区别在于已缺失、插入、倒位、取代和/或衍生化(derivatized)至少1、2、3个或几个核苷酸。启动子的同源物(至少在酵母中)能够保留作为启动子的活性,尽管其活性可为提高的、降低的,或依赖某种刺激物而存在的。本发明的启动子可以包含赋予发育表达控制和调节表达控制的一个或多个序列元件。已发现,两个新的启动子(HSP和HYP启动子,分别如SEQIDNO:1和SEQIDNO:2所示)及其同源物特别适于在酵母中(特别是在耶氏酵母中)使 靶基因的表达增强至相对高的水平。靶基因的例子包括生产类胡萝卜素或其他类异戊二烯化合物(isoprenoids)的途径中所涉及的基因。在一些实施方案中,HSP和HYP启动子包括其同源物能够引起相对高浓度的类胡萝卜素积累。在优选的实施方案中,本发明提供两个克隆的酵母启动子(分别为HSP和HYP启动子)。克隆的酵母启动子意指通过遗传工程中使用的标准克隆步骤克隆的酵母启动子,从而将DNA区段从其天然位置重置至不同的位点,其会在该位点处复制。克隆过程涉及想要的DNA区段的切除和分离,将DNA片断插入至载体分子中,以及将重组载体整合至细胞中,在此DNA区段的多个拷贝或克隆会得到复制。可以从解脂耶氏酵母菌株分离本发明的酵母启动子DNA序列。或者,可以基于SEQIDNO:1或SEQIDNO:2中所示DNA序列所表示的DNA序列来构建本发明的启动子序列。酵母启动子意指结构基因的5’端处的核苷酸序列,其指导转录的起始。启动子序列用于驱动下游基因的表达。启动子通过提供RNA聚合酶及其他起始和激活因子的结合位点来驱动转录。通常,启动子优选地向下游方向驱动转录。转录水平由启动子调控。因此,在构建异源启动子/结构基因组合时,将结构基因置于启动子的调节控制之下,使得基因的表达受到启动子序列的控制。优选地,将启动子置于结构基因的上游并且距离转录起始位点一定距离处,所述距离近似于该启动子与其控制的基因在天然设置中的距离。如本领域已知的,可以容许此距离的一些变化而不损失启动子功能。例如,启动子的转录效率可以通过直接测量(例如通过Northern印迹或引物延伸测量)来自该启动子的mRNA转录的量来确定,或是通过测量从该启动子表达的基因产物来间接地确定。根据本发明的方法,“转录”意指根据该方法从DNA模板开始产生互补的RNA分子。该过程中涉及蛋白如RNA聚合酶,所谓的σ因子和转录调节子蛋白。然后,合成的RNA在翻译过程中充当模板,而翻译过程产生生物合成的活性蛋白。“功能上连接”意指在这种连结中,例如本发明的启动子之一和要表达的核酸序列(以及如果适当的话其他调控元件(例如终止子))以这样的方式顺序安排(sequentialarrangement)使得每一个调控元件能够在该核酸序列的表 达中达成其功能。化学意义上的直接连接对此并不是绝对必要的。遗传控制序列例如增强子序列还能在更远的位置或者甚至从其他DNA分子对靶序列行使其功能。这样的排列是优选的,在该排列中要表达的核酸序列或要表达的基因被置于本发明的启动子序列之后(即在3’端),从而使两个序列共价连接在一起。启动子序列与要表达的核酸序列之间的距离可以是例如少于200个碱基对,少于100个碱基对,或少于50个碱基对。“表达活性”或“表达速率”意指在设定的一段时间过程中产生的蛋白的量。在本发明中,所述蛋白由基因编码,所述基因与HSP启动子或HYP启动子是功能上相连的。“引发的表达活性”或“引发的表达速率”意指当蛋白是由引发而产生的时,在设定的一段时间过程中产生的该蛋白的量。在本发明中,当编码所述蛋白的基因与与HSP启动子或HYP启动子是功能上相连的时,则该蛋白是由引发而产生的,当这些启动子与所述基因在功能上不相连时,则该蛋白不以显著量产生。生物合成的活性蛋白/酶产生的形成速率是转录速率和翻译速率的乘积(product)。根据本发明可能影响两种速率,并且因此影响微生物中产物的形成速率。根据本发明,“异源的”基因表达意指启动子及与其功能上相连的基因在野生型生物中并非天然地以此排列存在。因此,异源性基因表达包括这样的情形,其中启动子、或要表达的基因、或两种组件都不在对应的生物的野生型中天然存在;或者其中启动子和要表达的基因二者均在野生型生物中天然存在但处于遥远的染色体位置上,从而在野生型生物中不存在功能上的连接。根据本发明,术语“野生型”或“野生型生物”意指对应的初始生物(initialorganism)。依赖于上下文,术语“生物”可以指初始生物(野生型)或本发明经遗传修饰的生物,例如耶氏酵母属的生物。术语“取代”意指一个或多个核苷酸对一个或多个核苷酸的交换。“缺失”是通过直接连接来代替核苷酸。插入是将核苷酸引入至核酸序列中,其中用一个或多个核苷酸正式代替直接连接。两个核酸之间的同一性意指在各个情况下跨越核酸全长的核苷酸的同一性,尤其是使用设置如下参数的Clustal方法(HigginsDG,SharpPM.,(1998) Fastandsensitivemultiplesequencealignmentsonamicrocomputer.ComputAppl.Biosci.5(2):151-1),借助来自Informax(USA)的VectorNTISuite7.1软件通过比较计算出的同一性:多重比对参数:逐对比对参数:例如,与序列SEQIDNO:1或2具有至少70%同一性的核酸序列相应地意指这样的核酸序列,其序列与序列SEQIDNO:1或2相比(尤其是根据上述程序算法设定上述参数来比较)显示出至少70%同一性。“杂交”意指多核苷酸或寡核苷酸在严格条件下与大体互补的序列结合的能力,而在这些条件下不发生与非互补对象之间的非特异性结合。对此,所述序列优选为90-100%互补的。将能够互相特异性结合的互补序列的特性应用于例如Northern或Southern印迹技术中,或是PCR或RT-PCR的引物结合中。根据本发明,杂交在严格条件下发生。此类杂交条件描述于例如Sambrook,J.,Fritsch,E.F.,Maniatis,T.,in:MolecularCloning(ALaboratoryManual),第2版,ColdSpringHarborLaboratoryPress,1989,第9.31-9.57页中,或描述于CurrentProtocolsinMolecularBiology,JohnWiley&Sons,N.Y.(1989),6.3.1-6.3.6中。严格杂交条件意指具体为:在溶液中42℃过夜温育,所述溶液由50%甲 酰胺、5XSSC(750mMNaCl,75mM柠檬酸三钠)、50mM磷酸钠(pH7.6)、5X登哈特溶液(Denhardt'ssolution)、10%右旋糖酐硫酸酯和20g/ml变性的、剪切的(sheared)鲑鱼精子DNA组成,然后用0.1XSSC在65℃洗涤滤器。“功能上等同的片段”意指对于启动子而言,具有作为起始序列的基本上相同的启动子活性的片段。“片段”意指本申请所述启动子的部分的序列。尤为优选的是,使用核酸序列SEQIDNO:1或SEQIDNO:2作为启动子,用于在耶氏酵母属的生物中表达基因。所有前述的启动子都可以进一步以自身已知的方式(inamannerknownperse)从核苷酸构建模块(buildingblock)通过化学合成来产生,例如通过对双螺旋的互补核酸构建模块、个体重叠的片段压缩来进行。寡核苷酸的化学合成可以按已知方式,通过亚磷酰胺(phosphoamidite)方法(Voet,Voet,(1995)Biochemistry,第2版,WileyPressNewYork,pp.896-897)来进行。用DNA聚合酶的Klenow片段及连接反应来添加合成的寡核苷酸及填补缺口,以及通用的克隆方法描述于Sambrook等(1989)Molecularcloning:Alaboratorymanual,ColdSpringHarborLaboratoryPress中。用本发明的启动子,原则上可以在耶氏酵母属的生物中表达任何基因。这些要在耶氏酵母属的生物中表达的基因下文也称为“效果基因”。优选的效果基因是来自生物合成产物的生物合成途径的基因,所述生物合成产物可以在耶氏酵母属的生物中产生,即在野生型中或经遗传改造的野生型中产生。优选的生物合成产物是精细化学品。术语“精细化学品”是本领域所知的,并且包括由生物产生的并用于多种工业分支(例如但不限于制药业、农业、化妆品业、食品及饲料业)的化合物。这些化合物包括有机酸(例如酒石酸、衣康酸、和二氨基庚二酸),脂质,饱和及不饱和脂肪酸(例如花生四烯酸),二醇(例如丙二醇和丁二醇),芳香族化合物(例如芳香胺、香草醛和靛蓝(indigo)),类胡萝卜素和维生素及辅因子。高等动物已经失去了合成维生素、类胡萝卜素、辅因子和营养制品(nutraceuticals)的能力,因此需要摄入它们,尽管其他生物如细菌可容易地合成它们。这些分子或是生物活性分子本身,或是生物活性物质的前体,其充当许多代谢途径中的中间产物或电子载体。这些化合物除了自身营养价值外 还作为着色剂、抗氧化剂和催化剂或其他加工助剂而具有重大的工业价值。术语“维生素”是本领域已知的,并且包括生物正常行使功能所需但该生物自身不能合成的营养物。维生素的组可以包括辅因子和营养制品化合物。术语“辅因子”包括正常酶活性发生所需的非蛋白化合物。这些化合物可以是有机的或无机的;本发明的辅因子优选为有机的。术语“营养制品”包括促进生物和动物(尤其是人)中健康的食品添加剂。此类分子的例子是维生素、抗氧化剂以及某些脂质(例如多不饱和脂肪酸)。优选的能够在耶氏酵母属的生物中生产的精细化学品或生物合成产物是类胡萝卜素,例如八氢番茄红素、番茄红素、β-胡萝卜素、叶黄素、玉米黄素、虾青素、角黄素、海胆酮、3-羟基海胆酮、3’-羟基海胆酮、金盏花红素、堇黄素(violaxanthin)和金盏花黄素。优选的类胡萝卜素是酮式类胡萝卜素,例如虾青素、角黄素、海胆酮、3-羟基海胆酮、3’-羟基海胆酮、金盏花红素和金盏花黄素。因此,用本发明的启动子在酵母中表达的优选的基因选自编码蛋白的核酸的组,所述蛋白来自:a)有机酸的生物合成途径,b)脂质和脂肪酸的生物合成途径,c)二醇的生物合成途径,d)芳香族化合物的生物合成途径,e)维生素的生物合成途径,或f)类胡萝卜素,特别是酮式类胡萝卜素的生物合成途径。因此,用本发明的启动子在耶氏酵母属生物中表达的优选的基因是编码来自类胡萝卜素生物合成途径的蛋白的基因。优选的基因选自下组:编码酮酶的核酸、编码[β]-羟化酶的核酸、编码[β]-环化酶的核酸、编码[ε]-环化酶的核酸、编码玉米黄素环氧酶的核酸、编码花药黄质(antheraxanthin)环氧酶的核酸、编码新黄素合酶的核酸、编码HMG-CoA还原酶的核酸、编码(E)-4-羟基-3-甲基丁-2-烯基-二磷酸还原酶的核酸、编码1-脱氧-D-木糖-5-磷酸合酶的核酸、编码1-脱氧-D-木糖-5-磷酸还原异构酶(reductoisomerase)的核酸、编码异戊烯基-二磷酸[δ]-异构酶的核酸、编码香叶基-二磷酸合酶的核酸、编码法呢基-二磷酸合酶的核酸、编码香叶基-香叶基-二磷酸合酶的核酸、编码八氢番茄红素合酶的核酸、编码八氢番茄红素去饱和酶的核酸、编码前八氢番茄红素(prephytoene)合酶的核酸、编码ζ-胡萝卜素去饱和酶的核酸、编码crtISO蛋白的核酸、编码4-二磷酸胞苷-2-C-甲基-D-赤藓醇合酶的核酸、编码4-二磷酸胞苷-2-C-甲基-D-赤藓醇激酶 的核酸、编码2-甲基-D-赤藓醇-2,4-环二磷酸合酶的核酸、和编码羟基甲基丁烯基-二磷酸合酶的核酸。酮酶意指具有在类胡萝卜素的任选取代的[β]-紫罗兰酮环上引入酮基的酶活性的蛋白。具体而言,酮酶意指具有将[β]-胡萝卜素转变为角黄素的酶活性的蛋白。编码酮酶的核酸及其对应的酮酶的例子为例如来自雨生红球藻(Haematococcuspluvialis)、尤其是来自雨生红球藻雨生红球藻、橙黄土壤杆菌(Agrobacteriumaurantiacum)、产碱菌属(Alicaligenes)、马氏副球菌(Paracoccusmarcusii)、集胞藻属(Synechocystis)、慢生根瘤菌属(Bradyrhizobium)、雨生红球藻、副球菌属、橙色短波单胞菌(Brevundimonasaurantiaca)、泡沫节球藻(Nodulariaspumigena)的序列。[β]-环化酶意指具有将末端线性番茄红素残基转变为[β]-紫罗兰酮环的酶活性的蛋白。具体而言,[β]-环化酶意指具有将[γ]-胡萝卜素转变为[β]-胡萝卜素的酶活性的蛋白。[β]-环化酶基因的例子是编码如下登录号的[β]-环化酶的核酸:S66350番茄红素β-环化酶,CAA60119番茄红素合酶,AAG10429β环化酶[Yarrowiaerecta(直立耶氏酵母)],AAA81880番茄红素环化酶,AAB53337番茄红素β环化酶,AAL92175β-番茄红素环化酶[橙色宫灯百合(Sandersoniaaurantiaca)],CAA67331番茄红素环化酶[洋水仙(Narcissuspseudonarcissus)],AAM45381β环化酶[Yarrowiaerecta(直立耶氏酵母)],AAL01999番茄红素环化酶[黄色杆菌属菌种Py2(Xanthobactersp.Py2)],ZP_000190假设蛋白[橙色绿屈挠菌(Chloroflexusaurantiacus)],AAF78200番茄红素环化酶[慢生根瘤菌属菌种ORS278(Bradyrhizobiumsp.ORS278)],BAB79602crtY[成团泛菌鸡血藤致病变种(Pantoeaagglomeranspv.milletiae)],CAA64855番茄红素环化酶[灰色链霉菌(Streptomycesgriseus)],AAA21262番茄红素(dycopene)环化酶[成团泛菌(Pantoeaagglomerans)],C37802crtY蛋白–噬夏孢欧文氏菌(Erwiniauredovora),BAB79602crtY[成团泛菌鸡血藤致病变种],AAA64980番茄红素环化酶[成团泛菌],AAC44851番茄红素环化酶,BAA09593番茄红素环化酶[副球菌属菌种MBIC1143],CAB56061番茄红素β-环化酶[马氏副球菌],BAA20275番茄红素环化酶[长赤杆菌(Erythrobacterlongus)],AAK07430番茄红素β-环化酶[巴勒斯坦侧金盏花(Adonispalaestina)],CAA67331番茄红素环化酶[洋水仙],AAB53337番茄红素β环化酶,BAC77673番茄红素β-单环化酶[海洋细菌 P99-3]。羟化酶意指具有将羟基引入至类胡萝卜素的任选取代的[β]-紫罗兰酮环上的酶活性的蛋白。具体而言,羟化酶意指具有将[β]-胡萝卜素转变为玉米黄素或将角黄素转变为虾青素的酶活性的蛋白。羟化酶基因的例子是:编码来自雨生红球藻,登录号AX038729WO0061764)的羟化酶;以及如下登录号的羟化酶的核酸:CAA70427.1,CAA70888.1,CAB55625.1,AF499108-1,AF315289-1,AF296158-1,AAC49443.1,NP-194300.1,NP-200070.1,AAG10430.1,CAC06712.1,AAM88619.1,CAC95130.11AAL80006.1,AF162276-1,AA053295.1,MN85601.1,CRTZ_ERWHE,CRTZ_PANAN,BAB79605.1,CRTZ_ALCSP,CRTZ_AGRAU,CAB56060.1,ZP-00094836.1,AAC44852.1,BAC77670.1,NP-745389.1,NP-344225.1,NP-849490.1ZP-00087019.1,NP-503072.1,NP-852012.1,NP-115929.1,ZP-00013255.1。HMG-CoA还原酶意指具有将3-羟基-3-甲基戊二酰基-辅酶A转变为甲羟戊酸的酶活性的蛋白。(E)-4-羟基-3-甲基丁-2-烯基-二磷酸还原酶意指具有将(E)-4-羟基-3-甲基丁-2-烯基-二磷酸转变为异戊烯基二磷酸和二甲基烯丙基二磷酸的酶活性的蛋白。1-脱氧-D-木糖-5-磷酸合酶意指具有将羟基乙基-ThPP和甘油醛-3-磷酸转变为1-脱氧-D-木糖-5-磷酸的酶活性的蛋白。1-脱氧-D-木糖-5-磷酸还原异构酶意指具有将1-脱氧-D-木糖-5-磷酸转变为2-C-甲基-D-赤藓醇-4-磷酸的酶活性的蛋白。异戊烯基-二磷酸[δ]-异构酶意指具有将异戊烯基-二磷酸转变为二甲基烯丙基二磷酸的酶活性的蛋白。香叶基-二磷酸合酶意指具有将异戊烯基二磷酸和二甲基烯丙基二磷酸转变为香叶基-二磷酸的酶活性的蛋白。法呢基-二磷酸合酶意指具有连续地转变2分子的异戊烯基二磷酸及二甲基烯丙基二磷酸并将所得的香叶基-二磷酸转变为法呢基-二磷酸的酶活性的蛋白。香叶基-香叶基-二磷酸合酶意指具有将法呢基-二磷酸转变为香叶基-香叶基-二磷酸的酶活性的蛋白。八氢番茄红素合酶意指具有将香叶基-香叶基-二磷酸转变为八氢番茄红 素的酶活性的蛋白。八氢番茄红素去饱和酶意指具有将八氢番茄红素转变为六氢番茄红素(phytofluene)和/或将六氢番茄红素转变为4-胡萝卜素(ζ-胡萝卜素)的酶活性的蛋白。ζ-胡萝卜素去饱和酶意指具有将[ζ]-胡萝卜素转变为链孢红素(neurosporin)和/或将链孢红素转变为番茄红素的酶活性的蛋白。crtISO蛋白意指具有将7,9,7',9'-四-顺式-番茄红素转变为全反式番茄红素的酶活性的蛋白。HMG-CoA还原酶基因的例子是:编码来自拟南芥(Arabidopsisthaliana)的HMG-CoA还原酶的核酸,其登录号为NM-106299;以及进一步来自其他生物的具有如下登录号的HMG-CoA还原酶基因:P54961,P54870,P54868,P54869,O02734,P22791,P54873,P54871,P23228,P13704,P54872,Q01581,P17425,P54874,P54839,P14891,P34135,O64966,P29057,P48019,P48020,P12683,P43256,Q9XEL8,P34136,O64967,P29058,P48022,Q41437,P12684,Q00583,Q9XHL5,Q41438,Q9YAS4,O76819,O28538,Q9Y7D2,P54960,051628,P48021,Q03163,P00347,P14773,Q12577,Q59468,P04035,O24594,P09610,Q58116,O26662,Q01237,O01559,Q12649,O74164,O59469,P51639,O10283,O08424,P20715,P13703,P13702,Q96UG4,Q8SQZ9,O15888,Q9TUM4,P93514,Q39628,P93081,P93080,Q944T9,Q40148,Q84MM0,Q84LS3,Q9Z9N4,Q9KLM0。(E)-4-羟基-3-甲基丁-2-烯基-二磷酸还原酶基因的例子是:编码来自拟南芥(lytB/ISPH)的(E)-4-羟基-3-甲基丁-2-烯基-二磷酸还原酶的核酸;以及进一步来自其他生物的具有如下登录号的(E)-4-羟基-3-甲基丁-2-烯基-二磷酸还原酶基因:T04781,AF270978-1,NP-485028.1,NP-442089.1,NP-681832.1,ZP-00110421.1,ZP-00071594.1,ZP-00114706.1,ISPH_SYNY3,ZP-00114087.1,ZP-00104269.1,AF398145-1,AF398146-1,AAD55762.1,AF514843-1,NP-622970.1,NP-348471.1,NP-562001.1,NP-223698.1,NP-781941.1,ZP-00080042.1,NP-859669.1,NP-214191.1,ZP-00086191.1,ISPH_VIBCH,NP-230334.1,NP-742768.1,NP-302306.1,ISPH_MYCLE,NP-602581.1,ZP-00026966.1,NP-520563.1,NP-253247.1,NP-282047.1,ZP-00038210.1,ZP-00064913.1,CAA61555.1,ZP-00125365.1,ISPH_ACICA,EAA24703.1, ZP-00013067.1,ZP-00029164.1,NP-790656.1,NP-217899.1,NP-641592.1,NP-636532.1,NP-719076.1,NP-660497.1,NP-422155.1,NP-715446.1,ZP-00090692.1,NP-759496.1,ISPH_BURPS,ZP-00129657.1,NP-215626.1,NP-335584.1,ZP-00135016.1,NP-789585.1,NP-787770.1,NP-769647.1,ZP-00043336.1,NP-242248.1,ZP-00008555.1,NP-246603.1,ZP-00030951.1,NP-670994.1,NP-404120.1,NP-540376.1,NP-733653.1,NP-697503.1,NP-840730.1,NP-274828.1,NP-796916.1,ZP-00123390.1,NP-824386.1,NP-737689.1,ZP-00021222.1,NP-757521.1,NP-390395.1,ZP-00133322.1,CAD76178.15NP-600249.1,NP-454660.1,NP-712601.1,NP-385018.1,NP-751989.1。1-脱氧-D-木糖-5-磷酸合酶基因的例子是:编码来自番茄(Lycopersiconesculentum)的1-脱氧-D-木糖-5-磷酸合酶的核酸,以及进一步来自其他生物的具有如下登录号的1-脱氧-D-木糖-5-磷酸合酶基因:AF143812-1,DXS_CAPAN,CAD22530.1,AF182286-1,NP-193291.1,T52289,AAC49368.1,AAP14353.1,D71420,DXS_ORYSA,AF443590-1,BAB02345.1,CAA09804.2,NP-850620.1,CAD22155.2,AAM65798.1,NP-566686.1;CAD22531.1,AAC33513.1,CAC08458.1,AAG10432.1,T08140,AAP14354.1,AF428463-1,ZP-00010537.1,NP-769291.1,AAK59424,1,NP-107784.1,NP-697464.1,NP-540415.1,NP-196699.1,NP-384986.1,ZP-00096461.1,ZP-00013656.1,NP-353769.1,BAA83576.1,ZP-00005919.1,ZP-00006273.1,NP-420871.1,AAM48660.1,DXS_RHOCA,ZP-00045608.1,ZP-00031686.1,NP-841218.1,ZP-00022174.1,ZP-00086851.1,NP-742690.1,NP-520342.1,ZP-00082120.1,NP-790545.1,ZP-00125266.1,CAC17468.1,NP-252733.1,ZP-00092466.1,NP-439591.1,NP-414954.1,NP-752465.1,NP-622918.1,NP-286162.1,NP-836085.1,NP-706308.1,ZP-00081148.1,NP-797065.1,NP-213598.1,NP-245469.1,ZP-00075029.1,NP-455016.1,NP-230536.1,NP-459417.1,NP-274863.1,NP-283402.1,NP-759318,1,NP-406652.1,DXS_SYNLE,DXS_SYNP7,NP-440409.1,ZP-00067331.1,ZP-00122853.17NP-717142.1,ZP-00104889.1,NP-243645.1,NP-681412.1,DXSSYNEL,NP-637787.1,DXS-CHLTE,ZP-00129863.1,NP-661241.1,DXS_XANCP,NP-470738.1,NP-484643.1,ZP-00108360.1,NP-833890.1,NP-846629.1,NP-658213.1, NP-642879.1,ZP-00039479.1,ZP-00060584.1,ZP-00041364.1,ZP-00117779.1,NP-299528.1。1-脱氧-D-木糖-5-磷酸还原异构酶基因的例子是:编码来自拟南芥的1-脱氧-D-木糖-5-磷酸还原异构酶的核酸,以及进一步来自其他生物的具有如下登录号的1-脱氧-D-木糖-5-磷酸还原异构酶基因:AF148852,AY084775,AY054682,AY050802,AY045634,AY081453,AY091405,AY098952,AJ242588,AB009053,AY202991,NP-201085.1,T52570,AF331705-1,BAB16915.1,AF367205-1,AF250235-1,CAC03581.1,CAD22156.1,AF182287-1,DXR_MENPI,ZP-00071219.1,NP-488391.1,ZP-00111307.1,DXR_SYNLE,AAP56260.1,NP-681831.1,NP-442113.1,ZP-00115071.1,ZP-00105106.1,ZP-00113484.1,NP-833540.1,NP-657789.1,NP-661031.1,DXR-BACHD,NP-833080.1,NP-845693.1,NP-562610.1,NP-623020.1,NP-810915.1,NP-243287.1,ZP-00118743.1,NP-464842.1,NP-470690.1,ZP-00082201.1,NP-781898.1,ZP-00123667.1,NP-348420.1,NP-604221.1,ZP-00053349.1,ZP-00064941.1,NP-246927.1,NP-389537.1,ZP-00102576.15NP-519531.1,AF124757-19,DXR_ZYMMO,NP-713472.1,NP-459225.1,NP-454827.1,ZP-00045738.1,NP-743754.1,DXR_PSEPK,ZP-00130352.1,NP-702530.1,NP-8417441,NP-438967.1,AF514841-1,NP-706118.1,ZP-00125845.1,NP-404661.1,NP-285867.1,NP-240064.1,NP-414715.1,ZP-00094058.1,NP-791365.1,ZP-00012448.1,ZP-00015132.1,ZP-00091545.1,NP-629822.1,NP-771495.1,NP-798691.1,NP-231885.1,NP-252340.1,ZP-00022353.1,NP-355549.1,NP-420724.1.,ZP-00085169.1,EAA17616.1,NP-273242.1,NP-219574.1NP-387094.1,NP-296721.1,ZP-00004209.1,NP-823739.1,NP-282934.1,BAA77848.1,NP-660577.1,NP-760741.1,NP-641750.1,NP-636741.1,NP-829309.1,NP-298338.1,NP-444964.1,NP-717246.1,NP-224545.1,ZP-00038451.1,DXR_KITGR,NP-778563.1。异戊烯基-二磷酸[δ]-异构酶基因的例子是:编码来自巴勒斯坦侧金盏花的异戊烯基-二磷酸[δ]-异构酶的核酸,以及进一步来自其他生物的具有如下登录号的异戊烯基-二磷酸[δ]-异构酶基因:Q38929,O48964,Q39472,Q13907,O35586,P58044,O42641,O35760,Q10132,P15496,Q9YB30,Q8YNH4,Q42553,O27997,P50740,O51627,O48965,Q8KFR5,Q39471,Q39664, Q9RVE2,Q01335,Q9HHE4,Q9BXS1,Q9KWF6,Q9CIF5,Q88WB6,Q92BX2,Q8Y7A5,Q8TT35Q9KK75,Q8NN99,Q8XD58,Q7FE75,Q46822,Q9HP40,P72002,P26173,Q9Z5D3,Q8Z3X9,Q8ZM82,Q9X7Q6,O13504,Q9HFW8,Q8NJL9,Q9UUQ1,Q9NH02,Q9M6K9,Q9M6K5,Q9FXR6,O081691,Q9S7C4,Q8S3L8,Q9M592,Q9M6K3,Q9M6K7,Q9FV48,Q9LLB6,Q9AVJ1,Q9AVG8,Q9M6K6,Q9AVJ5,Q9M6K2,Q9AYS5,Q9M6K8,Q9AVG7,Q8S3L7,Q8W250,Q94IE1,Q9AVI8,Q9AYS6,Q9SAY0,Q9M6K4,Q8GVZ0,Q84RZ8,Q8KZ12,Q8KZ66,Q8FND7,Q88QC9,Q8BFZ6,BAC26382,CAD94476。香叶基-二磷酸合酶基因的例子是:编码来自拟南芥的香叶基-二磷酸合酶的核酸,以及进一步来自其他生物的具有如下登录号的香叶基-二磷酸合酶基因:Q9FT89,Q8LKJ2,Q9FSW8,Q8LKJ3,Q9SBR3,Q9SBR4,Q9FET8,Q7LKJ1,Q84LG1,Q9JK86。法呢基-二磷酸合酶基因的例子是:编码来自拟南芥的法呢基-二磷酸合酶的核酸,以及进一步来自其他生物的具有如下登录号的法呢基-二磷酸合酶基因:P53799,P37268,Q02769,Q09152,P49351,O24241,Q43315,P49352,O24242,P49350,P08836,P14324,P49349,P08524,O66952,Q082911P54383,Q45220,P57537,Q8K9A0,P22939,P45204,O66126,P55539,Q9SWH9,Q9AVI7,Q9FRX2,Q9AYS7,Q94IE8,Q9FXR9,Q9ZWF6,Q9FXR8,Q9AR37,O50009,Q94IE9,Q8RVK7,Q8RVQ7,O04882,Q93RA8,Q93RB0,Q93KB4,Q93RB5,Q93RB3,O93RB1,Q93RB2,Q920E5。香叶基-香叶基-二磷酸合酶基因的例子是:编码来自白芥(Sinapisalba)的香叶基-香叶基-二磷酸合酶的核酸,以及进一步来自其他生物的香叶基-香叶基-二磷酸合酶基因。八氢番茄红素合酶基因的例子是:编码来自噬夏孢欧文氏菌的八氢番茄红素合酶的核酸,以及进一步来自其他生物的八氢番茄红素合酶基因。八氢番茄红素去饱和酶基因的例子是:编码来自噬夏孢欧文氏菌的八氢番茄红素去饱和酶的核酸,以及进一步来自其他生物的八氢番茄红素去饱和酶基因。ζ-胡萝卜素去饱和酶基因的例子是:编码来自洋水仙的ζ-胡萝卜素去饱和酶的核酸,以及进一步来自其他生物的ζ-胡萝卜素去饱和酶基因。crtISO基因的例子是:编码来自番茄的crtISO的核酸,以及进一步来自其他生物的crtISO基因。本发明还涉及经遗传修饰的耶氏酵母属微生物,其中所述遗传修饰导致与野生型相比提高的表达速率或引起至少一个基因的表达,并且所述表达是由本发明所述启动子引起的。在本发明的经遗传修饰的耶氏酵母属生物的一个优选实施方案中,本发明的启动子在所述生物体中对所述基因的表达调控是通过如下实现的:a)将一个或多个上述重组核酸分子引入所述微生物的基因组中,使得所述微生物一个或多个内源基因的表达在引入的重组核酸分子控制下发生;b)将一个或多个基因引入所述微生物的基因组中,使得一个或多个引入的基因的表达在上述重组核酸分子控制下发生,所述重组核酸分子对于宿主微生物是内源的;或c)将一个或多个核酸构建体引入所述微生物中,其中所述一个或多个核酸构建体包含至少一个上述重组核酸分子,且此一个或多个重组核酸分子与一个或多个要表达的基因是功能上相连的。在一个实施方案中,可以在染色体内或染色体外将所述核酸构建体整合入根据特征c)的耶氏酵母属的微生物中。本发明的优选的启动子和优选的要表达的基因(效果基因)如上所述。具有效果基因的提高的或引发的表达速率的经遗传修饰的耶氏酵母属的微生物的生产在下文通过例示方式进行描述。在遗传修饰组合的情况下,可以进行单一转化或通过多个构建体转化。优选通过用核酸构建体转化初始生物来产生转基因生物,所述核酸构建体包含上述本发明的启动子的至少一个,其与要表达的效果基因是功能上相连的,若适当的话,其还与进一步的调控信号是功能上相连的。核酸构建体(其中本发明的启动子和效果基因是功能上相连的)在下文也称为表达盒。表达盒可以包含进一步的调控信号,其是控制效果基因在宿主细胞中表达的调控核酸序列。在一个优选实施方案中,表达盒在编码序列的上游(即其5’端)包含本发明的至少一个启动子,和多聚腺苷酸化信号,并且如果适当的话,还在下游(即在3’端)包含进一步的调控元件,所述调控元件可操作地连接至位于其间的(lyinginbetween)对于上述基因的至少一个的效果基因的 编码序列。可操作连接意指启动子,编码基因,终止子,适当的话以及进一步的调控元件的连续排列,该排列的方式使得每一个调控元件能在编码基因的表达过程中完成其意欲的功能。对于生物优选的核酸构建体、表达盒和载体及用于生产转基因生物的方法,以及转基因的耶氏酵母属生物本身,描述于WO2006/102342中,并通过如下实施例加以描述。本发明的核酸可以通过合成产生或天然地获得,或是包含了合成和天然核酸成分的混合物,并由来自不同生物的多种异源基因区段组成。针对生物偏好的密码子,如上所述,对合成的核苷酸序列给予了偏好性。这些生物所偏好的密码子可以从大多数感兴趣的生物种中表达的最高蛋白质频率的密码子来确定。在表达盒的制备中,可能操纵多种DNA片段,从而获得容易以正确方向读取且配有正确读框的核苷酸序列。可以将衔接头或接头附接至片段,以共同加入DNA片段中。用包含一个或多个用于插入该序列的限制位点的接头或多聚接头,是很方便地能以转录的方向来提供启动子和终止子区的。通常,接头具有1-10个限制位点,大多数情况下1-8个、优选2-6个限制位点。一般而言,调控区内的接头具有小于100bp,经常小于60bp,但至少为5bp的大小。启动子对于宿主生物而言可以是天然的(或同源的)也可以是外来的(或异源的)。表达盒优选以5'-3'转录方向包含启动子、编码核酸序列或核酸构建体以及转录终止区。不同的终止区可以根据需要互换。特别优选的效果基因是选自下组的那些:编码酮酶的核酸、编码[β]-羟化酶的核酸、编码[β]-环化酶的核酸、编码[ε]-环化酶的核酸、编码环氧酶的核酸、编码HMG-CoA还原酶的核酸、编码(E)-4-羟基-3-甲基丁-2-烯基-二磷酸还原酶的核酸、编码1-脱氧-D-木糖-5-磷酸合酶的核酸、编码1-脱氧-D-木糖-5-磷酸还原异构酶的核酸、编码异戊烯基-二磷酸[δ]-异构酶的核酸、编码香叶基-二磷酸合酶的核酸、编码法呢基-二磷酸合酶的核酸、编码香叶基-香叶基-二磷酸合酶的核酸、编码八氢番茄红素合酶的核酸、编码八氢番茄红素去饱和酶的核酸、编码前八氢番茄红素合酶的核酸、和编码ζ-胡萝卜素去饱和酶的核酸。借助上述本发明的方法可能的是,在耶氏酵母属的上述本发明的经遗传修饰的生物中通过本发明的启动子将代谢途径调控至特定的生物合成产物。出于这个目的,例如,通过引发或提高此生物合成途径的基因的转录速率或表达速率以增加的酶量来增强该种导致特定生物合成产物的代谢途径,其中所述增加的酶量导致合意的生物合成途径的这些酶的总活性增加,并因而导致指向合意的生物合成产物的代谢流增强。取决于合意的生物合成产物,需要提高或降低多个基因的转录速率或表达速率。改变多个基因的转录速率或表达速率通常是有利的,即,提高基因的组合的转录速率或表达速率和/或降低基因的组合的转录速率或表达速率。在本发明的经遗传修饰的生物中,至少一个提高的或引发的基因表达速率可以归因于本发明的启动子。此外,在经遗传修饰的生物中其他基因的额外改变的(即额外提高或额外降低的)表达速率可以(但不需要)来源于本发明的启动子。因此,本发明涉及用于通过培养耶氏酵母属的本发明的经遗传修饰的生物来生产生物合成产物的方法。具体而言,本发明涉及用于通过培养耶氏酵母属的本发明的经遗传修饰的生物来生产类胡萝卜素的方法,其中要表达的基因选自下组:编码酮酶的核酸、编码[β]-羟化酶的核酸、编码[β]-环化酶的核酸、编码[ε]-环化酶的核酸、编码环氧酶的核酸、编码HMG-CoA还原酶的核酸、编码(E)-4-羟基-3-甲基丁-2-烯基-二磷酸还原酶的核酸、编码1-脱氧-D-木糖-5-磷酸合酶的核酸、编码1-脱氧-D-木糖-5-磷酸还原异构酶的核酸、编码异戊烯基-二磷酸[δ]-异构酶的核酸、编码香叶基-二磷酸合酶的核酸、编码法呢基-二磷酸合酶的核酸、编码香叶基-香叶基-二磷酸合酶的核酸、编码八氢番茄红素合酶的核酸、编码八氢番茄红素去饱和酶的核酸、编码前八氢番茄红素合酶的核酸、和编码ζ-胡萝卜素去饱和酶的核酸。类胡萝卜素优选为选自下组:八氢番茄红素、六氢番茄红素、番茄红素、叶黄素、β-胡萝卜素、玉米黄素、虾青素、角黄素、海胆酮、3-羟基海胆酮、3’-羟基海胆酮、金盏花红素、堇黄素和金盏花黄素。此外,经遗传修饰的生物还可用于生产含有生物合成产物(尤其是类胡萝卜素,尤其是酮式类胡萝卜素,尤其是虾青素)的提取物,和/或用于生产动物和人食物补充剂,以及化妆品和药物。耶氏酵母属的经遗传修饰的生物与野生型相比具有增加的合意的生物合成产物,尤其是类胡萝卜素,尤其是酮式类胡萝卜素,尤其是虾青素的含量。在优选的实施方案中,本发明的酵母启动子来源于解脂耶氏酵母菌株。目前预期,本发明的酵母启动子(即同功的酵母启动子)可以获得自其他微生物。例如,酵母启动子可以来源于其他酵母菌株,如酿酒酵母(Saccharomycescerevisiae)的菌株。在另一个方面,本发明提供包含本发明的酵母启动子的重组表达载体。本发明的表达载体可为便利地用于重组DNA步骤的任何表达载体,并且载体的选择通常取决于要将其引入的宿主细胞。用于分别连接编码目的蛋白的DNA序列、酵母启动子和终止子的步骤,以及将它们插入合适的载体的步骤是本领域技术人员已知的。在又一个方面,本发明提供包含本发明的重组表达载体的宿主细胞。优选地,本发明的宿主细胞是真核细胞,尤其是酵母细胞。此类酵母宿主细胞的例子包括但不限于酵母属(Saccharomyces)菌株,尤其是酿酒酵母、克鲁弗酵母(Saccharomyceskluyveri)、或葡萄汁酵母(Saccharomycesuvarum)、裂殖酵母属菌种(Schizosaccharomycessp.),如粟酒裂殖酵母(Schizosaccharomycespombe)的菌株、汉逊酵母属菌种(Hansenulasp.)的菌株、毕赤酵母属菌种(Pichiasp.)、耶氏酵母属菌种,如解脂耶氏酵母、或克鲁维酵母属菌种(Kluyveromycessp.),如乳酸克鲁维酵母(Kluyveromyceslactis)。在优选的实施方案中,解脂耶氏酵母的菌株是适于本发明的宿主。实施例如下实施例对本发明进行阐释。下表1描述了用于下文范例中的一些解脂耶氏酵母菌株:表1:解脂耶氏酵母菌株下表2描述了用于下文范例中的一些质粒表2:质粒质粒主链/骨架插入物pMB6056pMB6052(HygRtef1P-xprT)crtZpMB6504pMB6056hspPpMB6509pMB6056hypPpMB6779pMB6149(LEU2lacZ)hspPpMB6781pMB6149hypP通过引入异源基因在内源性TEF1启动子的控制下(对照),构建了耶氏酵母株ML2461和ML6804。GGS基因和截短的HMG基因(“HMG-tr”)分别来源于与天然香叶基-香叶基焦磷酸合酶和羟基甲基戊二酰-CoA还原酶基因对应的耶氏酵母属序列。carRP和carB基因来源于卷枝毛霉(Mucorcircinelloides),并且它们分别编码双功能性的八氢番茄红素合酶/番茄红素环化酶和八氢番茄红素脱氢酶。合成了crtW基因以编码百慕大细小棒菌(Parvularculabermudensis)的胡萝卜素酮酶。合成了crtZ基因以编码粉末肠杆菌(Enterobacterpulveris)的胡萝卜素羟化酶。这些基因有时(但不总是)与营养缺陷型标志物(URA3,LEU2,URA2,LYS1,ADE1)或loxP位点、HygR或NatR标志物的残余联系起来。此处所述的所有基础分子生物学及DNA操作步骤通常是根据Sambrook等或Ausubel等(SambrookJ,FritschEF,ManiatisT(编).1989.MolecularCloning:ALaboratoryManual.ColdSpringHarborLaboratoryPress:NewYork;AusubelFM,BrentR,KingstonRE,MooreDD,SeidmanJG,SmithJA,StruhlK(编).1998.CurrentProtocolsinMolecularBiology.Wiley:NewYork)进行的。实施例1:生产pM6504(HygRHSPp-crtZ),其编码驱动胡萝卜素羟化酶基因crtZ的HSP启动子用MO8250(5’-CACACAAAGCTTGGTACCAGATAGTGCAATCACATGTTGCTAC)和MO8251(5’-CACACATTTTGTGGCTAGCATGTAGTATAAGTGTGTGTGTTGG)从制备自解脂耶氏酵母ATCC201249的gDNA扩增了对应于YALI0D20526g上游的基因内区域的SEQIDNO:1中指定的序列。用NheI和HindIII来切割此1kb片段,并连接至用NheI和HindIII切割的pMB6056(TEF1p-crtZHygR)以产生pMB6504(HSPp-crtZHygR)。实施例2:生产pM6509(HygRHSPp-crtZ),其编码驱动胡萝卜素羟化酶基因crtZ的来自解脂耶氏酵母的HYP启动子用MO8254(5’-CACACAAAGCTTGGTACCAGATCGCGGTCAGAAGGGGCAG)和MO8255(5’-CACACATTTTGTGGCTAGCATGTGAGAAAGTAGTTTTGAGATGG)从制备自解脂耶氏酵母ATCC201249的gDNA扩增了对应于YALI0D09889g上游的基因内区域的SEQIDNO:2中指定的序列。用NheI和HindIII来切割此1kb片段,并连接至用NheI和HindIII切割的pMB6056(TEF1p-crtZHygR)以产生pMB6509(HYPp-crtZHygR)。实施例3:生产玉米黄素用NotI切割pMB6056,pMB6504和pMB6509并独立地转染至ML2461(一种β胡萝卜素生产者)中,以及ML6804(一种角黄素生产者)中。将转化体在补充100mg/L潮霉素B的YPD上进行选择。将它们在30℃温育48小时。挑取菌落至补充100mg/L潮霉素B的YPD琼脂。使这些转化体的培养物在2mL圆底24孔板中的800μLYPD中于30℃生长72小时,并在INFORSMultitron中以800rpm振荡。为了提取,取样250μL至2mLEppendorfSafe-LockTM管(022363352)中。向每个样品添加约600μL的0.5mm直径氧化锆/二氧化硅珠(BioSpecProducts目录号11079105z)。在ReschMM300珠磨器(设置为20)中于庚烷:乙酸乙酯(1:1v:v)中于4℃将细胞破碎5分钟,并离心5分钟。进行多轮提取直至提取物无色,指示样品中类胡萝卜素已耗尽。在破碎之后将提取物汇集,蒸发、重悬于己烷:乙酸乙酯(1:1v:v)中并通过HPLC分析。图1显示了在摇瓶中用驱动crtZ表达的HSP或HYP来转化的ML2461中的类胡萝卜素水平,描绘为HPLC峰面积。由于耶氏酵母属中的插入是随机的,因此染色体定位随转化体而异。为了将位置效应降至最小,对HSP和HYP分别测定了10个和5个转化体并取平均值。实施例4:生产虾青素培养来源于ML6804转化体的培养物,取样并如上文所述提取。图2显示了用驱动crtZ表达的HSP或HYP启动子来转化的ML6804中的类胡萝卜素水平, 描绘为HPLC峰面积。显示了摇瓶中对于HSP和HYP各12个转化体的平均表达。实施例5:虾青素生产者的发酵罐中的基因表达为了检查上述异源构建体在发酵罐条件下的表达,将实施例4中产生的产虾青素的菌株用分批补料工艺培养于发酵罐中,所述培养在3L实验室规模(bench-scale)发酵罐中进行。初始批次阶段(initialbatchphase)培养基含有作为主要碳源的10%大豆油(vol:vol)。在批式生长期过程中,生物质水平(干细胞重量)达到最大,并且耶氏酵母细胞积累大的内部脂质体。在消耗了初始批次后,观察到溶解氧水平在发酵罐中的快速上升。在此时,开始进料大豆油,控制补料速度以将发酵罐溶解氧水平维持在20%的饱和度。在图3中指示的时间点处取样25μL的等分试样并如上文所述提取类胡萝卜素。对于RNA分析,对发酵罐一次取一个样以将从取样到冷冻的时间最小化。取出样品,并立即置于冰上。一式三份取等分试样,并在2mLEppendorfSafe-LockTM管中于13000rpm离心45秒。弃上清,并将所述样品置于干冰上,直至所有发酵罐均已取样。将样品储藏在-80℃。用QiagenRNeasyMiniRNA提取试剂盒(目录号74106)采用YeastIII规程伴随珠打(beadbeating)来提取RNA。向每个样品添加约600μL的0.5mm直径氧化锆/二氧化硅珠(BioSpecProducts目录号11079105z)。向样品添加600μLBufferRLT及β-ME(10μLβ-ME/1mLRLT)的等分试样。在ReschMM300珠磨器(设置为20)中于4℃将细胞破碎5分钟。以最高速离心样品10秒并将上清转移至新管。将样品再次以最高速离心2分钟并将裂解液转移至新管。向裂解液添加350μL的70%乙醇的等分试样,并通过上下移取进行混合。将700μL的样品的等分试样转移至RNeasymini柱并于13000rpm离心15秒。将流过物(flow-through)弃去。将350μLBufferRW1的等分试样添加至该柱,在13000rpm将其离心15秒。将10μLDnaseI储液的等分试样添加至70μL的BufferRDD并通过颠倒管体进行混合。将80μLDNaseI溶液添加至RNeasy二氧化硅-凝胶膜并在室温温育15分钟。将350μLBufferRW1的等分试样添加至该柱并在13000rpm将其离心15秒。将流过物弃去。将RNeasy柱转移至新的2mL收集管。为了洗涤柱子,添加500μLBufferRPE(含乙醇)的等分试样,并在13000rpm将其离心15秒。将流过物弃去,并重复之前的步骤。将RNeasy柱置于新的2mL收集管中并于 13000rpm离心1分钟以将膜干燥。将RNeasy柱转移至新的1.5mL收集管。将50μL的无RNA酶水的等分试样添加至膜,并在室温温育1分钟。以13000rpm将柱离心以洗脱。如上所述在Agilent2100生物分析仪上用AgilentRNAPico(Agilent#5067-1513)试剂盒对RNA进行定量并测试其质量。用VILO试剂盒(Invitrogen目录号11754-250)根据制造商的指导来合成第一链cDNA。简言之,将250ng的RNA在20μL反应中与4μL5xVILO反应混合剂(ReactionMix)、2μL10xSuperScript酶混合剂及水一起温育。将反应在25℃温育10分钟,42℃温育2小时并在85℃温育5分钟。将cDNA稀释至0.7ng/μL然后进行qPCR。用PrimerQuest软件(可免费获取自IDT网站)设计,并通过IDT合成用于qPCR的引物。表3:用于qPCR的引物在StratageneMx3000P热循环仪中用BrilliantIIIUltra-FastSYBERQPCR主混合物(MasterMix)(Agilent目录号600883)来进行qPCR。运行了几个20μL的反应。主混合物设置为含有除cDNA之外的全部成分,并向每个反应添加15μL等分试样以及5μL的cDNA。向每个反应添加10μL2xSYBERMix,0.3μL的500x稀释的参考染料(ReferenceDye),0.7μL水和4μL的引物混合物(正向和反向引物各2μM)。还用ACT1引物组和0.7ng/μLRNA作为模板运行了无逆转录酶反应(NRT)。对每个平板运行了无模板(NTC)反应,其用5μL的水取代了cDNA。如果一个实验运行多个平板,则还包括平板间校准物(interplatecalibrator,IPC))。对于IPC,选择单个模板并用ACT1引物组 在所有平板中一式三份运行。所有反应均一式三份运行。选择ACT1以对mRNA量进行标准化,并将Tef1α(一个组成型看家基因)用于倍数表达计算。计算dCt以去除变异(Avg样品-AvgACT1)。计算ddCt以标准化至标准物,在本研究中为TEF1α,其为一种强表达的内源性基因。(2^(dCt样品-dCtTEF))。图3显示了由产生的虾青素水平反映的crtZ表达的水平。图4显示了在3个时间点处来自与图3相同发酵罐的相对crtZRNA表达。实施例6:生产β-半乳糖苷酶为了评估来自HYP和HSP启动子的基因表达,将每个启动子功能性地融合至lacZ报告基因。用NheI和HindIII切割质粒pMB6149,并将实施例1和2中所述合适的1kbNheI-HindIII启动子片段插入以产生pMB6779(HSPp-lacZ)和pMB6781(HYPp-lacZ)。将来源于ML326的Leu+转化体的培养物培养于补充了尿嘧啶和赖氨酸的基本培养基中过夜,然后1/50稀释于10mLYPD中,并生长至2x107细胞/mL。将细胞沉淀并重悬于0.5mL破裂缓冲液(BreakingBuffer)(0.1MTrispH8,20%甘油v/v,1mMDTT)中。将0.25mL的等分试样转移至新鲜的管中,并添加12.5uLPMSF溶液(40mM溶于95%乙醇中)。将氧化锆/二氧化硅珠(BioSpecProducts目录号11079105z)添加至弯液面,并将管涡旋10分钟。将上清转移至新鲜的管。在4℃将溶液以最大速度离心15分钟。将950μL的Z缓冲液(16g/LNa2HPO4-7H2O,5.5g/LNaH2PO4-H2O,0.75g/LKCl,0.25g/LMgSO4·7H2O,2.7mL/Lβ-巯基乙醇)和50μL提取物的等分试样组合于玻璃管中并置于28℃水浴中。通过添加0.2mLONPG溶液(4mg/mLO-硝基苯基B-D-半乳糖苷于Z缓冲液中)来开始反应。允许反应继续直至显现中黄色(mediumyellowcolor),并通过添加0.5mL1MNa4CO3来终止反应。记录每个反应的时间并确定OD420。通过BioRad蛋白测定法来确定总细胞蛋白。β-半乳糖苷酶单位=((OD420)(378)/((以分钟计的时间)(以mL计的提取物体积)(蛋白mg/mL))图5显示了摇瓶中分别用HSP或HYP(其驱动单拷贝lacZ的表达)的4株和5株中β-半乳糖苷酶生产。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1