无核酸酶的基因组编辑的制作方法
本申请要求2014年9月3日提交的美国临时专利申请号62/045,451、2014年8月29日提交的美国临时专利申请号62/044,145、2014年3月24日提交的美国临时专利申请号61/969,709、2014年3月21日提交的美国临时专利申请号61/969,013的优先权,各申请通过引用全文纳入本文。
政府权利
本发明是在国立卫生研究院(National Institutes of Health)授予的合同HL064274下于政府资助下完成。政府对本发明享有某些权利。
发明领域
本发明涉及没有外源性核酸酶的基因组编辑。
发明背景
基因组的位点特异性操作是医学、生物技术和生物学研究中许多应用的理想目标。近年来,已经进行了许多努力来开发用于体内和体外在有丝分裂和有丝分裂后细胞中进行基因靶向的位点特异性核酸酶。然而,这些靶向的核酸酶通常对细胞有毒并且它们的脱靶活性可能是免疫原性和基因毒性的。本领域需要编辑细胞基因组而不使用外源提供的核酸酶的方法。本发明解决了这些问题。
技术实现要素:
提供了用于编辑细胞基因组而不使用外源提供的核酸酶的方法和组合物。该方法的方面包括将细胞与包含待整合到目标基因座中的核酸序列的靶向载体接触,其中该细胞不与核酸酶接触。另外,提供了发现用于实施所述方法的试剂、装置和试剂盒。
附图的简要说明
结合附图,通过以下详述更好地理解本发明。需要强调,按照惯例,附图的各个特征不成比例。相反,各种特征的尺寸被任意放大或者缩小以清楚显示。附图部分包括如下的附图。
图1.载体设计和靶向方案:密码子优化的人F-IX cDNA(浅绿)之前是编码2A肽的序列(P2A,深绿)。其侧接与从5’(蓝色)和3’(UTR,黄色)跨白蛋白终止密码子的序列同源的那些序列。同源臂分别长1.3和1.4Kb。整合到Alb基因座产生嵌合基因。然而,由2A肽诱导的核糖体跳跃产生2种分开的蛋白质。白蛋白留有21个氨基酸长的2A标签,而凝血因子连接至N端脯氨酸,其之后在ER中经处理作为信号肽的部分。
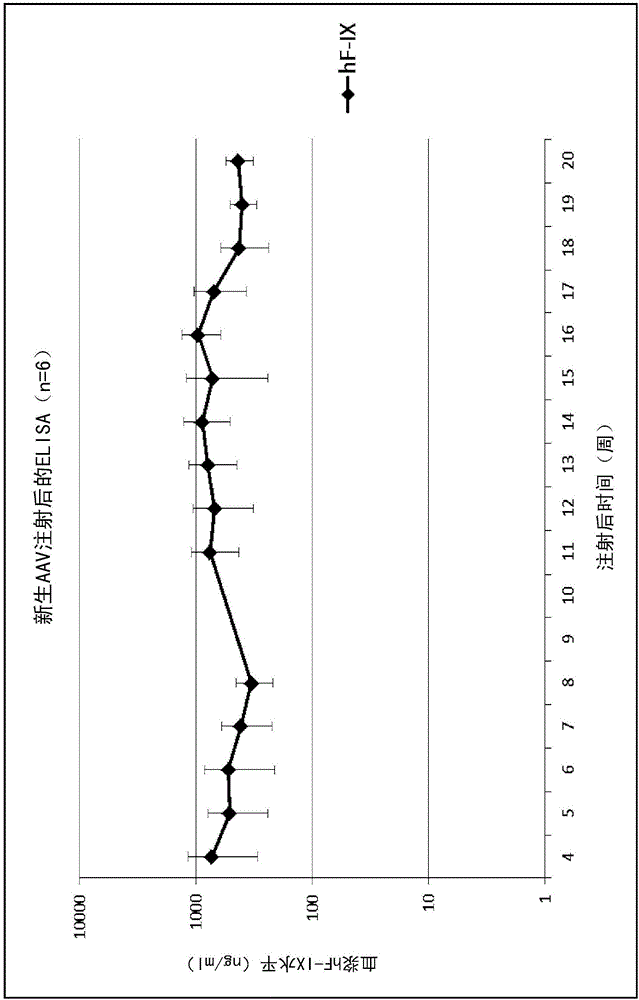
图2.用含通过点印迹滴定的2.5e11载体颗粒的50μl腹膜内(IP)注射入2天龄的C57BL/6J(B6)小鼠。从生命的第4周开始,每周通过ELISA评价血浆hF-IX,之后进行眼球后血液收集。N=6,误差线代表标准差。
图3.用含通过点印迹滴定的1e12载体颗粒的100μl静脉内(IV)注射成年C57BL/6J(B6)小鼠。从生命的第4周开始,每周通过ELISA评价血浆hF-IX,之后进行眼球后血液收集。N=3,误差线代表标准差。
图4.RT无偏PCR显示hF-IX从靶上整合开始表达。用引物RT(上)进行逆转录,之后是用随机引物进行第二链DNA合成,用MseI限制性酶切割,接头连接并且用引物对1和2进行PCR。蓝色:Alb外显子,橙色:Alb内含子,黑实现:载体和基因组之间同源性的终点。对PCR产物(下)进行测序并且发现对应于融合的白蛋白_F-IX转录本,如从靶上整合中所预期的那样。无偏方法没有产生对应于附加体表达或脱靶整合的PCR产物。
图5.显示白蛋白大小的单一抗-2A条带的血浆Western印迹分析表明仅有靶上表达。
图6.对肝的Western印迹分析。hF-IX条带的大小表示2A肽的高效核糖体跳跃。
图7.F-IX敲除小鼠中的表型校正(B6和CD-1杂交)。用1x 10^12个AAV8_hF-IX的载体基因(Vg)注射成年小鼠。在注射后2周通过aPTT试验来测量凝结时间。用AAV8_hF-IX靶向载体注射的小鼠显示显著改善的凝结时间。
图8.载体设计和实验方案。A.rAAV8载体编码密码子优化的侧接同源臂的hF9 cDNA和在前2A-肽编码序列,该同源臂指导向Alb终止密码子的5’整合。5’和3’臂的长度分别是1.3和1.4-kb。在通过同源重组整合后,Alb和hF9在DNA和RNA水平上融合,但是由于核糖体跳跃而产生2种分离的蛋白质。B.关于Alb同源臂,AAV反向控制具有与2A-肽编码序列、相邻的Alb外显子和在前剪接点一起反转的hF9。细白色矩形:Alb内含子;粗灰色矩形:Alb外显子;粗白色矩形:P2A;粗白色箭头:hF9;粗浅灰色矩形:基因外DNA;虚线:终止密码子;椭圆:反转的末端重复;P=脯氨酸。
图9.注射的小鼠中,人因子IX表达和活性。A.在用2.5e11vg的hF9实验构建体(n=6)或反转对照(n=3)IP注射的2天龄B6小鼠后通过ELISA测量的血浆hF9。检测限之下的测量值被分配为20ng/mL的阈值。PH=部分肝切除。误差线代表标准差。虚线表示正常F9水平的5%和20%。B.在用1e12vg的AAV hF9实验构建体(n=7),或反转对照(n=3)尾静脉注射,或者用30μg编码“正确”取向的hF9构建体的质粒(3.5e12拷贝数)高压注射入9周龄B6小鼠后通过ELISA测量的血浆hF9。检测限为20ng/mL。误差线和虚线同(A)。C.在用命名为MOI的AAV hF9实验构建体尾静脉注射入9周龄B6小鼠后通过ELISA测量的血浆hF9(每组n=4)。误差线代表标准差。D.在每只小鼠尾静脉注射1e12AAV8-hF9vg的2周后通过活化的部分血栓栓塞时间(aPPT)测量凝结效率(n=5)。误差线代表标准差。E.对来自用AAV8-hF9构建体或反转对照注射的小鼠的肝脏样品中hF9的Western印迹分析。hF9的预期大小是55-Kd。
图10.在DNA和RNA水平上的Alb靶向率。A.从使用与基因组基因座而不是载体退火的生物素化引物1(黑色)的显性扩增(LAM)开始的靶上整合率评价。然后显性扩增子结合至链霉亲和素化的珠并洗涤以排除附加体载体。用随机引物的后续第二链DNA合成,之后是CviQI限制性消化。然后连接相容的接头,之后是两轮巢式PCR(蓝色的引物2-3,然后红色的引物4-5)。CviQI在靶向和野生型等位基因中距离同源边界相同距离处切割,因此允许无偏扩增。第二次巢式PCR的扩增子然后用作使用引物6-7(绿色)或8-9(橙色)的qPCR试验的模板。B.对于mRNA定量,使用引物10-11或11-12来生成用于qPCR试验的cDNA。形状和填写代码与图1相同。C.黑色柱表示Alb等位基因的靶向率,即由引物6-7扩增的DNA模板的丰度与由引物8-9扩增的DNA模板的丰度之比,由0.7的系数校正以考虑肝实质细胞频率。灰色柱表示靶向的Alb等位基因的表达率,即由引物10-11扩增的cDNA模板的丰度与由引物11-12扩增的cDNA模板的丰度之比。各组N=3,而误差线代表标准偏差。
图11.hF9表达的特异性。A.用聚-dT引物从RT产生的cDNA用作使用引物13-14或14-15的qPCR试验的模板。B.柱表示Alb_hF9 mRNA与总含hF9的mRNA的比率,即由引物13-14扩增的cDNA模板的丰度与由引物14-15扩增的cDNA模板的丰度之比。各组N=3,而误差线代表标准偏差。C.用针对P2A的探针对肝脏样品的Northern印迹分析。较低的非特异性信号对应于18S rRNA的大小。D.对来自用AAV-P2A-hF9构建体或反转对照注射的小鼠的肝脏样品中P2A的Western印迹分析。P2A预期与白蛋白(66.5-Kd)融合。
图12.hF9肝脏免疫组化。从上到下,组图显示在阳性对照人肝脏、阴性对照未处理的小鼠肝脏中的人因子9染色(红色)和DAPI核复染(蓝色),和2个用AAV8-P2A-hF9处理的新生或成年小鼠的代表性染色。
图13.靶向率评价方案。从使用与基因组基因座而不是载体退火的生物素化引物1(黑色)的显性扩增(LAM)开始的靶上整合率评价(步骤1)。然后显性扩增子结合至链霉亲和素化的珠并洗涤以排除附加体载体(步骤2)。用随机引物的后续第二链DNA合成(步骤3),之后是CviQI限制性消化(步骤4)。然后连接相容的接头(步骤5),之后是两轮巢式PCR扩增(蓝色的引物2-3(步骤6),然后红色的引物4-5(步骤7))。CviQI在靶向和野生型等位基因中距离同源边界相同距离处切割,因此允许无偏扩增。然后第二次巢式PCR的扩增子用作使用引物6-7(绿色)或8-9(橙色)的qPCR试验的模板(步骤8)。
图14.通过qPCR评价的靶向率的标准曲线。靶向的等位基因(引物8和9,图3)和非靶向等位基因(引物6和7,图3)的qPCR标准曲线。使用的质量单位在功能上与摩尔等价,因为所有使用的扩增子是等长度的。
图15.通过ALT测量的毒性评价。在用编码我们的实验载体的AAV8(1e12)或编码已知非毒性盒(H1启动子-驱动shRNA的1e12)的阴性对照,或编码已知毒性盒的阳性对照(U6启动子-驱动shRNA的5e11)注射的小鼠中,注射后7天评价丙氨酸转移酶水平(ALT)。数据表示各组中四只独立小鼠的2次测量的平均。在此定义的统计学显著性为在不同变量的样品之间的单尾t检验中p<0.05。
图16.载体拷贝数。通过使用引物8和9的qPCR评价载体拷贝数(图3)。成年注射小鼠N=7,并且新生注射小鼠N=6,并在部分肝切除之前和之后分析。误差线代表标准差。
图17.从1000基因组计划(“http:”之后“//www.”之后“1000genomes”之后“.org”)中提取的人群中在相关Alb基因座处的单倍型。
图18.在以1×1012载体基因组/小鼠将AAV8-F9或AAVDJ-F9实验构建体尾静脉注射入9周龄的雌性B6小鼠后通过ELISA测量的血浆F9(各n=4),误差线代表标准差。
图19.在以1×1012载体基因组/小鼠尾静脉注射AAV8-F9(顶部)或以3×1011载体基因组/小鼠尾静脉注射AAV8-F9 Triple(底部)(各n=5)后2周,通过活化的部分血栓栓塞时间(aPTT)测量凝结效率。KO,敲除。误差线代表标准差。
图20.在以2.5×1011载体基因组/小鼠将AAV8-F9实验构建体颞浅静脉注射入2-天龄B6小鼠之后通过ELISA测量的血浆F9(n=4)。
图21.在以1×1012载体基因组/小鼠将AAV8-VRC01实验构建体尾静脉注射入9周龄的雌性B6小鼠后通过ELISA测量的血浆VRC01(针对HIV的广泛中和抗体)(各n=4),误差线代表标准差。夹心ELISA使用由针对人IgG的恒定区的抗体包被的平板,而功能性ELISA使用由HIV糖蛋白gp120包被的平板,该糖蛋白是被VRC01抗体识别的抗原。
发明详述
提供了用于编辑细胞基因组而不使用外源提供的核酸酶的方法和组合物。该方法的方面包括将细胞与包含待整合到目标基因座中的核酸序列的靶向载体接触,其中该细胞不与核酸酶接触。另外,提供了发现用于实施所述方法的试剂、装置和试剂盒。阅读以下更完整描述的组合物和方法细节,本领域技术人员将明白本发明的这些和其他目的、优点和特征。
在描述本方法和组合物之前,应理解,本发明不限于所述的具体方法或组合物,因为它们当然可能变化。还应理解,本文所用术语的目的仅是描述具体实施方式,不用来构成限制,因为本发明的范围仅受所附权利要求书的限制。
提供数值范围时,也应视作具体公开了该范围的上限和下限之间以下限单位十分之一为间隔的各中间数值,除非上下文另有明确说明。本发明还包括设定范围内任何设定数值或中间数值和该设定范围内任何其它设定数值或中间数值之间的各较小范围。所述范围可独立地包含或排除这些较小范围的上限、下限,本发明也包括这些较小范围不包含限值、包含任一或两个限值的各范围,以设定范围内任何限值的明确排除为准。设定范围包含一个或两个限值时,本发明也包括排除所述限值之一个或两个的范围。
除非另有说明,本文所用的所有科技术语与本发明所属领域普通技术人员所理解的通常含义相同。虽然也可采用与本文所述类似或等同的任何方法和材料实施或测试本发明,但在此描述一些潜在和优选的方法和材料。本文提及的所有出版物均通过引用纳入本文,与所引用出版物相关联来公开和描述这些方法和/或材料。应理解,出现抵触时,用本发明公开内容代替任何本文所纳出版物的公开内容。
正如本领域技术人员在阅读本公开后所能显见的,本文描述和说明的每个单独的实施方式具有离散的组成和特征,这些组成和特征可方便地分离或与任何其余多个实施方式的特征结合而不偏离本发明的范围和精神。任意提及的方法可以所提及的事件顺序进行或以逻辑上可行的任意其它序列进行。
必须注意到,本文和所附权利要求书所用的单数形式“一个”、“一种”和“所述”包括复数含义,除非上下文另有明确说明。因此,例如,提到“一个细胞”包括多个这样的细胞,提到“所述肽”包括本领域技术人员已知的一种或多种肽及其等同物(例如,多肽)等等。
提供本文讨论的出版物仅针对其在本申请提交日之前的公开。本文中所有内容均不应解释为承认本发明不能凭借在先发明而先于这些出版物。此外,所提供的出版日期可能与实际公开日期不同,这可能需要单独确认。
提供了用于编辑细胞的基因组的方法和组合物。基因组编辑表示遗传工程改造,其中从基因组插入、替换或移除感兴趣的核酸序列。在本发明的情况中,目标方法和组合物在将待在细胞中表达的核酸序列(本文中称为“转基因”)插入细胞的基因组的靶基因座处中特别有用。在一些情况中,转基因编码编码肽或多肽的RNA。在其他情况中,编码非编码RNA(即,不编码肽或蛋白的RNA)的转基因,例如,编码核酶、小发夹RNA(shRNA)、小RNA(miRNA)、或其前体、长-非编码RNA等的核酸序列。在一些情况中,将一个转基因插入靶基因座。在其他情况中,插入超过一个转基因,例如,向靶基因座中插入2、3、4或5或更多个转基因。在一些情况中,在整合到靶整合位点中之后,目标转基因在靶基因座处变得可操作地连接至内源性基因的启动子。在其他情况中,目标转基因可操作地连接至病毒载体上的启动子,并且在整合到靶整合位点中之后保持可操作地连接至该启动子。
在实践目标方法中,编辑细胞的基因组而不使用外源性核酸酶。“核酸酶”表示能够切割DNA,例如基因组DNA或线粒体DNA的核苷酸亚基之间的磷酸二酯键以产生双链断裂的酶。许多核酸酶的示例为本领域已知,包括人工工程改造的锌指核酸酶(ZFN)、转录激活因子样效应物核酸酶(TALEN)、CRISPR/Cas系统、和经工程改造的大范围核酸酶重新工程改造的寻靶内切酶、和天然产生的核酸酶如限制性内切酶、RecBCD内切酶、T7内切酶、T4内切酶IV、Bal 31内切酶、内切酶I(endo I)、内切酶II(endo VI,exo III)、微球菌核酸酶、脉孢菌内切酶、S1-核酸酶、P1-核酸酶、绿豆核酸酶I、黑粉菌核酸酶、DNA酶I、AP内切酶、和EndoR。外源性核酸酶表示来自细胞外的核酸酶,例如,编码在活细胞中存在并有活性但来自该细胞以外的核酸酶的核酸。如本文的工作实施例所证实,可在细胞中实现靶向的基因座编辑而不向高细胞提供核酸酶,即,不使细胞与核酸酶或编码核酸酶的核酸接触。
不使用外源性核酸酶的基因组编辑提供了相对于需要使用外源性核酸酶的方法多种益处。例如,核酸酶可以是免疫原性的,递送核酸酶编码基因的载体也可以是免疫原性的。另外,由于靶标特异性和脱靶切割,核酸酶活性可以是基因毒性。此外,将核酸酶编码基因导入细胞也带来了可能将核酸酶编码序列整合到基因组中并随后稳定表达核酸酶的风险,导致免疫原性和基因毒性以及由驱动核酸酶表达的启动子或编码核酸酶的载体上存在的其他启动子激活附近基因的更大风险。采用无核酸酶方法消除了这些风险。
在实施目标方法中,在载体(本文称为“靶向载体”)上向细胞提供待整合到细胞基因组中的转基因。换而言之,细胞与包含待通过靶向整合来整合到细胞基因组的核酸序列的靶向载体接触。在下述详细说明中,将描述包含靶向载体的组合物,之后是其使用的示例性方法。
组合物
在本发明的方面中,提供了发现可用于例如通过本发明的方法的基因组编辑的组合物。在一些实施方式中,组合物是靶向载体。如上所述,靶向载体是指包含待整合到细胞的基因组中的转基因的载体。本发明所包括的靶向载体的示例包括病毒载体和非病毒载体,例如,质粒、小环等。
在一些实施方式中,靶向载体是病毒载体。病毒载体是指外来DNA的片段可插入用来转移到细胞中的病毒或病毒染色体物质。在其生命循环中包括DNA阶段的任何病毒都可用作目标方法和组合物中的病毒载体。例如,病毒可以是单链DNA(ssDNA)病毒或双链DNA(dsDNA)病毒。同样合适的是在其生命循环中有DNA阶段的RNA病毒,例如,逆转录病毒,例如,MMLV、慢病毒,其被逆转录成DNA。病毒可以是整合病毒或非整合病毒。
作为一个非限制性示例,感兴趣的病毒是腺相关病毒。腺相关病毒或“AAV”表示病毒本身或其衍生物。除非另有说明,该术语涵盖所有的亚型以及天然产生和重组形式,例如,1型AAV(AAV-1)、2型AAV(AAV-2)、3型AAV(AAV-3)、4型AAV(AAV-4)、5型AAV(AAV-5)、6型AAV(AAV-6)、7型AAV(AAV-7)、8型AAV(AAV-8)、9型AAV(AAV-9)、10型AAV(AAV-10)、11型AAV(AAV-11)、禽AAV、牛AAV、犬AAV、马AAV、灵长类AAV、非灵长类AAV、羊AAV、杂交AAV(即,包含一种AAV亚型的衣壳蛋白和另一种亚型的遗传物质的的AAV)、包含突变AAV衣壳蛋白或嵌合AAV衣壳(即,具有来自2种或更多种AAV血清型的区或结构域或单个氨基酸的衣壳蛋白,例如,AAV-DJ、AAV-LK3、AAV-LK19)的AAV。“灵长类AAV”是指感染灵长类的AAV,“非灵长类AAV”是指感染非灵长类哺乳动物的AAV,“牛AAV”是指感染牛科动物的AAV等。
“重组AAV载体”或“rAAV载体”是指包含不是AAV来源的多核苷酸序列(即与AAV异源的多核苷酸),一般是待按照目标方法整合到细胞中的感兴趣核酸序列的AAV病毒或AAV病毒染色体物质。一般而言,异源多核苷酸侧接至少一个,并且一般两个AAV反向末端重复序列(ITR)。在一些情况中,重组病毒载体也包含对于重组病毒载体物质的包装而言重要的病毒基因。“包装”表示一系列导致病毒颗粒,例如AAV病毒颗粒组装和衣壳化的胞内事件。对AAV包装而言重要的核酸序列(即,“包装基因”)的示例包括AAV“rep”和“cap”基因,其分别编码腺相关病毒的复制和衣壳化蛋白。术语rAAV载体涵盖rAAV载体颗粒和rAAV载体质粒。
“病毒颗粒”是指包含使基于病毒的多核苷酸,例如,病毒基因组(如野生型病毒),或例如,目标靶向载体(如重组病毒)衣壳化的衣壳的病毒单位。“AAV病毒颗粒”是指包含至少一种AAV衣壳蛋白(一般是野生型AAV的所有衣壳蛋白)和衣壳化的多核苷酸AAV载体的病毒颗粒。如果颗粒包含异源多核苷酸(即,野生型AAV基因座以外的多核苷酸,如待递送到哺乳动物细胞中的转基因),其通常称为“rAAV载体颗粒”或简称为“rAAV载体”。因此,产生rAAV颗粒必定包括产生rAAV载体,因为载体包含于rAAV颗粒中。
目标靶向载体设置成引导转基因整合至细胞基因组中感兴趣的具体基因座,即,“靶基因座”。换而言之,整合是靶向的整合。用于靶向的特别感兴趣的哺乳动物中基因座的示例包括白蛋白基因;胶原基因,例如,1型胶原、2型胶原、3型胶原、4型胶原、5型胶原、6型胶原、7型胶原、8型胶原、9型胶原、10型胶原、11型胶原、12型胶原、13型胶原、14型胶原、15型胶原、16型胶原、17型胶原、18型胶原、19型胶原、20型胶原、21型胶原、22型胶原、23型胶原、24型胶原、25型胶原、26型胶原、27型胶原、28型胶原;肌动蛋白基因,例如,α肌动蛋白、β肌动蛋白等。
为了促进靶向整合,靶向载体包含允许在整合位点处的同源重组的核酸序列,例如,允许与白蛋白基因、胶原基因、肌动蛋白基因等同源重组的序列。该过程需要核苷酸序列同源性,使用“供体”分子,例如靶向杂体以模板修复“靶”分子,即向其中整合核酸序列的核酸,例如,细胞基因组中的靶基因座,并且导致遗传信息从供体转移至靶标。因此,在目标组合物的靶向载体中,待整合到细胞基因组中的转基因可侧接与切割位点处基因组序列有充足同源性的序列,例如,与侧接切割位点的核苷酸序列有70%、80%、85%、90%、95%或100%同源性,例如,在切割位点约50个或更少碱基内,例如,在约30个碱基内,在约15个碱基内,在约10个碱基内,在约5个碱基内,或正好侧接靶整合位点,以支持其和与之有同源性的基因组序列之间的同源重组。供体和基因组序列之间大约25、50、100、250或500个核苷酸或更多的序列同源性将支持之间的同源重组。
在一些实施方式中,与缺少侧接序列或具有与靶基因座不同源的侧接序列(例如,与不同基因组基因座同源的侧接序列,与靶基因组中的任何位置都没有同源性的侧接序列等)的载体相比,允许同源重组的侧接序列的存在提供了增加的靶位点整合率。在一些实施方式中,在给予后,0.01%或更多(例如,0.05%或更多、0.1%或更多、0.2%或更多、0.3%或更多、0.4%或更多、0.5%或更多、0.6%或更多、0.7%或更多、0.8%或更多、0.9%或更多、1%或更多、1.5%或更多、2%或更多、5%或更多、10%或更多)的接受靶向载体的细胞之间或组织中的细胞之间的靶基因座含有整合的转基因。可通过任意合适的试验(例如,如本文所述的那样的显性扩增试验)测量靶基因座中的整合率。
在一些实施方式中,转基因表达基本来自靶基因座处的整合。例如,在一些情况中,75%或更多(例如,80%或更多、85%或更多、90%或更多、95%或更多、99%或更多、99.5%或更多)的总转基因表达来自在靶基因座处整合的转基因。换而言之,在一些情况中,与来自靶基因座处的整合的表达相比,来自除靶基因座处的整合以外来源的转基因表达(例如,附加体表达,或在非靶基因座处整合)的相对分数是25%或更低(例如,20%或更低、15%或更低、10%或更低、5%或更低、1%或更低、0.5%或更低等)。可通过任意合适的试验,例如,本文所述的试验测量来自靶基因座整合的表达百分比。
侧接序列可以是任意长度,例如,10个核苷酸或更多、50个核苷酸或更多、100个核苷酸或更多、250个核苷酸或更多、500个核苷酸或更多、1000个核苷酸(1kb)或更多、5000个核苷酸(5kb)或更多、10000个核苷酸(10kb)或更多等。一般而言,供体序列的同源区将与需要重组的基因组序列有至少50%序列相同性。在某些实施方式中,存在60%、70%、80%、90%、95%、98%、99%或99.9%序列相同性。根据靶向载体的长度,可存在1%和100%序列相同性之间的任何值。
在一些情况中,侧接序列可在长度上互相基本相等,例如,可以比其他侧接序列短30%或更少,比其他侧接序列短20%或更少,比其他侧接序列短10%或更少,比其他侧接序列短50%或更少,比其他侧接序列短2%或更少,或者仅比其他侧接序列短几个核苷酸。在其他情况中,侧接序列可在长度上互相基本不同,例如,一个侧接序列可比其他侧接序列短40%或更多,50%或更多,有时60%或更多,70%或更多,80%或更多,90%或更多,或95%或更多。
通常,至少一个侧接重组序列将在靶基因座处包含基因的编码序列。例如,如果靶整合位点包含内源性基因的3’端,则在转基因5’方向上的靶向载体上的重组序列将基本与内源性基因的终止密码子上游的(例如相邻的)DNA序列同源,同时在转基因3’方向上的靶向载体上的同源序列将基本与内源性基因的终止密码子下游(例如相邻的)DNA序列同源。又例如,如果靶整合位点包含内源性基因的5’端,则在转基因5’方向上的靶向载体上的重组序列将基本与内源性基因的启示密码子上游(例如相邻的)DNA序列同源,同时在转基因3’方向上的靶向载体上的同源序列将基本与内源性基因的启示密码子下游(例如相邻的)DNA序列同源。将基因的编码序列在靶基因座处整合到靶基因座中有许多用途。例如,将基因的编码序列在插入位点的下游,或3’方向上的靶基因座处整合将确保基因的表达基本不会受到整合感兴趣基因的破坏。又例如,可能需要在靶基因座处整合基因的编码序列以表达作为细胞的靶基因座处基因序列变体的基因序列,例如,如果细胞的靶基因座处的基因是突变体,例如,用野生型基因序列补偿突变的靶基因座以治疗遗传疾病。
在一些实施方式中,需要编辑细胞的基因座而基本不破坏所编辑的基因座处的基因表达。为此,靶向载体也可包含一个或多个其他核酸序列,其提供转基因的表达而基本不破坏靶基因座处的基因表达。例如,靶向载体可包含在将转基因整合到靶整合位点中之后促进产生2个独立基因产物的核酸序列-在靶基因座处的内源性基因,和整合的转基因。这类核酸序列的示例包括编码2A肽;IRES;内含肽的序列;位点特异性蛋白酶(例如,弗林蛋白酶)的识别序列,编码作为凝结级联的部分被切割的可切割接头的序列;编码因子XI切割位点的序列;和内含子剪接供体/剪接受体序列。
“2A肽”表示小(18-22个氨基酸)肽序列,其允许在核糖体跳跃中,离散蛋白产物在单个编码序列中的高效、一致表达,无论基因在编码序列中的放置顺序。2A肽易于通过其共有基序(DVEXNPGP)和它们促进蛋白质切割的能力来鉴定。靶向载体中可使用任何方便的2A肽,例如,来自病毒如口蹄疫病毒(F2A)、马鼻炎A病毒、猪捷申病毒-1(P2A)或明脉扁刺蛾β四体病毒(T2A)的2A肽,或Szymczak-Workman,A.等“2A肽-连接的多顺反子载体的设计和构建(Design and Construction of 2A Peptide-Linked Multicistronic Vectors)”.来自:《基因转移:DNA和RNA的递送与表达》(Gene Transfer:Delivery and Expression of DNA and RNA)(Friedmann和Rossi编),美国纽约州冷泉港的CSHL出版社,2007(其公开内容通过引用纳入本文)中所述的任意2A肽。
一般而言,转基因和2A肽编码序列将位于靶向载体上以提供不间断表达,即,在转基因插入后在靶基因座处内源性基因的转录、翻译或活性。例如,可能需要将转基因在靶基因座处插入内源性基因的5’端附近的整合位点,例如,正好在靶基因座处内源性基因的起始密码子的下游。在这种情况中,2A肽编码序列将位于靶向载体内,使得其刚好在转基因的3’处,并且侧接经选择将引导同源重组并将转基因-2A肽编码序列盒整合到刚好在靶基因座处内源性基因的起始密码子下游的整合位点中的重组序列。又例如,可能需要将转基因在靶基因座处插入内源性基因的3’端以内的整合位点,例如,正好在靶基因座处内源性基因的终止密码子的上游。在这种情况中,2A肽编码序列将位于靶向载体内,使得其刚好在转基因的5’处,并且侧接经选择将引导同源重组并将2A-转基因盒整合到刚好在靶基因座处内源性基因的终止密码子上游的整合位点中的重组序列。
“内部核糖体浸入位点”或“IRES”表示允许在信使RNA(mRNA)序列的中间开始蛋白质翻译的核苷酸序列。例如,当IRES区段位于双顺反子真核mRNA分子中的2个开放阅读框之间时,其可驱动下游的蛋白质编码区的翻译而不依赖与mRNA分子的5′端结合的5′-帽结构,即在上游蛋白质编码区之前。在这种设定中,两种蛋白质都在细胞中产生。位于第一顺反子中的蛋白质通过加帽依赖性起始方法合成,而第二蛋白的翻译起始由位于2个蛋白质编码区之间的顺反子间的间隔子区中的IRES区段引导。已经从病毒基因组和细胞基因组中分离IRES。经人工工程改造的IRES也是本领域已知的。可在供体多核苷酸中采用任何方便的IRES。
一般而言,如2A肽那样,转基因和IRES将位于靶向载体上以提供靶基因座处的基因在插入转基因后的不间断表达。例如,可能需要在靶基因座处将转基因插入基因的5’非翻译区(UTR)内的整合位点中。在这种情况中,IRES将位于靶向载体内,使得其刚好在转基因的3’处,并且侧接经选择将引导同源重组并将转基因-IRES盒整合到5’UTR内的整合位点的重组序列。又例如,可能需要将转基因在靶基因座处插入内源性基因的3’UTR以内的整合位点,例如,在终止密码子的下游,但在聚腺苷酸化序列的上游。在这种情况中,IRES将位于靶向载体内,使得其刚好在转基因的5’处,并且侧接经选择将引导同源重组并将IRES-转基因盒在靶基因座处整合到3’UTR内的整合位点的重组序列。
“内含肽”表示能够切割自己并通过肽键重新接合翻译的多肽序列的剩余部分(“外显肽”)的多肽区段。换而言之,靶向载体包含核酸序列,其在翻译时促进由转基因编码的蛋白质从由修饰的靶基因座翻译的多肽切割。内含肽可以是天然产生的,即,自发催化蛋白剪接反应以切割自身序列并接合侧接外显肽序列的内含肽,或者是人工的,即已经工程改造以经过可控剪接的内含肽。内含肽一般包含N-端剪接区,其在最N-端的位置上包含Cys(C)、Ser(S)、Ala(A)、Gln(Q)或Pro(P)和下游TXXH序列;以及C-端剪接区,其在最C-端的位置上包含Asn(N)、Gln(Q)或Asp(D)并且在倒数第二的C-端位置上包含His(H)。另外,Cys(C)、Ser(S)或Thr(T)位于其中剪去内含肽的外显肽的+1位(外显肽的-1和+1被分别定义为内含肽插入位点的刚好N-端和C-端处的位置)。可在Liu,X-Q,“蛋白剪接内含肽:遗传迁移、起源和进化(Protein Splicing Intein:Genetic Mobility,Origin,and Evolution)”Annual Review of Genetics 2000,34:61-76和公开的数据,如万维网“tools(dot)neb(dot)com/inbase/mech(dot)php”上发现的新英格兰生物实验室网站(New England Biolabs)上的InBase数据库中找到内含肽促进蛋白质剪接的机制和内含肽剪接要求,其内容通过引用纳入本文。供体多核苷酸上已知赋予内含肽相关切割(自发或受控切割)的任何序列,例如,N-端剪接区和C-端剪接区发现用于目标组合物。构建成内含肽的感兴趣基因可在靶基因座的任何外显子中的整合位点处插入,即在靶基因座处基因的起始密码子和终止密码子之间。
位点特异性蛋白酶的识别序列一般表示编码由进行蛋白水解的酶识别的氨基酸序列的核酸序列。在一些情况中,这种氨基酸序列被称为“可切割接头”。例如,在一些情况中,可切割接头被切割作为凝结级联中的部分(例如,在一些情况中,位点特异性蛋白酶的识别序列是因子XI切割位点)。高度特异性的蛋白酶的非限制性示例和它们切割的序列包括凝血酶(在其切割位点Leu-Val-Pro-Arg-Gly-Ser处的精氨酸残基后切割)、TEV蛋白酶(在其切割位点Glu-X-X-Tyr-X-Gln-Ser处的谷氨酰胺残基后切割)、弗林蛋白酶(在序列的Arg-X-(Lys/Arg)-Arg的最后一个精氨酸后切割蛋白)、肠激酶(在其切割位点Asp-Asp-Asp-Asp-Lys处的赖氨酸残基后切割)、因子Xa(在其切割位点Ile-(Glu或Asp)-Gly-Arg处的精氨酸残基后切割);Genenase I(在位点Pro-Gly-Ala-Ala-His-Tyr处切割);HRV 3C蛋白酶(在其切割位点Leu-Glu-Val-Leu-Phe-Gln-Gly-Pro处的谷氨酰胺残基后切割)。在一些实施方式中,由胞内蛋白酶切割可切割接头。在一些实施方式中,由胞外蛋白酶切割可切割接头。
“内含子”是指基因中通过RNA剪接除去以生成基因最终成熟RNA产物的任意核苷酸序列。换而言之,靶向载体包含核酸序列,其在转录时促进感兴趣的基因编码的前-RNA从由修饰的靶基因座转录的前-RNA上切割,允许转基因从靶基因座的mRNA分开翻译(或者,如果转基因编码siRNA、miRNA等)。内含子一般包含5′剪接位点(剪接供体)、3’剪接位点(剪接受体)和分支点。剪接供体在内含子的5′端包括几乎不变的序列GU。剪接受体用几乎不变的AG序列终止内含子。在剪接受体的上游(5′方向),存在富嘧啶(C和U)区域或多聚嘧啶序列。在该多聚嘧啶序列的上游是分支点,其包含腺嘌呤核苷酸。除了包含这些元件以外,靶向载体可包含一个或多个促进从感兴趣的基因转录的mRNA的翻译的其他序列,例如,Kozak共有序列、核糖体接合位点、内部核糖体进入位点等。设置为内含子的感兴趣基因可在编码聚腺苷酸化序列的核酸序列5’任意位置的靶基因座的转录序列内的整合位点处插入,例如,靶基因座处基因的3’非翻译区,编码序列,或5’非翻译区。
如上所述,在一些情况中,可能需要向靶基因座中插入2个或更多个感兴趣的基因,例如,3个或更多个,4个或更多个,或5个或更多个感兴趣的基因。在这种情况中,可使用多个2A肽或IRES来产生双顺反子或多顺反子靶向载体。例如,可将转基因和可选择标记物在靶基因座处整合到基因的3’区中,使用2A肽来促进它们从靶基因座编码的多肽切割和互相切割。或者,可在靶向载体上提供在与靶向基因座处的基因的启动子不同的启动子控制下的感兴趣的编码序列。
一般而言,感兴趣的基因,2A肽和重组序列将位于靶向载体上以提供靶基因座处的基因在插入感兴趣的基因后的不间断表达。例如,如上所述,可能需要在靶基因座处基因的起始密码子的3’方向上或“下游”的整合位点中插入转基因,例如,在靶基因座处基因的起始密码子(即起始ATG)的3’方向上的前50个核苷酸内,例如,在起始密码子的3’方向上的前25个核苷酸内,在起始密码子的3’方向上的前10个核苷酸内,在起始密码子的3’方向上的前5个核苷酸内,或者在一些情况中,刚好在起始密码子的3’处,即与起始密码子相邻。在这种情况中,2A肽将位于靶向载体内,使得其刚好在感兴趣的基因的3’处,并且侧接经选择将引导同源重组并将感兴趣的基因整合到刚好在靶基因座处起始密码子3’处的整合位点中的重组序列。又例如,可能需要将感兴趣的基因插入整合位点,该整合位点是靶基因座处基因的终止密码子的5’方向上或“上游”,例如,在终止密码子(即,终止密码子,例如TAA、TAG或TGA)的5’方向的前50个核苷酸内,例如,在终止密码子的5’方向上的前25个核苷酸内,在终止密码子的5’方向上的前10个核苷酸内,在终止密码子的5’方向上的前5个核苷酸内,或者在一些实施方式中,刚好在终止密码子的5’处,即与终止密码子相邻。在这种情况中,2A肽将位于靶向载体内,使得其刚好在感兴趣的基因的5’处,并且侧接经选择将引导同源重组并将感兴趣的基因整合到刚好在靶基因座处终止密码子5’处的整合位点中的重组序列。
靶向载体也可包含序列,例如限制性位点、核苷酸多态性、可选择标记物等,其可用于评价感兴趣的基因在整合位点处的成功插入。一般而言,靶向载体也将包含含有序列,例如,病毒序列,例如复制起点、加帽基因、复制基因、ITR等的载体主链,其并不与感兴趣的靶区同源并且不用于插入感兴趣的靶区。
方法
在目标方法的实践中,细胞,例如有丝分裂细胞,有丝分裂后细胞在体外或体内与靶向载体接触。换而言之,细胞与靶向载体接触使得靶向载体被细胞摄入。可通过任意方便的方法将目标靶向载体导入细胞中,该方法导致靶向载体被细胞摄入,例如,作为裸核酸,作为与诸如脂质体或泊洛沙姆的试剂复合的核酸,或作为病毒(例如,腺病毒、AAV、逆转录病毒)中的遗传物质等。本领域熟知使细胞接触核酸载体(其为质粒)的方法如电穿孔、氯化钙转染和脂质转染,并且可使用其中的任意。本领域也熟知将核酸载体包装到病毒衣壳中,收获包含核酸载体的病毒颗粒,和使细胞与包含核酸载体的病毒颗粒接触的方法和系统,可使用其中的任意。一旦在细胞内,靶向载体可维持于附加体,例如,质粒,小环DNA,病毒如腺相关病毒,腺病毒、巨细胞病毒等,或者它们可通过同源重组或随机整合来整合到靶细胞基因组中,例如,逆转录病毒衍生载体,如MMLV、HIV-1、ALV等。
在一些实施方式中,以包含靶向载体的病毒颗粒向细胞提供靶向载体。在这种情况中,靶向载体一般将包含目标核酸序列,例如,转基因,促进2种独立基因产物产生的核酸序列,对靶整合位点同源的序列等作为与病毒基因组序列相关的异源序列,例如,反向末端重复(ITR)。在其生命循环中包括DNA阶段的任何病毒都可用作目标方法和组合物中的病毒载体。例如,病毒可以是单链DNA(ssDNA)病毒或双链DNA(dsDNA)病毒。同样合适的是在其生命循环中有DNA阶段的RNA病毒,例如,逆转录病毒,例如,MMLV、慢病毒,其被逆转录成DNA。病毒可以是整合病毒或非整合病毒。
例如,腺相关病毒特别适用于目标方法。腺相关病毒或“AAV”表示病毒本身或其衍生物。除非另有说明,该术语涵盖所有的亚型以及天然产生和重组形式,例如,1型AAV(AAV-1)、2型AAV(AAV-2)、3型AAV(AAV-3)、4型AAV(AAV-4)、5型AAV(AAV-5)、6型AAV(AAV-6)、7型AAV(AAV-7)、8型AAV(AAV-8)、9型AAV(AAV-9)、禽AAV、牛AAV、犬AAV、马AAV、灵长类AAV、非灵长类AAV、羊AAV、杂交AAV(即,包含一种AAV亚型的衣壳蛋白和另一种亚型的遗传物质的的AAV)、包含突变AAV衣壳蛋白或嵌合AAV衣壳(即,具有来自2种或更多种AAV血清型的区或结构域或单个氨基酸的衣壳蛋白,例如,AAV-DJ、AAV-LK3、AAV-LK19)的AAV等。
可使用本领域已知的方法构建包含感兴趣的异源核酸序列,例如转基因,促进2种独立基因产物产生的核酸序列,与靶整合位点同源的序列等并且用于生成rAAV病毒粒子的AAV表达载体。参见,例如,Koerber等,(2009)Mol.Ther.17:2088;Koerber等,(2008)Mol Ther.16:1703-1709;美国专利号7,439,065、6,951,758和6,491,907。例如,可将异源序列直接插入已经从中切去主要AAV开放阅读框(“ORF”)的AAV基因组中。也可删除AAV基因组的其他部分,只要保留允许复制和包装功能的足够ITR部分。可使用本领域已知的技术设计这类构建体。参见美国专利号5,173,414和5,139,941;国际公开号WO 92/01070(1992年1月23日公开)和WO 93/03769(1993年3月4日公开);Lebkowski等,(1988)Molec.Cell.Biol.8:3988-3996;Vincent等,(1990)Vaccines 90(冷泉港实验室出版社);Carter,B.J.(1992)Current Opinion in Biotechnology 3:533-539;Muzyczka,N.(1992)Curr.Topics Microbiol.Immunol.158:97-129;Kotin,R.M.(1994)Human Gene Therapy 5:793-801;Shelling和Smith(1994)Gene Therapy1:165-169;以及Zhou等,(1994)J.Exp.Med.179:1867-1875。
为了产生rAAV病毒粒子,使用已知技术,如通过转染将AAV表达载体导入合适的宿主细胞中。多种转染技术是本领域一般已知的。参见例如,Graham等,(1973)Virology,52:456;Sambrook等(1989)《分子克隆,实验室手册》(Molecular Cloning,A Laboratory Manual),纽约州冷泉港实验室;Davis等,(1986)《分子生物学基本方法》(Basic Methods in Molecular Biology),Elsevier,和Chu等,(1981)Gene 13:197。特别合适的转染方法包括磷酸钙共沉淀(Graham等,(1973)Virol.52:456-467)、直接微注射到培养的细胞中(Capecchi,M.R.(1980)Cell 22:479-488)、电穿孔(Shigekawa等,(1988)BioTechnigues 6:742-751)、脂质体介导的基因转移(Mannino等,(1988)BioTechniques 6:682-690)、脂质-介导的转导(Felgner等,(1987)Proc.Natl.Acad.Sci.USA 84:7413-7417),和使用高速微粒的核酸递送(Klein等,(1987)Nature 327:70-73)。
用于产生rAAV病毒粒子的合适宿主细胞包括微生物、酵母细胞、昆虫细胞、和哺乳动物细胞,并且可以或已经用作异源DNA分子的受主。该术语包括已经转染的原始细胞的后代。因此,本文所用的“宿主细胞”一般是指已经用外源性DNA序列转染的细胞。可使用来自稳定人细胞系293的细胞(易于通过例如美国典型培养物保藏中心的登录号ATCC CRL1573获得)。例如,人细胞系293是人胚肾细胞系,其已经用5型腺病毒DNA片段转化(Graham等,(1977)J.Gen.Virol.36:59)并且表达腺病毒E1a和E1b基因(Aiello等,(1979)Virology 94:460)。易于转染293细胞系,并且提供产生rAAV病毒粒子的便捷平台。在昆虫细胞中产生AAV病毒粒子的方法为本领域已知,并且可用于产生目标rAAV病毒粒子。参见例如,美国专利公开号2009/0203071;美国专利号7,271,002;和Chen(2008)Mol.Ther.16:924。
产生的AAV病毒可以是复制型或复制缺陷型。“复制型”病毒(例如,复制型AAV)是指感染性并且也能够被复制到感染的细胞中(例如,在辅助病毒或辅助病毒功能存在下)的表型上野生型的病毒。在AAV的情况中,复制型一般需要存在功能性AAV包装基因。一般而言,由于缺少一个或多个AAV包装基因,本文所述的rAAV载体在哺乳动物细胞(尤其是人类细胞)中是复制缺陷型。一般而言,这类rAAV载体缺少任意AAV包装基因序列以最小化通过AAV包装基因和进入的rAAV载体之间的重组生成复制型AAV的可能性。在许多实施方式中,本文所述的rAAV载体制备物是含有很少(如果存在)的复制型AAV(rcAAV,也称为RCA)的那些(例如,少于1rcAAV/102个rAAV颗粒,少于约1rcAAV/104个rAAV颗粒,少于约1rcAAV/108个rAAV颗粒,少于约1rcAAV/1012个rAAV颗粒,或没有rcAAV)。
细胞可与目标靶向载体,例如,以质粒,以病毒等在体外或体内接触。如果体外接触,细胞可来自建立的细胞系或者它们可以是原代细胞,其中“原代细胞”、“原代细胞系”和“原代培养物”在本文中可互换使用以指代已经来自对象并且经修饰而没有明显进一步培养,即,“离体”修饰的细胞和细胞培养物,例如,用于回到对象中,或者允许在体外生长有限代,即,培养物分裂。例如,原代培养物是可能已经传代0次、1次、2次、4次、5次、10次、或15次的培养物,但次数不足以通过危机期(crisis stage)。一般而言,本发明的原代细胞系在体外保持少于10代。一般而言,待接触的细胞允许同源重组。
如果细胞是原代细胞,它们可通过任何方便方法从个体中收获。例如,可通过单采血液成分术、白细胞单采血液成分术、密度梯度离心等方便地收获白细胞,同时通过活检最方便地收获来自组织如皮肤、肌肉、骨髓、脾脏、肝脏、胰腺、肺、肠、胃等的细胞。可使用合适的溶液来分散或悬浮收获的细胞。这类溶液一般会是平衡盐溶液,例如,整理盐水、PBS、汉克斯平衡盐溶液等,一般补充胎牛血清或其他天然产生的因子,与低浓度(一般为5-25mM)的可接受的缓冲液联用。方便的缓冲液包括HEPES,磷酸盐缓冲液、乳酸盐缓冲液等。可立即使用细胞,或者,它们可长时间储存、冷冻,解冻并且能够重复使用。在这种情况中,细胞通常将在10%DMSO,50%血清,40%缓冲的培养基,或且本领域常用的一些其他溶液中冷冻以在这类冷冻温度下保存细胞,并且以本领域已知的解冻冷冻的培养细胞的方式解冻。
为了在体外诱导DNA整合,向细胞提供靶向载体,例如病毒,持续约30分钟至约24小时,例如,1小时、1.5小时、2小时、2.5小时、3小时、3.5小时、4小时、5小时、6小时、7小时、8小时、12小时、16小时、18小时、20小时、或约30分钟至约24小时的任意其他时间段,其可以约每天至约每4天,例如,每1.5天、每2天、每3天,或约每天至约每4天的任意其他频率的频率重复。可一次或多次,例如,1次,2次,3次或超过3次向目标细胞提供靶向载体,并且在各接触事件之后允许细胞与靶载体孵育一段时间,例如,16-24小时,在这之后用新鲜培养基替换培养基并且另外培养细胞。
将细胞与靶向载体接触可发生在任何培养基中并且可在促进细胞存活的任何培养条件下。例如,细胞可以在任何方便的合适营养培养基中悬浮,如伊氏改良型DMEM或RPMI 1640,其补充胎牛血清或热灭活的山羊血清(约5-10%)、L-谷氨酰胺、硫醇(尤其是2-巯基乙醇)和抗生素,例如,青霉素和链霉素。培养基可含有细胞响应的生长因子。本文定义的生长因子是能够通过跨膜受体上的特异性作用,在培养物或完整组织中促进细胞的存活、生长和/或分化的分子。生长因子包括多肽和非多肽因子。
一般而言,向细胞提供有效量的靶向载体以促进重组和整合。有效量的靶载体是相对于阴性对照,例如,与空载体接触的细胞观察到诱导其中转基因整合的细胞数量增加2倍或更多的量。可通过任何常规方法测量整合的量。例如,可通过例如,流式细胞术检测基因座中感兴趣的基因的存在。可使用将扩增靶基因座的引物来进行PCE或Sourthern杂交来检测插入的存在。可通过Western,ELISA确定整合的感兴趣的基因的表达或活性,其测试在与供体多核苷酸接触例如2小时、4小时、8小时、12小时、36小时、48小时、72小时或更长之后的蛋白质活性。又例如,可通过共整合成像标记物或可选择标记物,并且检测细胞中成像或可选择标记物的存在来测量整合。
一般而言,使用目标组合物和方法的细胞遗传修饰不会伴随基因在修饰的基因座,即靶基因座处的表达破坏。换而言之,在将感兴趣的基因靶向整合到靶基因座中后,靶基因座处的基因正常表达在空间和时间上维持,并且保持在相对于正常水平基本无变化的水平上,例如,与正常水平相差5倍或更少的水平,例如,与正常水平相差4倍或更少,或3倍或更少,更通常2倍或更少。
在一些情况中,可通过分离遗传修饰的细胞与其余的群来针对包含转基因的细胞富集细胞群。遗传修饰的细胞的分离一般依赖于共整合到靶基因座中的可选择标记物的表达。“可选择标记物”表示可用于选择细胞,例如,已经由本申请的组合物靶向的细胞的试剂。在一些情况中,选择可以是阳性选择;即从群中分离细胞,例如,以产生包含遗传修饰的细胞的富集群。在其他情况中,选择可以是阴性选择;即从细胞中分离群,例如,以产生包含遗传修饰的细胞的富集群。可通过对使用的可选择标记物可视的方便分离技术来进行分离。例如,如果已经插入了荧光标记物,可通过荧光活化的细胞分选来分离细胞,而如果已经插入了细胞表面标记物,可通过亲核分离技术,例如磁性分离、亲核色谱、用与固体机制接合的亲核试剂“淘选”或其他常规技术来从异源群中分离细胞。提供准确分离的技术包括,荧光活化的细胞分选仪,它可具有不同的复杂程度,例如多个色通道、低角度和钝角光散射检测通道、阻抗通道等。可通过采用与死细胞相关的染料(例如,碘化丙啶)来针对死细胞选择细胞。可采用不会对遗传修饰的细胞活力产生过度有害影响的任何技术。
通过这种方式实现了对包含转基因的细胞高度富集的细胞组合物。“高度富集”表示遗传修饰的细胞将占细胞组合物的70%或更高、75%或更高、80%或更高、85%或更高、90%或更高,例如,占细胞组合物的约95%或更高、或98%或更高。换而言之,组合物可以是遗传修饰的细胞的基本纯的组合物。
通过本文所述的方法产生的遗传修饰的细胞可立即使用。或者,细胞在液氮温度下冷冻并且长期储存,解冻并且能够重复使用。在这种情况中,细胞通常将在10%DMSO,50%血清,40%缓冲的培养基,或且本领域常用的一些其他溶液中冷冻以在这类冷冻温度下保存细胞,并且以本领域已知的解冻冷冻的培养细胞的方式解冻。
可在各种培养条件下培养遗传修饰的细胞。细胞可在培养中增殖,即,在促进其增殖的条件下生长。培养基可以是液体或办液体,例如,含有琼脂、甲基纤维素等。细胞群可以在合适营养培养基中悬浮,如伊氏改良型DMEM或RPMI 1640,一般补充胎牛血清(约5-10%)、L-谷氨酰胺,硫醇,尤其是2-巯基乙醇,和抗生素,例如,青霉素和链霉素。培养基可含有细胞响应的生长因子。本文定义的生长因子是能够通过跨膜受体上的特异性作用,在培养物或完整组织中促进细胞的存活、生长和/或分化的分子。生长因子包括多肽和非多肽因子。
可将已经通过这种方式遗传修饰的细胞移植到对象中用于诸如基因治疗的目的,例如,以治疗疾病,或作为抗病毒、抗病原体或抗癌治疗剂,用于产生农业中遗传修饰的生物体,或用于生物研究。对象可以是新生、幼年或成年。特别感兴趣的是哺乳动物对象。可用本发明的方法治疗的哺乳动物物种耗用包括犬科和猫科;马科;牛科;羊科等,以及灵长类,尤其是人类。动物模型,尤其是小型哺乳动物,例如鼠类,兔类等可用于实验研究。
细胞可单独或与合适的物质或基质一起向对象提供,例如,以支持它们在其植入的组织中的生长和/或组织。通常,给予至少1x103个细胞,例如,5x103个细胞、1x104个细胞、5x104个细胞、1x105个细胞、1x106个细胞或更多。可通过任意以下途径向对象引入细胞:胃肠外、皮下、静脉内、颅内、脊柱内、眼内、或进入脊液。可通过注射、导管等引入细胞。局部递送,即向损伤位点递送的方法的示例包括例如,通过奥马耶储器,例如用于鞘内递送(参见例如,美国专利号5,222,982和5385582,通过引用纳入本文);通过推注,例如,通过注射器例如进入关节;通过连续输注,例如,通过插管,例如,用对流(参见例如,美国申请号20070254842,通过引用纳入本文);或通过其上已经可逆固定有植入细胞的装置(参见例如,美国申请号20080081064和20090196903,通过引用纳入本文)。
向对象给予治疗的次数可变化。将遗传修饰的细胞引入所述对象可为一次事件;但在某些情况中,所述治疗可在有限的时间引起改善并需要持续的一系列重复治疗。在其它情况中,在观察到效果之前可能需要多次给予遗传修饰的细胞。确切的方案取决于疾病或病症、疾病的阶段和正接受治疗的个体对象的参数。
在本发明的其他方面中,采用靶向载体来体内修饰细胞DNA。在这些体内实施方式中,向个体直接给予靶向载体,例如,以病毒。可通过多种本领域已知的向对象给予核酸的方法来给予靶向载体。可将靶向载体整合到多种制剂中。更具体地,可通过与合适的药学上可接受的运载体获悉试剂组合来将本发明的靶向载体配制成药物组合物。
药物制备物是在药学上可接受的载剂中包含靶向载体(例如作为病毒)的组合物。“药学上可接受的载剂”指被联邦或州政府管理机构批准或可被批准,或美国药典或其它通常接受的药典所列的用于哺乳动物,如人类的载剂。术语“载剂”是指用以配制本发明的化合物来给予哺乳动物的稀释剂、佐剂、赋形剂或运载体。这类药物载剂可以是脂质,例如,脂质体,例如,脂质体枝状聚合物;液体,如水和油,包括石油、动物、织物或合成来源的那些,如花生油、大豆油、矿物油、芝麻油等,盐水;阿拉伯胶、明胶、淀粉糊剂、滑石、角蛋白、硅胶、尿素等。此外,助剂,稳定剂,增稠剂,润滑剂和着色剂也可能使用。可将药物组合物配制成固体、半固体、液体或气体形式,如片剂、囊剂、粉末、颗粒剂、油膏、溶液、栓剂、注射剂、吸入剂、凝胶、微球和气溶胶。因此,靶向载体的给予可以多种方式实现,包括经口、含服、经直肠、胃肠外、腹膜内、眼内、皮内、透皮、气管内等给予。活性剂可在给药后是全身性的或者可通过使用区域给药、组织内给药、或使用在植入位点处保持活性剂量的植入物定位。活性剂可配制用于瞬时活性,或者其可配制用于缓释。
对于一些病症,尤其是中枢神经系统病症,需要配制药剂以穿过血脑屏障(BBB)。将药物递送通过血脑屏障(BBB)的一个策略要求通过渗透手段如甘露醇或白三烯,或通过使用血管活性物质如缓激肽在生化上破坏BBB。使用BBB开口来将特异性药剂靶向脑部肿瘤的潜力也是一个选项。当通过血管内注射给予本发明的组合物时,BBB破坏剂可与该治疗组合物共同给予。通过BBB的其他策略需要使用内源性转运系统,包括窖蛋白-1介导的转胞吞作用,运载体介导的转运蛋白如葡萄糖和氨基酸运载体,受体介导的针对胰岛素或转铁蛋白的转胞吞作用,和活性外排转运蛋白如p-糖蛋白。活性转运部分也可偶联至治疗性化合物用于本发明来促进转运通过血管的内皮壁。或者,BBB后的治疗剂的药物递送可通过局部递送,例如,通过奥马耶储器,例如用于鞘内递送(参见例如,美国专利号5,222,982和5385582,通过引用纳入本文);通过推注,例如,通过注射器例如玻璃体内或颅内;通过连续输注,例如,通过插管,例如,用对流(参见例如,美国申请号20070254842,通过引用纳入本文);或通过其上已经可逆固定有药剂的装置(参见例如,美国申请号20080081064和20090196903,通过引用纳入本文)。
一般而言,提供了有效量的靶向载体。关于离体方法如上所述,体内有效量或有效剂量的靶向载体是诱导细胞数量2倍或更多增加的量,该细胞中相对于阴性对照,例如,与空载体或不相关多肽接触的细胞,可观察到靶向载体和靶基因座之间的重组。可通过方便方法测量重组的量,例如,如上所述和本领域已知。计算待给予的靶向载体的有效量或有效剂量在本领域普通技术人员的技能之内并且对于本领域技术人员而言是常规的。无须再言,待给予的最终量将取决于给药途径和待治疗的疾病或病症的性质。
给予特定患者的有效量将取决于多种因素,其中的几种可能在患者间不同。称职的临床医师将能够确定给予患者以根据需要停止或逆转疾病病症过程的靶向载体的有效量。使用LD50动物数据,和药剂的其他可得信息,临床医师能根据给药途径确定个体的最大安全剂量。例如,静脉内给予的剂量可能超过鞘内给予的剂量,考虑到给予治疗性组合物的流体的更大体量。类似地,从身体快速清除的组合物可以更高剂量给予,或重复剂量给予,以保持治疗性浓度。采用普通技术,称职的临床医师将能够在常规临床试验的过程中优化特定治疗剂的剂量。
为了纳入药物,靶向载体可获自合适的市售来源。作为一般性建议,每剂中胃肠外给予的靶向载体的总药学上有效量将在可通过剂量响应曲线测量的范围内。
基于靶向载体的治疗必须是无菌的。易于通过过滤通过无菌滤膜(例如,0.2μm膜)来实现无菌性。治疗性组合物一般将被置于具有无菌进入端口的容器中,例如,可用皮下注射针头刺穿的塞子的静脉内溶液包或瓶中。基于靶向载剂的治疗剂可以水性溶液或冻干的制剂储存在单位或多剂容器中,例如,密封的安瓿或瓶中用于重建。作为冻干制剂的示例,用5ml无菌过滤的1%(w/v)的化合物水溶液填充10-mL瓶中,并且冻干所得的混合物。通过使用注射用抑菌水重建冻干的化合物来制备输注溶液。
根据所需的制剂,药物化合物可包括药学上可接受的,无毒性运载体稀释剂,其定义为通常用于配制用于动物或人给药的药物组合物的载剂。选择稀释剂以不影响组合的生物活性。这类稀释剂的示例是蒸馏水、缓冲水、生理盐水、PBS、林格氏溶液、右旋糖溶液和汉克斯溶液。另外,药物组合物或制剂可包含其他运载体,佐剂,或非毒性、非治疗性、无免疫原性稳定剂,赋形剂等。组合物也可包括其他物质来模拟生理条件,如pH调节和缓冲剂、毒性调节剂、润湿剂和去污剂。
组合物也可包括多种稳定剂中的任一种,如抗氧化剂。当药物组合物包含多肽时,该多肽可与多种增强多肽的体内稳定性,或者增强其药物性质(例如,增加多肽的半衰期,降低其毒性,增加溶解性或摄取)的已知化合物络合。这类修饰或络合剂的示例包括硫酸盐、葡萄糖酸盐、柠檬酸盐和磷酸盐。组合物的核酸或多肽可与增强其体内属性的分子络合。这类分子包括,例如,碳水化合物、多胺、氨基酸、其他肽、离子(例如,钠、钾、钙、镁、锰)、和脂质。
可在《雷明顿药物科学》(Remington′s Pharmaceutical Sciences),宾夕法尼亚州费城的马克出版公司(Mace Publishing Company),第17版,(1985)中找到关于适合各种类型给药的制剂的其他指导。关于药物递送方法的简单概述参见Langer,Science 249:1527-1533(1990)。
可给予药物组合物用于预防性和/或治疗性处理。可按照标准药学方法,包括例如在细胞培养物或实验动物中测定LD50(使50%群体死亡的剂量)和ED50(在50%群体中有效治疗的剂量)来确定活性成分的毒性和疗效。毒性和疗效的剂量比是治疗指数,并可表示为LD50/ED50。优选治疗指数大的疗法。
在一些实施方式中,以有效量给予对象的药物组合物显示出很少至没有肝脏毒性(例如,显示没有明显肝脏毒性、没有显示明显肝脏毒性、对肝脏基本没有毒性等)。可以多种方式测量肝脏毒性,如测量丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(ASP)之一、两者或其比率。在一些实施方式中,与在这种给药之前测量肝脏毒性相比(或与未处理的对照相比或与测量接受的正常范围的值,即参考值相比),给予有效量的药物组合物诱导肝脏毒性增加(通过选择的方便试验测量)少于50%(例如,少于40%、少于30%、少于20%、少于15%、少于10%、少于5%、少于4%、少于3%、少于2%、少于1%、少于0.5%、或0%)。在一些实施方式中,与这种给予前的测量相比(或与未处理的对照相比或与测量接受的正常范围的值,即参考值相比),给予有效量的药物组合物在肝脏毒性的测量中没有诱导统计学上显著增加(例如,p-值小于0.1、0.05、0.01或更低)。在一些实施方式中,与这种给予前的测量相比(或与未处理的对照相比或与测量接受的正常范围的值,即参考值相比),给予有效量的药物组合物降低肝脏毒性的测量(例如,在通过给药治疗的病症导致肝脏毒性时可能的结果)5%或更多(例如,10%或更多、15%或更多、20%或更多、30%或更多、40%或更多、50%或更多等)。
获自这些细胞培养和/或动物研究的数据可用于配制一定范围的剂量以用于人体。活性成分的剂量一般包括低毒性ED50的循环浓度范围内成线性。该剂量可根据所用的剂型和所用的给药途径在此范围内变化。
用于配制药物组合物的组分优选高纯度并且基本不含潜在有害污染物(例如,至少是国家食品级(NF),通常至少是分析级,并且更一般至少是药品级)。此外,用于体内使用的组合物通常是无菌的。在给定的化合物必须在使用前合成的情况中,所得的产物一般基本不含任何潜在毒性试剂,特别是任何内毒素,其可能在合成或纯化过程期间存在。用于胃肠外给药的组合物也是无菌的,基本等渗的并且在GMP条件下制备。
待给予特定患者的治疗性组合物的有效量将取决于多种因素,其中的几种可能在患者间不同。称职的临床医师将能够确定给予患者以根据需要停止或逆转疾病病症过程的治疗剂的有效量。使用LD50动物数据,和药剂的其他可得信息,临床医师能根据给药途径确定个体的最大安全剂量。例如,静脉内给予的剂量可能超过鞘内给予的剂量,考虑到给予治疗性组合物的流体的更大体量。类似地,从身体快速清除的组合物可以更高剂量给予,或重复剂量给予,以保持治疗性浓度。采用普通技术,称职的临床医师将能够在常规临床试验的过程中优化特定治疗剂的剂量。
应用
发现本文所述的方法和组合物可用于需要从细胞中的特定基因座表达转基因的任何体外或体内应用,例如,当需要以与靶基因座处的内源性基因相同的空间和时间限制模式在细胞中表达一种或多种转基因同时保持该基因座处内源性基因的表达并同时避免使用外源性核酸酶的风险时。通过使用目标方法和组合物编辑细胞的基因组,可相对于需要使用外源性核酸酶的方法实现多种益处。例如,使用目标方法和组合物将避免与向细胞提供外源性核酸酶相关的潜在免疫原性和基因毒性,该外源性核酸酶是多肽或编码核酸。也避免了核酸酶编码序列可能整合到基因组中并且随后稳定表达核酸酶的风险,这可能导致增强的免疫原性和基因毒性以及由驱动核酸酶表达的启动子活化相邻基因。
用于将一个或多个转基因在靶基因座处整合到细胞DNA的目标方法和组合物发现用于许多领域,包括,例如,基因治疗、农业、生物技术和研究。例如,这类修饰是治疗上有用的,例如,通过用基因的野生型拷贝补偿对象中的遗传突变来治疗遗传疾病;通过促进/增强细胞活性(例如,促进伤口愈合来治疗慢性伤口或预防急性伤口或瓣失败,通过增强与伤口愈合相关的细胞活性)促进天然发生的过程;调节细胞响应(例如,通过提供胰岛素来治疗糖尿病);在对象中,例如在特定细胞群中或在特定条件下表达抗病毒、抗病原体或抗癌治疗剂等。这种遗传修饰的其他用途包括在诱导的多潜能干细胞(iPSC)的诱导中,例如,以从个体产生iPSC用于诊断、治疗或研究用途;用于产生遗传修饰的生物体,例如用于制备通过细胞大规模产生蛋白质用于治疗、诊断或研究目的;在农业中,例如,用于产生改善的作物;或在研究中,例如,用于研究疾病的动物模型。
例如,目标方法和组合物可用于治疗对象中的疾病、病症或医疗状况。本文所用术语“治疗”、“处理”等通常指获得所需的药理学和/或生理学作用。从完全或部分防止疾病或其症状方面来说,这种作用可以是预防性的,和/或从部分或完全治愈疾病和/或由该疾病产生的不良影响来说,这种作用可以是治疗性的。本文所用术语“治疗”包括在哺乳动物中进行的任何疾病治疗,包括:(a)在可能易患该疾病或症状但尚未诊断患有该疾病的对象中防止该疾病的发生;(b)抑制疾病,即阻滞其发展;或(c)缓解疾病,即引起该疾病消退。可在疾病或损伤发生之前、期间或之后给予治疗剂。特别感兴趣的是治疗正在发作的疾病,其中治疗稳定化或降低患者的不希望临床症状。这种治疗理想地在受影响的组织中完全丧失功能之前进行。目标治疗将理想地在疾病的症状期给予,并且在一些情况中在疾病的症状期后给予。术语“个体”、“对象”、“宿主”和“患者”在本文中互换使用,指任何需要诊断、处理或治疗的哺乳动物对象,尤其是人。
为此,目标组合物的一个或多个转基因可包括编码治疗剂的基因。“治疗剂”表示试剂,例如,核酶、siRNA、shRNA、miRNA、肽、多肽等,其对细胞或个体有治疗效果,例如,促进生物过程来治疗医疗病症,例如,疾病或病症。
可使用目标方法和组合物整合到细胞基因组中的治疗剂的示例包括(即,整合的转基因编码)试剂如核酶、siRNA、shRNA、miRNA、肽(例如,核酸编码肽)、或多肽(例如,核酸编码多肽),其改变细胞活性。在一些情况中,转基因编码肽或多肽。考虑对其中表达肽或多肽(例如,通过编码该肽或多肽的核酸)的多细胞生物体有治疗活性的肽或多肽的示例包括,但不限于:因子VIII、因子IX、β-球蛋白、低密度脂蛋白受体、腺苷脱氨酶、嘌呤核苷磷酸化酶、鞘磷脂酶、葡糖脑苷脂酶、囊肿性纤维化跨膜传导调节蛋白、α1-抗胰蛋白酶、CD-18、鸟氨酸转氨甲酰酶、精氨基琥珀合成酶、苯丙氨酸羟化酶、支链α-酮酸脱氢酶、延胡索酰乙酰乙酸水解酶、葡萄糖6-磷酸酶、α-L-岩藻糖苷酶、β-葡糖醛酸糖苷酶、α-L-艾杜糖苷酸酶、半乳糖1-磷酸尿苷酰转移酶;神经保护因子,例如,神经营养因子(例如,NGF、BDNF、NT-3、NT-4、CNTF)、Kifap3、Bcl-xl、坍塌反应调节蛋白1、Chkβ、钙调蛋白2、可刺激神经调节蛋白、NPT1、Eef1a1、Dhps、Cd151、Morf412、CTGF、LDH-A、At11、NPT2、Ehd3、Cox5b、Tuba1a、γ-肌动蛋白、Rpsa、NPG3、NPG4、NPG5、NPG6、NPG7、NPG8、NPG9、NPG10、多巴胺、白介素、细胞因子、小肽、表1中所列的基因/蛋白质(参见下文:BCKDH复合物(E1a、E1b和E2亚基);甲基丙二酰-CoA变位酶;丙酰-CoA羧化酶(α和β亚基);异戊酰CoA脱氢酶;HADHA;HADHB;LCHAD;ACADM;ACADVL;G6PC(GSD1a);G6PT1(GSD1b);SLC17A3;SLC37A4(GSDlc);酸α-葡糖苷酶;OCTN2;CPT1;CACT;CPT2;CPS1;ARG1;ASL;OTC;UGT1A1;FAH;COL7A1;COL17A1;MMP1;KRT5;LAMA3;LAMB3;LAMC2;ITGB4;和/或ATP7B)等。上述蛋白质列表是指哺乳动物蛋白质,并且在许多实施方式中指人蛋白质,其中上述蛋白质的核苷酸和氨基酸序列一般为本领域技术人员所知。
表1.各种疾病中缺陷的基因/蛋白质列表
在其他情况中,转基因编码不编码蛋白质的RNA,例如,编码核酶的核酸、小发夹RNA(shRNA)、小RNA(miRNA)或其前体。本文所用术语“小RNA”是指任何类型的干扰RNA,包括但不限于内源性小RNA和人工小RNA(例如,合成miRNA)。内源性小RNA是在能够调节mRNA的复制利用的基因组中天然编码的小型RNA。人工小RNA可以是除了内源性小RNA以外的任何类型的RNA序列,其能够调节mRNA的活性。小RNA序列可以是有这些序列中的任意一种或多种组成的RNA分子。小RNA(或“miRNA”)序列已经描述于出版物,如Lim等,2003,Genes&Development,17,991-1008,Lim等,2003,Science,299,1540,Lee和Ambrose,2001,Science,294,862,Lau等,2001,Science 294,858-861,Lagos-Quintana等,2002,Current Biology,12,735-739,Lagos-Quintana等,2001,Science,294,853-857,和Lagos-Quintana等,2003,RNA,9,175-179中。小RNA的示例包括以下任意RNA:较大RNA的片段,或miRNA、siRNA、stRNA、sncRNA、tncRNA、snoRNA、smRNA、shRNA、snRNA,或其他小非编码RNA。参见例如,美国专利申请号20050272923、20050266552、20050142581、和20050075492。“小RNA前体”(或“前-miRNA”)是指具有其中有小RNA序列的茎环结构的核酸。“成熟小RNA”(或“成熟miRNA”)包括已经从小RNA前体(“前-miRNA”)上切下的小RNA,或者已经合成(例如,在实验室中无细胞合成)并且具有约19个核苷酸至约27个核算管,例如,具有19nt、20nt、21nt、22nt、23nt、24nt、25nt、26nt、或27nt的长度的成熟小RNA。成熟小RNA可结合至靶mRNA并且抑制靶mRNA的翻译。
可整合到靶基因座中的治疗剂的其他示例包括(即,整合的转基因编码)促进免疫预防的试剂(也称为在提花的免疫预防,或VIP)。促进免疫预防的试剂的示例包括但不限于:抗体或包含免疫球蛋白结构域和免疫效应结构域的嵌合多肽。作为非限制性示例,促进免疫预防的试剂了包括中和性抗体,或嵌合多肽,其针对选自以下的病原体有特异性:人免疫缺陷病毒(HIV)、流感病毒、呼吸道合胞病毒(RSV)、丙型肝炎病毒(HCV)、疟原虫(例如,恶性疟原虫(Plasmodium falciparum)、三日疟原虫(Plasmodium malaria)等)、真菌或细菌病原体等。例如,促进免疫预防的试剂了包括中和性抗体,或嵌合多肽,其靶向选自在以下株间保守的表位:人免疫缺陷病毒(HIV)、流感病毒、呼吸道合胞病毒(RSV)、丙型肝炎病毒(HCV)、疟原虫(例如,恶性疟原虫(Plasmodium falciparum)、三日疟原虫(Plasmodium malaria)等)、真菌或细菌病原体等。
在一些情况中,治疗剂改变其中表达该治疗剂的细胞的活性。换而言之,该试剂具有细胞内在效果。例如,该试剂可以是胞内蛋白质、跨膜蛋白质或分泌蛋白质,其在细胞中表达时,将取代或“补偿”细胞中的突变蛋白。在其他情况中,治疗剂改变其中表达该治疗剂的细胞以外的细胞的活性。换而言之,该试剂具有细胞外在效果。例如,整合的感兴趣的基因可编码细胞因子、趋化因子、生长因子、激素、抗体、或调节其他细胞活性的细胞表面受体。
可将目标方法和组合物应用到任何疾病、病症或天然细胞过程,其将受益于通过整合感兴趣的转基因来调节细胞活性。例如,目标方法和组合物发现用于治疗遗传疾病。可用目标组合物和方法治疗任何由确定的遗传缺陷导致的遗传疾病(例如,具有单个基因缺陷的疾病、具有2个缺陷基因、3个缺陷基因、4个缺陷基因、5个缺陷基因、2个或更多个缺陷基因、3个或更多个缺陷基因、4个或更多个缺陷基因、5个或更多个缺陷基因的疾病等)。缺陷可来自单个基因中的一个或多个突变(例如,1、2、3、4、5或更多突变),或者可来自2个或更多个基因(例如,3个或更多个基因、4个或更多个基因、5个或更多个基因、2个基因、3个基因、4个基因、5个基因等)中的一个或多个突变。由遗传缺陷导致的疾病的非限制性示例包括:血友病(例如,A型血友病、B型血友病)、支链有机酸尿症(例如,槭树糖浆尿病(MSUD)、异戊酸血症(IVA)、丙酸尿症(PA)和甲基丙二酸尿症(MMA)、3-甲基巴豆酰甘氨酸尿症、I型3-甲基戊烯二酸尿症、短/支链乙酰-CoA脱氢酶缺乏、2-甲基-3-羟基丁酰基-CoA脱氢酶缺乏、异丁酰基-CoA脱氢酶缺乏、3-羟基异丁酸尿症、丙二酸尿症等)、长链脂肪酸氧化疾病、糖原贮积病(例如,I型糖原贮积病(GSD1)、II型糖原贮积病、III型糖原贮积病、IV型糖原贮积病、V型糖原贮积病、VI型糖原贮积病、VII型糖原贮积病、VIII型糖原贮积病、IX型糖原贮积病、X型糖原贮积病、XI型糖原贮积病、XII型糖原贮积病、0型糖原贮积病等)、肉碱循环障碍、尿素循环障碍、克里格勒-纳贾尔综合征、遗传性酪氨酸血症、大疱性表皮松解症、肝豆状核变性(Wilson disease)、腺苷脱氨酶缺乏、镰状细胞疾病、X连锁重症联合免疫缺陷(SCID-X1)、地中海贫血、囊性纤维化、α-1抗胰蛋白酶缺乏、戴-布二氏贫血、高雪氏病、生长激素缺乏等。
又例如,目标方法和组合物发现用于治疗神经系统疾病和保护CNS免受神经系统疾病,例如,神经退行性疾病,包括例如,帕金森病、阿尔茨海默病、亨廷顿氏病、肌萎缩侧索硬化(ALS)、库夫斯病(巴藤病)、额颞叶痴呆与帕金森病、进行性核上性麻痹、匹克氏病、朊病毒病(例如,克雅二氏症)、淀粉样变性、青光眼、糖尿病视网膜病、衰老相关的黄斑变性(AMD)等);神经精神紊乱(例如,焦虑症(例如,强迫症)、情绪疾病(例如,抑郁)、儿童疾病(例如,注意力缺陷障碍、自闭症)、认知障碍(例如,谵妄、痴呆)、精神分裂症、物质相关疾病(例如,成瘾)、进食障碍等);离子通道病(例如,癫痫症、偏头痛等);溶酶体贮积症(例如,泰-萨二氏病、戈谢病、法布瑞氏症、庞帕病、尼曼-匹克氏病、黏多糖贮积症(MPS)和相关疾病等);CNS自身免疫疾病(例如,多发性硬化、脑脊髓炎、肿瘤伴随综合征(例如,小脑变性)、自身免疫内耳疾病、阵挛肌阵挛综合征等);脑梗死、中风、外伤性脑损伤和脊髓损伤。
又例如,目标方法和组合物可用于治疗医疗病症和疾病,其中需要异位表达治疗剂与促进组织修复、组织再生、或保护免受进一步组织损伤,例如,促进伤口愈合;促进细胞和/或相邻细胞的存活,例如,在退行性疾病中,例如,神经变形疾病、肾病、肝病等;预防或治疗感染等。
如何使用目标方法治疗医疗病症的其他示例公开于本发明的其他地方,或者对本领域普通技术人员而言是显而易见的。
目标方法和组合物发现用于对感兴趣的细胞进行成像,例如,包含整合的感兴趣的基因的细胞。同样,待整合的转基因(或转基因之一)可编码成像标记物。成像标记物表示可用于定位并且任选地可视化细胞,例如,已经由本申请的组合物靶向的细胞的非细胞毒性剂。成像部分可能需要加入底物来进行检测,例如,辣根过氧化物酶(HRP)、β-半乳糖苷酶、荧光素酶等。或者,成像部分可提供不需要添加用于检测的底物就可检测的信号,例如,荧光团或发色团染料,例如,Alexa Fluor或Alexa Fluor或者包含荧光团或发色团的蛋白质,例如,荧光蛋白。本文所用的荧光蛋白(FP)是指具有发荧光能力(即,在一个波长上吸收能力并且在另一个波长上发射能量)的蛋白质。例如,绿色荧光蛋白(GFP)是指在510nm或约510nm处的发射光谱上有峰的多肽。本领域已知在各种波长处发光的多种FP。感兴趣的FP包括但不限于,绿色荧光蛋白(GFP)、黄色荧光蛋白(YFP)、橙色荧光蛋白(OFP)、青色荧光蛋白(CFP)、蓝色荧光蛋白(BFP)、红色荧光蛋白(RFP)、远红荧光蛋白、或近红外荧光蛋白、及其变体。
又例如,目标方法和组合物发现可用于分离感兴趣的细胞,例如,包含整合的转基因的细胞。为此,待整合的转基因(或转基因之一)可编码可选择标记物。“可选择标记物”表示可用于选择细胞,例如,已经由本申请的组合物靶向的细胞。在一些情况中,选择可以是阳性选择;即从群中分离细胞,例如,以产生包含遗传修饰的富集的细胞群。在其他情况中,选择可以是阴性选择;即从细胞中分离群,例如,以产生包含遗传修饰的细胞的富集群。可采用任何方便的可选择标记物,例如,药物选择标记物,例如,在药物存在下防止细胞死亡的标记物,在药物存在下促进细胞死亡的标记物,成像标记物等;可选择用于使用成像技术的成像标记物,例如,荧光活化的细胞分选;可选择用于使用亲和分离技术的多肽或肽,例如荧光活化的细胞分选、磁性分离、亲和色谱、用与固体基质接合的亲和试剂“淘选”等。
在一些情况中,转基因可偶联至例如,在试剂,例如辅因子或药物存在/缺失下调节编码的蛋白质的稳定性的编码结构域。可使用的去稳定化结构域的非限制性示例包括在雷帕霉素衍生的C20-MaRap缺失下不稳定的突变FRB结构域(Stankunas K等,(2003)使用敲入小鼠和二聚化的化学诱导剂的条件等位基因(Conditional protein alleles using knockin mice and a chemical inducer of dimerization).Mol Cell.12(6):1615-24);在其配体Shield-1缺失下代谢不稳定的FKBP12突变多肽(Banaszynski LA等,(2006)一种使用合成小分子调控活细胞中蛋白质功能的快速、可逆和可调节方法(A rapid,reversible,and tunable method to regulate protein function in living cells using synthetic small molecules).Cell.126(5):995-1004);在甲氧苄啶(TMP)缺失下代谢不稳定的突变大肠杆菌二氢叶酸还原酶(DHFR)多肽(Mari Iwamoto等,(2010)一种调控哺乳动物中枢神经系统中蛋白质稳定性的一般化学方法(A general chemical method to regulate protein stability in the mammalian central nervous system).Chem Biol.2010年9月24日;17(9):981-988)等。
如上所述,可整合本领域普通技术人员想要在细胞中表达的任何核酸序列可整合到靶基因座中,例如,任何编码非编码RNA的核酸,例如,核酶、siRNA、shRNA、miRNA、或长非编码RNA;或任何编码编码肽或多肽的RNA的核酸序列。在一些情况中,可整合超过一种待表达的序列,例如,可整合2个或更多个感兴趣的多核苷酸,可整合3个或更多个多核苷酸,可整合4个或更多个多核苷酸,例如可整合5个或更多个多核苷酸。因此,例如,可整合治疗性基因和成像标记物;可整合治疗性基因和非编码RNA;可整合治疗性基因和可选择标记物,可整合成像标记物和可选择标记物,可整合治疗性基因、成像标记物和可选择标记物等。
试剂、装置和试剂盒
也提供试剂、装置和其试剂盒以使用一个或多个上述描述方法。对象试剂、装置和其试剂盒可有很多变化。
除上述组分以外,主题试剂盒还将包含用于实践主题方法的说明书。这些说明书可以多种形式存在于目标试剂盒中,其中的一种或多种可存在于试剂盒中。试剂盒包装或包装插页等中的这些说明书存在的一种形式是在合适的介质或基材上的印刷信息,例如,上面印刷信息的一张或多张纸。另一种方式是其上可纪录信息的计算机可读介质,例如,盘、CD等。可以存在的另一种方式是可通过互联网在远处获得信息的网址。试剂盒中可存在任何方便方式。
实施例
提供以下实施例的目的是向本领域普通技术人员完整地公开和描述如何制备和使用本发明,这些实施例不意在限制发明人认为的发明范围,也不代表下述实验是所进行的所有或仅有的实验。努力保证所用数值(如量、温度等)的准确性,但应允许一些实验误差和偏差。除非另有说明,份数是重量份数,分子量是重量平均分子量,温度是摄氏度,压力是大气压或接近大气压。
分子和细胞生物化学中的一般方法可在下列标准教科书中找到:如《分子克隆:实验室手册》(Molecular Cloning:A Laboratory Manual)第三版(Sambrook等,港实验室出版社,2001);《分子生物学简明实验方案》(Short Protocols in Molecular Biology),第4版(Ausubel等编,约翰韦利森公司,1999);《蛋白方法》(Protein Methods)(Bollag等,约翰韦利森公司,1996);《基因治疗的非病毒载体》(Nonviral Vectors for Gene Therapy)(Wagner等编,学术出版社,1999);《病毒载体》(Viral Vectors)(Kaplift和Loewy编,学术出版社,1995);《免疫学方法手册》(Immunology Methods Manual)(I.Lefkovits编,学术出版社,1997);和《细胞和组织培养:生物技术中的实验室方法》(Cell and Tissue Culture:Laboratory Procedures in Biotechnology)(Doyle和Griffiths,约翰韦利森公司,1998),其内容通过引用纳入本文。本公开中提及的用于遗传操作的试剂、克隆载体和试剂盒可购自商品供应商,如伯乐公司(BioRad)、斯查塔基公司(Stratagene)、英杰公司(Invitrogen)、西格玛-奥德里奇公司(Sigma-Aldrich)和克隆泰克公司(Clontech)。
实施例1
不使用核酸酶的体内基因靶向促进了新生或成年小鼠的AAV8载体注射之后的hF-IX治疗水平。
实现治疗性水平的位点特异性基因靶向通常假定需要使用与脱靶效应相关的内源性核酸酶(例如,CRISPR、TALEN、ZFN)。具体地,递送内源性核酸酶编码载体用于体内应用可导致由持续表达衍生的不良免疫结果以及基因毒性。避免使用核酸酶,我们在体内进行AAV8载体介导的少启动子hF-IX基因靶向白蛋白基因座用于治疗B型血友病。之前是编码2A-肽的序列的少启动子hF-IX基因侧接同源臂,其将其整合以DNA融合物靶向白蛋白ORF。hF-IX表达因此与稳定的白蛋白表达在转录、RNA加工、定位和稳定性、翻译起始和ER定位水平上连锁。2A肽诱导核糖体跳跃,由此标记而不破坏白蛋白。通过避免使用核酸酶而最小化脱靶整合,并且缺少载体传播的启动子消除了由罕见的脱靶整合导致相邻癌基因活化的风险。
首先,我们以2.5e11Vg/小鼠用编码hF-IX靶向盒的AAV8载体对2天龄B6小鼠进行IP注射。我们然后从生命的第4周开始每周跟踪血浆hF-IX水平。血浆hF-IX水平在正常的约10%处达到平衡,其在临床上对应于显著的疾病缓解。重要的是,hF-IX血浆水平在2/3肝切除后迅速反弹回到其原始水平,由此建立了稳定的转基因整合。通过进行RT,之后接头连接,无偏PCR并测序,我们验证了hF-IX表达基本完全来自靶上整合。具体地,该方法并没有检测到来自附加体或来自任何脱靶整合的任何hF-IX表达。其他进一步证据来自当使用抗2A肽或抗白蛋白抗体时重叠的Western印迹信号。使用抗-hF-IX探针的Northern印迹显示在白蛋白-hF-IX融合mRNA的预期大小处的单一条带。接着,我们检查与新生相关的肝细胞分裂对于治疗水平的基因靶向是否必要。以1e12Vg/小鼠用我们的AAV8载体对成年小鼠进行尾静脉注射。每周监测hF-IX水平显示在正常的15%处的稳定表达。我们现在B型血友病小鼠中重复这些研究并且使用qPCR、IHC和NGS来对靶上整合率和脱靶整合的分别进行定量。
结果,AAV介导的体内非破坏性和少启动子基因靶向方法可同时应用于新生和成年。以2A-融合体将转基因整合靶向高度表达的内源性基因可消除对核酸酶的需要,因此消除了脱靶效应,同时允许治疗水平的转基因表达。
实施例2
方法
对于载体构建,首先将跨终止密码子的Alb基因组DNA的片段插入pTRUF质粒主链上的AAV2 ITR之间(Lisowski等,Molecular therapy:the journal of the American Society of Gene Therapy 20,1912-1923,2012)。然后以巢式插入P2A编码序列和hF9 cDNA。对于反向对照,切除中心区段并且以相反取向整合回。在HEK293细胞中产生rAAV8并且通过点印迹滴定。用2.5e11vg的rAAV8(hF9或反向)腹膜内注射入2天龄B6小鼠,并且从生命的第4周开始通过眼球后采血每周采血。成年B6小鼠接受1e12vg的rAAV8(hF9或反向)的尾静脉注射或3.5e12vg质粒的高压注射,并且类似地每周采血用于ELISA。按照成熟方案进行2/3部分肝切除(PH)。在PH时和处死小鼠后收集用于DNA、RNA和蛋白质分析以及IHC的肝组织。按照成熟的方案对用于hF9 IHC的冷冻肝组织进行切片和染色。TaqMan qPCR试验、Northern和Western印迹使用成熟方案。如前所述,在B型血友病敲除小鼠上进行aPTT试验(Shi等,Gene therapy 20,987-996,2013)。
结果
进行无核酸酶的重组腺相关病毒(rAAV)介导的少启动子基因靶向以改善B型血友病小鼠的出血素质。具体地,少启动子人凝结因子IX(hF9)基因靶向肝脏表达的白蛋白(Alb)基因座。hF9与在前的2A-肽编码序列一起靶向,以正好在Alb终止密码子上游整合。虽然hF9在DNA和RNA水平上融合至Alb,通过核糖体跳跃的方式合成2种分离蛋白质。因此,hF9表达与稳定肝脏白蛋白表达连锁而不破坏它。将AAV8-hF9载体注射到新生和成年小鼠中以实现肝细胞中约0.5%的白蛋白等位基因中的靶整合。已经确认hF9仅从靶上整合产生并且核糖体跳跃是非常高效的。获得了正常的7-20%的稳定hF9血浆水平,并且受处理的因子IX缺陷型小鼠有正常的凝结时间。以2A-融合物向高度表达的内源性基因的转基因整合避免了对核酸酶和/或载体传播启动子的需求。该示例性方法允许通过极大消除了脱靶效果同时仍然提供来自整合的治疗性表达水平来对幼年和成年进行安全和有效的基因靶向。
靶向hF9基因,其在影响1/30,000男性的X连锁阴性疾病B型血友病中缺乏。由于从肝脏产生的血浆凝结因子IX的缺乏,受影响的个体患有严重的自发性出血。重建哪怕1-2%的凝结因子可显著改善生物质量,而重建5-20%将极大改善出血素质。使用嗜肝rAAV8血清型来靶向用于在从稳定肝特异性Alb启动子整合后表达的hF9。我们假定:(1)Alb启动子应该允许高水平的凝结因子产生,即使整合仅发生在小部分的肝细胞中;和(2)在Alb基因座处的高转录活性使其更易于通过同源重组进行转基因整合。
没有核酸酶的基因靶向应该仅影响肝脏中小部分的Alb等位基因。无论如何,我们选择通过在Alb阅读框的末端以2A-融合靶向hF9来最小化Alb基因的破坏和异常(图8A)。来自正链RNA病毒的2A-肽允许通过核糖体跳跃的方式从单个开放阅读框中产生多个蛋白(Kim,J.H.等,在人细胞系、斑马鱼和小鼠中来自猪捷申病毒-1的2A肽的高切割效率(High cleavage efficiency of a 2A peptide derived from porcine teschovirus-1 in human cell lines,zebrafish and mice).PloS one 6,e18556,doi:10.1371/journal.pone.0018556(2011))。该过程留下了用约20个C端氨基酸标记的第一翻译蛋白质,和仅有1个额外N端脯氨酸的第二蛋白质。两种蛋白质的功能一般被保留,并且使用2A-肽的临床试验没有报告免疫原性。使用单链AAV来靶向密码子优化的hF9 cDNA,之前是编码猪捷申病毒-1的2A肽(P2A)的序列,以正好整合到Alb终止密码子的5’处。整合后,Alb和hF9从强Alb启动子中共转录并且因此应在剪接、核离开、mRNA稳定性、翻译起始和ER定位水平上共调节。2个分开的蛋白质经翻译,同时含有单链,使得Alb的ER-相关翻译之后立即是用于分泌的凝结因子的翻译和加工。最后,为了进一步降低脱靶hF9表达的几率,载体在hF9信号肽前没有ATG起始密码子,或者在2A-肽编码序列或在前Alb外显子中没有起始密码子。
首先,以2.5e11载体基因组(vg)/小鼠用编码hF9靶向盒的rAAV8或反向对照进行对2天龄C57BL/6(B6)小鼠的腹膜内(IP)注射(图8B)。相对于Alb同源臂在对照中反转的片段不仅包括hF9基因,也包括P2A编码序列,相邻Alb外显子和在前剪接连接。反向对照不应允许在靶上整合后明显的hF9表达,但会允许与来自实验构建体(通过其他方式控制的附加体表达,如下)相似的脱靶表达水平。从生命的第4周开始,通过酶联免疫试验(ELISA)每周测量血浆hF9蛋白水平(图9A)。对于实验族,血浆hF9水平在350-1000ng/mL处平衡,其对应于正常的7-20%。对于反向对照组,hF9血浆水平处于或低于检测水平(20ng/mL),表明在实验组中,hF9表达事实上并不来自靶上整合。在2/3部分肝切除后,hF9保持了原始血浆蛋白水平,该手术过程已知降低超过90%的附加体AAV转基因表达,进一步确认了稳定的转基因整合。
为了确定新生所见的肝生长是否是治疗水平的基因靶向所必要的,使用成年小鼠中相同的载体将hF9靶向Alb基因座。以1x1012vg/小鼠(大约5e13/Kg)用rAAV8载体或反向对照通过尾静脉注射成年B6小鼠。第三组小鼠接受高压尾静脉注射编码“正确”方向的少启动子hF9构建体的质粒。对于rAAV hF9小鼠组,发现血浆hF9水平稳定在正常的7-20%(图9B)。较低MOI的载体注射剂导致较低的血浆hF9水平而没有平台期以表示上阈限效果(图9C)。对于成人和新生,反向对照组的hF9血浆水平处于或低于检测限。减少的hF9血浆水平也与用质粒高压注射的小鼠相关。因此,明显的靶向取决于rAAV矢量化。最后,在成年F9敲除(KO)B型血友病小鼠中进行rAAV注射。由处理的KO小鼠中活化的部分血栓栓塞时间(aPTT)所确定的功能性凝结将恢复至与野生型小鼠的水平相似的水平(图9D)。hF9生物活性与709±91ng/mL的血浆蛋白质水平相关,这与野生型小鼠中的水平相似(图9B-D)。
通过免疫组化(IHC)确认来自肝脏的hF9表达(图12)。对肝脏样品的Western印迹分析检测到预期分子量的hF9,证明核糖体跳跃是高效的,并且表明ELISA和IHC信号都对应于精确加工的hF9(图9E)。
hF9是分泌蛋白。因此,IHC信号是稀疏的并且不能用于对靶向率的定量。相反,使用qPCR来对由hF9对Alb的靶向率进行定量评价。为了避免来自附加体rAAV的假信号,首先以不受整合的hF9序列的存在或缺失影响的方式扩增基因组Alb基因座的3’区段(图10a,图13)。由于在靶向和野生型等位基因中的终止密码子的3’方向上大致相等的距离处有共同的限制性位点,无偏扩增变得可能。然后PCR扩增子用于2个不同qPCR试验的模板:一个对靶向的Alb等位基因的丰度进行定量,而另一个对未靶向的野生型等位基因的丰度进行定量。在肝脏中,仅肝细胞被rAAV8靶向(Nakai,H等,小鼠中用腺相关病毒血清型8的非限制的肝细胞转绕(Unrestricted hepatocyte transduction with adeno-associated virus serotype 8vectors in mice).J Virol 79,214-224,doi:10.1128/JVI.79.1.214-224.2005(2005))。因此,我们保守地校正了70%的肝细胞频率并且发现被hF9靶向的Alb等位基因的比率对于新生或成年注射的小鼠而言平均为0.5%(图10c和图14中相关标准曲线)。然后通过比较在无偏cDNA模板上进行的2个相应qPCR试验检验了融合的Alb_hF9mRNA与野生型Alb mRNA的比例(图10B)。发现新生或成年注射的小鼠的比例平均都是0.1%(图10c)。该值往往低于DNA水平上的整合率,虽然差异不是统计学显著的。嵌合hF9-Alb mRNA转录本的产生、加工和/或稳定性可能相对于野生型Alb mRNA降低。一些整合也可能发生在不表达白蛋白的非肝脏实质细胞中。所观察到的靶向率高于之前的报告(Miller,D.G.等,腺相关病毒载体的体内基因靶向(Gene targeting in vivo by adeno-associated virus vectors).Nature biotechnology 24,1022-1026,doi:10.1038/nbt1231(2006);Paulk,N.K.,Loza,L.M.,Finegold,M.J.和Grompe,M.AAV-介导的基因靶向被非同源性末端连接的瞬时抑制或体内蛋白酶显著增强(AAV-mediated gene targeting is significantly enhanced by transient inhibition of nonhomologous end joining or the proteasome in vivo).Human gene therapy 23,658-665,doi:10.1089/hum.2012.038(2012)),并且在成年小鼠中是特别有价值的,其中预期非繁殖细胞允许低的同源重组率。我们假设Alb基因座的高表达率和相关的染色质状态将导致高的靶向率。破坏诱导的增殖不可能被严格排除,但是在注射后没有观察到ALT水平的升高(图15)。
AAV载体可能以附加体或靶上或脱靶整合体存在于细胞中。通过qPCR评价总载体拷贝数(图16)。新生注射的小鼠中部分肝切除后载体拷贝数的较小变化表明已经极大地稀释了附加体载体。在该情况中,载体拷贝数可被视作脱靶与靶上整合的比率的大致下限。然而,在没有载体传播的启动子的情况中,hF9应该仅从靶上整合中表达。部分肝切除后重建的高hF9水平(图9A)支持了这种假设,因为只有稳定整合的转基因会在这种过程之后反弹,不同于瞬时附加体表达所看到的那样。在用反向对照载体处理后缺少明显hF9血浆水平进一步证明了降低的脱靶表达。我们使用RT-qPCR来直接评价总hF9mRNA集合之间融合的Alb_hF9mRNA的比率(图11A)。对于新生注射的小鼠可成年注射的小鼠而言,发现比率都是1∶1(图11B)。这表明hF9几乎只从靶上整合中表达。事实上,来自用P2A探针的Northern印迹的唯一特异性信号对应于预期的融合Alb-P2A-hF9 mRNA(图11C)。最后,使用抗-2A-肽抗体的Western印迹表明,2A-肽在Alb的预期分子量水平上与单一物质相关(图11D),正如仅当表达限于靶上整合并且之后是高效核糖体跳跃的情况下所预期的。
rAAV已经成为临床治疗的常用载体。虽然在成人中转基因表达时间可持续至少几年,尚不知道能否用含常规启动子的载体获得许多遗传疾病需要的终身表达。来自AAV载体的附加体表达快速消失,甚至在一轮细胞分裂之后。这使得诱导细胞再生的和/或在幼年治疗同时组织持续生长的疾病将有有限的表达。由于从初次载体给予导致的强体液免疫,AAV载体的二次融合不太可能导致二次转导。相反,本文所述的方法产生载体整合,其将随着时间消除表达丢失,即使是在生长的组织中。然而,这依赖于选择合适的AAV血清型以避免被已存在的免疫所中和。
先前证明将hF9靶向转基因小鼠中的嵌合基因座的工作(Li,H.等,在血友病的小鼠模型中恢复凝血的体内基因组编辑(In vivo genome editing restores haemostasis in a mouse model of haemophilia).Nature 475,217-221,doi:10.1038/nature10177(2011))已经依赖于可能与免疫和基因毒性副作用相关的核酸酶的共表达。当将hF8靶向小鼠和非人灵长类的Alb基因座时,对内源性核酸酶的同样限制也是如此(Anguela,X.等,ZFN介导的白蛋白靶向“避风港”在A型血友病的小鼠模型中产生治疗水平的人因子VIII(ZFN Mediated Targeting Of Albumin“Safe Harbor”Results In Therapeutic Levels Of Human Factor VIII In a Mouse Model Of Hemophilia A).Blood 122,720(2013)),可能是因为没有提供同源臂并且整合依赖于非同源末端连接。rAAV已经用于临床基因治疗试验来治疗B型血友病(Nathwani,A.C.等,B型血友病中腺相关病毒载体介导的基因转移(Adenovirus-associated virus vector-mediated gene transfer in hemophilia B).The New England journal of medicine 365,2357-2365,doi:10.1056/NEJMoa1108046(2011))。然而,这些临床试验中的转基因从载体传播的启动子表达,其可能诱导癌基因活化,如已在小鼠中报告的那样(Donsante,A.等,小鼠肝细胞癌中AAV载体整合位点(AAV vector integration sites in mouse hepatocellular carcinoma).Science 317,477,doi:10.1126/science.1142658(2007))。如通过测量丙氨酸转移酶水平所评价,注射本文所述的hF9靶向载体没有观察到肝毒性(图15)。
本文所述的工作证明了用于没有核酸酶和没有载体传播的启动子的体内基因靶向的治疗效果。在人类患者群中靶基因座处的遗传多样性可能由于同源性降低而潜在地导致可变的治疗功效。然而,我们发现1000个人群的基因组样品中约95%在相关的Alb序列中有不超过2种单倍型,这证明了这种方法的广泛应用性(图17)。
这种针对rAAV的少启动子和无核酸酶基因靶向策略的有利安全性概况使其成为治疗血友病和其他遗传缺陷的首选(Yew,N.S.和Cheng,S.H.溶酶体贮积症的基因疗法(Gene therapy for lysosomal storage disorders).Pediatric endocrinology reviews:PER 11Suppl 1,99-109(2013))。更一般地,该策略可在由分泌蛋白传送治疗效果的任何时候(例如,广泛中和抗体)或者靶向孵育选择性优势时应用(Paulk,N.K.,Loza,L.M.,Finegold,M.J.和Grompe,M.AAV-介导的靶向受到非同源末端连接的瞬时抑制或体内蛋白酶的显著增强(AAV-mediated gene targeting is significantly enhanced by transient inhibition of nonhomologous end joining or the proteasome in vivo).Human gene therapy 23,658-665,doi:10.1089/hum.2012.038(2012))。
实施例3
图18提供了通过在以1×1012载体基因组/小鼠将AAV8-F9或AAVDJ-F9实验构建体尾静脉注射入9周龄的雌性B6小鼠后测量(通过ELISA测量)血浆F9获得的数据(各n=4)。
图19提供了在以1×1012载体基因组/小鼠尾静脉注射AAV8-F9(顶部)或以3×1011载体基因组/小鼠尾静脉注射AAV8-F9 Triple(底部)后2周,(通过活化的部分血栓栓塞时间(aPTT))测量凝结效率获得的数据(各n=5)。
图20提供在以2.5×1011载体基因组/小鼠用AAV8-F9实验构建体颞浅静脉注射入2-天龄B6小鼠之后测量(通过ELISA测量)血浆F9获得的数据(n=4)。
图21提供了通过在以1×1012载体基因组/小鼠用AAV8-VRC01实验构建体尾静脉注射入9周龄的雌性B6小鼠后测量(通过ELISA测量)血浆VRC01获得的数据(各n=4)。夹心ELISA使用由针对人IgG的恒定区的抗体包被的平板,而功能性ELISA使用由HIV糖蛋白gp120包被的平板,该糖蛋白是被VRC01抗体识别的抗原。
前述内容只是说明本发明的原理。应理解,本领域技术人员能够设计各种安排,虽然本文没有明确描述或显示这些安排,但它们均体现本发明的原理并包含在本发明构思和范围内。而且,本文所述的所有实施例和条件语言主要旨在辅助读者理解本发明的原理和本发明对发展现有技术作出的贡献,且不对这些具体引用的实施例和条件构成限制。而且,本文有关本发明原理、方面、实施方式以及具体实施例的所有陈述都应包括其结构和功能等同物。此外,这些等同物应包括目前已知的等同物和将来开发的等同物,即新开发的具有相同功能的任何元件,无论其是何种结构。因此,本发明的范围不限于本文所示和所述的示例性实施方式。而是,本发明的范围和构思由所附权利要求书限定。
- 还没有人留言评论。精彩留言会获得点赞!