病原体和抗微生物剂抗性检测的制作方法
相关申请
本申请根据35u.s.c.§119(e)要求于2014年9月4日提交的第62/046,135号美国临时申请和于2014年10月7日提交的第62/061,093号美国临时申请的优先权,这两个申请均通过引用而整体并入本文。
背景技术:
许多人类和动物疾病是由病原体感染所引起的。虽然抗微生物剂可以减缓或阻止许多病原体的生长,但某些病原体对一种或多种抗微生物剂具有抗性。用于检测病原体和病原体的抗微生物剂抗性的系统和方法需要改进。
援引并入
本说明书中提到的所有出版物、专利和专利申请均通过引用而并入本文,其程度犹如特别地且单独地指出每个单独的出版物、专利或专利申请通过引用而并入。
技术实现要素:
本文提供了用于检测病原体和病原体的抗微生物剂抗性的实施方式。
在实施方式中,本文提供了一种用于样品分析的筒匣,其包含:抗微生物剂;微生物生长培养基;以及至少一种试剂,其选自代谢指示剂、用于核酸扩增反应的试剂和用于基于核酸探针的测定的试剂。任选地,所述筒匣进一步包含可能含有或可能疑似含有病原体的样品。任选地,所述样品为从受试者获得的血液样品,并且所述从受试者获得的血液样品可以为约500μl或更少。任选地,所述至少一种试剂、所述抗微生物剂和所述微生物生长培养基处于所述筒匣中分开的、流体隔离的器皿中。任选地,所述抗微生物剂和所述微生物生长培养基处于所述筒匣中的同一器皿中。任选地,所述抗微生物剂、所述微生物生长培养基和所述至少一种试剂处于所述筒匣中的同一器皿中。任选地,所述抗微生物剂选自抗生素、抗病毒剂、抗真菌剂和抗寄生虫剂。任选地,所述抗微生物剂为抗生素。任选地,所述至少一种试剂为代谢指示剂。任选地,所述至少一种试剂为代谢指示剂和用于核酸扩增反应的试剂。任选地,所述至少一种试剂为代谢指示剂和用于基于核酸探针的测定的试剂。任选地,所述至少一种试剂为代谢指示剂、用于核酸扩增反应的试剂和用于基于核酸探针的测定的试剂。任选地,所述代谢指示剂选自刃天青(resazurin)、5-氰基-2,3-二甲苯基四唑鎓氯化物(ctc)、二乙酸羧基荧光素琥珀酰亚胺酯(cfda-se)和萤光素。任选地,所述代谢指示剂为刃天青。任选地,所述用于核酸扩增反应的试剂为核酸聚合酶。任选地,所述用于核酸扩增反应的试剂为引物对。任选地,所述引物对能够与细菌标志物的核酸或其互补体特异性杂交。任选地,所述细菌标志物选自16srrna、16srdna、23rrna、rpob、gyrb、dnak、amoa和mip。任选地,所述细菌标志物为16srrna。任选地,所述引物对能够与抗微生物剂抗性标志物的核酸或其互补体特异性杂交。任选地,所述用于基于核酸探针的测定的试剂为核酸探针。任选地,所述核酸探针能够与细菌标志物的核酸或其互补体特异性退火。任选地,所述细菌标志物选自16srrna、16srdna、23rrna、rpob、gyrb、dnak、amoa和mip。任选地,所述细菌标志物为16srrna。任选地,所述核酸探针能够与抗微生物剂抗性标志物的核酸或其互补体特异性杂交。任选地,所述筒匣可进一步包含能与病原体的抗原结合的抗体。任选地,所述筒匣进一步包含核酸染料。
在实施方式中,本文提供了一种样品分析方法,该方法包括:将含有或疑似含有病原体的样品的至少第一部分与微生物生长培养基、抗微生物剂和代谢指示剂一起温育以产生反应混合物,其中所述代谢指示剂能够被代谢以产生代谢产物;以及检测所述代谢产物。任选地,所述样品为从受试者获得的血液样品。任选地,所述从受试者获得的血液样品为约500μl或更少。任选地,所述代谢产物生成可检测的信号。任选地,所述可检测的信号选自荧光、颜色和发光。任选地,所述代谢指示剂选自刃天青、5-氰基-2,3-二甲苯基四唑鎓氯化物(ctc)、二乙酸羧基荧光素琥珀酰亚胺酯(cfda-se)和萤光素。任选地,所述代谢指示剂为刃天青,并且所述代谢产物为试卤灵(resorufin)。任选地,所述抗微生物剂选自抗生素、抗病毒剂、抗真菌剂和抗寄生虫剂。任选地,所述抗微生物剂为抗生素。任选地,将所述样品与所述微生物生长培养基、抗微生物剂和代谢指示剂一起温育约1hr至约8hr。任选地,所述方法进一步包括在不存在所述抗微生物剂和代谢指示剂的情况下,在所述微生物生长培养基中预培养所述样品。任选地,所述方法进一步包括在温育所述样品之前将所述样品稀释。任选地,将所述样品稀释至约1个至约108个病原体/反应混合物。任选地,所述方法进一步包括将所述样品的至少第二部分或含有或疑似含有病原体的第二样品与至少一种试剂一起温育,该试剂选自用于核酸扩增反应的试剂和用于基于核酸探针的测定的试剂。任选地,所述至少一种试剂为用于核酸扩增反应的试剂,并且所述方法包括在足以支持所述样品中病原体的核酸扩增的条件下温育至少所述第二部分或第二样品以及检测该核酸的扩增。任选地,所述至少一种试剂为用于基于核酸探针的测定的试剂,并且所述方法包括在足以支持核酸探针与所述样品中的病原体的核酸特异性杂交的条件下温育至少所述第二部分或所述第二样品以及检测该病原体的核酸。任选地,所述病原体的核酸为细菌标志物的核酸或其互补体。任选地,所述细菌标志物选自16srrna、16srdna、23rrna、rpob、gyrb、dnak、amoa和mip。任选地,所述细菌标志物为16srrna。任选地,所述病原体的核酸为抗微生物剂抗性标志物的核酸或其互补体。任选地,所述方法进一步包括在样品处理装置中接收筒匣,其中该样品处理装置包含流体运送系统,并且其中该筒匣包含所述样品、所述微生物生长培养基、所述抗微生物剂和所述代谢指示剂;以及通过所述流体运送系统将所述样品的至少第一部分转移至与所述微生物生长培养基、所述抗微生物剂和所述代谢指示剂形成流体连通。
在实施方式中,本文提供了一种样品分析方法,该方法包括:在样品处理装置中接收筒匣,其中该样品处理装置包含流体运送系统,并且其中该筒匣包含:含有或疑似含有病原体的样品、用于核酸扩增反应的试剂、抗微生物剂和微生物生长培养基;通过所述流体运送系统将所述样品的第一部分转移至与所述用于核酸扩增反应的试剂形成流体连通,以产生包含所述样品的所述第一部分和所述用于核酸扩增反应的试剂的第一混合物;通过所述流体运送系统将所述样品的第二部分转移至与所述抗微生物剂和所述微生物生长培养基形成流体连通,以产生包含所述样品的所述第二部分、所述抗微生物剂和所述微生物生长培养基的第二混合物;在足以支持来自所述样品中病原体的核酸扩增的条件下温育所述第一混合物;在足以支持所述第二混合物中的病原体生长的条件下培养所述第二混合物;检测来自所述样品中病原体的核酸的扩增;以及检测所述样品中的病原体的生长。任选地,检测来自所述样品中病原体的核酸的扩增包括检测来自所述第一混合物中的染料的荧光。任选地,检测来自所述样品中病原体的核酸的扩增和检测所述样品中的病原体的生长均在所述筒匣被接收于所述样品处理装置中后不超过24小时发生。
在实施方式中,本文提供的方法包括:在样品处理装置中接收筒匣,其中该样品处理装置包含流体运送系统,并且其中该筒匣包含含有或疑似含有病原体的样品、抗微生物剂、微生物生长培养基和能够与所述病原体的核酸或其互补体特异性杂交的核酸探针;通过所述流体运送系统将所述样品的第一部分转移至与所述核酸探针形成流体连通,以产生包含所述样品的所述第一部分和所述核酸探针的第一混合物;通过所述流体运送系统将所述样品的第二部分转移至与所述抗微生物剂和所述微生物生长培养基形成流体连通,以产生包含所述样品的所述第二部分、所述抗微生物剂和所述微生物生长培养基的第二混合物;在足以与所述样品中的病原体的核酸或其互补体特异性杂交的条件下温育所述第一混合物;在足以支持所述病原体生长的条件下培养所述第二混合物;检测所述样品中的病原体的核酸;以及检测所述样品中的病原体的生长。
在任何实施方式中,所述样品为从受试者获得的血液样品。在任何实施方式中,所述从受试者获得的血液样品为约500μl或更少。在任何实施方式中,检测所述病原体的物种。在任何实施方式中,检测抗微生物剂抗性基因。在任何实施方式中,所述筒匣进一步包含能与病原体中的抗原结合的抗体。在任何实施方式中,检测所述样品中的病原体的生长包括用细胞计数器检查所述第二混合物。在任何实施方式中,检查包括对病原体细胞的数目进行计数。在任何实施方式中,检查包括检测所述病原体的抗原。在任何实施方式中,检查包括确定经历细胞分裂的病原体细胞的比率或数目。在任何实施方式中,检测所述样品中的病原体的生长包括用分光光度计检查所述第二混合物。在任何实施方式中,检查包括确定所述第二混合物的光密度。在任何实施方式中,所述筒匣进一步包含代谢指示剂,其中该代谢指示剂能够被代谢以产生代谢产物,并且所述方法包括通过所述流体运送系统将所述样品的所述第二部分转移至与所述抗微生物剂、所述微生物生长培养基和所述代谢指示剂形成流体连通,以产生包含所述样品的所述第二部分、所述抗微生物剂、所述微生物生长培养基和所述代谢指示剂的第二混合物。在任何实施方式中,通过检测所述代谢产物来检测所述病原体的生长。在任何实施方式中,所述代谢产物生成可检测的信号。在任何实施方式中,所述可检测的信号选自荧光、颜色和发光。在任何实施方式中,所述代谢指示剂选自刃天青、5-氰基-2,3-二甲苯基四唑鎓氯化物(ctc)、二乙酸羧基荧光素琥珀酰亚胺酯(cfda-se)和萤光素。在任何实施方式中,所述代谢指示剂为刃天青。
在实施方式中,本文提供的系统包含抗微生物剂;微生物生长培养基;至少一种试剂,其选自代谢指示剂、用于核酸扩增反应的试剂和用于基于核酸探针的测定的试剂;以及样品处理装置,其中该样品处理装置包含流体运送系统和至少一个检测器。任选地,所述系统进一步包含筒匣,其中该筒匣包含所述抗微生物剂、微生物生长培养基和所述至少一种试剂。任选地,所述抗微生物剂、微生物生长培养基和所述至少一种试剂处于所述筒匣中分开的、流体隔离的器皿中。任选地,所述抗微生物剂和微生物生长培养基处于所述筒匣中的同一器皿中。任选地,所述抗微生物剂、微生物生长培养基和所述至少一种试剂处于所述筒匣中的同一器皿中。任选地,所述筒匣进一步包含含有或疑似含有病原体的样品。任选地,所述样品为从受试者获得的血液样品。任选地,所述从受试者获得的血液样品为约500μl或更少。任选地,所述至少一种试剂为代谢指示剂。任选地,所述至少一种试剂为代谢指示剂和用于核酸扩增反应的试剂。任选地,所述至少一种试剂为代谢指示剂和用于基于核酸探针的测定的试剂。任选地,所述至少一种试剂为代谢指示剂、用于核酸扩增反应的试剂和用于基于核酸探针的测定的试剂。任选地,所述代谢指示剂选自刃天青、5-氰基-2,3-二甲苯基四唑鎓氯化物(ctc)、二乙酸羧基荧光素琥珀酰亚胺酯(cfda-se)和萤光素。任选地,所述代谢指示剂为刃天青。任选地,所述用于核酸扩增的试剂为核酸聚合酶。任选地,所述用于核酸扩增反应的试剂为引物对。任选地,所述引物对能够与细菌标志物的核酸或其互补体特异性杂交。任选地,所述细菌标志物选自16srrna、16srdna、23rrna、rpob、gyrb、dnak、amoa和mip。任选地,所述细菌标志物为16srrna。任选地,所述引物对能够与抗微生物剂抗性标志物的核酸或其互补体特异性杂交。任选地,所述用于基于核酸探针的测定的试剂为核酸探针。任选地,所述核酸探针能够与细菌标志物的核酸或其互补体特异性杂交。任选地,所述细菌标志物选自16srrna、16srdna、23rrna、rpob、gyrb、dnak、amoa和mip。任选地,所述细菌标志物为16srrna。任选地,所述核酸探针能够与抗微生物剂抗性标志物的核酸或其互补体特异性杂交。任选地,所述筒匣进一步包含能与病原体的抗原结合的抗体。任选地,所述筒匣进一步包含核酸染料。任选地,所述至少一个检测器选自分光光度计、光电倍增管、光电二极管、相机和细胞计数器。
在实施方式中,本文提供的方法包括确定样品中病原体的物种、亚种或菌株。
在实施方式中,本文提供的方法包括鉴定病原体或样品中的抗微生物剂抗性基因或突变。
在实施方式中,本文提供的方法包括检测病原体的生长,其中检测生长包括用细胞计数器检查培养物。
在实施方式中,用细胞计数器检查培养物的生长包括对病原体细胞的数目进行计数,检测病原体细胞中的抗原,检测病原体细胞的dna含量,或获得经历细胞分裂的病原体细胞的测量结果。
在实施方式中,本文提供的方法包括检测病原体的生长,其中检测生长包括用分光光度计检查培养物。任选地,可以确定所述培养物的光密度。
在实施方式中,在本文提供的用于检测样品中病原体的核酸扩增和用于检测样品中病原体生长的方法中,两者均在包含含有所述病原体的样品的筒匣被接收于所述样品处理装置中后不超过24、16、12、10、8、6、5、4、3、2或1小时发生。
除非上下文另有明确规定,否则本文对“样品”的任何提及或描述也适用于样品的一部分。
在实施方式中,可通过由样品处理装置内的一个或多个部件(例如流体运送系统、细胞计数器等)所执行的自动化步骤来执行本文所述的任何过程。所述部件可由可以执行样品处理方案的控制器来控制。
当结合以下描述和附图考虑时,将会进一步领会并理解本发明的其他目的和优点。虽然以下描述可能包含描述本发明特定实施方式的具体细节,但不应当将这些细节解释为对本发明范围的限制,而应当解释为可能的实施方式的示例。对于本发明的各个方面,在不脱离本发明精神的情况下,可在本发明的范围内进行许多改变和修改。
附图说明
图1示出了本文提供的样品和样品处理装置的示例性示意图。
图2和图3示出了如本文所述的筒匣的至少一些实施方式。
图4a、4b和4c示出了用于容纳拭子的示例性筒匣和器皿。
图5a-5f示出了如通过在从开始用抗生素和刃天青培养起0、1、2、3、4、5和6hr时间点检测590nm处的荧光所测量的,在卡那霉素(图5a-5c)或羧苄青霉素(图5d-5f)以及在100μl总反应体积中终浓度为20μm(图5a和5d)、40μm(图5b和5e)或80μm(图5c和5f)的刃天青中,卡那霉素抗性大肠杆菌(e.coli)k12mg1655菌株的生长特性。示出了以5×102个细胞/总反应体积(a)、5×103个细胞/总反应体积(b)、5×104个细胞/总反应体积(c)和5×105个细胞/总反应体积(d)的细菌细胞浓度开始的培养物的生长特性。
图6a-6f示出了如通过在从开始用抗生素和刃天青培养起0、1、2、3、4、5和6hr时间点检测590nm处的荧光所测量的,在羧苄青霉素(图6a-6c)或卡那霉素(图6d-6f)以及在100μl总反应体积中终浓度为20μm(图6a和6d)、40μm(图6b和6e)或80μm(图6c和6f)的刃天青中,羧苄青霉素抗性大肠杆菌k12mg1655菌株的生长特性。示出了以5×102个细胞/总反应体积(a)、5×103个细胞/总反应体积(b)、5×104个细胞/总反应体积(c)和5×105个细胞/总反应体积(d)的细菌细胞浓度开始的培养物的生长特性。
图7a-7f示出了如通过在从开始用抗生素和刃天青培养起0、1、2、3、4、5、6和7hr时间点检测590nm处的荧光所测量的,在卡那霉素(图7a-7c)或羧苄青霉素(图7d-7f)以及在10μl总反应体积中终浓度为20μm(图7a和7d)、40μm(图7b和7e)或80μm(图7c和7f)的刃天青中,卡那霉素抗性大肠杆菌k12mg1655菌株的生长特性。示出了以5×101个细胞/总反应体积(a)、5×102个细胞/总反应体积(b)、5×103个细胞/总反应体积(c)和5×104个细胞/总反应体积(d)的细菌细胞浓度开始的培养物的生长特性。
需要注意的是,附图和其中的元件不必要按形状或比例绘制。例如,为便于呈现或使呈现清楚,附图中元件的形状或比例可进行简化或修改。应进一步理解,附图和其中的元件仅用于示例性说明目的,不应理解为以任何方式进行限制。
具体实施方式
本文提供了用于鉴定病原体以及鉴定病原体的抗微生物剂抗性的实施方式。本文描述的各个特征可应用于下文阐述的任何特定的实施方式或者应用于针对或涉及鉴定病原体或病原体的抗微生物剂抗性的其他任何类型的实施方式。本文描述的系统和方法可作为独立的系统或方法,或作为集成系统或方法的一部分而应用。应当理解,所公开的系统和方法的不同方面可以单独地、共同地或彼此组合地来理解。
样品
如本文所使用的样品可以是可含有或疑似含有一种或多种病原体的任何材料。样品可以是例如体液、分泌物或组织样品。样品的实例可包括但不限于血液、血清、唾液、尿液、胃液和消化液、泪液、粪便、精液、阴道液、来源于肿瘤组织的间质液、眼内液、汗液、粘液、耳垢、油、腺分泌物、呼气、脊髓液、毛发、指甲、皮肤细胞、血浆、鼻拭子或鼻咽洗液、脊髓液、脑脊液、组织、咽拭子、活检组织、胎盘液、羊水、脐带血、重点流体(emphaticfluid)、腔液、痰液、脓、微生物群、胎便、乳汁或其他排泄物。可从例如人、动物、植物、微生物、环境、食物或从其他来源提供样品。在实施方式中,样品可以含有从来自受试者的拭子(例如鼻拭子)获得的材料。如本文所使用的,样品是指整个原始样品或其任何部分。
在实施方式中,可从受试者上的各个位置(例如臂、耳、手、脚等)获得样品。在实施方式中,可从受试者的手指或脚趾获得样品。如本文所使用的,受试者是指脊椎动物,并且包括哺乳动物和人。哺乳动物包括但不限于鼠、猿、人、家畜、运动动物和宠物。
本文提供的方法能够从小体积或小量的从受试者获得的样品检测病原体。在实施方式中,从受试者收集的样品可以具有大约或小于1000、900、800、700、600、500、400、300、200、100、90、80、70、60、50、40、30、25、20、15、10或5微升的体积。在一个实施方式中,从受试者获得的体液样品为全血样品。在特定的实施方式中,全血样品通过手指针刺而获得,并具有大约或小于1000、900、800、700、600、500、400、300、200、100、90、80、70、60、50、40、30、25、20、15、10或5微升的体积。例如,在实施方式中,从受试者收集的样品可以是收集自受试者的手指并且具有约500微升或更小体积的血液。在另一个实施方式中,可通过使拭子(例如鼻拭子)或固体样品如粪便或组织样品与缓冲液或其他液体溶液接触来获得样品,该缓冲液或其他液体溶液为大约或小于1000、900、800、700、600、500、400、300、200、100、90、80、70、60、50、40、30、25、20、15、10或5微升。
当病原体可以以低拷贝数存在时,如在感染的早期阶段,通常需要大体积或大量的样品和/或长的培养期以使拷贝数增加至可检测的水平。相比之下,本文提供的方法允许在小体积/量的样品中以及在较短的时间段内检测病原体,甚至对于含有低拷贝数病原体的样品也是如此。
病原体和抗微生物剂
可以对样品进行检测以确定该样品中是否存在特定病原体和/或确定该样品中的病原体是否对包括但不限于抗生素、抗病毒剂、抗真菌剂和抗寄生虫剂的抗微生物剂具有抗性或敏感性。如本文所使用的,病原体是指可在诸如人、动物或植物的多细胞生物体中引起疾病的微生物,并且可包括例如细菌、真菌、原生生物、寄生虫和病毒。
细菌包括引起疾病的那些细菌,如白喉(例如白喉棒杆菌(corynebacteriumdiphtheria))、百日咳(例如百日咳博德特氏菌(bordetellapertussis))、炭疽(例如炭疽芽孢杆菌(bacillusanthracia))、伤寒、鼠疫、志贺氏菌病(例如痢疾志贺氏菌(shigelladysenteriae))、肉毒中毒(例如肉毒梭菌(clostridiumbotulinum))、破伤风(例如破伤风梭菌(clostridiumtetani))、结核病(例如结核分枝杆菌(mycobacteriumtuberculosis))、细菌性肺炎(例如流感嗜血菌(haemophilusinfluenzae))、霍乱(例如霍乱弧菌(vibriocholerae))、沙门氏菌病(例如伤寒沙门氏菌(salmonellatyphi))、消化性溃疡(例如幽门螺杆菌(helicobacterpylori))、军团病(例如军团菌属的种(legionellaspp.))和莱姆病(例如布氏疏螺旋体(borreliaburgdorferi))。其他病原性细菌包括大肠杆菌(escherichiacoli)、产气荚膜梭菌(clostridiumperfringens)、艰难梭菌(clostridiumdifficile)、铜绿假单胞菌(pseudomonasaeruginosa)、金黄色葡萄球菌(staphylococcusaureus)和酿脓链球菌(streptococcuspyogenes)。细菌的其他实例包括表皮葡萄球菌(staphylococcusepidermidis)、葡萄球菌属的种(staphylococcussp.)、肺炎链球菌(streptococcuspneumoniae)、无乳链球菌(streptococcusagalactiae)、肠球菌属的种(enterococcussp.)、蜡状芽孢杆菌(bacilluscereus)、双歧双歧杆菌(bifidobacteriumbifidum)、乳杆菌属的种(lactobacillussp.)、单核细胞增生利斯特氏菌(listeriamonocytogenes)、诺卡氏菌属的种(nocardiasp.)、马红球菌(rhodococcusequi)、猪红斑丹毒丝菌(erysipelothrixrhusiopathiae)、疮疱丙酸杆菌(propionibacteriumacnes)、放线菌属的种(actinomycessp.)、动弯杆菌属的种(mobiluncussp.)、消化链球菌属的种(peptostreptococcussp.)、淋病奈瑟氏球菌(neisseriagonorrhoeae)、脑膜炎奈瑟氏球菌(neisseriameningitides)、粘膜炎莫拉氏菌(moraxellacatarrhalis)、韦荣氏球菌属的种(veillonellasp.)、伴放线放线杆菌(actinobacillusactinomycetemcomitans)、鲍氏不动杆菌(acinetobacterbaumannii)、布鲁氏菌属的种(brucellasp.)、弯曲杆菌属的种(campylobactersp.)、二氧化碳嗜纤维菌属的种(capnocytophagasp.)、人心杆菌(cardiobacteriumhominis)、啮蚀艾肯氏菌(eikenellacorrodens)、土拉热弗朗西丝氏菌(francisellatularensis)、杜氏嗜血菌(haemophilusducreyi)、幽门螺杆菌、金氏金氏菌(kingellakingae)、侵肺军团菌(legionellapneumophila)、多杀巴斯德氏菌(pasteurellamultocida)、肉芽肿克雷伯氏菌(klebsiellagranulomatis)、肠杆菌科(enterobacteriaceae)、柠檬酸杆菌属的种(citrobactersp.)、肠杆菌属的种(enterobactersp.)、肺炎克雷伯氏菌(klebsiellapneumoniae)、变形菌属的种(proteussp.)、肠炎沙门氏菌(salmonellaenteriditis)、志贺氏菌属的种(shigellasp.)、粘质沙雷氏菌(serratiamarcescens)、小肠结肠炎耶尔森氏菌(yersiniaenterocolitica)、鼠疫耶尔森氏菌(yersiniapestis)、气单胞菌属的种(aeromonassp.)、类志贺邻单胞菌(plesiomonasshigelloides)、霍乱弧菌、副溶血弧菌(vibrioparahaemolyticus)、创伤弧菌(vibriovulnificus)、不动杆菌属的种(acinetobactersp.)、黄杆菌属的种(flavobacteriumsp.)、洋葱伯克霍尔德氏菌(burkholderiacepacia)、类鼻疽伯克霍尔德氏菌(burkholderiapseudomallei)、嗜麦芽黄单胞菌(xanthomonasmaltophilia)、嗜麦芽糖寡养单胞菌(stenotrophomonasmaltophila)、脆弱拟杆菌(bacteroidesfragilis)、拟杆菌属的种(bacteroidessp.)、普雷沃氏菌属的种(prevotellasp.)、梭杆菌属的种(fusobacteriumsp.)和减少螺菌(spirillumminus)。抗生素是用来杀死、抑制或减缓细菌或其他微生物的生长的药剂,并且包括但不限于氨基糖苷类(如阿米卡星、庆大霉素、卡那霉素、新霉素、奈替米星、妥布霉素、巴龙霉素、链霉素和奇霉素),安沙霉素类(如格尔德霉素、除莠霉素和利福昔明),碳头孢烯类(如氯碳头孢),碳青霉烯类(如厄他培南、多利培南、亚胺培南/西司他丁和美罗培南),头孢菌素类(如头孢羟氨苄、头孢唑啉(cefaxolin)、头孢噻吩(头孢金素)、头孢氨苄、头孢克洛、头孢羟唑、头孢西丁、头孢丙烯、头孢呋辛、头孢克肟、头孢地尼、头孢托仑、头孢哌酮、头孢噻肟、头孢泊肟、头孢他啶、头孢布烯、头孢唑肟、头孢曲松、头孢吡肟、头孢洛林和头孢吡普),糖肽类(如替考拉宁、万古霉素、特拉万星、达巴万星和奥利万星),林可酰胺类(如克林霉素和林可霉素),脂肽类(如达托霉素),大环内酯类(如阿奇霉素、克拉霉素、地红霉素、红霉素、罗红霉素、醋竹桃霉素、泰利霉素和螺旋霉素),单环β-内酰胺类(如氨曲南),硝基呋喃类(如呋喃唑酮和呋喃妥因),噁唑烷酮类(如利奈唑胺、泊西唑利德、雷德唑胺(radezolid)和妥利唑胺(torezolid)),青霉素类(如阿莫西林、氨苄西林、阿洛西林、羧苄青霉素、氧唑西林、双氧西林、氟氯西林、美洛西林(mexlocillin)、甲氧西林、萘夫西林、苯唑西林、青霉素g、青霉素v、哌拉西林、替莫西林和替卡西林),多肽类(如杆菌肽、粘菌素和多粘菌素b),喹诺酮类/氟喹诺酮类(如环丙沙星、依诺沙星、加替沙星、吉米沙星、左氧氟沙星、洛美沙星、莫西沙星、萘啶酸、诺氟沙星、氧氟沙星、曲伐沙星、格帕沙星、司帕沙星和替马沙星),磺胺类(如磺胺米隆、磺胺乙酰胺、磺胺嘧啶、磺胺嘧啶银、磺胺地托辛、磺胺甲二唑、磺胺甲噁唑、磺胺、柳氮磺吡啶、磺胺异噁唑、甲氧苄氨嘧啶-磺胺甲噁唑(trimethoprim-sulfamethoxazole)和磺酰氨基柯衣定(sulfonamidochrysoidine)),四环素类(如地美环素、多西环素、米诺环素、土霉素和四环素),抗分枝杆菌类(如氯法齐明、氨苯砜、卷曲霉素、环丝氨酸、乙胺丁醇、乙硫异烟胺、异烟肼、吡嗪酰胺、利福平、利福布汀、利福喷丁、链霉素),胂凡纳明,氯霉素,磷霉素,夫西地酸,甲硝唑,莫匹罗星,平板霉素,奎奴普丁/达福普汀,甲砜霉素,替加环素,替硝唑,甲氧苄啶和teixobactin。
病毒包括但不限于麻疹病毒、腮腺炎病毒、风疹病毒、脊髓灰质炎病毒、肝炎病毒(例如甲型、乙型、丙型、丁型和戊型肝炎病毒)、流感病毒、腺病毒、狂犬病病毒、黄热病病毒、eb病毒(epstein-barrvirus)、疱疹病毒(herpesviruses)、乳头瘤病毒(papillomavirus)、埃博拉病毒(ebolavirus)、流感病毒(influenzavirus)、日本脑炎(japaneseencephalitis)病毒、登革热病毒(denguevirus)、汉坦病毒(hantavirus)、仙台病毒(sendaivirus)、呼吸道合胞病毒(respiratorysyncytialvirus)、正粘病毒(othromyxoviruses)、水疱性口炎病毒(vesicularstomatitisvirus)、维斯纳病毒(visnavirus)、巨细胞病毒(cytomegalovirus)和人免疫缺陷病毒(hiv)。抗病毒剂是用来杀死、抑制或减缓病毒生长的药剂,并且包括但不限于抗(hiv)剂(如阿巴卡韦、地达诺新、恩曲他滨、拉米夫定、司他夫定、富马酸替诺福韦二吡呋酯(tenofovirdisoproxilfumarate)、齐多夫定、地拉夫定、依法韦仑、依曲韦林、奈韦拉平、利匹韦林、阿扎那韦、地瑞那韦、福沙那韦、茚地那韦、奈非那韦、利托那韦、沙奎那韦、替拉那韦、恩夫韦地、马拉维若、度鲁特韦、埃替格韦、雷特格韦、可比司他及其组合)、抗流感病毒剂(如扎那米韦、磷酸奥司他韦、帕拉米韦、金刚烷胺和金刚烷乙胺)、抗疱疹病毒剂(如阿昔洛韦、伐昔洛韦、喷昔洛韦、碘苷、阿糖腺苷、三氟尿苷、膦甲酸和泛昔洛韦)、抗肝炎病毒剂(如阿德福韦、拉米夫定、替比夫定、替诺福韦、泛昔洛韦、恩替卡韦、利巴韦林、特拉匹韦、西咪匹韦、索非布韦、雷迪帕韦、奥比他韦(ombitasvir)、paritaprevir、利托那韦、达沙布韦和波普瑞韦)、抗巨细胞病毒(cmv)剂(如更昔洛韦、西多福韦、缬更昔洛韦、膦甲酸、马可巴韦和来氟米特)、抗呼吸道合胞病毒(rsv)剂(如利巴韦林和帕利珠单抗)以及抗水痘带状疱疹病毒(vsv)剂(如阿昔洛韦、伐昔洛韦、喷昔洛韦、泛昔洛韦、溴呋啶、膦甲酸和阿糖腺苷)。
真菌包括但的不限于支顶孢属的种(acremoniuinspp.)、曲霉属的种(aspergillusspp.)、表皮癣菌属的种(epidermophytonispp.)、甄氏外瓶霉(exophialajeanselmei)、明脐菌属的种(exserohilunmspp.)、紧密着色真菌(fonsecaeacompacta)、裴氏着色真菌(fonsecaeapedrosoi)、尖孢镰孢(fusariumoxsporum)、蛙粪霉属的种(basidiobolusspp.)、双极霉属的种(bipolarisspp.)、皮炎芽生菌(blastomycesderinatidis)、假丝酵母属的种(candidaspp.)、cladophialophoracarrionii、粗球孢子菌(coccoidiodesimmitis)、耳霉属的种(conidiobolusspp.)、隐球菌属的种(cryptococcusspp.)、弯孢霉属的种(curvulariaspp.)、腐皮镰孢(fusariumsolani)、白地霉(geotrichumcandidum)、荚膜组织胞浆菌荚膜变种(histoplasmacapsulatumvar.capsulatum)、荚膜组织胞浆菌杜氏变种(histoplasmacapsulatumvar.duboisii)、威尼克外瓶霉(hortaeawerneckii)、lacazialoboi、可可毛色二孢菌(lasiodiplodiatheobromae)、塞内加尔小球腔菌(leptosphaeriasenegalenisis)、霍塔毛孢子菌(piedraiahortae)、花斑糠疹(pityriasisversicolor)、波氏假阿利什霉(pseudallesheriaboydii)、罗梅罗刺壳孢菌(pyrenochaetaromeroi)、无根根霉(rhizopusarrhizus)、短尾帚霉(scopulariopsisbrevicaulis)、双间柱顶孢柱霉(scytalidiumdimidiatum)、申克孢子丝菌(sporothrixschenckii)、毛癣菌属的种(trichophytonspp.)、毛孢子菌属的种(trichosporonspp.)、接合菌真菌(zygomycetefungi)、灰马杜拉分枝菌(madurellagrisea)、足马杜拉分枝菌(madurellamycetomatis)、糠秕马拉色氏霉菌(malasseziafurfur)、小孢子菌属的种(microsporumspp.)、罗萨梯新龟甲形菌(neotestudinarosatii)、加拿大甲霉(onychocolacanadensis)、巴西副球孢子菌(paracoccidioidesbrasiliensis)、疣状瓶霉(phialophoraverrucosa)、何德毛结节菌(piedraiahortae)、伞枝犁头霉(absidiacoryinbifera)、微小根毛霉(rhizomucorpusillus)和无根根霉(rhizopusarrhizus)。抗真菌剂是用来杀死、抑制或减缓真菌生长的药剂,并且包括但不限于多烯类抗真菌剂(如两性霉素b、坎底辛(candicin)、非律平(filipin)、哈霉素、那他霉素、制霉菌素和龟裂霉素),唑类抗真菌剂(如阿巴芬净、联苯苄唑、布康唑、克霉唑、益康唑、芬替康唑、异康唑、酮康唑、卢立康唑、咪康唑、奥莫康唑、奥昔康唑、含他康唑、硫康唑、噻康唑、阿巴康唑、艾氟康唑、氟环唑、氟康唑、艾沙康唑、伊曲康唑、泊沙康唑、丙环唑、拉夫康唑和特康唑、伏立康唑)以及棘白菌素类(如阿尼芬净、卡泊芬净和米卡芬净(micofungin))。
寄生虫包括但不限于原生动物、线虫、绦虫、吸虫和其他寄生虫,如引起疾病的寄生虫,包括但不限于疟疾(例如恶性疟原虫(plasmodiumfalciparum))、钩虫、绦虫、蠕虫、鞭虫、癣、饯虫(roundworm)、蛲虫、蛔虫、丝虫、盘尾丝虫病(例如旋盘尾丝虫(onchocercavolvulus))、血吸虫病(例如血吸虫属的种(schistosomaspp.))、弓形体病(例如弓形虫属的种(toxoplasmaspp.))、锥虫病(例如锥虫属的种(trypanosomaspp.))、利什曼病(利什曼原虫属的种(leishmaniaspp.))、贾第虫病(例如兰伯贾第虫(giardialamblia))、阿米巴病(例如溶组织内阿米巴(entamoebahistolytica))、丝虫病(例如马来丝虫(brugiamalayi))和旋毛虫病(例如旋毛线虫(trichinellaspiralis))。抗寄生虫剂是用来杀死、抑制或减缓寄生虫生长的药剂,并且包括但不限于抗线虫药(如甲苯达唑、双羟萘酸噻嘧啶、噻苯哒唑、乙胺嗪(diethylcarbamazine)和伊维菌素)、抗绦虫药(如氯硝柳胺、吡喹酮和阿苯哒唑)、抗吸虫药(如吡喹酮)、抗阿米巴药(如利福平和两性霉素b)以及抗原生动物药(如美拉胂醇、依氟鸟氨酸、甲硝唑、替硝唑和米替福新)。
样品制备
收集样品之后,在测定之前可经历一个或多个样品制备步骤。或者,在收集样品之后,可直接对样品进行测定。在一个实施方式中,可从受试者获得多个样品,并单独检测每个样品的病原体。例如,可检测第一样品或第一样品的至少一部分,以确定该样品中是否存在病原体,并且可检测第二样品或第二样品的至少一部分,以确定该样品中的病原体是否对抗微生物剂具有抗性或敏感性。在另一个实施方式中,可将单个样品分成至少两个流体隔离的部分(例如至少第一部分和第二部分)。在某些实施方式中,样品的每个部分可直接用于病原体检测。第一部分可用于至少第一实验室试验或其一部分,而第二部分可用于至少第二实验室试验或其一部分。在实施方式中,样品的第一部分可在第一实验室试验中使用以确定该样品中是否存在感兴趣的特定病原体,而样品的第二部分可在第二实验室试验中使用以便可以确定样品中的病原体是否对抗微生物剂具有抗性或敏感性。
在其他实施方式中,可首先对样品中的病原体进行富集或浓缩(例如通过物理方法,如使用针对病原体的基于抗体的捕获表面,培养病原体,离心以使病原体向含有病原体液体悬浮液的管底移动,或过滤以从病原体液体悬浮液中捕获病原体)。可直接检测所富集或浓缩的样品的病原体。或者,可将所富集或浓缩的样品分成至少两个流体隔离的部分,并检测每个部分的病原体。如上所述,第一部分可用于至少第一实验室试验或其一部分,而第二部分可用于至少第二实验室试验或其一部分。在实施方式中,样品的第一部分可在第一实验室试验中使用以确定该样品中是否存在感兴趣的特定病原体,而样品的第二部分可在第二实验室试验中使用以便可以确定样品中的病原体是否对抗微生物剂具有抗性或敏感性。
在特定的实施方式中,在检测病原体之前将样品在微生物生长培养基中预培养。“微生物生长培养基”或“生长培养基”可互换使用,并且可以是足以支持感兴趣的病原体生长的任何合适的营养基质。微生物生长培养基可以是液体、半固体或固体。可将样品预培养约15、14、13、12、11、10、9、8、7、6、5、4、3、2或1hr或更短时间。在一个实施方式中,将样品预培养约1hr至约8hr。在另一个实施方式中,将样品预培养约2hr至约7hr。在又一个实施方式中,将样品预培养约3hr至约6hr,约3hr至约5hr,或约3hr至约4hr。在进一步的实施方式中,将样品预培养约2hr至3hr,约2hr至约4hr,约2hr至约5hr,或约2hr至约6hr。在另一个实施方式中,将样品培养约1hr至约2hr,约1hr至约3hr,约1hr至约4hr,约1hr至约5hr,或约1hr至约6hr。
在一个实施方式中,将样品预培养直到病原体生长至对数中期。在另一个实施方式中,将样品预培养直到病原体生长至约1010个病原体/ml、约109个病原体/ml、约108个病原体/ml、约107个病原体/ml、约106个病原体/ml、约105个病原体/ml、约104个病原体/ml、约103个病原体/ml或约102个病原体/ml或更高的浓度。在一个实施方式中,将样品预培养直到病原体生长至约109至约106个病原体/ml、约109至约107个病原体/ml或约109至约108个病原体/ml的浓度。在又一个实施方式中,病原体生长至约108至约106个病原体/ml或约108至约107个病原体/ml的浓度。
然后可检测预培养的样品的病原体,或将其分成至少两个流体隔离的部分以检测病原体。
在另一个实施方式中,可在检测病原体之前对预培养的样品或未经预培养的样品进行稀释,以获得浓度为约1至约108个病原体/反应、101至约108个病原体/反应、约102至约108个病原体/反应、约103至约108个病原体/反应、约104至约108个病原体/反应、约105至约108个病原体/反应、约106至约108个病原体/反应或约107至约108个病原体/反应的一种或多种检测反应混合物。在另一个实施方式中,将样品稀释至约101至约107个病原体/反应、约101至约106个病原体/反应、约101至约105个病原体/反应、约101至约104个病原体/反应、约101至约103个病原体/反应或约101至约102个病原体/反应的浓度。在一个实施方式中,将样品稀释至约1、101、102、103、104、105、106、107或108个病原体/反应或其间的任何范围的浓度。
根据待进行的测定类型,其他样品制备步骤可包括以下的一个或多个:将组织样品切片、切碎或分成两片或更多片;对样品或样品的一部分进行混合、搅拌、裂解、超声处理、均质化、固定或进行其他任何处理;将样品或其一部分离心;过滤(例如,使样品或其一部分通过过滤器或膜);允许或使血液样品凝结;将样品或样品的一部分浓缩(例如,通过沉降或离心血液样品,或含有来自组织样品的组织匀浆的溶液,或利用电磁珠),以提供沉淀物和上清液;用染料对样品或样品的一部分进行染色;向样品中添加标记物或试剂;或另外准备对样品、样品的一部分、样品的组成部分或样品内细胞或结构的一部分进行检测、可视化或定量。
用于检测病原体的方法
可使用多种方法来确定样品中是否存在特定的病原体。例如,样品可用于免疫测定以测定存在于感兴趣的病原体中的抗原(通常为多肽)。或者,免疫测定可涉及使用抗原来检测样品中是否存在针对病原体产生的抗体。免疫测定包括,例如,elisa、免疫印迹法和用于显微镜检查的基于抗体的细胞染色。
例如,elisa通常涉及能够特异性结合感兴趣抗原(例如,指示流感病毒感染的抗原)的至少一种抗体。将含有或疑似含有感兴趣抗原的样品非特异性地(例如,通过吸附至表面)或特异性地(例如,在“夹心”elisa中通过对同一抗原具有特异性的另一种抗体来捕获)固定在支持体(例如微阵列、微珠、端头、样品转移装置、皿、毛细管或其他管、反应室或具有用于固定的表面的其他任何合适的支持体)上。将抗原固定后,添加检测抗体,从而与抗原形成复合物。检测抗体可与酶缀合,或者可通过进而与酶缀合的第二抗体进行自身检测。在加入缀合酶的底物后,生成可检测的信号,该信号指示该样品中抗原的存在和/或量。底物的选择将取决于所缀合的酶。合适的底物包括荧光底物和显色底物。
在一些elisa中,固相捕获表面可包括可向其添加样品(例如,稀释的血液、血浆或其他样品)的附着的第一抗体。如果存在,样品中的抗原可与第一抗体结合并被固定化。可以添加酶试剂,其包括,例如,与产生可检测产物或者可以其他方式进行检测的酶(例如碱性磷酸酶或辣根过氧化物酶)偶联或缀合的抗体。如果酶试剂的抗体部分可结合抗原,则该酶试剂也被固定在捕获表面。添加酶底物可导致产生效应的产物,例如可被测量和作图的光。以这种方式,可测定样品中存在的抗原的量。
在另一个实例中,样品可在基于核酸扩增的试验中使用,以测定感兴趣的病原体中存在的核酸序列。可使用的核酸扩增反应包括涉及热循环的扩增方法(例如聚合酶链反应(pcr))和等温扩增方法(例如链置换扩增(sda)、滚环扩增(rca)、环介导的等温扩增(lamp)、解旋酶依赖性扩增(hda),以及wo2014/145291、wo2014/145296和wo2014/145298中描述的扩增方法,每个申请的内容均通过引用而整体并入本文以用于所有目的)。用于rna扩增的示例性方法包括体外转录。在逆转录pcr(rt-pcr)中,rna首先逆转录成cdna,然后在pcr反应中进行指数式扩增。两种最常用的逆转录酶为禽成髓细胞瘤病毒逆转录酶(amv-rt)和莫洛尼鼠白血病病毒逆转录酶(mmlv-rt)。通常使用特异性引物、随机六聚体或寡聚dt引物来引发逆转录步骤。然后可使用得到的cdna作为随后pcr反应中的模板。
通常,用于测定感兴趣病原体的核酸扩增反应将使用至少一种,更通常至少两种多核苷酸引物(即引物对),该多核苷酸引物与感兴趣病原体的核酸或其互补体特异性杂交,并且充当产生相应核酸的拷贝的起始点。足以支持核酸扩增的条件是本领域已知的,并且描述于例如wo2014/145291、wo2014/145296和wo2014/145298中。例如,pcr的条件通常包括1)变性步骤,在该步骤期间将包含含有靶dna的样品、引物对、taq聚合酶和脱氧核苷三磷酸(dntp)的反应混合物加热至94-96℃持续约1-10min,以使双链dna变性成单链dna;2)退火步骤,在该步骤期间将反应温度降低至约50-65℃持续约20-40秒,以使引物与单链dna模板退火;以及3)延伸/延长步骤,在该步骤期间调节反应温度,以允许通过在5’至3’方向上添加与模板互补的dntp来合成与该dna模板链互补的新dna链。延伸/延长温度可根据所使用的dna聚合酶而变化。例如,当使用taq聚合酶时,延伸/延长温度通常为72℃。上述三个步骤通常可以重复20-40次(称为循环),直到核酸得到充分扩增。
可通过监测反应的荧光的增加(例如,在使用嵌入双链dna的荧光染料的测定中)或通过监测反应的吸光度或浊度的增加(例如,在由于dna合成期间的核苷酸掺入而产生的焦磷酸根与mg++反应形成不溶性焦磷酸镁的测定中)来测量核酸扩增测定。可进一步分析核酸扩增测定,例如,通过获得一段时间内的荧光、吸光度或浊度值,并分析数据来确定指示样品中感兴趣核酸的存在或量的拐点。例如,可通过将数据拟合成指数曲线并基于高于基线的阈值选择拐点来进行该分析。
在又一个实例中,可在基于核酸探针的测定中检测病原体。这些基于核酸探针的测定可包含与病原体的核酸或其互补体特异性杂交的一种或多种核酸探针。靶核酸可以是例如dna、rna、mrna、mirna、rrna或trna。本发明的核酸探针可包含dna、rna、经修饰的核苷酸(例如甲基化的或标记的核苷酸)、经修饰的骨架化学部分(例如含吗啉环的骨架)、核苷酸类似物或其中两种或更多种的组合。该探针可以是完整基因或基因片段的编码链或互补链,或其表达产物。该探针的核苷酸序列可以是与样品中的核酸序列具有足够互补性的任何序列,从而允许该探针在期望的杂交条件下与样品中的靶核酸杂交。在理想情况下,该探针将仅与样品中感兴趣的核酸靶标杂交,而不会非特异性地结合样品中的其他非互补核酸或样品中的靶核酸的其他区域。在实施方式中,靶核酸可以是已通过例如pcr而扩增的核酸,使得核酸探针用来检测已扩增的核酸。
杂交条件可以根据杂交反应中所需的严格性程度而变化。例如,如果杂交条件是高严格性的,则探针将只结合样品中与其具有极高程度的互补性的核酸序列。低严格性杂交条件将允许探针与样品中的核酸序列杂交,该核酸序列具有一定的互补性,但没有那种如在高严格性下发生杂交所要求的与探针序列的高度互补性。杂交条件将根据生物样品、探针类型和靶标而变化。技术人员将知道如何针对本方法的特定应用来优化杂交条件,或者可替代地,知道如何针对指定的一组条件下的最佳应用来设计核酸探针。关于在核酸扩增反应中使用的引物的杂交条件可类似地进行优化。
核酸探针可连接至标签,例如半抗原、生物素、地高辛、异硫氰酸荧光素(fitc)、二硝基苯基、氨基甲基香豆素乙酸、乙酰氨基芴和汞-巯基-配体复合物、显色染料、荧光染料以及用于检测靶核酸的其他任何合适的标签。在一些实施方式中,各自具有不同靶核酸和不同标签的多个探针同时与单个样品杂交,例如大约或大于约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个或更多个不同的探针。
在一些实施方式中,含有与核酸模板链(或具有相似或相同的序列的链)的一部分互补的核苷酸序列和含有荧光报道分子(荧光团)和猝灭剂中的一种或两种的核酸探针包含在本文提供的反应中。在实例中,核酸探针可含有在其5’或3’末端的荧光报道分子,以及在另一末端的猝灭剂。在另一实例中,核酸探针可在其5’或3’末端含有荧光报道分子,并且它可与含有猝灭剂的核酸引物退火。含有猝灭剂的核酸引物可在引物的位置上含有猝灭剂,使得当核酸探针与引物退火时,荧光报道分子被猝灭。在含有荧光报道分子和猝灭剂对的探针中,可选择荧光报道分子和猝灭剂,以使得猝灭剂可有效地猝灭报道分子。在一些实施方式中,荧光报道分子与猝灭剂配对,其中荧光报道分子的发射最大值类似于猝灭剂的吸收最大值。
可用作荧光报道分子的荧光团包括,例如,calfluorgold、calfluororange、quasar570、calfluorred590、calfluorred610、calfluorred610、calfluorred635、quasar670(biosearchtechnologies)、vic、ned(lifetechnologies)、cy3、cy5、cy5.5(gehealthcarelifesciences)、oyster556、oyster645(integrateddmatechnologies)、lcred610、lcred610、lcred640、lcred670、lcred705(rocheappliesscience)、德克萨斯红(texasred)、fam、tet、hex、joe、tmr和rox。可使用的猝灭剂包括,例如,ddq-i、ddq-ii(eurogentee)、eclipse(epochbiosciences)、iowablackfq、iowablackrq(integrateddnatechnologies)、bhq-1、bhq-2、bhq-3(biosearchtechnologies)、qsy-7、qsy-21(分子探针)和dabcyl。
在一个实施方式中,核酸探针与底物共价或非共价偶联。可与核酸探针偶联的底物的非限制性实例包括微阵列、微珠、移液器吸头、样品转移装置、皿、毛细管或其他管、反应室或其他任何合适的形式。例如,可用于偶联核酸探针的微珠是本领域已知的,并且包括磁性和非磁性珠。可用1、2、3、4、5、6、7、8、9、10种或更多种染料对微珠进行标记,以促进珠子的编码和与其连接的核酸探针的鉴定。微珠的编码可用来在单个测定中区分至少10、50、100、200、300、400、500、600、700、800、900、1000、1500、2000、5000个或更多个不同的微珠,每个微珠对应于对不同靶核酸具有特异性的不同核酸探针。在另一个实例中,核酸探针与反应室如端头的表面偶联。例如,端头的内表面可涂覆有对单个靶核酸具有特异性的核酸探针。或者,端头的内表面可涂覆有对不同靶核酸具有特异性的两种或更多种不同的核酸探针。当两种或更多种不同的核酸探针与相同的内部端头表面偶联时,每个不同的核酸探针可偶联在不同的已知位置处,例如沿着端头的轴线在不同位置处形成不同的有序环或带。在这种情况下,可通过将样品向上吸至端头并使样品中所含的核酸与在沿着端头的连续位置处涂覆的核酸探针结合,在同一样品中分析多种不同的核酸。然后可如本文所述将结合事件可视化,其中条带图案中各条带的位置对应于特定的已知核酸。
在一个实施方式中,可通过例如上述核酸扩增或基于探针的测定来测定样品的细菌标志物,如16s核糖体(小亚基)rna(16srrna)或其基因(16srdna)。如果确定样品对于16srrna或16srdna呈阳性,则指示该样品含有细菌,因此提供该样品的受试者可能患有细菌感染。可使用的其他细菌标志物包括,例如,23srrna、rpob、gyrb、dnak、amoa和mip基因或其基因产物。在另一个实例中,可测定样品的真菌标志物,如核糖体顺反子的内转录间隔区(its)(例如,如schoch等人,procnatlacadsciusa.2012年4月17日;109(16):6241-6246中所述)。这样的基于生物体类别的标志物可提供关于受试者可能具有的感染的总体类型(例如细菌、病毒或真菌)或样品中的生物体类型的信息。
可用于检测病原体的病原体的其他示例性抗原和核酸包括但不限于本文所述的病原体的抗原和核酸。例如,逆转录病毒核酸和抗原包括hivgag、pol和env基因及其基因产物,nef蛋白,逆转录酶,和其他hiv组分。单纯疱疹病毒核酸和抗原的说明性实例包括但不限于编码即时早期蛋白质、糖蛋白d的基因及其基因产物和其他单纯疱疹病毒组分。水痘带状疱疹病毒核酸和抗原的非限制性实例包括编码9pi、gpii的基因及其基因产物和其他水痘带状疱疹病毒组分。日本脑炎病毒核酸和抗原的非限制性实例包括编码e、m-e、m-e-ns1、ns1和ns1-ns2a蛋白的基因及其基因产物和其他日本脑炎病毒组分。肝炎病毒核酸和抗原的说明性实例包括但不限于编码乙型肝炎病毒的s、m和l蛋白,乙型肝炎病毒的前s抗原的基因及其基因产物和其他肝炎(例如甲型、乙型和丙型肝炎)病毒组分。流感病毒核酸和抗原的说明性实例包括但不限于编码血凝素和神经氨酸酶(neurarnimidase)的基因及其基因产物和其他流感病毒组分。麻疹病毒核酸和抗原的说明性实例包括但不限于编码麻疹病毒融合蛋白的基因及其基因产物和其他麻疹病毒组分。风疹病毒核酸和抗原的说明性实例包括但不限于编码蛋白质e1和e2的基因及其基因产物和其他风疹病毒组分。轮状病毒核酸和抗原包括编码vp7sc的基因及其基因产物和其他轮状病毒组分。巨细胞病毒核酸和抗原的说明性实例包括但不限于编码包膜糖蛋白b的基因及其基因产物和其他巨细胞病毒组分。呼吸道合胞病毒核酸和抗原的非限制性实例包括编码rsv融合蛋白、m2蛋白的基因及其基因产物和其他呼吸道合胞病毒组分。狂犬病病毒核酸和抗原的代表性实例包括但不限于编码狂犬病糖蛋白、狂犬病核蛋白的基因及其基因产物和其他狂犬病病毒组分。乳头瘤病毒核酸和抗原的说明性实例包括但不限于编码l1和l2衣壳蛋白、与宫颈癌相关的e6/e7抗原的基因及其基因产物。关于病毒抗原和核酸的其他实例,参见例如,fundamentalvirology,第二版,fields,b.n.和knipe,d.m编著,1991,ravenpress,newyork。
可用于本发明组合物和方法的说明性真菌核酸和抗原包括但不限于假丝酵母真菌抗原组分;隐球菌真菌抗原如荚膜多糖和其他隐球菌真菌抗原组分;组织胞浆菌属真菌抗原如热休克蛋白60(hsp60)和其他组织胞浆菌属真菌抗原组分;球孢子菌属真菌抗原如小球抗原和其他球孢子菌属真菌抗原组分;以及癣真菌抗原如发癣菌素和其他球孢子菌属真菌抗原组分,以及编码这些抗原的任何dna或rna。
可用于本发明组合物和方法的细菌核酸和抗原包括但不限于:百日咳细菌抗原,如百日咳毒素、丝状血凝素、百日咳杆菌粘附素、fm2、fim3、腺苷酸环化酶和其他百日咳细菌抗原组分;白喉细菌抗原,如白喉毒素或类毒素和其他白喉细菌抗原组分;破伤风细菌抗原,如破伤风毒素或类毒素和其他破伤风细菌抗原组分;链球菌细菌抗原,如m蛋白和其他链球菌细菌抗原组分;革兰氏阴性杆菌细菌抗原,如脂多糖和其他革兰氏阴性细菌抗原组分;结核分枝杆菌细菌抗原,如分枝菌酸、热休克蛋白65(hsp65)、30kda主要分泌蛋白、抗原85a和其他分枝杆菌抗原组分;幽门螺杆菌细菌抗原组分;肺炎球菌细菌抗原,如肺炎球菌溶血素、肺炎球菌荚膜多糖和其他肺炎球菌细菌抗原组分;流感嗜血菌细菌抗原,如荚膜多糖和其他流感嗜血菌细菌抗原组分;炭疽细菌抗原,如炭疽保护性抗原和其他炭疽细菌抗原组分;立克次体细菌抗原,如rompa和其他立克次体细菌抗原组分,以及编码这些抗原的任何dna或rna。本文所述的细菌核酸和抗原也包括其他任何细菌、分枝杆菌、支原体、立克次体或衣原体核酸和抗原。
可用于本发明组合物和方法的其他寄生虫核酸和抗原包括但不限于:恶性疟原虫抗原,如裂殖子表面抗原、子孢子表面抗原、环子孢子抗原、配子体/配子表面抗原、红内期抗原pf155/resa和其他疟原虫抗原组分;硕大利什曼原虫(leishmaniamajor)和其他利什曼原虫抗原,如gp63、脂磷聚糖及其相关蛋白质和其他利什曼原虫抗原组分;弓形虫抗原,如sag-1、p30和其他弓形虫抗原组分;血吸虫抗原,如谷胱甘肽-s-转移酶、副肌球蛋白和其他血吸虫抗原组分;和克氏锥虫(trypanosomacruzi)抗原,如75-77kda抗原、56kda抗原和其他锥虫抗原组分,以及编码这些抗原的任何dna或rna。
样品中存在来自病原体的抗原或核酸指示该样品中存在病原体,因此在样品来自人或动物的情况下,指示该人或动物可能患有由该病原体引起的疾病。通过对样品的一部分进行免疫测定、核酸扩增反应、基于核酸探针的测定或用于可能存在于样品中的病原体的其他任何合适的测定,测定结果可提供关于该样品中是否存在特定病原体以及(在某些实施方式中)该样品中病原体的量的定量测量的信息。
用于确定对抗微生物剂的敏感性或抗性的方法
虽然样品中病原体的鉴定提供了有价值的信息,但为了指导感染病原体的受试者或其他病原体管理目标的潜在治疗计划,可能还需要确定病原体对一种或多种抗微生物剂如抗生素是否具有敏感性或抗性。当微生物如细菌的群体(或亚群)获得或呈现出对一种或多种抗微生物剂的抗性时,可见抗微生物剂抗性。对多种抗微生物剂治疗具有抗性的微生物被称为“多重耐药的”,并且这些微生物被称为具有或呈现出“多重耐药性”;上述任一术语均可缩写为“mdr”。当微生物群体在尽管存在抗微生物剂或(在mdr的情况下)尽管存在多种抗微生物剂的情况下仍存活(并且通常在数目上继续增长并倍增)时,观察到或表现出对一种或多种抗微生物剂的抗性。例如,许多抗生素化合物包括β-内酰胺环(四个碳的环);青霉素是具有β-内酰胺环的抗生素的实例。许多细菌具有可切割β-内酰胺环的β-内酰胺酶,从而保护细菌免受此类抗生素的影响。可切割β-内酰胺环的酶(通常见于革兰氏阴性细菌中并且可赋予抗生素抗性)包括tem和robβ-内酰胺酶。在另一个实例中,耐药性流感嗜血菌细菌可具有blatem或blarob抗性基因(尽管也发现blatem-2和blarob-1等,但通常为blatem-1)。在致病生物体中发现的抗微生物剂抗性标志物的其他实例包括kpc抗性基因(在肺炎克雷伯氏菌碳青霉烯酶(kpc)中发现)、meca和mecc抗性基因(导致对含β-内酰胺的抗生素如甲氧西林的抗性)以及万古霉素抗性基因a和b(vana和vanb)(例如在抗万古霉素肠球菌中发现)。抗微生物剂抗性生物体的其他实例包括抗甲氧西林金黄色葡萄球菌(mrsa)、万古霉素中间体金黄色葡萄球菌(visa)、抗万古霉素金黄色葡萄球菌(vrsa)、具有扩展谱β-内酰胺酶(esbl)的细菌(例如肠杆菌科)和多重耐药性鲍氏不动杆菌(mrab)。可通过检测赋予抗微生物剂抗性的核酸标志物、蛋白质标志物、其他标志物或其组合来鉴定耐药靶生物体,包括mdr靶生物体。
可使用多种方法来检测病原体对一种或多种抗微生物剂的响应。例如,可对从疑似具有病原体感染的受试者中获得的样品进行基于核酸的试验,以测定该样品中是否存在赋予抗微生物剂抗性的基因,导致抗微生物剂抗性的基因的缺失,或赋予抗微生物剂抗性的突变(例如点突变、单核苷酸多态性(snp)或多核苷酸突变)。这类基于核酸的试验可包括,例如核酸扩增反应和上述基于核酸探针的测定。在一个实例中,可如wo2015/076919所述进行用于检测突变的基于核酸的试验,该申请通过引用而整体并入本文以用于所有目的。
例如,为了检测靶核酸中感兴趣的特定核苷酸的存在或不存在(例如,在突变或snp的情况下),可选择与靶核酸中包括感兴趣的核苷酸或与之相邻的区域选择性结合的第一或第二引物。该引物可设计为使得其选择性地:i)当该区域含有感兴趣的核苷酸时与该区域结合,或ii)当该区域含有感兴趣的核苷酸时不与该区域结合。可用所选引物来执行如本文所述的方法,并且扩增反应的结果可提供关于靶核酸中存在或不存在感兴趣的核苷酸的信息。例如,如果第一引物的模板结合区被设计为具有与包含感兴趣的特定核苷酸(例如突变)的靶核酸中的序列互补的核苷酸序列,则用所选引物从样品中成功扩增靶核酸可表明该样品含有具有感兴趣的特定核苷酸的靶核酸。在一些实施方式中,用于分析靶核酸中感兴趣的核苷酸的引物可在该引物的3’末端含有关键核苷酸(即对应于靶核酸中感兴趣的核苷酸的同一位置的核苷酸)。在这样的情况下,引物的3’末端核苷酸的杂交可能依赖于靶核酸中感兴趣的核苷酸的存在。如果引物的3’末端核苷酸不与靶核酸中的核苷酸杂交(例如由于核苷酸之间的错配),则该错配可显著影响核酸聚合酶由引物合成延伸产物。因此,在一些实施方式中,具有对应于感兴趣的核苷酸的3’末端核苷酸的引物可用于确定靶核酸中特定核苷酸的存在或不存在。在这样的实施方式中,在一些情况下可选择在引物的3’末端的关键核苷酸与靶核酸中感兴趣的核苷酸互补,并且在一些其他情况下可选择在引物的3’末端的关键核苷酸与靶核酸中感兴趣的核苷酸不互补。感兴趣的核苷酸可代表例如靶核酸的野生型形式、突变体形式或多态性。
在其他实施方式中,可通过选择引物,使得感兴趣的核苷酸存在于不与第一或第二引物的模板结合区互补的区域中的靶核酸中,来检测靶核酸中感兴趣的特定核苷酸(例如突变或snp)。例如,感兴趣的核苷酸可以大致在靶核酸序列的中间。在实施方式中,感兴趣的核苷酸可以在“内部基序”中,内部基序是靶核酸链的一部分,其与本文提供的用来扩增靶核酸的引物对中的一条引物的尾区互补,并且具有与该引物对中的另一引物的尾区相同或相似的核苷酸序列。在实施方式中,当感兴趣的核苷酸在内部基序中时,可以将引物对制备成在引物的尾区中含有与内部基序或其互补体互补并且可用来确定在靶序列中的内部基序中存在或不存在感兴趣的核苷酸的核苷酸序列。引物的尾区中的核苷酸序列与该引物的延伸产物中的内部基序暂时杂交可提高本文提供的反应的速率。在一些情况下,引物的尾区中的核苷酸序列对该引物的延伸产物中的内部基序的亲和力越大,反应可越快发生。而且,通常,在引物的尾区中的核苷酸序列中可与该引物的延伸产物中的内部基序中的核苷酸结合的核苷酸数目越大,该延伸产物的尾区中的核苷酸序列对延伸产物中的内部基序的亲和力越大。因此,在实施方式中,可以通过使用引物来确定在靶序列中存在或不存在感兴趣的核苷酸,所述引物在引物的尾区中具有能与靶序列中的内部基序或其互补体结合的核苷酸序列,并且在尾区内具有或不具有与内部基序或其互补体中感兴趣的特定核苷酸特异性结合的核苷酸。通常,当引物的尾区中的核苷酸序列含有与该引物的延伸产物中的核苷酸(对应于靶标中感兴趣的核苷酸)互补的核苷酸时,将比当引物的尾区中的相关核苷酸不与该引物的延伸产物中的核苷酸(对应于靶标中感兴趣的核苷酸)互补时更快地发生反应。
在可用来检测病原体对一种或多种抗微生物剂的响应的方法的另一个实例中,可向包含在从受试者获得的样品中的病原体提供在抗微生物剂的存在下在微生物生长培养基中生长的机会,并且可评估病原体在抗微生物剂的存在下的生长。在这样的实例中,通常病原体为细菌。然而,该方法也可应用于其他病原体,如真菌、原生生物、寄生虫或病毒。如本文所使用的,病原体在抗微生物剂的存在下的生长可称为“抗微生物剂存在下的生长”。在病原体对抗微生物剂敏感的情况下,病原体在存在抗微生物剂的生长条件下培养时比其在无抗微生物剂的相同条件下培养时,通常将会具有显著减少的生长(包括不生长)。因此,如果病原体在该病原体耐受的抗微生物剂的存在下在微生物生长培养基中培养,则该病原体仍将会具有高水平的抗微生物剂存在下的生长。相反,如果病原体在该病原体敏感的抗微生物剂的存在下在微生物生长培养基中培养,则该病原体将会具有低水平的(或无)抗微生物剂存在下的生长。
如本文所使用的,“培养”是指将微生物维持在足以支持该微生物生长的条件下。此外,本文提及的足以支持病原体在微生物生长培养基中生长的条件等(例如“生长条件”)是指,在混合物中不存在抗微生物剂时,或者在培养基中存在抗微生物剂但该病原体对该抗微生物剂具有抗性时,通常足以支持该病原体在该培养基中生长的条件。例如,如果病原体容易在37℃的温度下在巧克力琼脂上生长,则巧克力琼脂和37℃的条件是足以支持该病原体生长的条件。然而,如果微生物生长培养基中存在抗微生物剂并且该病原体对该抗微生物剂没有抗性,则该病原体可能不能生长,或者在其他足以支持该病原体生长的条件下可能具有降低的生长。因此,本文提及的足以支持病原体生长的条件不反映在混合物中可能存在抗微生物剂或者病原体对抗微生物剂可能具有抗性。如果将病原体培养在足以支持病原体生长的条件下,但培养基中存在抗微生物剂,并且该病原体对该抗微生物剂没有抗性,则该病原体可能不能生长或可能具有降低的生长。相反,如果将病原体培养在足以支持病原体生长的条件下,即使培养基中存在抗微生物剂,如果该病原体对该抗微生物剂具有抗性,则该病原体可能仍然能够正常生长或仅具有轻微的生长受损,尽管培养基中存在抗微生物剂。
用于评估病原体在抗微生物剂的存在下的生长的传统方法通常涉及,在可获得病原体响应于抗微生物剂的抗微生物剂存在下的生长的准确测量结果之前有漫长的培养时间(例如至少48、72或96小时的培养时间)。在本文提供的实施方式中,可以比传统方法更快地获得病原体响应于抗微生物剂的抗微生物剂存在下的生长,如在抗微生物剂的存在下在足以支持抗微生物剂存在下的生长的条件下(即在合适的生长培养基中并在适合病原体生长的温度下)开始培养病原体的24、22、20、18、16、14、12、10、9、8、7、6、5、4、3、2或1小时内。
在本文提供的实施方式中,可使用多种不同的方法快速评估在抗微生物剂的存在下病原体的抗微生物剂存在下的生长。例如,可在含有感兴趣的抗微生物剂的液体生长培养基中培养病原体,并且可在培养开始后的一个或多个时间点测量液体生长培养基的光密度。例如可在分光光度计中在600nm或接近600nm的波长下测量光密度。随着液体生长培养基中病原体数目的增加,样品的光密度增加。在另一个实例中,可以在生长培养基中用抗微生物剂开始培养病原体后的一个或多个时间点评估含有抗微生物剂的生长培养基中的病原体,用于测量正在分裂的病原体细胞(例如百分比、比率、绝对数目等)。可通过多种方法来评估病原体细胞的细胞分裂,例如通过细胞计数法测定细胞的形态(例如,以观察细胞裂体生殖或分裂之前的增大的尺寸)或通过评估细胞中指示细胞分裂的一种或多种标志物(例如通过用针对细胞分裂期间选择性表达的蛋白质(例如微管蛋白同源物fstz)的抗体来标记病原体细胞;例如,可通过细胞计数法来监测细胞的这种标记)。在另一个实例中,可以在生长培养基中用抗微生物剂开始培养病原体后的一个或多个时间点评估含有抗微生物剂的生长培养基中的病原体,用于测量正在复制或已经复制了dna的病原体细胞(例如百分比、比率、绝对数目等)。例如,可通过用核酸染料(例如hoechst染料、dapi、溴化乙锭、sybr染料等)对细胞进行染色来测定细胞的dna含量。
在另一个实例中,可在微生物生长培养基中用抗微生物剂开始培养后的一个或多个时间点评估含有抗微生物剂的微生物生长培养基中的病原体的一种或多种生物化学特性(例如一种或多种蛋白质、小分子或脂质的水平,或者细胞呼吸或代谢活动的水平)。这样的生物化学特性可提供关于病原体对抗微生物剂的响应的信息。在一个实施方式中,可在抗微生物剂的存在下测定病原体的代谢活性,以确定该病原体对该抗微生物剂的抗性或敏感性。例如,可通过在抗微生物剂和代谢指示剂的存在下在微生物生长培养基中培养病原体并检测代谢产物来测定该病原体的代谢活性。如本文所使用的,“代谢指示剂”是指能够被代谢活性病原体或感染有病原体(例如病毒)的细胞代谢从而产生代谢产物的物质。如本文所使用的“代谢产物”是指由于代谢指示剂的代谢而产生的任何中间体或产物。检测到代谢产物指示病原体具有抗微生物剂抗性。在特定的实施方式中,代谢产物生成可检测的信号,如颜色、荧光或发光。代谢指示剂的实例包括但不限于刃天青、5-氰基-2,3-二甲苯基四唑鎓氯化物(ctc)、二乙酸羧基荧光素琥珀酰亚胺酯(cfda-se)和萤光素。各代谢指示剂的实例包括但不限于试卤灵、ctc甲
刃天青(7-羟基-3h-吩噁嗪-3-酮10-氧化物)是一种蓝色染料,其发出微弱的荧光,直到被不可逆地还原成粉红色且强红色荧光的试卤灵。活的代谢活性细胞能够将刃天青还原成试卤灵,后者可通过比色法或通过测量约590nm处的荧光进行检测。荧光输出与活细胞数目成比例,并且可用分光光度计进行测量。因此,可根据该测定的荧光或颜色的变化来检测抗微生物剂抗性,并且可根据该测定的低荧光或无荧光或无颜色变化来检测抗微生物剂敏感性。ctc是一种单四唑鎓氧化还原染色剂,当其被化学或生物还原时产生红色荧光ctc甲
在一个实施方式中,可在不存在如上所述的抗微生物剂和代谢指示剂的情况下对从受试者获得的样品进行预培养,以增加样品中病原体的浓度。或者,如果样品含有足量的病原体,则样品可以不需要预培养。可将样品稀释,随后在含有抗微生物剂和代谢指示剂的适当微生物生长培养基中进行培养。在一个实施方式中,可将样品在抗微生物剂和代谢指示剂的存在下在微生物生长培养基中培养约1hr至约8hr。在另一个实施方式中,可将样品培养约2hr至约6hr。在进一步的实施方式中,可将样品培养约10、20或30分钟或更长时间至约1、2、3、4、5、6、7、8、9或10hr或更短时间。样品可在约37℃下培养。
在本文提供的方法中,总反应体积可以在约1μl至约200μl之间。在特定的实施方式中,总反应体积可以为约10μl至约100μl。总反应中代谢指示剂如刃天青的浓度可以为约10、20、30、40、50、60、70、80、90或100μm。在另一个实施方式中,代谢指示剂浓度可以在约10至约100μm之间。在特定的实施方式中,代谢指示剂浓度可以在约20至约80μm之间。在一个实施方式中,本文所述的方法可以检测约1、101、102、103、104、105、106、107或108个病原体/反应。在另一个实施方式中,所述方法可以检测约101至约105个病原体/反应。
在特定的实施方式中,样品可与抗微生物剂接触,并且可在向样品引入抗微生物剂之后的一个或多个时间间隔评估病原体的一种或多种细胞死亡标志物。细胞死亡标志物可以是,例如细胞中一种或多种生物化学标志物的表达、染色体结构的变化或特定细胞形态的发展。与细胞死亡相关的生物化学标志物可以是,例如蛋白质(例如蛋白酶如胱天蛋白酶)、核酸(例如片段化的dna)或小分子(例如活性氧(ros))。在实施方式中,某些生物化学标志物的水平可能随着细胞死亡而升高或降低(即,一些标志物的水平可能随着细胞正在死亡/已经死亡而升高,而另一些标志物的水平可能随着细胞正在死亡/已经死亡而降低)。在实施方式中,可在病原体暴露于抗微生物剂之后的一个或多个时间点评估病原体的与细胞死亡相关的一种或多种变化。该信息可用来确定病原体是否对抗微生物剂具有抗性或敏感性。在实施方式中,可用一种或多种染料对已经暴露于特定抗微生物剂的病原体进行染色,并且可获得已染色的病原体的图像。通过模式识别方法,可将受测病原体样品的图像信息与已知对被测抗微生物剂具有抗性或敏感性的病原体的图像信息进行比较。基于该分析,可以非常快速地确定该病原体对感兴趣的抗微生物剂的敏感性或抗性。
在实施方式中,可在抗微生物剂的存在下,在足以支持抗微生物剂存在下的生长的条件下,开始培养病原体24、22、20、18、16、14、12、10、9、8、7、6、5、4、3、2或1小时内,对病原体响应于抗微生物剂的抗微生物剂存在下的生长进行任何上述测量。类似地,在实施方式中,利用本文提供的系统和方法,可在针对病原体抗微生物剂抗性开始处理含有病原体的样品24、22、20、18、16、14、12、10、9、8、7、6、5、4、3、2或1小时内确定病原体的抗微生物剂抗性状态。
检测病原体的存在并确定病原体的抗微生物剂抗性/敏感性
在本文所述的任何方法中,从受试者获得的第一样品可用于测定病原体的存在,而从受试者获得的第二样品可用于测定病原体的抗微生物剂抗性或敏感性。或者,在本文所述的任何方法中,样品的第一部分可用于测定病原体的存在,而样品的第二部分用于测定病原体的抗微生物剂抗性或敏感性。
在一个实施方式中,可通过使样品经历核酸扩增测定,诸如通过pcr、rt-pcr或者根据wo2014/145291、wo2014/145296或wo2014/145298中提供的方法,使用样品的第一部分或第一样品测定该样品中是否存在病原体的核酸,并且可诸如通过pcr、rt-pcr或者根据wo2014/145291、wo2014/145296、wo2014/145298或wo2015/076919中提供的方法,使用样品的第二部分或第二样品测定该病原体中是否存在抗微生物剂抗性基因或突变。
在另一个实施方式中,可通过使样品经历核酸扩增测定,诸如通过pcr、rt-pcr或者根据wo2014/145291、wo2014/145296或wo2014/145298中提供的方法,使用样品的第一部分或第一样品测定该样品中是否存在病原体的核酸,并且可通过测定样品中的病原体在抗微生物剂的存在下的代谢活性,使用样品的第二部分或第二样品测定该病原体的抗微生物剂抗性或敏感性。在特定的实施方式中,病原体的核酸是细菌标志物(例如16srrna),并且使用代谢指示剂(刃天青)来测定病原体的代谢活性。
在一个实施方式中,可通过使样品经历基于核酸探针的测定,使用样品的第一部分或第一样品测定该样品中是否存在病原体的核酸,并且可诸如通过pcr、rt-pcr或者根据wo2014/145291、wo2014/145296、wo2014/145298或wo2015/076919中提供的方法,使用样品的第二部分或第二样品测定该病原体中是否存在抗微生物剂抗性基因或突变。
在一个实施方式中,可通过使样品经历基于核酸探针的测定,使用样品的第一部分或第一样品测定该样品中是否存在病原体的核酸,并且可通过测定样品中的病原体在抗微生物剂的存在下的代谢活性,使用样品的第二部分或第二样品测定该病原体的抗微生物剂抗性或敏感性。在特定的实施方式中,病原体的核酸是细菌标志物(例如16srrna),并且使用代谢指示剂(例如刃天青)来测定病原体的代谢活性。
本文公开的测定的其他任何组合可用来检测病原体的存在以及确定病原体的抗微生物剂抗性或敏感性。在实施方式中,用于检测病原体的存在的测定和用于确定病原体的抗微生物剂抗性或敏感性的测定可并行进行或可替代地依次进行。例如,首先可进行用于检测病原体的存在的测定,并根据结果,随后可进行用于确定病原体的抗微生物剂抗性或敏感性的测定。在其他实施方式中,用于检测病原体的存在的测定的任何部分均可与用于确定病原体的抗微生物剂抗性或敏感性的测定的任何部分同时进行。
样品处理系统和装置
在实施方式中,可在样品处理装置中进行本发明的方法。本文提供的样品、筒匣、系统或样品处理方法可具有第8,088,593号美国专利、wo2014/127379、第2015/0072362号美国公开或wo2015/035260中所描述的任何特征,每个文献均通过引用而整体并入本文以用于所有目的。
可以参照图1描述本文提供的实施方式。可将样品110引入样品处理装置100中。
样品处理装置100可以是在壳体内包含一个或多个用于处理样品的硬件部件的仪器,该硬件部件例如是样品处理系统,包括流体运送系统,加热元件,离心机,包括但不限于光电二极管、光电倍增管(pmt)、分光光度计、光学传感器(例如,用于发光、荧光、吸光度或比色法)、相机和细胞计数器的检测器,移液器,热控制单元,和控制器。如本文所使用的术语“样品处理系统”是指被配置为辅助样品成像、检测、定位、重新定位、保留、摄取和存放的装置或系统。在一个实例中,具有移液能力的机器人为样品处理系统。在另一个实例中,可能具有或可能不具有(其他)机器人能力的移液器为样品处理系统。样品处理系统可运送任何类型的样品,包括但不限于体液、分泌物或组织样品。样品处理系统可以能够处理流体、固体或半固体。样品处理系统可以能够接收、存放和/或移动样品,和/或对于装置内的样品处理可能有用和/或必需的该装置内的其他任何物质。样品处理系统可以能够接收、存放和/或移动可含有样品和/或装置内的其他任何物质的容器或器皿(例如测定单元、试剂单元)。在一些情况下,样品处理系统为流体运送系统。本文关于流体运送系统的任何描述也可适用于其他样品处理系统,反之亦然。流体运送系统可包含各种类型的泵和阀,或移液器,该移液器可包括但不限于容积式移液器、排气移液器和抽吸型移液器。流体运送系统可包含端头。例如,移液器端头可以可拆卸地连接至移液器。该端头可与移液器喷嘴接合。样品处理装置100可具有如例如wo2014/127379、第8,088,593号美国专利或第8,435,738号美国专利中所描述的任何特征,这些文献的所有内容均通过引用而整体并入本文以用于所有目的。
可通过任何合适的结构或方法将样品110引入样品处理装置100中。在实施方式中,可直接将样品110引入样品处理装置100中。在其他实施方式中,可先将样品110引入筒匣中,然后可将该筒匣引入样品处理装置中。筒匣可包含试剂、其他样品或用于样品处理的其他组分。在实施方式中,筒匣可具有wo2014/127379、第8,088,593号美国专利或第8,435,738号美国专利中所描述的筒匣的任何特征,或者可通过这些文献中所描述的任何方法将样品引入样品处理装置中。
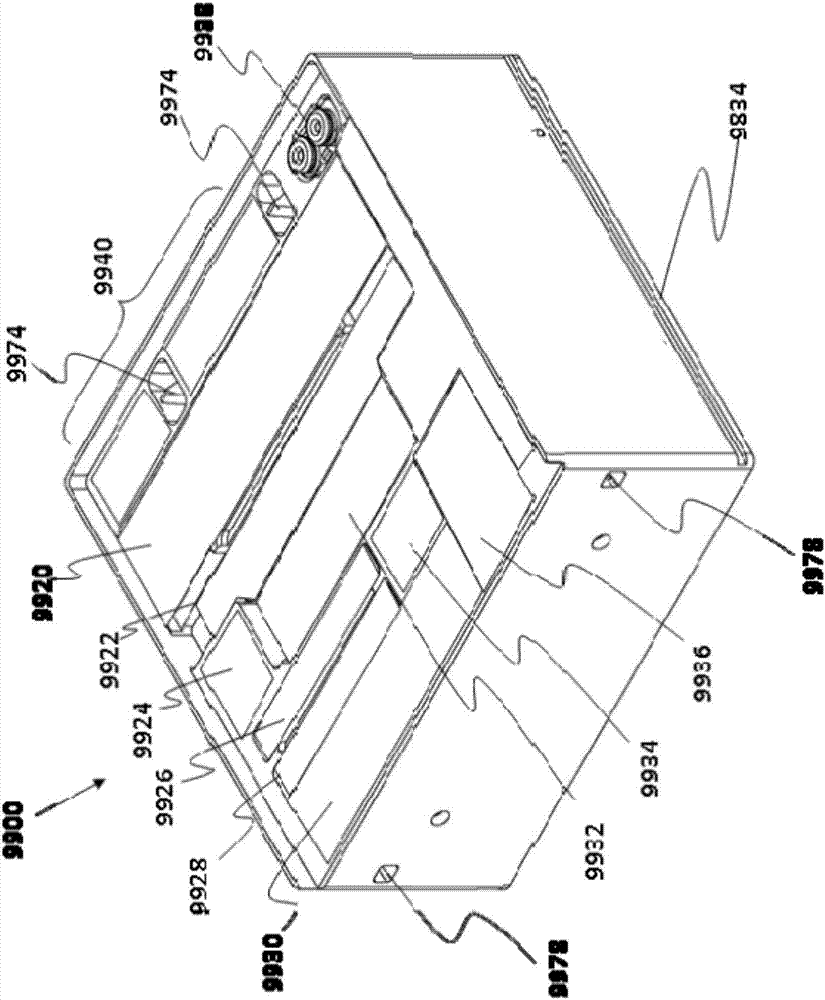
现在将参照图2描述筒匣9900的一个非限制性实例。该实施方式显示在筒匣9900上可以存在多个不同区域9920至9940,以提供不同类型的装置、端头、试剂、反应位置等。在一个非限制性实例中,筒匣9900上的这些区域中的一个区域可在这些区域之一中包含至少一个器皿或容器,该器皿或容器可容纳如本文所述的一种或多种抗微生物剂或其他药物。这些部件的混合取决于将使用筒匣9900进行的测定的类型。举非限制性实例而言,筒匣9900可具有用来容纳一个或多个样品容器、移液器端头、显微镜皿、大体积移液器端头、大体积试剂井(well)、大体积带、具有反应器皿线性阵列的皿、圆形器皿、去除帽的端头、离心机器皿、配置用于光学测量的离心机器皿和/或核酸扩增器皿的区域。前述中的任何一种可位于不同区域9920至9940中。一些实施方式可按照类似于共同转让的wo2014/127379、第8,088,593号美国专利或第8,435,738号美国专利所示的筒匣的阵列来排列端头和器皿,这些文献中的每一个均通过引用而全文并入本文以用于所有目的。
举非限制性实例而言,试剂也可在筒匣中变化,并且可被选择为至少包括进行至少两种或更多种类型的测定组(assaypanel)所需的那些组分,该测定组例如是但不限于针对潜在病原体的组、脂质组或cheml4组或两种或更多种不同实验室测试组的其他组合。例如,一些筒匣可具有试剂、稀释剂和/或反应器皿,以支持来自核酸扩增、基于核酸探针的测定、代谢/生化测定、普通化学法、免疫测定或细胞计数的至少两种不同的测定类型。
筒匣的任一个或多个部件是样品处理装置的样品处理系统或流体运送系统可及的。筒匣中的不同区域可配置为匹配在系统中所使用的移液器头的间距。任选地,一些区域被配置为位于为移液器头间距的倍数或分数的间距处。例如,筒匣的一些部件位于1/3×的间距处,其他部件位于1/2×的移液器间距处,其他部件位于1×间距处,其他部件位于2×间距处,而另外的其他部件位于4×间距处。
仍参照图2,应当理解,可能有一些部件位于筒匣的一个平面处,而其他部件位于更低或更高的平面处。例如,一些部件可位于皿或其他部件的下方。因此,一旦去除上部部件,则下部部件变得可及。这种多层方式提供了就筒匣上的部件而言更大的包装密度。筒匣9900上还可存在定位特征,诸如但不限于被配置为接合该系统中筒匣接收位置上的匹配槽的导轨9834。该筒匣还可具有对准(registration)特征(物理、光学等),一旦筒匣被系统识别,则该对准特征允许系统准确地接合筒匣的部件。举非限制性实例而言,尽管在测定处理期间可从筒匣9900去除部件,但应当理解,一些实施方式可允许所有部件返回到筒匣以便统一存放。任选地,该系统的一些实施方式可具有存放区域、容器、斜槽等,以在从系统弹出筒匣之前丢弃筒匣中未返回到筒匣的那些部件。在一些实施方式中,这些区域可以是系统中用于接收废物的专用区域。
现在将参照图3描述筒匣的另一个实施方式。该实施方式类似于图2的实施方式,不同之处在于该实施方式使用高度降低的筒匣9901,其中侧壁具有降低的垂直高度。这提供了更少的材料以便用于一次性使用并带有反应器皿和/或试剂。此外,在一个非限制性实例中,筒匣9901上的这些区域中的一个区域可在这些区域之一中包含至少一个器皿或容器,该器皿或容器可容纳如本文所述的一种或多种抗微生物剂或其他药物。
在另一实施方式中,图4a示出了用于容纳拭子的示例性器皿(拭子容器)和示例性筒匣,该筒匣包括接纳部(receptacles)(针对例如拭子容器、试剂器皿、测定单元、混合器皿、运送单元、移液器端头、废物器皿和样品收集器皿的腔和井),并且被配置用于容纳试剂器皿、反应器皿以及其他器皿和器具。拭子可用来从受试者获得样品。受试者可使用拭子自己获得样品,或者医疗专业人员(例如静脉切开师、护士或医生)可使用拭子从受试者获得样品。可使用拭子诸如从受试者的鼻、咽喉、口、耳、皮肤或其他身体区域获得样品。从拭子容器引出的箭头指示出拭子容器可以如何放置到筒匣中的接纳部中。
图4b示出了示例性拭子容器(被配置用于容纳拭子)和示例性筒匣(其包括针对试剂和器皿的腔和井,并且被配置用于容纳试剂器皿、反应器皿以及其他器皿和器具)。除了如图4a的实施方式中所示出的被配置用于容纳试剂器皿、反应器皿以及其他器皿和器具的腔和井之外,图4b中示出的示例性筒匣还包括除了拭子容器之外还适合容纳其他样品器皿(例如,血液或尿液样品器皿)的腔和井。从拭子容器引出的箭头指示出拭子容器可以如何放置到筒匣中的接纳部中。
图4c示出了示例性拭子容器和示例性筒匣,该筒匣包括用于容纳拭子和拭子容器的腔和井,以及被配置用于容纳试剂器皿、反应器皿以及其他器皿和器具(其可以任选地包括其他样品器皿,例如,血液或尿液样品器皿)的腔和井。从拭子引出的箭头指示出拭子可以如何放置到筒匣中的拭子接纳部中。从拭子容器引出的箭头指示出拭子容器可以如何放置到筒匣中的拭子容器接纳部中。
如图4a、图4b和图4c中所示,用于容纳拭子的器皿可以装载到筒匣上,在那里器皿可以得以保存直到需要用于处理;筒匣可以装载到样品处理装置上,从而装载拭子(以及还有在该筒匣上的其他任何样品容器或样品)。图4a、图4b和图4c示出了用于容纳拭子的示例性容器(拭子容器)和示例性筒匣(其包括针对试剂和器皿的腔和井,并且被配置用于容纳试剂器皿、测定单元、混合器皿、移液器端头、运送单元以及其他器皿和器具中的一个或多个,所述其他器皿和器具包括其他样品器皿,例如,血液或尿液样品器皿)。从拭子容器引出的箭头指示出拭子容器可以如何放置到筒匣中的接纳部中。
如图4a中所示,用于容纳拭子的器皿(拭子容器10)可以通过放置到接纳部30中而装载到筒匣20上。如图所示的筒匣20还包括用于接收和容纳试剂和器皿的腔和井40。拭子容器10可以包含位于拭子容器10内适当位置处的拭子,或者可以在没有位于拭子容器10内适当位置处的拭子的情况下装载到筒匣上。
如图4b中所示,拭子容器10可以通过放置到接纳部30中而装载到筒匣20上。如图所示的筒匣20还包括用于接收和容纳试剂和器皿的腔和井40。在图4b中示出的实施方式中,筒匣20还包括样品收集器皿50,该样品收集器皿50可以容纳例如血液、尿液或其他样品。从拭子容器10引出的箭头指示出拭子容器10可以如何放置到筒匣20中的接纳部30中。因此,如图4b中所示,拭子容器10可以装载到筒匣20上,在那里它可以得以保存直到需要用于分析;筒匣20可以装载到分析装置或分析系统上,从而装载拭子容器10(以及也位于筒匣20上适当位置处的任何一个或多个样品容器)。筒匣20可以具有接纳部30。如图4b中所示,拭子容器10可以通过放置到接纳部30中而装载到筒匣20上。如图所示的筒匣20还包括用于接收和容纳试剂和器皿的腔和井40。如图所示的筒匣20还包括样品收集器皿50,该样品收集器皿50可以容纳例如血液、尿液、痰或其他样品。样品收集器皿50在筒匣20中的样品收集器皿接纳部51的适当位置处示出。从拭子容器10引出的箭头指示出拭子容器10可以如何放置到筒匣20中的接纳部30中。
如图4c中所示,拭子容器10可以通过放置到接纳部30中而装载到筒匣20上。如图所示的筒匣20还包括用于接收和容纳试剂和器皿的腔和井40。如图4c的实施方式中所示,筒匣20包括被配置用于容纳拭子70的拭子接纳部60。在实施方式中(例如,在图1c中示出的实施方式中),具有拭子接纳部60的筒匣20可以任选地包括样品收集器皿50,该样品收集器皿50可以容纳例如血液、尿液或其他样品。这样的拭子70可以在其用于收集样品之前容纳在拭子接纳部60中。在实施方式中,可以在用拭子70收集样品之后将拭子70放置在拭子容器10内。在图4c中示出的实施方式中,在使用拭子70之前,拭子容器10可以在没有位于拭子容器10内适当位置处的拭子的情况下装载到筒匣上,并且在用拭子70收集样品之后,可将拭子容器10重新放置在接纳部30中,在拭子容器10内容纳拭子70。
在实施方式中,筒匣可包含一种或多种抗微生物剂。在筒匣内,可在隔离的结构(例如流体隔离的井或器皿)中提供抗微生物剂,使得抗微生物剂最初不与筒匣中的其他试剂或样品直接接触。一旦将筒匣插入样品处理装置中,则抗微生物剂可与筒匣中的一种或多种其他试剂或样品直接接触(例如通过流体运送系统)。抗微生物剂可以为任何合适的形式,如干燥的、在溶液中或在悬浮液中。筒匣可包含例如至少1、2、3、4、5、6、7、8、9、10、15种或更多种不同的特异性抗微生物化合物或不同类别的抗微生物化合物。在某些实施方式中,抗微生物剂可位于筒匣中,预先混合在微生物生长培养基或其他合适材料中。
在实施方式中,一旦将样品110引入样品处理装置100(如图1所示)中,则可在样品处理装置100内以多种不同方式对样品110进行处理。例如,在样品处理装置100内,可通过流体运送系统将样品110分成至少两个不同的流体隔离的部分(例如至少第一部分和第二部分)。第一部分可用于至少第一实验室试验或其一部分,而第二部分可用于至少第二实验室试验或其一部分。在实施方式中,样品的第一部分可在第一实验室试验中使用以确定该样品中是否存在感兴趣的特定病原体,而样品的第二部分可在第二实验室试验中使用以便可以确定样品中的病原体是否对抗微生物剂具有抗性或敏感性。
在实施方式中,可将至少两个样品引入样品处理装置中,并且可在样品处理装置中对每个样品进行不同的处理。例如,第一样品可用于至少第一实验室试验或其一部分,而第二样品可用于至少第二实验室试验或其一部分。在实施方式中,第一样品可在第一实验室试验中使用以确定该样品中是否存在感兴趣的特定病原体,而第二样品可在第二实验室试验中使用以便可以确定样品中的病原体是否对抗微生物剂具有抗性或敏感性。在实施方式中,筒匣可包含至少1、2、3、4、5、6、7、8、9、10个或更多个样品。可在筒匣中的分开的、流体隔离的器皿中提供一个或多个样品,并将该样品引入样品处理装置中。
在实施方式中,可经由本文提供的样品处理装置100内的自动化过程来进行测定,以检测样品中病原体的存在和/或病原体对抗微生物剂的响应。在实施方式中,样品的一部分可直接用来检测该样品中的病原体对抗微生物剂的响应。在其他实施方式中,可首先在样品处理装置内对样品中的病原体进行富集或浓缩(例如通过物理方法,如使用针对病原体的基于抗体的捕获表面,培养病原体,离心以使病原体向含有病原体液体悬浮液的管底移动,或过滤以从病原体液体悬浮液中捕获病原体),并且所富集或浓缩的病原体可用来检测病原体的存在或病原体对抗微生物剂的响应。因此,样品处理装置可包含用于富集或浓缩病原体的部件,如离心机。另外,可经由筒匣向样品处理装置提供用于富集或浓缩病原体的试剂或部件。例如,筒匣可包含用于结合病原体的基于抗体的捕获表面、用于培养病原体的生长培养基、用于将病原体离心的离心器皿和用于捕获病原体的过滤器。可在筒匣中在分开的、流体隔离的器皿或室中提供各种试剂或部件。
在本文提供的实施方式中,引入样品处理装置100中的样品110的一个或多个部分可在一种或多种测定中使用,以检测病原体对一种或多种抗微生物剂的响应。为了测量病原体在抗微生物剂的存在下的生长,可在样品处理装置内提供微生物生长培养基和抗微生物剂。此外,可以提供核酸染料、代谢指示剂(如刃天青)或其他试剂,以测定病原体在抗微生物剂的存在下的生长。在实施方式中,可经由也包含用于在样品处理装置中进行处理的样品的筒匣将生长培养基引入该样品处理装置中。在其他实施方式中,将生长培养基引入样品处理装置中可以与将样品引入该装置中分开进行。在实施方式中,可将多种不同类型的生长培养基引入样品处理装置中,以支持多种不同类型的病原体的生长(例如2、3、4、5、6、7、8、9、10、15、20种或更多种不同类型的生长培养基,以支持2、3、4、5、6、7、8、9、10、15、20种或更多种不同类型的病原体的生长)。在实施方式中,可将单一类型生长培养基的多个不同的分开的、流体隔离的部分引入样品处理装置中(单独地或与其他类型的生长培养基组合地)。在实施方式中,可在样品处理装置内,例如通过流体运送系统,将单个器皿中的生长培养基分成两个或更多个部分。
在实施方式中,引入样品处理装置中的生长培养基可与抗微生物剂预先混合以用于测定病原体的生长,使得在将生长培养基引入样品处理装置中时,该抗微生物剂处于生长培养基中。在其他实施方式中,在将生长培养基引入样品处理装置中时,生长培养基不含抗微生物剂,然后将抗微生物剂添加至样品处理装置内的生长培养基中。例如,可经由筒匣将生长培养基引入样品处理装置中,并且该筒匣可在分开的器皿中包含生长培养基和抗微生物剂。一旦位于样品处理装置中,抗微生物剂和生长培养基即可混合(例如,流体运送系统可通过以下方式使抗微生物剂和生长培养基形成流体连通:抽吸为液体或悬浮形式的抗微生物剂,然后将抗微生物剂分配至生长培养基中,或者可抽吸液体生长培养基并将其分配至液体或固体形式的抗微生物剂中)。另外,可通过流体运送系统使样品与抗微生物剂和生长培养基形成流体连通。
在实施方式中,引入样品处理装置中的生长培养基可与抗微生物剂和代谢指示剂预先混合。在其他实施方式中,使生长培养基与抗微生物剂预先混合,并将代谢指示剂添加至样品处理装置中的生长培养基中。在其他实施方式中,在将生长培养基引入样品处理装置中时,生长培养基不含抗微生物剂或代谢指示剂,而是将抗微生物剂和代谢指示剂添加至样品处理装置中的生长培养基中。例如,筒匣可在分开的器皿中包含生长培养基、抗微生物剂和代谢指示剂。一旦位于样品处理装置中,即可通过流体运送系统使抗微生物剂、生长培养基和代谢指示剂混合。在另一个实例中,抗微生物剂和生长培养基位于筒匣中的同一器皿中。在又一个实例中,抗微生物剂、生长培养基和代谢指示剂位于筒匣中的同一器皿中。另外,可通过流体运送系统使样品与抗微生物剂、生长培养基和代谢指示剂形成流体连通。
在一些实施方式中,可将多种不同的抗微生物剂引入样品处理装置中,使得可以根据需要将不同的抗微生物剂引入生长培养基中。例如,可将携带生长培养基和第一抗微生物剂及第二抗微生物剂的筒匣引入样品处理装置中。一旦位于样品处理装置中,基于针对待测病原体或抗微生物剂抗性所选择的方案,可将第一抗微生物剂或第二抗微生物剂与生长培养基组合。因此,根据本文提供的实施方式,基于针对样品或其中的病原体的各种不同的处理目标,可将不同的抗微生物剂与本文提供的样品处理装置内的不同生长培养基混合并匹配。
例如,利用本文提供的实施方式,可向包含生长培养基和第一抗微生物剂及第二抗微生物剂的样品处理装置的控制器提供方案,其中该方案包含针对流体运送系统(例如,自动化移液器)的指令,即使用样品处理装置,根据样品中所鉴定的病原体和/或用来针对该病原体进行检测的感兴趣的抗微生物剂,将第一抗微生物剂或第二抗微生物剂与生长培养基相混合。在实施方式中,可以评估病原体在抗微生物剂的存在下的生长,而无需将病原体从其原始样品移至单独的生长培养基中。在这样的实例中,可直接将抗微生物剂与含有病原体的样品混合,随后可评估该病原体对该抗微生物剂的响应。除非上下文另有明确规定,否则本文关于评估病原体在含有抗微生物剂的生长培养基中的生长的任何描述也可适用于将抗微生物剂直接引入含有病原体的样品中的条件。如果要评估病毒响应于抗微生物剂的生长,用于该病毒的生长培养基通常包含病毒可在其中复制的宿主细胞。
在实施方式中,可在样品处理装置中针对一种或多种标志物处理可能含有病原体的样品,该标志物指示该样品是否含有来自一类潜在病原体的至少一种类型的生物体,如细菌、病毒、真菌、寄生虫或原生生物。例如,可在样品处理装置中测定样品的细菌标志物,如16srrna、23srrna、rpob、gyrb、dnak、amoa和mip基因或其基因产物。在另一个实例中,可测定样品的真菌标志物,如核糖体顺反子的内转录间隔区(its)。可在样品处理装置中通过核酸扩增、基于核酸探针的测定或任何其他合适的测定来检测所述一种或多种标志物。在一个实施方式中,可在筒匣中提供用于核酸扩增反应的试剂和/或用于基于核酸探针的测定的试剂。该筒匣还可在分开的、流体隔离的器皿中包含样品。可通过向样品处理装置中插入筒匣来将试剂和样品引入样品处理装置中。在一个实施方式中,样品处理装置的流体运送系统转移样品或其一部分,使其与用于核酸扩增和/或基于核酸探针的测定的试剂形成流体连通。然后可将混合物在足以支持该样品中病原体的核酸扩增的条件下进行温育,或在足以支持核酸探针与该样品中病原体的核酸杂交的条件下进行温育。
执行核酸扩增或基于核酸探针的测定的样品处理装置可包含用于促进核酸测定的执行的一个或多个硬件部件,如热控制单元。热控制单元可维持所选的温度或者温度范围或循环以便执行或支持核酸测定(例如,为了pcr测定而进行热循环或为了等温测定或基于核酸探针的测定而维持选定的恒定温度)。样品处理装置可进一步包含用于监测核酸测定的一个或多个检测器或传感器,并且还可用来测量非核酸测定(例如普通化学测定、免疫测定、代谢测定等)。
在其他实施方式中,为了测定病原体的细胞分裂、dna复制或病原体的其他特征,可通过装置内的流体运送系统将病原体移至样品处理装置内的细胞计数器,其中该样品细胞计数器包含可接收显微镜载玻片的显微镜载物台。在实施方式中,向含有显微镜载玻片的筒匣提供样品,并将筒匣插入样品处理装置中。然后可将病原体引入样品处理装置内的显微镜载玻片上。
在实施方式中,利用本文提供的系统和方法,可如上所述测量指示细胞死亡的标志物,如细胞中一种或多种生物化学标志物的表达,染色体结构的变化,或特定细胞形态的发展。样品可与抗微生物剂接触,并且可在抗微生物剂引入该样品之后的一个或多个时间间隔评估病原体的一种或多种细胞死亡标志物。在实施方式中,可通过对已暴露于特定抗微生物剂并在样品处理装置中成像的病原体进行染色来检测所述一种或多种细胞死亡标志物。在实施方式中,可将样品提供至含有染色剂的筒匣以及插入至包含图像捕获装置如电荷耦合器件(ccd)相机或cmos传感器的样品处理装置中的筒匣。在实施方式中,样品的染色和成像在样品处理装置内是自动化的。
在实施方式中,可向样品处理装置提供用于检测或鉴定样品中的病原体的多种不同的试剂。可将这类多种不同的试剂提供至样品处理装置,例如还包含供处理的样品的筒匣中。例如,在单个筒匣内,可提供任何数目和组合的以下类型的试剂:a)用于核酸扩增反应以检测来自病原体的特异性核酸的存在,从而指示样品中存在该病原体的引物对(即含有第一引物和第二引物);b)用于核酸扩增反应以检测病原体中特异性抗微生物剂抗性基因的存在,从而指示样品中存在该抗微生物剂抗性基因的引物对;c)用于核酸扩增反应以检测病原体中特异性抗微生物剂抗性突变(例如基因中的点突变)的存在,从而指示样品中存在该抗微生物剂抗性突变的引物对;d)用于核酸扩增反应以检测指示一类微生物(例如细菌、病毒或真菌)的核酸序列,从而指示样品中存在一般类别的微生物的引物对;e)对病原体的靶核酸具有特异性、在基于核酸探针的测定中用来确定样品中是否存在该病原体的核酸探针;f)对病原体中的抗微生物剂抗性基因具有特异性、在基于核酸探针的测定中用来确定该病原体中是否存在抗微生物剂抗性基因的核酸探针;g)对病原体中的抗微生物剂抗性突变(例如基因中的点突变)具有特异性、在基于核酸探针的测定中用来检测是否存在该抗微生物剂抗性突变的核酸探针;h)对指示一类微生物(例如细菌、病毒或真菌)的核酸序列具有特异性、在基于核酸探针的测定中用来检测是否存在一类微生物的核酸探针;i)用于感兴趣的病原体的生长培养基;j)抗微生物剂,使得可向病原体提供在抗微生物剂的存在下在生长培养基中生长的机会,以便确定该病原体对该抗微生物剂的响应;k)核酸染料(例如hoechst染料、dapi、溴化乙锭、sybr染料);以及1)用于检测病原体在抗微生物剂的存在下生长的代谢指示剂(例如刃天青、ctc、cfda-se和萤光素)。此外,在实施方式中,可向样品处理装置提供多个数目的(例如2、3、4、5、6、7、8、9、10种或更多种)任何上述试剂,并且这些试剂可以是不同的引物、探针、抗微生物剂、生长培养基等。在一个实施方式中,也可经由如本文所述的筒匣向样品处理装置提供特定测定所需的所有试剂。在一个实施方式中,各种试剂可位于筒匣中分开的、流体隔离的器皿中。在另一个实施方式中,任何数目或组合的试剂可位于筒匣中的同一器皿中。
利用本文提供的系统和方法,可以评估样品的病原体,并且在实施方式中,可以评估样品中潜在病原体的以下1、2、3个或所有4个特征:a)存在于样品中的一类病原体(例如细菌、病毒或真菌);b)样品中的病原体的具体种、亚种或株;c)样品中的病原体对抗微生物剂的生长响应;或d)样品或其中的病原体是否含有抗微生物剂抗性基因或抗微生物剂抗性突变。此外,可测定样品中的病原体的不同类别或病原体的不同种、亚种或株,并且可测定病原体对不同抗微生物剂的响应或抗微生物剂抗性基因。在实施方式中,可在单个样品处理装置的壳体内进行任何或全部测定。在其他实施方式中,可以用多于一个样品处理装置进行该测定。
在实施方式中,反馈回路可允许在本文提供的系统、装置和方法内开始或完成另一测定之后启动反射测试,该反射测试可引发后续的测定、制备步骤和/或其他过程。这样的后续测定、制备步骤和/或其他过程可在没有任何人为干预的情况下自动启动。任选地,响应于第一测定结果执行反射测试。例如,筒匣可预先装载用于第一测定以检测样品中是否存在病原体的试剂(例如用于核酸扩增反应以检测病原体的核酸的试剂),以及用于第二测定以确定病原体的抗微生物剂抗性或敏感性的试剂(例如抗微生物剂、微生物生长培养基和代谢指示剂)。如果第一测定的结果指示样品中存在病原体,则在该装置中用相同的样品运行第二测定。装置方案被设计成说明运行反射测试的可能性。可在第一测定完成之前启动或执行第二测定的一些或所有方案步骤。例如,可以在用于检测病原体是否存在的测定完成之前,开始在抗微生物剂的存在下在微生物生长培养基中培养样品。
在实施方式中,可以评估样品的以下方面:可能存在于该样品中的一组病原体,以及可能存在于该组中一种或多种病原体中的一种或多种抗微生物剂抗性性状。例如,可以检测样品的多种性传播疾病病原体,并且还可以评估样品中一种或多种这样的病原体对一种或多种抗微生物剂的响应。可以根据本文提供的系统和方法来检测的组的其他实例包括医院获得性感染组(例如mrsa)或热带病病原体组。在实施方式中,可在受试者进入患者医护单位(例如医院或诊所)之前,检测受试者的一种或多种病原体或一组病原体,并且一旦进入患者医护单位就另外或单独检测一种或多种病原体或一组病原体。本文提供的系统和方法可用来连续监测患者的感染,因此可用来改善在医护单位或在患者家中对患者的医护。例如,如果确定患者具有对特定抗微生物剂敏感的病原体感染,则可向该患者施用该抗微生物剂。在某些实施方式中,例如,如果患者具有感染而且还需要手术,则可将可能在手术期间使用或在手术期间植入受试者中的物体(例如贴片)用将会阻碍引起感染的病原体生长的抗微生物剂预先涂覆或以其他方式掺入该抗微生物剂。
在实施方式中,样品处理装置可配置为传送从样品获得的数据。在实施方式中,样品处理装置可配置为通过网络进行通信。样品处理装置可包括可与网络接合的通信模块。样品处理装置可经由有线连接或无线地连接至网络。该网络可以是局域网(lan)或广域网(wan)如因特网。在一些实施方式中,该网络可以是个人局域网。该网络可包括云。样品处理装置可连接至网络而无需中间装置,或者可能需要中间装置将样品处理装置连接至网络。样品处理装置可以通过网络与另一装置通信,该另一装置可以是任何类型的联网装置,包括但不限于个人计算机、服务器计算机或膝上型计算机;个人数字助理(pda),诸如windowsce装置;电话,诸如蜂窝电话、智能电话(例如,iphone、android、blackberry等)或位置感知的便携式电话(例如gps);漫游装置,诸如联网的漫游装置;无线装置,诸如无线电子邮件装置或能够与计算机网络无线通信的其他装置;或可以通过网络而可能通信并处理电子交易的其他任何类型的网络装置。这样的通信可包括向云计算基础设施或可被其他装置访问的其他任何类型的数据存储基础设施提供数据。
样品处理装置可以向例如卫生保健专业人员、卫生保健专业场所如实验室或其附属机构提供关于样品的数据。实验室、卫生保健专业人员或受试者中的一个或多个可具有能够接收或访问由该样品处理装置提供的数据的网络装置。样品处理装置可配置为向数据库提供关于样品的数据。样品处理装置可配置为向电子病历系统、向实验室信息系统、向实验室自动化系统或其他系统或软件提供关于样品的数据。样品处理装置可以以报告的形式提供数据。
实验室、装置或其他实体或软件可对关于样品的数据进行实时分析。分析可包括样品的定性和/或定量评估。数据分析可包括随后对样品的定性和/或定量评估。任选地,报告可基于原始数据、预处理的数据或经分析的数据而生成。可制作这样的报告以便维持从样品获得的数据的机密性、关于从中获得样品的受试者的身份和其他信息、数据的分析以及其他机密信息。该报告和/或数据可传输至卫生保健专业人员。可向数据库、电子病历系统、向实验室信息系统、向实验室自动化系统或其他系统或软件提供由样品处理装置获得的数据或对这类数据的分析或报告。
在实施方式中,本文提供的系统和方法的使用可减少在患者中使用中心静脉导管(“中心线”)的需求。在一些情况下,至少部分地由于需要定期从患者获得相对较大量的血液样品,因此可在患者中保留中心线。患者的中心线的存在可能是不期望的,例如,因为其可增加患者发展出一种或多种感染如金黄色葡萄球菌或表皮葡萄球菌感染的风险。通过使用本文提供的系统和方法处理来自受试者的小体积样品,在某些患者中不使用中心线是可能的。例如,不是通过中心线从患者获得相对大体积的血液以供分析,而是可通过替代部位(例如手指)获得小体积的血液,并且可将该小体积的血液用于采用本文提供的系统和方法进行分析。在实施方式中,可使用并非经由患者的中心线获得的样品进行本文提供的方法。在实施方式中,可在24小时时间段内从患者收集至少1、2、3、4、5、6、7、8、9、10、11、12、15或20次用于本文提供的系统或方法的样品,其中没有样品是经由患者的中心线而获得的。在实施方式中,可在24小时时间段内收集至少1、2、3、4、5、6、7、8、9、10、11、12、15或20个样品并将其用于本文提供的系统或方法,其中没有样品是经由患者的中心线而获得的。
虽然本文已经示出和描述了本发明的优选实施方式,但对于本领域技术人员显而易见的是,这些实施方式只是以示例的方式提供的。本领域技术人员现将在不偏离本发明的情况下想到许多更改、改变和替代。应当理解,在实践本发明的过程中可以采用本文所描述的本发明实施方式的各种替代方式。例如,一个实施方式的特征可与另一个实施方式的特征相组合,无论这种组合在本文中是否已经描述。还应当理解,虽然出于方便的目的,本文中已经使用有限数目的术语和短语描述了本文提供的发明,但本发明也可以使用本文未提供的同样准确描述本发明的其他术语和短语进行描述。
应当理解,除非上下文另有明确规定,否则在本文的说明书和随后的整个权利要求书中使用的“一个”、“一种”和“该”的含义包括复数的提及物。例如,提到“一个测定”可以指单个测定或多个测定。另外,除非上下文另有明确规定,否则在本文的说明书和随后的整个权利要求书中使用的“在......中”的含义包括“在......中”和“在......上”。所附权利要求不应解释为包括装置加功能式限定,除非在给定的权利要求中使用短语“用于......的装置”明确地叙述了这样的限定。如在此处的说明书和随后的整个权利要求书中所用的,描述为含有第二个对象的“至少一部分”的第一对象可含有所有量的/完整的第二对象。
如在此处的说明书和随后的整个权利要求书中所用的,术语“包含”、“包括”和“含有”以及相关的时态是包含在内且开放式的,并且不排除额外的、未叙述的要素或方法步骤。而且,在一些情况下,拓宽性词语和短语如“一个或多个(一种或多种)”、“至少”、“但不限于”或其他类似短语的存在不应被理解为有以下含义:在可能不存在这类拓宽性短语的情况下,预期或要求较窄的范围。最后,除非上下文另有明确规定,否则在此处的说明书和随后的整个权利要求书中使用的“或”的含义包括连接性和转折性的含义。因此,除非上下文另有明确规定,否则术语“或”包括“和/或”。
本文档包含受到版权保护的材料。版权拥有人(在此为申请人)对于本专利文件或专利公开内容中任何一个在美国专利商标局专利文件或记录中出现时的摹本复制不持异议,但除此之外在任何情况下均保留所有版权。以下声明应当适用:copyright2014-15theranos,inc.。
以下实施例仅为了说明目的而提供,而非意在以任何方式限制本公开内容。
实施例
实施例1
用于检测抗微生物剂抗性或敏感性的刃天青还原方法
将已知对卡那霉素具有抗性的单个大肠杆菌菌落(大肠杆菌k12mg1655)和已知对羧苄青霉素具有抗性的单个大肠杆菌菌落(大肠杆菌k12mg1655)单独在lb培养基中培养12-15hr,直到细菌细胞处于对数中期(约108个细胞/ml)。然后将培养物在含有50μg/ml卡那霉素或100μg/ml羧苄青霉素的lb培养基中连续稀释至5×102、5×103、5×104和5×105个细胞。将刃天青以在100μl的总反应体积中20μm、40μm或80μm的终浓度添加至各稀释液中。将每个稀释的培养物在37℃下培养,并从在抗生素的存在下开始培养起o、1、2、3、4、5和6hr在波长590nm处测量荧光。
图5a-5c显示,在卡那霉素的存在下及在所有刃天青浓度下,卡那霉素抗性菌株在所有细胞浓度下均表现出生长。在卡那霉素的存在下,较高的初始细胞浓度(例如5×103、5×104和5×105个细胞)表现出更快的生长,因此,可在开始培养的1-5hr内检测对抗生素的抗性。在开始培养后约6hr,较低的初始细胞浓度(5×102个细胞)开始显示出对抗生素的抗性。相比之下,图5d-5f显示,在羧苄青霉素的存在下,在所有刃天青浓度下,卡那霉素抗性菌株在各种细胞浓度下均表现出缓慢生长或无生长。
图6a-6c显示,在羧苄青霉素的存在下及在所有刃天青浓度下,羧苄青霉素抗性菌株在所有细胞浓度下均表现出生长。在羧苄青霉素的存在下,较高的初始细胞浓度(例如5×103、5×104和5×105个细胞)表现出更快的生长,因此,可在开始培养的1-5hr内检测对抗生素的抗性。在开始培养后约6hr,较低的初始细胞浓度(5×102个细胞)开始显示出对抗生素的抗性。相比之下,图6d-6f显示,在卡那霉素的存在下,在所有刃天青浓度下,羧苄青霉素抗性菌株在各种细胞浓度下均表现出缓慢生长或无生长。
实施例2
小反应体积中的刃天青还原方法
使用卡那霉素抗性菌株重复刃天青还原方法,但是在10μl总反应体积中以5×101、5×102、5×103和5×104个细胞/反应的最终细胞浓度进行。使用与上文相同的最终刃天青浓度(20μm、40μm或80μm)、卡那霉素浓度和羧苄青霉素浓度。从在抗生素的存在下开始培养起0、1、2、3、4、5、6和7hr在波长590nm处测量荧光。
如图7a-7c所示,在卡那霉素的存在下及在所有刃天青浓度下,卡那霉素抗性菌株在所有细胞浓度下均表现出生长。在卡那霉素的存在下,较高的初始细胞浓度(例如5×102、5×103和5×104个细胞)表现出更快的生长,因此,可在开始培养的1-6hr内检测对抗生素的抗性。在开始培养后约7hr,较低的初始细胞浓度(5×101个细胞)开始显示出对抗生素的抗性。相比之下,图7d-7f显示,在羧苄青霉素的存在下,在所有刃天青浓度下,卡那霉素抗性菌株在各种细胞浓度下均表现出缓慢生长或无生长。
因此,刃天青还原测定可用来使用含有低拷贝数病原体(例如101-105个细胞)的少量样品(例如10-100μl)并在短时间内(例如,在抗微生物剂的存在下开始培养的1-7hr内)检测抗微生物剂抗性/敏感性。此外,该刃天青还原测定不需要裂解细胞并且可在37℃下进行。因此,该刃天青还原测定是一种用于确定病原体对抗微生物剂的抗性或敏感性的方便且快速的测定。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种封闭式病原体检测卡盒的制作方法与工艺
- 检测16种呼吸道病原体的基因芯片检测用试剂盒及方法与流程
- 一种同时检测多种病原体的五重PCR检测方法与流程
- 逆转肿瘤多药耐药的基因组合物h‑R3/PAMAM G5/MDR1 siRNA及其应用的制作方法与工艺
- 用于对肉类、植物或植物部分进行病原体检测和病害治理的方法与流程
- 一种用于检测治疗恶性肿瘤的一线药物耐药基因表达量的试剂盒的制造方法与工艺
- 用于检测植物病原体的装置和方法与流程
- 用于检测多种病原体的荧光实时检测方法及应用与流程
- 一种用于检测手足口病相关病原体的LAMP引物组合物及其相关应用的制造方法与工艺
- 一种用于检测巴氏杆菌氯霉素类药物耐药基因的分子标记及其应用的制造方法与工艺