一种真菌免疫调节蛋白FIP‑dsq2及其应用的制作方法
本发明涉及一种运用基因工程手段得到的真菌免疫调节蛋白FIP-dsq2及其应用。
背景技术:
:
真菌免疫调节蛋白(Fungal immunomodulatory proteins,以下简称为FIPs)具有增强免疫力等多种重要的生理功能。
FIPs最早是用食用菌类提取而被发现的,但提取工艺复杂、周期长、成本高、得率低,很难开发利用。虽然FIPs具有序列和结构保守性,但是不同来源的FIPs活性和稳定性差异很大。
通过基因工程方法从已完成基因组测序的真菌中获得可开发利用的新FIPs蛋白,既能丰富FIPs家族的种类,更能为人类健康的保健和治疗提供新的免疫调节剂。
技术实现要素:
:
本发明的目的是通过生物信息学方法筛选到新的来源于真菌的免疫调节蛋白,使其能够应用于制备免疫调节剂和抗肿瘤药物。
本发明人通过生物信息学方法筛选到一种来源于真菌Dichomitus squalens LYAD-421 SS1的免疫调节蛋白FIP-dsq2,发现其适合于在保健食品和医药中使用。
所述真菌免疫调节蛋白FIP-dsq2,全长111个氨基酸,理论分子量为12.512kDa,其氨基酸序列如SEQ ID NO.1所示。
FIP-dsq2蛋白是一种新型的真菌免疫调节蛋白。本发明人通过将其氨基酸序列在GenBank中进行BLAST比对发现:FIP-dsq2蛋白与小孢灵芝、赤灵芝、紫灵芝和金针菇真菌免疫调节蛋白GMI、FIP-gja、LZ-8和FIP-fve的序列同源性仅分别为61.3%、60.4%、58.6%和51.8%。说明FIP-dsq2是一种新的真菌免疫调节蛋白。
本发明还提供并合成了编码上述真菌免疫调节蛋白FIP-dsq2的基因:通过一对引物FIP-dsq2-F(EcoRI):5'-C CAA GAA TTC GTC GAC ACT TCC-3'和FIP-dsq2-R(XhoI):5'-AAA AAA CTC GAG ATT CCA TTG AGC-3',用基因合成的方法克隆了这一真菌免疫调节蛋白FIP-dsq2的基因,DNA全序列分析结果表明,fip-dsq2全长336bp,其DNA序列如SEQ ID NO.2所示。
本发明还提供了包含蛋白FIP-dsq2基因的重组表达载体。方法是将本发明的真菌免疫调节蛋白FIP-dsq2基因插入到表达载体合适的限制性酶切位点之间,使其核苷酸序列可操作的与表达调控序列相连接。优选的表述载体是pGEX-6T-1。
作为本发明的一个最优选的实施方案,所述表达载体合适的限制性酶切位点之间是pGEX-6T-1上的EcoRI和XhoI限制性酶切位点之间,得到重组大肠表达载体pGEX-fip-dsq2。
将上述重组表达载体转化宿主细胞大肠杆菌。所述宿主细胞优选为大肠杆菌Rosetta,得到重组菌株Rosetta(pGEX-fip-dsq2)。
本发明还提供了包含真菌免疫调节蛋白FIP-dsq2基因的重组菌株,优选为重组菌株Rosetta(pGEX-fip-dsq2)。
本发明还提供了制备真菌免疫调节蛋白FIP-dsq2的方法,包括以下步骤:
1)将含FIP-dsq2基因的重组表达载体转化宿主细胞,得重组菌株;
2)培养重组菌株,诱导重组真菌免疫调节蛋白FIP-dsq2的表达;以及
3)回收并纯化所表达的真菌免疫调节蛋白FIP-dsq2。
经肿瘤抑制、凋亡和迁移实验证实:FIP-dsq2蛋白对人肺腺癌肿瘤细胞A549具有明显的抑制增殖、诱导凋亡和阻止迁移的作用,可应用于保健品和医药等工业(详见实施例2~4)。
通过如下实验证明了本发明提供的新的免疫调节蛋白的功能:
1、体外抗肿瘤活性
实验结果:
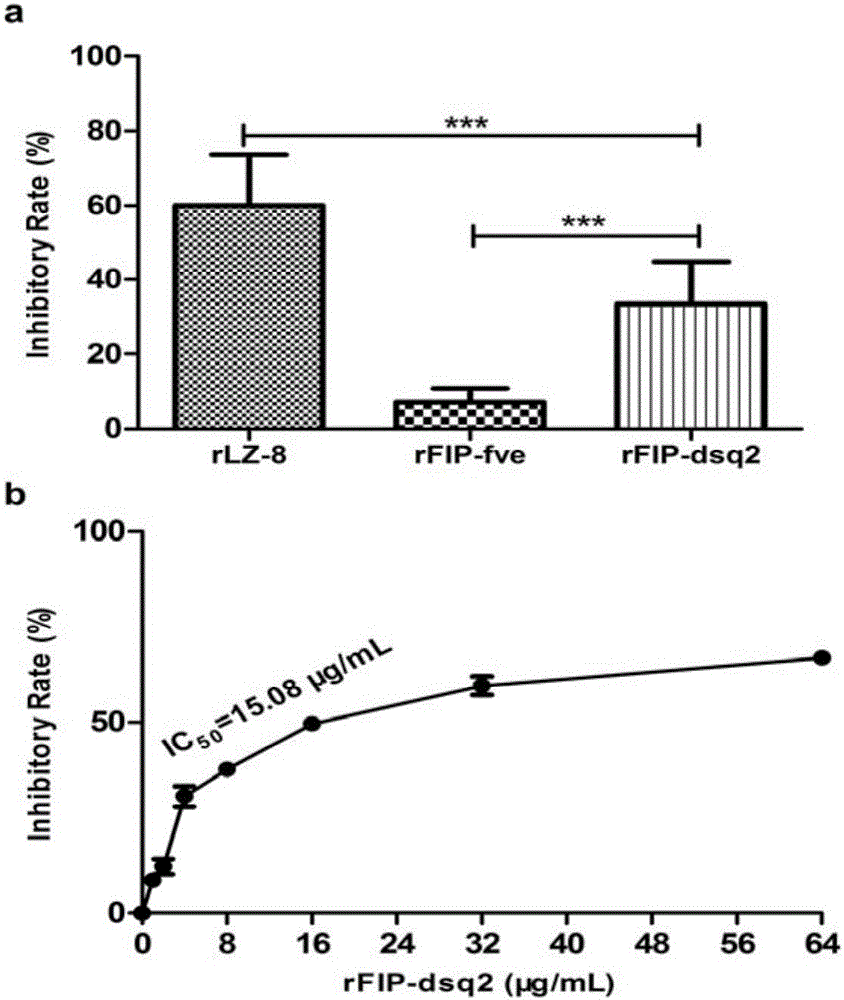
FIP-dsq2对肺腺癌A549细胞具有毒性作用,半致死计量IC50为15.08μg/mL(图2);8μg/ml的不同来源的真菌免疫调节蛋白比较实验结果表明,FIP-dsq2对A549的毒性作用略弱于灵芝免疫调节蛋白LZ-8,显著高于金针菇免疫调节蛋白FIP-fve
结论:
FIP-dsq2对肿瘤细胞具有极强的高毒性作用,及具应用潜力。(实施例3)
2、诱导肿瘤细胞凋亡分析
实验结果:
FIPs对A549细胞具有凋亡作用,8μg/ml的FIP-dsq2、LZ-8和FIP-fve处理A549细胞24h后,凋亡率分别为20.71%、38.82%、10.88%(图3)。
结论:
FIP-dsq2对肿瘤细胞A549具有凋亡作用,其诱导凋亡作用低于LZ-8,却显著高于FIP-fve,是极具潜力的抗肿瘤药物(实施例4)。
3、抑制肿瘤细胞迁移检测
实验结果:
24h后,未处理细胞(NC)划出伤口明显愈合,8μg/ml的LZ-8处理后,伤口愈合现象不明显;8μg/ml的FIP-dsq2处理后,伤口愈合现象较为显著;而8μg/ml的FIP-fve处理A549细胞24h后,伤口愈合情况极为显著,与阴性对照极为相似(图4)。
结论:
FIP-dsq2可以抑制肿瘤细胞A549迁移,FIP-dsq2对肿瘤细胞A549的迁移抑制作用略微差于LZ-8,却显著强于FIP-fve,是极具潜力的抗肿瘤药物(实施例5)。
本发明优点和有益效果:
1、可以提供相当数量的免疫调节蛋白质FIP-dsq2纯品,完全能满足临床与医药应用需求。
FIP-dsq2在该大肠杆菌表达系统中实现高效表达,表达量为29mg/L(实施例2);经柱纯化后,蛋白质的含量达到电泳纯(图1)。而目前通常从几千克食用菌中只能提取毫克级蛋白。
2、FIP-dsq2具有抗肿瘤活性,具有治疗应用潜力。
抗肿瘤效应检测结果表明,FIP-dsq2对A549具有毒性作用(实施例3),可以诱导A549凋亡(实施例4),抑制A549迁移(实施例5);其抗肿瘤效应与灵芝免疫调节蛋白LZ-8相当,但显著高于金针菇免疫调节蛋白FIP-fve,极具应用潜力。
3、首次运用基因工程手段提供了一个新的真菌来源的免疫调节蛋白。
由于运用基因工程手段来产业化生产真菌免疫调节蛋白FIP-dsq2产品还未见报道。本发明首次提供了一个新的真菌来源的免疫调节蛋白FIP-dsq2。而且,根据本发明的技术方案就可以实现利用基因工程手段生产真菌免疫调节蛋白FIP-dsq2。
附图说明:
图1~图4是对本发明纯化制备的真菌免疫调节蛋白FIP-dsq2进行分析和功能实验,其中:
图1是SDS-PAGE分析纯化的FIPs:其中,条带1和4为蛋白marker,条带2、3、5分别为纯化的灵芝免疫调节蛋白LZ-8、金针菇免疫调节蛋白FIP-fve和Dichomitus squalens免疫调节蛋白FIP-dsq2。
图2是FIP-dsq2蛋白抑制肿瘤细胞A549增殖结果。
图3是FIP-dsq2蛋白诱导肿瘤细胞A549凋亡结果。
图4是FIP-dsq2蛋白抑制肿瘤细胞A549迁移结果。
具体实施方式
以下实施例仅用于举例说明本发明的方法,并不限制本发明的范围。
试验材料
1、细胞株:人肺腺癌细胞A549,购买于北京协和医院细胞资源中心。
2、试剂耗材
CCK试剂盒:全式金细胞活性检测试剂盒;
TransDetctTM Annexin V-FITC/PI Cell Apoptosis Detection Kit:全式金细胞凋亡检测试剂盒;
PCR引物合成和基因测序均由上海生工生物公司完成;
酶类:内切酶EcoRI和XhoI购自TaKaRa公司,连接酶购自Invitrogen公司;Prescission Protease由实验室制备;
仪器:离心机、振荡摇床、显微镜、酶标仪、流式细胞仪;
生化试剂:氨苄青霉素、青霉素(钠盐)、硫酸链霉素、溴酚兰、噻唑兰(MTT)、胎牛血清(FBS),二甲基亚砜(DMSO)为Sigma产品。
3、培养基
高糖DMEM培养液,加入10%FBS、100U/ml青霉素、100μg/ml链霉素,0.22μm滤膜过滤灭菌后4℃保存。
说明:以下实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》(第三版)J.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行。
本实施例中的抗肿瘤效应检测,均以灵芝免疫调节蛋白(LZ-8)和金针菇免疫调节蛋白(FIP-fve)为阳性对照。
实施例1真菌免疫调节蛋白FIP-dsq2编码基因筛选、克隆和表达载体构建
以金针菇免疫调节蛋白FIP-fve为诱饵,在NCBI真菌基因组数据库中进行BLAST比对,在担子真菌Dichomitus squalens LYAD-421SS1基因组中发现与FIP-fve同源性为51.8%的FIP-dsq2编码基因,基因全长336bp(333bp外加一个终止密码子TAA),其DNA序列如SEQ ID NO.2所示。经密码子优化后,合成基因。
设计并合成引物FIP-dsq2-F(EcoRI):5'-C CAA GAA TTC GTC GAC ACT TCC-3'和FIP-dsq2-R(XhoI):5'-AAA AAA CTC GAG ATT CCA TTG AGC-3',用以上引物扩增合成基因。用EcoRI和XhoI酶切PCR扩增产物,获得目标基因fip-dsq2,将目标基因连接到经相同酶切的表达载体pGEX-6T-1,获得含有真菌免疫调节蛋白FIP-dsq2基因的重组表达载体pGEX-fip-dsq2,转化大肠杆菌Rosetta,获得重组菌株Rosetta(pGEX-fip-dsq2)。
实施例2真菌免疫调节蛋白FIP-dsq2表达纯化
取阳性转化子Rosetta(pGEX-fip-dsq2)菌株,接种于20mL含有50μg/ml氨苄的LB培养液中,37℃200rpm过夜活化。次日,以2%的接菌量,接种于200mL含有50μg/ml氨苄的LB培养液中,37℃200rpm培养至OD600为0.8-1.0,加0.1mM IPTG,20℃200rpm过夜诱导16h后,离心收集菌体。0.2体积的PBS溶解菌体,超声波破碎,离心收集上清。GST柱纯化后,用100U/ml的Prescission Protease 4℃过夜酶切,去除GST标签。过Q柱和分子筛纯化FIP-dsq2蛋白。
实验结果:
经以上表达系统表达FIP-dsq2蛋白的理论分子量为14.08KDa(包括部分载体序列和限制酶切位点翻译氨基酸);FIP-dsq2在大肠杆菌中高效表达,表达量为29mg/L;经柱纯化后,蛋白质的含量达到电泳纯(图1)。
结论:
FIP-dsq2在该大肠杆菌表达系统中实现高效表达,因此可以快速提供相当数量的蛋白质纯品,以满足临床与医药应用需求。
实施例3CCK法测定真菌免疫调节蛋白FIP-dsq2体外抗肿瘤活性
实验方法:
1)在DMEM培养液中传代培养A549细胞,计数肿瘤细胞,稀释到终浓度为2.5×105细胞/ml。
2)在96孔培养板内每孔加入100μl肿瘤细胞悬浮液,培养24h后,分别加入100μl的重组蛋白样品,终浓度为0、1、2、4、8、16、32和64μg/ml。同时加入相同方法制备的8μg/mL灵芝和金针菇免疫调节蛋白LZ-8和FIP-fve做阳性对照。每个样品5个平行。
3)混匀后,放于5%CO2,37℃培养箱中培养24小时。
4)24小时后,CCK法检测细胞活性(具体操作参见说明书)。
实验结果:
FIP-dsq2对肺腺癌A549细胞具有毒性作用,半致死计量IC50为15.08μg/mL(图2);8μg/ml的不同来源的真菌免疫调节蛋白比较实验结果表明,FIP-dsq2对A549的毒性作用略弱于灵芝免疫调节蛋白LZ-8,显著高于金针菇免疫调节蛋白FIP-fve。
结论:
FIP-dsq2对肿瘤细胞具有极强的高毒性作用,及具应用潜力。
实施例4真菌免疫调节蛋白FIP-dsq2诱导肿瘤细胞凋亡分析
实验方法:
1)在5%CO2,37℃培养箱中用DMEM培养液培养A549细胞,细胞计数,使其终浓度为lx106细胞/ml。
2)在6孔培养板中每孔加入0.8ml肿瘤细胞悬浮液,培养24h后,分别加入0.2ml终浓度为8μg/ml的重组真菌免疫调节蛋白FIP-dsq2、LZ-8和FIP-fve,以正常生长的肿瘤细胞做阴性对照;在5%CO2,37℃培养箱中培养24小时。
3)去上清,胰酶消化,3000rpm,室温离心5分钟,收集肿瘤细胞。凋亡检测试剂盒检测凋亡,具体操作参见说明书。
实验结果:
FIPs对A549细胞具有凋亡作用,8μg/ml的FIP-dsq2、LZ-8和FIP-fve处理A549细胞24h后,凋亡率分别为20.71%、38.82%、10.88%(图3)。
结论:
FIP-dsq2对肿瘤细胞A549具有凋亡作用,其诱导凋亡作用低于LZ-8,却显著高于FIP-fve,是极具潜力的抗肿瘤药物。
实施例5真菌免疫调节蛋白FIP-dsq2抑制肿瘤细胞迁移检测
实验方法:
4)在5%CO2,37℃培养箱中用DMEM培养液培养A549细胞,细胞计数,使其终浓度为5x105细胞/ml。
5)在6孔培养板中加入上述肿瘤细胞悬浮液,在5%CO2,37℃培养箱中培养24小时,细胞平铺长满,用tip头在培养板单层细胞中间划线,PBS洗去悬浮细胞和碎片。
6)分别加入终浓度为8μg/ml的重组真菌免疫调节蛋白FIP-dsq2、LZ-8和FIP-fve,以正常生长的肿瘤细胞做阴性对照;在5%CO2,37℃培养箱中培养24小时。
7)显微镜观察细胞生长情况,并拍照。
实验结果:
24h后,未处理细胞(NC)划出伤口明显愈合,8μg/ml的LZ-8处理后,伤口愈合现象不明显;8μg/ml的FIP-dsq2处理后,伤口愈合现象较为显著;而8μg/ml的FIP-fve处理A549细胞24h后,伤口愈合情况极为显著,与阴性对照极为相似(图4)。
结论:
FIP-dsq2可以抑制肿瘤细胞A549迁移,FIP-dsq2对肿瘤细胞A549的迁移抑制作用略微差于LZ-8,却显著强于FIP-fve,是极具潜力的抗肿瘤药物。
- 还没有人留言评论。精彩留言会获得点赞!