水稻P31comet蛋白及其编码基因在调控花粉育性中的应用的制作方法
本发明涉及一种水稻p31comet蛋白及其编码基因在调控花粉育性中的应用。
背景技术:
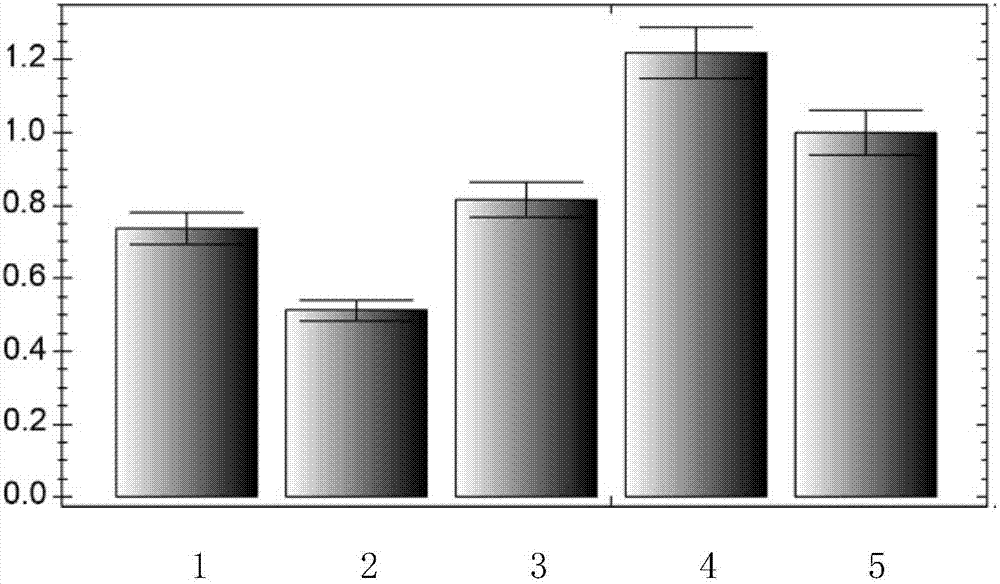
:水稻是重要的粮食作物,全世界50%以上的人口以稻米为主食。我国稻谷产量占全球37%左右,是世界上最大的稻米生产国。同时水稻也是我国第一大粮食作物,有超过60%的中国人口以水稻为主要食物。提高水稻产量一直是我国农业生产上的关键。20世纪60年代,以矮秆育种为标志的“绿色革命”让水稻产量得到了突破性增长,80年代末水稻单产比70年代初提高了63%。20世纪70年代,以杂种优势利用为特征的水稻品种改良使我国水稻单产发生了又一次飞跃。袁隆平研究出的三系法杂交水稻使我国稻谷单产在矮化育种的基础上再次增产20%,被誉为我国水稻生产的“第二次绿色革命”。杂交水稻在生活力、生长势、抗性、适应性和丰产性等许多性状上表现出显著的杂种优势。杂交水稻技术的推广应用,缓解了我国人口迅速增长与粮食短缺的矛盾,为保障我国粮食安全做出了巨大贡献。减数分裂是真核生物有性生殖细胞形成中的一类特殊类型的核分裂方式。减数分裂过程可以归纳为一次染色体dna复制后紧跟两次连续的细胞核分裂,从而使染色体的数目相比性母细胞减少一半,产生单倍体的雌配子和雄配子。这些单倍体配子随后则通过受精作用产生二倍体的合子,最终又恢复成亲代的染色体数目,从而保证了物种染色体数目的恒定。此外,同源染色体间遗传物质的相互交换,以及非同源染色体间的自由组合,可以使配子的遗传物质得以在双亲的染色体间进行交融与组合,这一特点极大地增加了杂交群体的遗传多样性以及杂交后代的适应能力。因此,减数分裂的重要意义在于不仅使后代的染色体数目保持恒定,它又通过同源重组使个体间的遗传物质在双亲染色体之间发生交换,从而维持了物种的遗传多样性并促进了物种的进化。对于动植物来说,减数分裂这一最基本的特征给遗传改良带来了无限广阔的机遇。技术实现要素:本发明的目的是提供一种水稻p31comet蛋白及其编码基因在调控花粉育性中的应用。本发明提供的蛋白质,获自水稻,命名为p31comet蛋白,是如下(a)或(b):(a)由序列表中序列1所示的氨基酸序列组成的蛋白质;(b)将序列1的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且与植物花粉育性相关的由序列1衍生的蛋白质。花粉育性又称为雄性育性。为了使(a)中的p31comet蛋白便于纯化和检测,可在由序列表中序列1所示的氨基酸序列组成的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。表1标签的序列标签残基序列poly-arg5-6(通常为5个)rrrrrpoly-his2-10(通常为6个)hhhhhhflag8dykddddkstrep-tagii8wshpqfekc-myc10eqkliseedl上述(b)中的p31comet可人工合成,也可先合成其编码基因,再进行生物表达得到。上述(b)中的p31comet蛋白的编码基因可通过将序列表中序列3所示的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上表1所示的标签的编码序列得到。编码所述p31comet蛋白的基因(p31comet基因)也属于本发明的保护范围。所述基因为如下(1)-(4)中任一所述的dna分子:(1)序列表中序列2所示的dna分子;(2)编码区如序列表中序列3自5′末端第1至861位核苷酸所示的dna分子;(3)在严格条件下与(1)或(2)限定的dna序列杂交且编码与植物花粉育性相关蛋白的dna分子;(4)与(1)或(2)或(3)限定的dna序列具有90%以上同源性且编码与植物花粉育性相关蛋白的dna分子。上述严格条件可为用0.1×sspe(或0.1×ssc),0.1%sds的溶液,在dna或者rna杂交实验中65℃下杂交并洗膜。含有所述p31comet基因的重组表达载体、表达盒、转基因细胞系或重组菌均属于本发明的保护范围。本发明还保护所述p31comet蛋白或其编码基因在调控植物雄性育性中的应用。所述植物为单子叶植物或双子叶植物。所述双子叶植物可为禾本目植物。所述禾本目植物可为禾本科植物。所述禾本科植物可为稻属植物。所述稻属植物具体可为水稻,例如盐稻8号水稻。本发明还保护一种特异dna分子,包括如下元件:区段a、区段b和区段c;所述区段c(间隔序列)位于区段a和区段b之间;所述区段a与所述区段b反向互补;所述区段a如序列表中序列4自5′末端第735-1421位核苷酸所示。所述特异dna分子具体可如序列表的序列4所示。所述特异dna分子转录得到的rna分子也属于本发明的保护范围。所述特异dna分子编码的sirna也属于本发明的保护范围。本发明还保护一种培育雄性不育植物的方法,包括如下步骤:抑制目的植物中所述p31comet基因的表达,得到雄性不育植物。本发明还保护一种培育转基因植物的方法,包括如下步骤:抑制目的植物中所述p31comet基因的表达,得到花粉母细胞的同源染色体不能配对的转基因植物。所述“抑制目的植物中所述p31comet基因的表达”是通过导入所述特异dna分子实现的。所述“抑制目的植物中所述p31comet基因的表达”是通过导入干扰载体实现的;所述干扰载体含有特异dna片段(发夹结构dna);所述特异dna片段包括如下元件:区段a、区段b和区段c;所述区段c(间隔序列)位于区段a和区段b之间;所述区段a与所述区段b反向互补;所述区段a如序列表中序列4自5′末端第735-1421位核苷酸所示。所述干扰载体具体可为在pcambia2300-actin载体的多克隆位点(具体可为psti位点)插入序列表的序列4所示的双链dna分子得到的重组质粒。本发明还保护一种培育雄性不育植物的方法,包括如下步骤:抑制目的植物中所述p31comet蛋白的活性,得到雄性不育植物。所述目的植物为单子叶植物或双子叶植物。所述双子叶植物可为禾本目植物。所述禾本目植物可为禾本科植物。所述禾本科植物可为稻属植物。所述稻属植物具体可为水稻,例如盐稻8号水稻。本发明还保护p31comet蛋白、p31comet基因、所述特异dna分子、所述rna分子、所述sirna或以上任一所述方法在植物育种中的应用。所述育种的目的为选育雄性不育性的植物。所述植物为单子叶植物或双子叶植物。所述双子叶植物可为禾本目植物。所述禾本目植物可为禾本科植物。所述禾本科植物可为稻属植物。所述稻属植物具体可为水稻,例如盐稻8号水稻。以上任一所述雄性不育性具体体现为不结实和/或花粉呈现败育的表型和/或同源染色体不能配对。本发明提供了p31comet蛋白及其编码基因,p31comet蛋白通过调控水稻减数分裂进而影响正常配子的产生来控制水稻的育性。结合采用组织特异性抑制基因表达的方法,p31comet基因可以应用于水稻杂交育种。因此,p31comet蛋白及其编码基因在水稻育种实践中具有重要意义,可以为通过利用杂种优势途径提高水稻产量与品质提供重要资源。附图说明图1为中籼3037与水稻不育突变体p31comet的表型观察图。图2为p31comet基因的组织特异性表达分析图。图3为实施例3中中籼3037和突变体p31comet花粉母细胞中的染色体行为观察图。图4为rnai干扰植株和突变体p31comet植株花粉母细胞中的染色体行为观察图。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。盐稻8号:江苏省盐城市明天种业科技有限公司。中籼3037:参考文献:wang,k.,tang,d.,hong,l.,xu,w.,huang,j.,li,m.,gu,m.,xue,y.andcheng,z.(2010)depandaforegulatereproductivehabitinrice.plosgenetics6.中籼3037为文中的“zhongxian3037”,公众可从中国科学院遗传与发育生物学研究所获得。日本晴:中国农科院作物科学研究所水稻种质资源中心保藏,库编号ila13071。pucrnai载体:参考文献:hengxiuyu,mowang,dingtangetal.osspo11-1isessentialforbothhomologouschromosomepairingandcrossoverformationinrice.chromosoma.2010(119):625-636.;公众可从中国科学院遗传与发育生物学研究所获得。pcambia2300-actin载体:参考文献:hengxiuyu,mowang,dingtangetal.osspo11-1isessentialforbothhomologouschromosomepairingandcrossoverformationinrice.chromosoma.2010(119):625-636.;公众可从中国科学院遗传与发育生物学研究所获得。根癌农杆菌eha105:北京天恩泽生物技术有限公司,产品目录号:140383。愈伤组织诱导培养基(n6d2培养基):(nh4)2so4463mg,kno32830mg,cacl2·2h2o166mg,mgso4·7h2o185mg,kh2po4400mg,ki0.8mg,h3bo31.6mg,mnso4·4h2o4.4mg,znso4·7h2o1.5mg,肌醇100mg,甘氨酸2mg,烟酸0.5mg,vb11mg,vb60.5mg,feso4·7h2o27.8mg,na2-edta·2h2o37.3mg,蔗糖30g,植物胶2.5g,2,4-d2mg,水解酪蛋白0.5g,去离子水加至1l,ph为5.8。农杆菌侵染培养基(aam液体培养基):cacl2·2h2o440mg,mgso4·7h2o370mg,kh2po4170mg,kcl2940mg,ki0.83mg,h3bo36.2mg,mnso4·4h2o22.3mg,znso4·7h2o8.6mg,na2moo4·2h2o0.25mg,cuso4·5h2o0.03mg,cocl2·6h2o0.03mg,肌醇100mg,甘氨酸2mg,烟酸0.5mg,vrl1mg,vb60.5mg,feso4·7h2o27.8mg,na2-edta·2h2o37.3mg,蔗糖68.5g,葡萄糖36g,谷氨酰胺0.877g,水解酪蛋白0.5g,天冬氨酸0.266g,精氨酸0.228g,甘氨酸0.075g,去离子水加至1l,ph为5.2。共培养培养基(n6d2c培养基):(nh4)2so4463mg,kno32830mg,cacl2·2h2o166mg,mgso4·7h2o185mg,kh2po4400mg,ki0.8mg,h3b031.6mg,mnso4·4h2o4.4mg,znso4·7h2o1.5mg,肌醇100mg,甘氨酸2mg,烟酸0.5mg,vb11mg,vb60.5mg,feso4·7h2o27.8mg,na2-edta·2h2o37.3mg,蔗糖30g,葡萄糖10g,植物胶2.5g,2,4-d2mg,水解酪蛋白0.5g,去离子水加至1l,ph为5.2。倒平板之前加入乙酰丁香酮(as)并使其浓度为100μm。筛选培养基ccd2s1:nh4no3640mg,kno31212mg,cacl2·2h2o588mg,mgso4·7h2o247mg,kh2po4136mg,ki0.83mg,h3bo33.1mg,mnso4·4h2o11.2mg,znso4·7h2o5.76mg,na2moo4·2h2o0.24mg,cuso4·5h2o0.03mg,cocl2·6h2o0.03mg,肌醇90mg,甘氨酸2mg,烟酸6mg,vb18.5mg,vb61mg,feso4·7h2o27.8mg,na2-edta·2h2o37.3mg,甘露醇36.43g,蔗糖20g,植物胶2.5g,2,4-d2mg,水解酪蛋白0.5g,去离子水加至1l,ph为5.8。倒平板之前加入g418并使其浓度为100mg/l。筛选培养基ccd2s2:nh4no3640mg,kno31212mg,cacl2·2h2o588mg,mgso4·7h2o247mg,kh2p04136mg,ki0.83mg,h3bo33.1mg,mnso4·4h2o11.2mg,znso4·7h2o5.76mg,na2moo4·2h2o0.24mg,cuso4·5h2o0.03mg,cocl2·6h2o0.03mg,肌醇90mg,甘氨酸2mg,烟酸6mg,vb18.5mg,vb61mg,feso4·7h2o27.8mg,na2-edta·2h2o37.3mg,甘露醇36.43g,蔗糖20g,植物胶2.5g,2,4-d2mg,水解酪蛋白0.5g,去离子水加至1l,ph为5.8。倒平板之前加入g418并使其浓度为200mg/l。预分化培养基(cca培养基):nh4no3640mg,kno31212mg,cacl2·2h2o588mg,mgso4·7h2o247mg,kh2po4136mg,ki0.83mg,h3bo33.1mg,mnso4·4h2o11.2mg,znso4·7h2o5.76mg,na2moo4·2h2o0.24mg,cuso4·5h2o0.03mg,cocl2·6h2o0.03mg,肌醇90mg,甘氨酸2mg,烟酸6mg,vb18.5mg,vb61mg,feso4·7h2o27.8mg,na2-edta·2h2o37.3mg,麦芽糖20g,脱落酸(aba)5mg,植物胶3g,2,4-d2mg,6-ba2mg,萘乙酸(naa)1mg,水解酪蛋白0.3g,去离子水加至1l,ph为5.8。倒平板之前加入g418并使其浓度为200mg/l。分化培养基(msr培养基):nh4no31650mg,kno31900mg,cacl2·2h2o440mg,mgso4·7h2o370mg,kh2po4170mg,ki0.83mg,h3bo36.2mg,mnso4·4h2o22.3mg,znso4·7h2o8.6mg,na2moo4·2h2o0.25mg,cuso4·5h200.03mg,cocl2·6h2o0.03mg,肌醇100mg,甘氨酸2mg,烟酸0.5mg,vb10.1mg,vb60.5mg,feso4·7h2o27.8mg,na2-edta·2h2o37.3mg,蔗糖30g,植物胶4g,6-ba2mg,激动素(kt)0.5mg,水解酪蛋白0.3g,萘乙酸(naa)0.2mg,玉米素(zt)0.2mg,去离子水加至1l,ph为5.8。倒平板之前加入g418并使其浓度为200mg/l。壮苗培养基:nh4no3825mg,kno3950mg,cacl2·2h2o220mg,mgso4·7h2o185mg,kh2p0485mg,ki0.83mg,h3bo36.2mg,mnso4·4h2o22.3mg,znso4·7h2o8.6mg,na2moo4·2h2o0.25mg,cuso4·5h2o0.03mg,cocl2·6h2o0.03mg,肌醇100mg,甘氨酸2mg,烟酸0.5mg,vb10.1mg,vb60.5mg,feso4·7h2o27.8mg,na2-edta·2h2o37.3mg,蔗糖30g,多效唑(met)6mg,植物胶2g,萘乙酸(naa)1mg,水解酪蛋白0.3g,去离子水加至1l,ph为5.8。实施例1、p31comet蛋白及其编码基因的获得一、水稻突变体p31comet的获得及其表型分析和遗传分析以水稻品种中籼3037为出发植株,经过ems诱导,获得一个不育突变体,命名为水稻不育突变体p31comet。水稻不育突变体p31comet在营养生长及开花时间等方面和中籼3037(图1a)没有任何差别。抽穗后,突变体p31comet表现出典型的不育表型且不结实(图1b)。中籼3037的成熟花药为黄色,花药中充满花粉,花粉用i2-ki染色可变为深蓝色(图1c),而突变体p31comet的成熟花药为白色,花粉用i2-ki染色不会变蓝,呈现典型不育花粉特征(图1d)。水稻突变体p31comet和中籼3037杂交得到f1代,f1自交得到f2代,对f2代植株进行表型鉴定,其鉴定结果如表2所示。表2中,正常株数是指具有野生型植株表型的株数,p31comet表型株数是指具有不育表型的株数。表2的结果表明水稻雄性不育这一性状符合单基因控制遗传规律。表2水稻不育突变体p31comet的遗传分析正常株数p31comet表型株数总株数分离比180622422.90∶1二、p31comet基因的图位克隆对f2群体中的雄性不育隐性个体植株进行突变基因的初步定位。应用sts标记,将突变基因定位在5号染色体短臂近着丝粒位置7.8mb至9.47mb之间约2mb的范围内。为了对突变基因进行更精细的定位,从f2-f6群体中获得约2600株突变体表型植株,经过对高代群体进行sts标记分析,最后将突变基因定位在了9.15mb及9.47mb这两个sts标记之间,其间的物理距离约为300kb。利用水稻基因组注解数据库(http://rice.plantbiology.msu.edu/cgi-bin/gbrowse/rice/)分析发现,在锁定范围内进行突变基因预测并对其基因组序列进行测序,结果发现在突变基因预测的第一外显子存在单碱基缺失,导致形成了一个终止密码子(tga),在翻译的时候将导致翻译的提前终止。三、p31comet蛋白及其编码基因的获得提取日本晴的总rna并反转录为cdna。以cdna为模板,分别进行orf扩增、5’race和3’race,拼接后得到全长序列。全长序列编码序列表的序列1所示的蛋白质。将序列表的序列1所示的蛋白质命名为p31comet蛋白,由286个氨基酸残基组成。将编码p31comet蛋白的基因命名为p31comet基因,p31comet基因包含7个外显子和6个内含子,p31comet基因的全长序列(4021bp)如序列表的序列2所示,其编码序列(cds)如序列表的序列3自5’末端第1-861位核苷酸所示。实施例2、p31comet基因表达分析待测样本为:中籼3037的根、茎、叶、幼穗;水稻突变体p31comet的幼穗。1、提取待测样本的总rna,反转录为cdna。2、以步骤1得到的cdna为模板,进行real-timepcr反应,采用引物qrt-f和引物qrt-r检测p31comet基因的表达水平,采用引物ubi-f和引物ubi-r检测内参基因(ubiquitin基因)的表达水平。qrt-f:5’-gtacccctccagatgtgtat-3’;qrt-r:5’-aggtaggcctcttatcgtat-3’;ubi-f:5’-caagatgatctgccgcaaatgc-3’;ubi-r:5’-tttaaccagtccatgaacccg-3’。real-timepcr采用sybrgreeni(invitrogen)嵌合荧光法进行,pcr反应用bio-radcfx96-real-timercr仪完成,得到的结果用bio-radcfxmanager软件分析。扩增反应所用酶为hotstarttaq聚合酶(takara)。检测结果如图2所示。图2中,纵坐标为p31comet基因的相对表达量,1为p31comet基因在中籼3037根中的表达情况,2为p31comet基因在中籼3037茎中的表达情况,3为p31comet基因在中籼3037叶中的表达情况,4为p31comet基因在中籼3037幼穗中的表达情况,5为p31comet基因在水稻突变体p31comet幼穗中的表达情况。结果表明,p31comet基因在中籼3037各个组织中均有表达,幼穗中表达量最高,p31comet基因在突变体p31comet幼穗中的表达量与在中籼3037幼穗中的表达量无显著差异。实施例3、突变体p31comet细胞学表型分析待测样本为:中籼3037减数分裂时期的幼穗、水稻突变体p31comet减数分裂时期的幼穗。依次进行如下步骤:1、取待测样本,用卡诺氏固定液(无水乙醇∶冰醋酸=3∶1;体积比)固定24h。2、用解剖针将花药拨出至载玻片上,加少许醋酸洋红,用解剖针迅速将花药敲碎,使花粉母细胞游离出来,盖上盖玻片。3、取载玻片,在盖玻片一侧加适量45%醋酸水溶液,在另一侧放置一张大小合适的滤纸条,反复重复此步骤,直到将载玻片上的醋酸洋红清除干净,然后将载玻片放入液氮中浸泡20sec,迅速取出,用刀片揭去盖玻片。4、取载玻片,依次放入70%乙醇水溶液、90%乙醇水溶液和100%乙醇中浸泡各5min,进行梯度脱水,干燥后滴加4’,6-diamidino-2-phenylindole(dapi),然后用荧光显微镜观察染色体表型。结果如图3所示。图3中,第一行为中籼3037花粉母细胞的观察结果,第二行为水稻不育突变体p31comet花粉母细胞的观察结果。中籼3037的花粉母细胞中,在偶线期时,同源染色体开始配对和联会,粗线期时,联会复合体已经组装完成,并且在这个时期,交叉也开始出现。到终变期时,染色体极度浓缩成点状,此时可以观察到12个呈环状或者棒状的二价体。中期i时,12个二价体整齐得排列在赤道板上。后期i时,同源染色体相互分离,在纺锤丝的牵引下,分别向细胞两极移动,最终形成两个子细胞。减数第二次分裂与有丝分裂相似,每条染色体的两个姊妹染色单体相互分离,在纺锤丝牵引下移向细胞两极,最终产生染色体数目减半的四分体。在突变体p31comet花粉母细胞中,从细线期到粗线期,染色体行为与野生型中的一样,同源染色体也能识别、配对和联会,但粗线期染色体明显呈现不联会的现象,形态上看比野生型中更为杂乱。在终变期,可以清晰地观察到24个单价体的出现,其数目正好为野生型中的12个二价体的两倍,表型为每个二价体形成2个单价体。在中期i,突变体中的单价体则随机地分布在整个细胞核中。后期i时,由于突变体中单价体无法被两极纺锤丝正确牵引,在细胞中只能发生随机分离,从而导致移向两极的染色体在数量上不均衡,这种不均衡最终必然使随后形成的小孢子内染色体组的紊乱,导致花粉败育。实施例4、p31comet基因功能分析一、构建rnai载体及重组农杆菌1、选取日本晴的8mm幼穗,提取总rna,并反转录为cdna。2、以步骤1得到的cdna为模板,采用rnai-f和rnai-r组成的引物对进行pcr扩增,回收pcr扩增产物。rnai-f:5’-gtggatccatggagagggctaccacctcc-3’;rnai-r:5’-cagtcgacgcttgcaccacgctcattggc-3’。rnai-f和rnai-r中,下划线分别标注bamhi和sali酶切位点。3、用限制性内切酶bamhi和sali双酶切步骤2的pcr扩增产物,回收酶切产物。4、用限制性内切酶bamhi和sali双酶切pucrnai载体,回收约2880bp的载体骨架。5、将步骤3的酶切产物和步骤4的载体骨架连接,得到重组质粒。6、用限制性内切酶xholi和bglii双酶切步骤5的重组质粒,然后将载体骨架与步骤3得到的酶切产物连接,得到重组质粒。7、用限制性内切酶psti酶切步骤6的重组质粒,回收酶切产物。8、用限制性内切酶psti酶切pcambia2300-actin载体,回收10379bp的载体骨架,将载体骨架去磷酸化。9、将步骤7的酶切产物和步骤8去磷酸化的载体骨架进行连接,得到rnai干扰载体。根据测序结果,对rnai干扰载体进行结构描述如下:在pcambia2300-actin载体的psti位点间插入了序列表的序列4所示的双链dna分子。rnai干扰载体可在植物细胞中转录产生带发夹结构的dsrna,引发rnai,从而抑制目的基因p31comet基因的表达。序列4所示的双链dna分子包括一个正向序列及其反向互补系列,正向序列如序列4自5′末端第735-1241位核苷酸所示,反向互补序列如序列4自5′末端第15-521位核苷酸所示。二、农杆菌介导的水稻基因转化1、取步骤一得到的rnai干扰载体,导入根癌农杆菌eha105,得到重组菌eha105/rnai。2、将步骤1得到的重组菌eha105/rnai的单菌落接种于3ml含50mg/l卡那霉素和10mg/l利福平的yeb液体培养基中,28℃、150rpm振荡培养直至od600nm为0.6-0.8,用含有200μm乙酰丁香酮的aam液体培养基重悬菌体,将od600nm值调为0.8-1.0,得到菌悬液。3、诱导水稻愈伤组织(幼胚):取开花后10天左右的盐稻8号的种子,先用75%酒精表面消毒3分钟,再用含2.5%活性氯的次氯酸钠(加入2滴tween-20)浸泡大约90分钟,每十分钟摇动一次,然后用无菌水冲洗5-6次。将种子置于无菌滤纸上,用解剖刀切取幼胚接种在愈伤组织诱导培养基上,28℃暗培养7天。4、侵染:将完成步骤3的愈伤组织浸泡于步骤2制备的菌悬液中,侵染20min,每5分钟摇动一次。侵染后将菌悬液倒掉,取愈伤组织,用无菌滤纸吸干水分,然后置于铺有一层无菌滤纸的共培养培养基上,28℃暗培养3天。5、将步骤4共培养的愈伤组织转移至筛选培养基ccd2s1上,28℃、暗培养10天,新长出的抗性愈伤组织转入筛选培养基ccd2s2上,28℃继续暗培养10天。6、预分化:将步骤5的抗性愈伤组织转入预分化培养基上,28℃暗培养10天。7、分化:将步骤6预分化的愈伤组织置于分化培养基上,26℃、光照培养至苗高8cm左右。8、壮苗:完成步骤7后,取再生苗,置于壮苗培养基上生根壮苗,26℃、光照培养条件下培养至生根。9、完成步骤8后,炼苗移入大田,常规栽培管理。10、采用pcambia2300-actin载体替代rnai载体按照步骤1-9进行操作。三、转基因植株的pcr鉴定1、取步骤二的9获得的植株,提取植株的基因组dna,用引物f和r进行pcr鉴定。f:5’-atggagagggctaccacctcc-3’;r:5’-gcttgcaccacgctcattggc-3’。可以同时扩增出507bp片段(测序结果如序列4自5′末端第735-1241位核苷酸所示)和1967bp片段(测序结果如序列2自5′末端第9-1975位核苷酸所示)的植株为转基因植株,命名为rnai干扰植株。2、取步骤二的10获得的植株,提取的植株的dna,用pcambia2300-actin的特异引物23-f和23-r进行pcr鉴定。23a-f:5’-ccttatctgggaactactca-3’;23a-r:5’-atctcctgtcatctcacctt-3’。可以扩出600bp大小条带的植株为转空载体植株。四、转基因植株性状分析待测样本为:10株野生型植株(盐稻8号)、10株转空载体植株、10株rnai干扰植株、10株突变体p31comet植株。1、观察植株表型,在营养生殖阶段,rnai干扰植株、突变体p31comet植株、转空载体植株和野生型植株的生长状况无明显差异。在抽穗后,10株rnai干扰植株、10株突变体p31comet植株均表现为败育,而转空载体植株和野生型植株结实正常。2、将播种后约100天的各植株成熟期小花在解剖镜下观察,结果发现,突变体p31comet植株和rnai干扰植株成熟期花药与野生型成熟期花药相比,花药呈现明显的不规则形态,且不能被i2-ki染色染上深蓝色。转空载体水稻和野生型水稻花药均可被i2-ki染色染上深蓝色且表型无显著差异。3、进一步观察待测样本花粉母细胞减数分裂细胞学表型,方法如下:(1)取待测样本,用卡诺氏固定液(无水乙醇∶冰醋酸=3∶1;体积比)固定24h。(2)用解剖针将花药拨出至载玻片上,加少许醋酸洋红,用解剖针迅速将花药敲碎,使花粉母细胞游离出来,盖上盖玻片。(3)取载玻片,在盖玻片一侧加适量45%醋酸水溶液,在另一侧放置一张大小合适的滤纸条,反复重复此步骤,直到将载玻片上的醋酸洋红清除干净,然后将载玻片放入液氮中浸泡20sec,迅速取出,用刀片揭去盖玻片。(4)取载玻片,依次放入70%乙醇水溶液、90%乙醇水溶液和100%乙醇中浸泡各5min,进行梯度脱水,干燥后滴加4’,6-diamidino-2-phenylindole(dapi),然后用荧光显微镜观察染色体表型。结果如图4所示。图4a为突变体p31comet植株粗线期观察结果,图4b为突变体p31comet植株终变期观察结果,图4c为rnai干扰植株粗线期观察结果,图4d为rnai干扰植株终变期观察结果。结果表明,rnai干扰植株花粉母细胞和突变体p31comet植株花粉母细胞终变期染色体均呈现24个单价体的表型,转空载体植株和野生型植株染色体表型正常。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1