一种与肺鳞癌辅助诊断相关的血清miRNA标志物及其应用的制作方法
本发明属于基因工程及肿瘤学领域,涉及一种与肺鳞癌辅助诊断相关的血清miRNA标志物及其应用。
背景技术:
肺癌(Lung Cancer)是当前全球最常见的恶性肿瘤之一。在中国,肺癌的发病率和死亡率均居首位。非小细胞肺癌(NSCLC)约占肺癌的85%。其中,肺鳞癌是NSCLC中最常见的亚型之一。虽然外科治疗目前是肺鳞癌首选和最主要的治疗方法,并且能对早期的肺鳞癌患者达到治愈的目的,但由于肺鳞癌患者早期临床表现无明显特异性,在我国早期诊断率仍较低。目前,低剂量CT检查(Low-dose computed tomography(LDCT))是较为推荐的用于肺癌及肺部结节的筛查。但由于如高误报率,潜在的过度诊断可能,过高的成本以及可能造成的辐射暴露危害等原因导致其使用受到一定限制。目前临床应用最为广泛的肿瘤标志物,如squamous cell carcinoma antigen(SCC),carcinoembryonic antigen(CEA),neuronspecific enolase(NSE)and Cyfra 21-1,也缺乏一定的灵敏性和特异性。随着基因组学、蛋白组学以及代谢组学等生物技术的发展,越来越多的生物标志物已被发现或研究。因此,发现新的能够早期诊断肺鳞癌的标记物指日可待,从而促进肺鳞癌早期干预和治疗,延长病人的生存期。
微小RNA(miRNAs)是一类长度在22个左右的核苷酸的小非编码RNA分子,其通过转录后调控广泛参与了各种生命活动过程,包括肿瘤的发生、侵袭及转移等。研究发现,miRNA的表达在肿瘤中有不同程度的上调和下调,为其能够作为一种新兴的肿瘤标志物奠定了基础。已有研究发现,游离的miRNA能够稳定存在于外周血中,并且可以作为诊断肿瘤的无创标志物。多项研究表明,循环miRNA在胃癌、乳腺癌、结直肠癌等肿瘤中具有潜在诊断价值。因此,本研究利用Exiqon miRNAqPCR panel芯片以及基于qRT-PCR的相对定量法,通过对大样本的肺鳞癌血清的研究,旨在寻找对肺鳞癌具有潜在诊断价值的血清miRNA。并对这些miRNA在肺鳞癌组织中以及外周血清外泌体中的表达进行验证,以进一步明确其与肺鳞癌的关系。若根据这类miRNA设计针对于肺鳞癌的诊断试剂盒,将会推动我国肺鳞癌的诊治水平,也为将来对肺鳞癌的进一步研究提供思路。
技术实现要素:
本发明的目的在于提供一种与肺鳞癌辅助诊断相关的血清miRNA标志物。
本发明的另一目的在于提供上述血清miRNA标志物及其引物在制备肺鳞癌辅助诊断试剂盒以及在制备治疗肺鳞癌的药物中的应用。
本发明的又一目的在于提供用于肺鳞癌辅助诊断和治疗的试剂盒及药物。
本发明的目的可以通过以下技术方案实现:
一种与肺鳞癌辅助诊断相关的血清miRNA标志物,该标志物为miR-106a-5p(AAAAGUGCUUACAGUGCAGGUAG),miR-20a-5p(UAAAGUGCUUAUAGUGCAGGUAG)和miR-93-5p(CAAAGUGCUGUUCGUGCAGGUAG)中的一种或多种。该血清miRNA标志物优选为miR-106a-5p、miR-20a-5p和miR-93-5p中两种或两种以上的组合,进一步优选为miR-106a-5p、miR-20a-5p和miR-93-5p三种miRNA所组成的组合。
上述的血清miRNA标志物在辅助诊断肺鳞癌中的应用。
上述的血清miRNA标志物在制备肺鳞癌辅助诊断试剂盒或治疗肺鳞癌药物中的应用。
一种与肺鳞癌辅助诊断相关的血清miRNA标志物的引物,该引物包含miR-106a-5p、miR-20a-5p和miR-93-5p中的一种或多种miRNA的引物;优选为包含血清miRNA中miR-106a-5p、miR-20a-5p和miR-93-5p中两种或两种以上miRNA的引物;进一步优选为包含血清miRNA中miR-106a-5p、miR-20a-5p和miR-93-5p三种miRNA的引物。
上述的引物在辅助诊断肺鳞癌或制备肺鳞癌辅助诊断试剂盒中的应用。
一种肺鳞癌辅助诊断试剂盒,该试剂盒用于检测血清miR-106a-5p、miR-20a-5p和miR-93-5p中的一种或多种miRNA;优选为用于检测血清miR-106a-5p、miR-20a-5p和miR-93-5p中两种或两种以上miRNA;进一步优选为用于检测血清中的miR-106a-5p、miR-20a-5p和miR-93-5p三种miRNA。
一种肺鳞癌辅助诊断试剂盒,该试剂盒中含有血清miRNA中miR-106a-5p、miR-20a-5p和miR-93-5p中的一种或多种miRNA的引物;优选为含有血清miRNA中miR-106a-5p、miR-20a-5p和miR-93-5p中两种或两种以上miRNA的引物;进一步优选为含有血清miR-106a-5p、miR-20a-5p和miR-93-5p三种miRNA的引物。
该试剂盒还可以包括PCR技术常用试剂,如逆转录酶,缓冲液,dNTPs,MgCl2,DEPC水和Taq酶等;还可以含有标准品和/或对照品。
本发明所涉及的与肺鳞癌诊断相关的血清miRNA标志物miR-106a-5p、miR-20a-5p和miR-93-5p中的每种miRNA的序列均已公开,但是将各miRNA标志物单独或进行组合作为肺鳞癌辅助诊断标志物需要本领域技术人员付出创造性劳动。各miRNA标志物的扩增引物均可通过市场购买获得,本发明实施例中使用的血清miRNA标志物的引物为购自广州锐博公司所合成生产的特异性miRNA茎环RT-PCR引物。
具体地说,本发明解决问题的技术方案包括:(1)建立统一标准的标本库和数据库:以标准操作程序(SOP)采集符合标准的血液样本,系统收集完整的人口学资料和临床资料。(2)血清miRNA差异表达谱分析:分析肺鳞癌和正常对照人群中差异表达的血清miRNA,并对差异表达miRNAs进行进一步大样本多阶段验证。(3)通过多阶段的验证,明确这些miRNA诊断肺鳞癌的能力。(4)血清miRNA诊断试剂盒的研制:根据肺鳞癌患者与正常人群血清中的差异表达miRNA开发miRNAs诊断试剂盒,实现对肺鳞癌患者的无创辅助诊断。(4)分析这些miRNA在肺鳞癌组织以及外泌体中的表达情况,揭示这些miRNA与肺鳞癌的关系,为将来研制可能与这些miRNA相关的治疗肺鳞癌的药物提供依据。
本发明人以标准操作程序(SOP)采集符合标准的血液样本,系统收集完整的人口学资料、临床资料,并采用了Exiqon miRNAqPCR panel芯片以及qRT-PCR方法等。
具体来说研究的实验方法主要包括以下几个部分:
1.研究样本选择:初治、未行手术以及放化疗干预且经病理确认为肺鳞癌的患者。正常对照为在医院进行体检的正常人群。
2.Exiqon miRNAqPCR panel芯片初筛:利用TRIZOL-LS试剂对血清混合样本进行RNA提取,并进行qRT-PCR操作获得初筛结果。
3.训练集、验证集:利用AM1556试剂盒(ABI公司)对每个血清样本进行RNA提取,通过逆转录反应得到cDNA样品,加入PCR引物和SYBR Green荧光染料进行PCR反应。4.利用TRIZOL-LS试剂提取肺鳞癌和癌旁组织中的RNA,ExoQuick试剂盒(SBI公司)和AM1556试剂盒(ABI公司)提取外泌体中的RNA,通过qRT-PCR的方法,检测miRNA在组织以及外泌体中的表达差异。
5.统计分析:运用χ2检验、配对t检验以及非参数秩和检验比较miRNA表达水平在不同研究组中的差异。通过计算ROC曲线分析证实血清miRNA的诊断价值。
本发明研究组目前通过对肺鳞癌病人的外周血清中的miRNA进行系统的表达分析,现已发现了一组3个具有临床诊断潜能的肺鳞癌血清microRNA标记物(miR-106a-5p、miR-20a-5p和miR-93-5p)。
本发明的有益效果:
1.相较于传统的肿瘤标志物,血清miRNA作为新型的生物标志物,具有稳定性好、微创易获取、灵敏性和特异性高的特点。这类分子标志物的开发利用将为包括肿瘤在内的各种疾病的诊断以及进一步治疗提供新的方向。
2.研究者通过Exiqon miRNAqPCR panel芯片以及基于qRT-PCR的绝对定量法,对肺鳞癌和正常对照人群血清中的差异表达miRNA进行严密、多阶段的验证和评价。证实了这组miRNA作为诊断肺鳞癌的无创标记物的可靠性以及可重复性。
3.研究者发现miR-106a-5p、miR-20a-5p和miR-93-5p在肺鳞癌患者中的表达明显高于正常对照组。同时,miR-106a-5p、miR-20a-5p和miR-93-5p在肺鳞癌患者组织以及血清外泌体中的表达也高于正常对照。这些结果将给未来研究这些miRNA对于肺鳞癌的机制以及针对这些miRNA对于肺鳞癌的治疗提供新的思路。
附图说明
图1:实验流程图
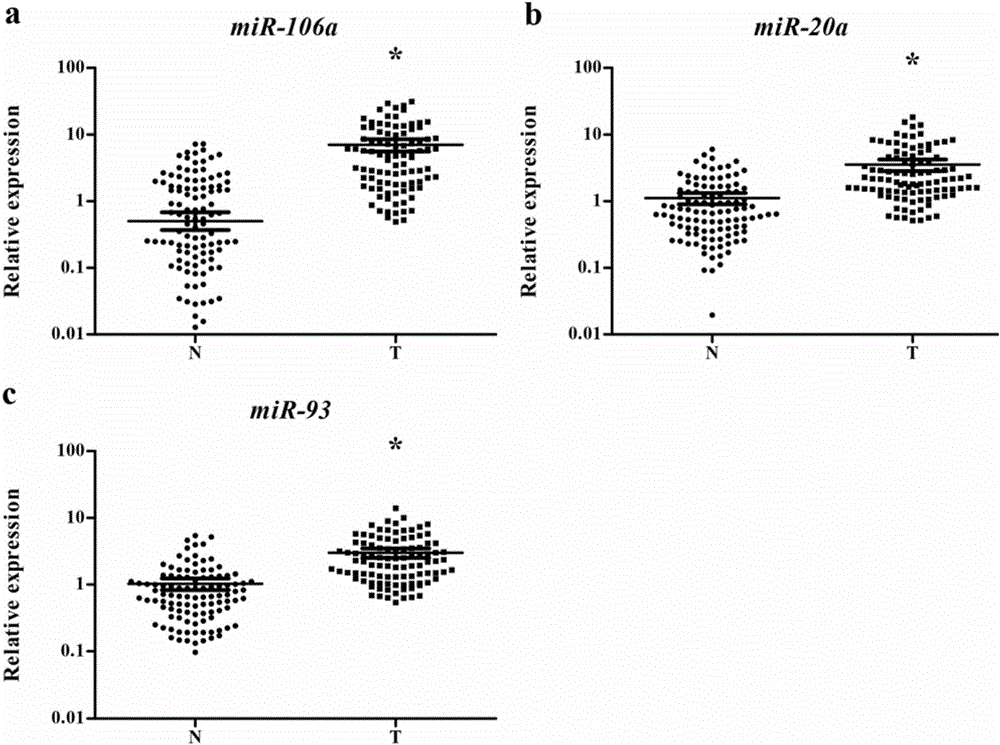
图2:在肺鳞癌血清中高表达的3个miRNA*:P<0.001
图3:对所获得的miRNA进行ROC曲线分析
a:训练集,测试集和验证集的合集;b:训练集;c:测试集;d:验证集。
图4:3个miRNA在肺鳞癌组织中的表达情况*:P<0.05,**P<0.001
图5:3个miRNA在肺鳞癌患者血清外泌体中的表达情况*:P<0.001
具体实施方式
发明人于2012年至2015年从南京医科大学第一附属医院收集了大量的肺鳞癌患者和正常体检人群的静脉血清样品,通过对样品资料的整理,从中选择了100例肺鳞癌和108例正常对照的样本作为Exiqon miRNA qPCR panel芯片初筛和后续一系列qRT-PCR验证的实验样品。同时还留取了32例肺鳞癌组织和36例癌旁组织。所选择的患者血清样本均来自于初治、未行手术以及放化疗干预且经病理确认为肺鳞癌的病人。并系统采集了这些样本的人口学资料、临床资料。
参照流程图(图1),从肺鳞癌以及正常对照血清样本中随机选择了30例肺鳞癌样本以及10例正常对照,并且分别混合成了3例肺鳞癌血清混合样本和1个正常混合样本(一个混合样本由10例200ul血清样本汇合形成2ml的样本)。对这4例混合样本进行Exiqon miRNA qPCR panel芯片初筛和分析,具体步骤参照Exiqon miRNA qPCR panel芯片的说明书:
1.血清抽提
取出血清样品,样品化冻后3000x g离心5min去除一些碎片及一些不溶成分。转移250ul上清至新的1.5ml管中,加入750ul TRIZOL-LS后,剧烈震荡5s。
2.两相分离
匀浆后样品于15到30℃孵育5分钟。每1ml的TRIZOL-LS试剂匀浆的样品中加入0.2ml的氯仿,盖紧管盖。手动剧烈振荡管体15秒后,15到30℃孵育2到3分钟。4℃下13,000g离心15分钟。
3.RNA沉淀
将水相转移到新离心管中。水相与异丙醇混合以沉淀其中的RNA,加入异丙醇的量为:1ml TRIZOL-LS试剂匀浆的样品中加0.5ml的异丙醇和5ul的糖元。4℃静置半小时,让RNA尽可能的析出。于4℃13,000g离心15分钟。
4.RNA清洗
移去上清液,每1ml TRIZOL-LS试剂匀浆的样品中加入至少1ml的75%(v/v)乙醇,清洗RNA沉淀。静置10分钟,然后4℃下10000g离心5分钟。
5.重新溶解RNA沉淀
去除乙醇溶液,空气中干燥RNA沉淀5-10分钟,加入无RNA酶的水用枪反复吹打几次,然后55到60℃孵育10分钟。
6.测量浓度:
通常能得到~5μg RNA/50ml血清。
7.cDNA合成
(1)稀释模板RNA:使用DEPC水将20-25ng模板RNA稀释至14ul(终浓度为1.492-1.786ng/μl)。
(2)准备反应液:将5×Reaction Buffer以及DEPC水置于冰上溶解,并震荡混匀。Enzyme mix置于-20℃冰盒,使用前轻弹混匀后置于冰上。所有试剂均离心后使用。
(3)配置反应液:配置下表中的反应液
(4)混合并离心试剂:震荡或者抽吸混匀反应液后离心,以保证所有溶液彻底混合均匀。
(5)逆转录反应及热失活:将反应液于42℃温育60分钟后,于95℃温育5分钟以失活逆转录酶。
8.Real-Time PCR
试剂:
Nuclease free water(Exiqon)
SYBRTM Green master mix(Exiqon)
cDNA模板
ROX(Invitrogen)
miRNA PCR ARRAY(Exiqon)
仪器:
ABI PRISM7900 system(Applied Biosystems)
(1)准备Real-time PCR试剂:将制备的cDNA模板,DEPC水和SYBRTM Green master mix置于冰上溶解15-20分钟。
(2)稀释cDNA模板:将RT反应获得的cDNA模板用nuclease free water稀释110倍(例如,向20μl反应液中加入2180ul nuclease free water)。
(3)混合所有反应试剂:
A.将PCR板简单离心后,移去封膜。
B.将110倍稀释的cDNA模板与2×SYBR Green master mix按照1:1体积比混合。
C.倒置混匀反应液并离心
D.将混合反应液加入板中的每个孔
E.重新封好PCR板
(4)将PCR板简单低温离心
(5)Real-time PCR扩增:根据下表中的反应条件进行Real-time PCR扩增和溶解曲线分析。
Real-time PCR循环条件如下表:
数据分析:采用ΔΔCt方法
使用PCR仪器附带的软件进行初步数据分析,获得原始的Cq值(Cp或Ct,依仪器不同名称可能不同)。
我们建议使用GenEx qPCR分析软件(www.exiqon.com/mirna-pcr-analysis)对数据进行标准和深入的数据分析。
a.计算每个处理组中的每个通路相关基因的ΔCt。
ΔCt(group 1)=average Ct–average of HK genes’Ct for group 1 array
ΔCt(group 2)=average Ct–average of HK genes’Ct for group 2 array
b.计算2个PCR Array(或两组)中每个基因的ΔΔCt。
ΔΔCt=ΔCt(组2)-ΔCt(组1)
备注:通常组1是对照,组2是实验组。
c.通过2-ΔΔCt计算组2与组1对应基因的表达差异。
在芯片初筛后,得到了如下表中的38个差异表达miRNA(3个肺鳞癌血清混合样本中相对于正常样本都超过了1.5倍差异)。
对于初筛得到的38个差异表达miRNA,通过训练集,测试集和验证集,采用基于qRT-PCR的相对定量法进行验证,具体步骤为:
1.血清RNA提取:选用ABI公司血清RNA提取试剂盒(AM1556),参照试剂盒说明,每个样本吸取200ul进行提取RNA,并最后用100ul DEPC水进行溶解。
2.cDNA的制备:
1)采用50μL反应体系进行逆转录实验
以上反应体系混匀,瞬时离心后,以下列程序进行反应:
2)上述反应之后再反应体系中再加入如下反应物
3.qPCR
1)采用5μL反应体系,按以下比例进行试验
反应体系混匀,瞬时离心后,放置于实时定量PCR仪中,以下列程序进行反应:
反应结束后添加溶解曲线。
数据分析:通过Ct值可以获得每个样本中的miRNA的相对浓度。利用SPSS 16.0软件进行统计分析,得到了一组在训练集,测试集和验证集中均一致于肺鳞癌血清中高表达的3个miRNA:miR-106a-5p、miR-20a-5p和miR-93-5p(在训练集,测试集和验证集中P值都小于0.05,图2)。通过这3个miRNA,可以计算每个样本的ROC曲线。如图3,这3个miRNA组成的分子标志物能够很好的区分肺鳞癌患者和正常人群。
研究组之后进一步检测了这3个miRNA在肺鳞癌组织以及血清中外泌体的表达,肺鳞癌组织提取RNA利用TRIZOL,外泌体提取试剂盒为ExoQuick试剂盒(SBI公司)。200ul血清所提取出的外泌体用200ul DEPC水重悬后,利用AM1556试剂盒(ABI公司)对外泌体RNA进行提取,步骤同血清RNA提取过程。
运用非参数检验分析发现,miR-106a-5p、miR-20a-5p和miR-93-5p在肺鳞癌组织中的表达要高于癌旁组织(图4)。miR-106a-5p、miR-20a-5p和miR-93-5p在肺鳞癌血清外泌体中的表达亦明显高于正常人群(图5)。
试剂盒包括一批血清miRNA qRT-PCR引物,还可以有相应PCR技术所需的常用试剂,如:逆转录酶,缓冲液,dNTPs,MgCl2,DEPC水,荧光探针,RNA酶抑制剂,Taq酶等,可根据具体采用的实验方法选用,这些常用试剂都是本领域技术人员熟知的,另外还可以有标准品和对照(如定量标化的正常人样本等)。此试剂盒的价值在于只需要血清而不需要其它组织样品,通过最精简的荧光法检测血清样本中miRNA的表达含量,来辅助诊断该样本来源患者的罹患肺鳞癌的可能性。血清miRNA检测方便,且定量精确,大大提高疾病诊断的敏感性和特异性,因此将此试剂盒投入实践,可以帮助指导诊断以及进一步的个体化治疗。
- 还没有人留言评论。精彩留言会获得点赞!