基于罗丹明的GSH水溶性荧光探针的制备方法和应用与流程
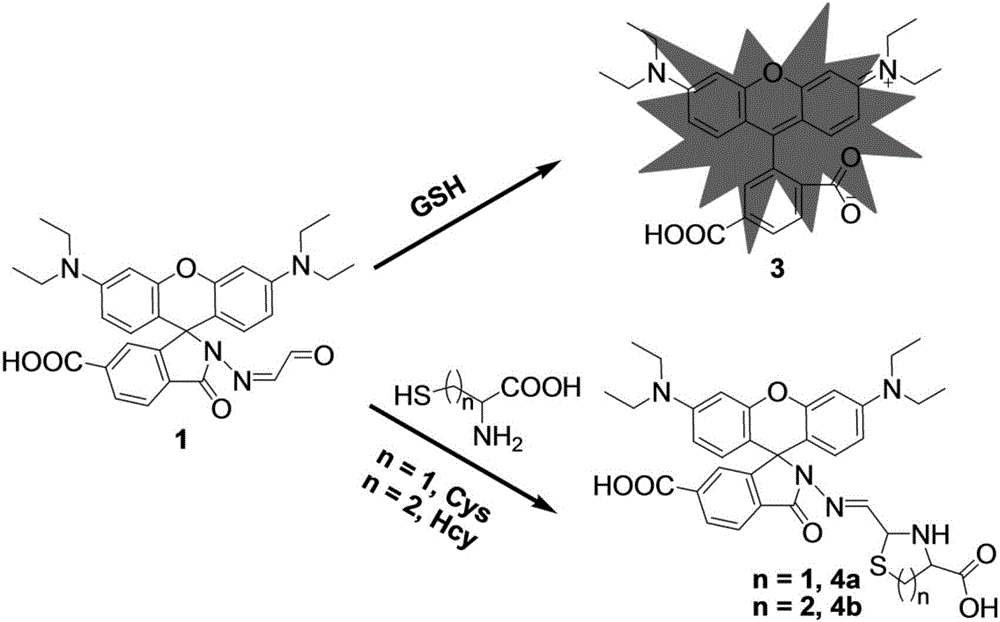
本发明属于荧光探针技术领域,具体涉及基于罗丹明的GSH水溶性荧光探针的制备方法和应用。
背景技术:
近年来,由于荧光探针具有高灵敏度、高分辨率、对待测样品无损以及可实现原位、实时、快速检测等优点,已经被作为生物样品监测以及生物体内荧光成像的重要分析工具(Que,E.L.;Domaille,D.W.;Chang,C.J.Chem.Rev.2008,108,1517-1549)。大部分荧光探针被设计并用来检测金属阳离子,而几乎很少用来检测生物小分子(Chen,X.Q.;Pradhan,T.;Wang,F.;Kim,J.S.;Yoon,J.Y.Chem.Rev.,2012,112,1910–1956.)。谷胱甘肽(GSH)、半胱氨酸(Cys)以及同型半胱氨酸(Hcy)统称为生物硫醇,他们在生命活动中发挥着重要的作用(Shang,L.;Qin,C.J.;Wang,T.;Wang,M.;Wang,L.X.;Dong,S.J.J.Phys.Chem.C.2007,111,13414-13417)。这些硫醇在生物体内的浓度的变化与某些生命过程正常与否息息相关(Hwang,C.;Sinskey,A.J.;Lodish,H.F.science 1992,257,1496-1502)。谷胱甘肽广泛存在于生物体内,其在细胞内的含量为1.0-15mM(Meister,A.;Anderson,M.E.;Powrie,F.;Puri,R.N.Annu.Rev.Biochem.1983,52,711-760)。研究表明,GSH在细胞内发挥着非常重要的功能,包括维持细胞内氧化还原反应平衡、异型生物质的新陈代谢、细胞内信息传递以及基因表达(Kanzok,S.M.;Schirmer,R.H.;lozef,R.Becker,K.J.Biol.Chem.2000,275,40180-40186)。体内GSH水平不正常将会导致癌症、老化、心脏病以及其他的疾病(Whillier,S.;Raftos,J.E.;Kuchel,P.W.Redox Rep.2008,13,277-282)。正因为GSH有着非常重要的生理及临床意义,设计有效的荧光探针去精确检测细胞内谷胱甘肽的含量非常重要。
由于对精确检测细胞内谷胱甘肽含量的需求越来越大,一些基于不同荧光团的荧光探针已经被合成,如香豆素类(Chen,C.Y.;Liu,W.;Xu,C.;Liu,W.S.Biosens.Bioelectron 2015,71,68-74)、芘类(Hu,Y.;Heo,C.H.;Kim,G.;Jun,E.J.;Yin,J.;Kim,H.M.;Yoon,J.Anal.Chem.2015,87,3308-3313)、荧光素类(Wang,L.;Chen,H.Y.;Wang,H.L.;Wang,F.;Kambam,S.;Wang,Y.;Zhao W.B.;Chen,X.Q.Sens.Actuators B 2014,192,708-713)、氟硼吡咯类(Wang,F.Y.;Zhou,L.;Zhao,C.C.;Wang,R.;Fei,Q.;Luo,S.H.;Guo,Z.Q.;Tiana,H.;Zhu,W.H.Chem.Sci.2015,6,2584-2589)、花青素类(Niu,L.Y.;Guan,Y.X.;Chen,Y.Z.;Wu,L.Z.;Tung,C.H.;Q.Z.Yang,Chem.Soc.Rev.2015,44,6143-6160)、萘酰亚胺类(Beija,M.;Afonso,C.A.M.;Martinho,J.M.G.Chem.Soc.Rev.2009,38,2410-2433)、螺吡喃类(Shao,N.;Jin,J.Y.;Wang,H.;Zheng,J.;Yang,R.H.;Chan,W.H.;Abliz,Z.J.Am.Chem.Soc.2010,132,725-736)以及派洛宁类(Liu,H.;Wang,H.;Shenvi,S.;Hagen,T.M.;Liu,RRR.M.Acad.Sci.2004,1019,346-349)。尽管这些荧光探针对谷胱甘肽的检测有着重要的意义,但它们存在着以下四个缺点。(1)这些探针的分析波长短,因此容易被生物基质样品的自荧光信号干扰;(2)由于谷胱甘肽与其他生物硫醇即半胱氨酸及同型半胱氨酸具有非常相似的化学结构,因此有效的区分谷胱甘肽与半胱氨酸、同型半胱氨酸是非常困难的;(3)由于一些探针本身存在比较强的背景荧光或者检测分析物时荧光增强的倍数很小,导致该类荧光探针的灵敏度很低;(4)几乎所有这些被报道过的荧光探针仅溶于纯有机溶剂或有机-水组成的混合溶剂中,这都大大限制了荧光探针在生物体内的进一步的应用。荧光分子探针的主要应用于生物、医学和环境监测,所以在纯水溶液中的识别具有潜在的广泛应用价值。另外,许多探针分子的荧光性质会受质子的影响,在水溶液中可以通过缓冲溶液控制稳定的pH值,使识别研究的结果更可靠。因此,设计和合成具有长的分析波长、高的选择性和高的灵敏度并能在100%水溶液中高效的检测谷胱甘肽类荧光探针迫在眉睫。
罗丹明衍生物是荧光探针领域中应用最广泛的一类染料,罗丹明类荧光探针具有分析波长长、摩尔吸光系数大、荧光量子产率高以及光稳定性较好等优点。最为关键的是,罗丹明的内酰胺螺环状结构没有荧光,破坏这种结构后能够引起荧光发射增强。由于此结构上的优势,罗丹明内酰胺类化合物是理想的OFF-ON型荧光分子探针,从而能实现对分析物高灵敏度的荧光检测。据我们所知,大部分罗丹明类荧光探针都用来监测金属阳离子(Li,D.;Li,C.Y.;Li,Y.F.;Qin,H.R.;Tan,K.Y.Sens.Actuators B 2016,223,705-712),报道过的文献很少有用来检测谷胱甘肽。
本文利用罗丹明类荧光具有长的分析波长以及高的灵敏度的优点,设计并合成了一种简单的基于罗丹明的能在100%水溶液中检测谷胱甘肽的荧光探针。一方面,用羧基修饰罗丹明结构,能大大提高探针的水溶性;另一方面,利用分析物的SH与探针的醛基之间发生水解-加成反应,实现谷胱甘肽与半胱氨酸、同型半胱氨酸的区分。
技术实现要素:
本发明的目的是提供了一种基于罗丹明的GSH的水溶性荧光探针,该荧光探针具有长的分析波长、高灵敏度以及高选择性的检测GSH,并能够应用于活细胞的荧光成像。
本发明的技术方案是,一种基于罗丹明的GSH水溶性荧光探针,其结构式如下:
本发明的荧光探针应用于GSH的检测,其特征在于探针本身处于闭环状态没有荧光,探针与GSH反应后螺环打开,从而导致荧光改变。
所述的一种基于罗丹明的GSH水溶性荧光探针的制备方法。步骤如下:
化合物Rh1的合成:在将1,2,4-偏苯三酸酐和3-二乙氨基苯酚加入到含有N,N-二甲基甲酰胺的圆底烧瓶中,在氮气保护下,磁力搅拌回流6小时,停止反应;反应混合物冷却至室温后,加入二次蒸馏水,充分搅拌后,用二氯甲烷进行萃取,合并有机层并减压蒸馏除去溶剂。粗产品用二氯甲烷/甲醇为6:1(体积比)的洗脱剂柱层析分离得红色固体(化合物Rh1)。
化合物Rh2的合成:将化合物Rh1溶解在无水甲醇中,搅拌下滴加水合肼。在氮气保护下,磁力搅拌回流反应混合物搅拌下回流24小时;减压蒸馏除去溶剂。粗产品用二氯甲烷/甲醇为10:1(体积比)的洗脱剂柱层析分离得白色固体(化合物Rh2)。
荧光探针1的合成:将化合物Rh2和乙二醛溶解在无水甲醇中搅拌。在室温下,磁力搅拌反应混合物12小时;减压蒸馏除去溶剂。粗产品用二氯甲烷/水为12:1(体积比)的洗脱剂柱层析分离得淡黄色固体,得到目标产物。制备反应式如下:
本发明的有益效果是:本发明的荧光探针的水溶性好,能完全溶解在100%纯水溶液中。该荧光探针在GSH存在下荧光发生显著变化,可以用于高灵敏度的检测GSH。该荧光探针的检测范围为0.08to 25μM,检测限为27nM。其次,该荧光探针的检测环境为生理范围内的pH=6-8。同时,该荧光探针对GSH的响应迅速,响应时间在90秒以内。该荧光探针对GSH表现出很好的选择性,不受其它生物硫醇(Cys,GSH)及其它氨基酸(Ala,Ile,Leu,Met,Phe,Pro,Trp,Val,Asn,Gln,Gly,Ser,Thr,Tyr,Arg,His,Lys,Asp,Glu)的影响。尤其是,该荧光探针可应用于活细胞的荧光成像,检测细胞内的GSH含量,这对于深入研究GSH在生物体内生理和病理过程的动力学机理具有重要意义。
附图说明
图1为荧光探针与不同浓度的GSH作用后的荧光光谱图。
横坐标为波长,纵坐标为荧光强度。荧光探针的浓度均为10μM,GSH浓度分别为:0,0.08,1.0,2.0,3.0,5.0,7.0,9.0,11.0,13.0,15.0,20.0,23.0,25.0μM。荧光激发波长为510nm。插图为探针对GSH浓度的线性响应图。
图2为荧光探针与GSH的作用机理图。
图3为荧光探针与GSH作用后的紫外可见吸收光谱图。
横坐标为波长,纵坐标为吸光度。荧光探针的浓度均为10μM,GSH浓度为25μM。
图4为pH对荧光探针的影响图。
图5为荧光探针在不同GSH浓度(1,5,11,15μM)下,荧光强度随时间变化的关系曲线图。
图6为荧光探针的选择性图。
横坐标为波长,纵坐标为荧光强度。荧光探针的浓度均为10μM,GSH浓度为30μM,Cys、Hcy及其它19种氨基酸的浓度均为1mM。
图7为GSH的细胞成像图。
图8为细胞毒性试验。横坐标为荧光探针的浓度,纵坐标为细胞的存活率。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明,但不限于此。
实施例1:
荧光探针的合成
化合物Rh1的合成:在含有50mL N,N-二甲基甲酰胺的100mL圆底烧瓶中加入1,2,4-偏苯三酸酐(1.92g,10mmol)和3-二乙氨基苯酚(3.30g,20mmol),氮气保护下,磁力搅拌回流6小时,停止反应;反应混合物冷却至室温后,加入二次蒸馏水(200mL),充分搅拌后,用二氯甲烷(100mL×3)进行萃取,合并有机层并减压蒸馏除去溶剂。粗产品用二氯甲烷/甲醇为6:1(体积比)的洗脱剂柱层析分离得红色固体Rh1(0.419g,产率:8.6%)。1H NMR(400MHz,CD3OD)δ8.19(d,J=8.0Hz,1H),8.08(d,J=8.0Hz,1H),7.80(s,1H),7.28(d,J=8.0Hz,2H),6.98(d,J=8.0Hz,2H),6.89(s,2H),3.64(d,J=8.0Hz,8H),1.28(s,12H).13CNMR(100MHz,CD3OD)δ164.9,160.4,157.9,134.3,132.8,132.6,131.8,131.7,116.1,115.9,98.1,47.7,13.9.MS(TOF)m/z 487.3.
化合物Rh2的合成:化合物Rh1(0.490g,1.00mmol)溶解在50.0mL无水甲醇中,搅拌下滴加水合肼(0.30ml,5.25mmol)。氮气保护下,磁力搅拌回流反应混合物搅拌下回流24小时;减压蒸馏除去溶剂。粗产品用二氯甲烷/甲醇为10:1(体积比)的洗脱剂柱层析分离得白色固体(化合物Rh2)(0.193g,产率:38.5%)。1H NMR(400MHz,CD3OD)δ8.06(d,J=8.0Hz,1H),7.84(d,J=8.0Hz,1H),7.63(s,1H),6.39-6.46(m,6H),4.62(bs,2H),3.60(q,J=8.0Hz,8H),1.17(t,J=8.0Hz,12H).13C NMR(100MHz,CD3OD)δ163.9,153.9,152.1,149.0,130.6,129.0,127.4,121.7,108.2,103.7,98.1,64.6,44.0,11.5.MS(TOF)m/z501.4.
荧光探针1的合成:化合物Rh2(0.500g,1.00mmol)和乙二醛(0.107g,2.00mmol)溶解在25.0mL无水甲醇中搅拌。在室温下,磁力搅拌反应混合物12小时;减压蒸馏除去溶剂。粗产品用二氯甲烷/水为12:1(体积比)的洗脱剂柱层析分离得淡黄色固体(探针1)(0.430g,产率:79.8%)。1H NMR(400MHz,CDCl3):δ9.44(d,J=8.0Hz,1H),8.19(d,J=8.0Hz,1H),8.08(d,J=8.0Hz,1H),7.80(s,1H),7.42(d,J=8.0Hz,1H),6.45(d,J=8.0Hz,4H),6.40(s,2H),6.25(d,J=8.0Hz,2H),3.33(d,J=8.0Hz,8H),1.17(t,J=8.0Hz,12H).13C NMR(100MHz,CDCl3):δ192.7,183.1,166.0,153.0,152.7,149.3,141.3,135.0,128.6,127.5,126.6,124.1,108.3,103.9,98.2,66.1,44.4,12.6.MS(TOF)m/z 541.3.Anal.calcd.for C31H32N4O5(1):C,68.87;H,5.99;N,10.36;O,14.80.Found:C,69.73;H,6.03;N,10.61;O,14.93.结果表明,所得产物结构正确。
实施例2:
荧光探针与GSH作用的溶液配制
将一定量的荧光探针溶解在水中,得到浓度为1.0×10-4mol·L-1探针的备用溶液。将一定量的GSH用水溶解后,转移到500mL的容量瓶中,加水至刻度线,得到浓度为1.0×10-2mol·L-1的GSH。将1.0×10-2mol·L-1的GSH溶液用水逐渐稀释,得到1.0×10-3-1.0×10-8mol·L-1的GSH水溶液。将1.0mL探针的备用溶液和1.0mL的GSH水溶液加入到10mL的容量瓶中,用缓冲溶液定容后,得到浓度为1.0×10-5mol·L-1的荧光探针和1.0×10-3-1.0×10-8mol·L-1的GSH混合待测溶液。
实施例3:
荧光探针与GSH作用的荧光光谱的测定
用pH值为7.4的缓冲溶液为溶剂测定了荧光探针与GSH作用的荧光光谱,结果如图1。荧光探针的浓度为10μM,GSH的浓度依次为0,0.08,1.0,2.0,3.0,5.0,7.0,9.0,11.0,13.0,15.0,20.0,23.0,25.0μM,激发波长固定为510nm,发射波长范围为530~650nm,狭缝宽度为5.0nm/5.0nm。从图1可以看出,加入GSH之前,荧光探针在576nm处没有荧光发射峰。随着GSH的加入,在576nm处发射峰大幅度的增强,并且随着GSH浓度的增大,探针的荧光强度不断增强,当加入25μM的GSH时,荧光强度增强至未加入GSH时的69倍。这是因为探针分子的醛基与GSH反应生成开环的罗丹明衍生物。如图1的插图所示,荧光强度跟GSH的浓度呈现线性关系,线性范围是8.0×10-9~25.0×10-6M,检测限是27nM。所用的荧光测定仪器为Perkin Elmer LS 55荧光分光光度计。图2为荧光探针与GSH作用的机理图,从图中可以看出荧光探针与GSH发生了加成-水解反应,使得螺环打开,从而导致荧光发生显著变化。
实施例4:
荧光探针与GSH作用的紫外可见吸收光谱性质的测定
图3为荧光探针与GSH作用后的紫外可见吸收光谱图,GSH的加入量为25μM。从图4中可以看出,没有加入GSH时,探针在560nm处有较弱的吸收峰,加入GSH之后,在该处的吸收峰大幅度增强。紫外可见吸收光谱测定用的仪器为Perkin Elmer Lambda 25型紫外可见分光光度计。
实施例5:
溶液pH值对荧光探针测定GSH的荧光性质的影响
我们考察了pH值对荧光探针测定GSH的荧光强度的影响。我们研究的pH范围为2.0~12.0,荧光探针的浓度为10μM,GSH的浓度为25μM。实验结果如图4所示,荧光探针随着pH的变化,荧光强度基本不变,说明pH对探针本身没有很大的影响。然而,加入GSH之后,当pH<5,荧光探针随着pH的降低荧光强度增大,这是因为在酸性条件下,探针发生质子化,使得罗丹明结构处于开环状态;。在pH>8范围内,随pH的增大,荧光强度逐渐降低。pH在6~8的范围内荧光强度基本不变。综上所述,当pH值在6.0到8.0之间时,不影响荧光探针对GSH的测定,这非常有利于该探针用于实际样品中GSH的测定。
实施例6:
荧光探针与GSH作用的响应时间的测定
为了研究荧光探针对GSH的响应时间,我们考察了荧光探针在不同GSH浓度下(1,5,11,15μM)的荧光光谱的变化情况,其结果如图5。从图中可以看出,该探针对GSH的响应时间不到90秒,满足在实际样品中进行实时监测时对响应时间的要求。从图5我们还可以看出,荧光强度一旦达到最大值后,在之后的时间里,荧光强度不再发生变化,会出现一个平台,这表明此荧光探针光稳定性好。
实施例7:
荧光探针对GSH测定的选择性
在浓度为10μM的荧光探针溶液中加入Cys、Hcy及其它19种氨基酸(1mM)前后的荧光强度变化。从图6中可以看出,加入其它的生物硫醇和其它17种氨基酸,荧光强度都没有明显的改变。尽管Asp和Glu有较小程度的荧光增强,但这个改变几乎可以忽略。而相同的条件下加入GSH,在576nm处出现一个很强的荧光发射峰。这些结果表明,荧光探针对GSH有较好的选择性。
实施例8:
荧光探针在活细胞中的应用
一般情况下,细胞内的GSH含量非常丰富,因此直接向细胞内加入探针,也能检测到强的红色荧光信号,如图7a所示。但是,当在加入探针之前加入一定量的硫醇抑制剂NEM时,如图7b所示,细胞内没有荧光信号。然而当再向此细胞中加入GSH时,检测到细胞内又出现了很强的红色荧光信号(图7c)。而加入Cys与Hcy时,细胞内没有荧光(图7d和7e)。因此可以说明,该探针可高选择性的检测细胞内的GSH。此外,我们还做了细胞毒性试验,如图8所示,当加入0~20μM GSH探针,20min之后,细胞的成活率均在98%以上,因此可以说明,该荧光探针可应用于检测活细胞内的GSH,并且毒性较小。
- 还没有人留言评论。精彩留言会获得点赞!
- 中氮茚罗丹明酰肼类铜离子比率荧光探针及其应用的制造方法与工艺
- 一种吲哚啉螺吡喃比色探针、制备方法及应用与制造工艺
- 一种基于罗丹明B的Fe<sup>3+</sup>分子荧光传感器、制备方法及应用
- 一种纳米Fe<sub>3</sub>O<sub>4</sub>/Na<sub>2</sub>S<sub>2</sub>O<sub>8</sub>联合降解罗丹明B的方法
- 一种纳米Fe<sub>3</sub>O<sub>4</sub>/H<sub>2</sub>O<sub>2</sub>协同降解罗丹明B的方法
- 一种高铁酸钾/活性炭联合处理罗丹明b废水的方法
- 一种用于芬顿反应的负载型固体催化剂及其制备方法
- 一种lc-ms/ms测定食品中亮黑和罗丹明b的方法
- 基于罗丹明b和氨乙基硫醚的化合物在活细胞成像中的应用
- 一种高荧光量子产率磷掺杂荧光碳点及其制备方法和应用