神经干细胞培养液及培养方法与流程
本发明属于神经干细胞培养技术领域,具体涉及一种神经干细胞的培养液及培养方法。
背景技术:
神经干细胞(NSCs)是一类具有分裂潜能和自更新能力的母细胞,可以通过不对等的分裂方式产生神经组织的各类细胞,包括神经元、少突胶质细胞和星形胶质细胞。而利用转分化技术可实现NSCs在体外大量繁殖、自我更新及多向分化。而从人体(如中枢神经系统)分离得到的少量NSCs通过增殖达到一定浓度和标准移植入人体后,在体内微环境的影响下,可分化为相应的NSCs,使受损的神经的功能得到修复,而且植入的NSCs可以向神经病变部位迁移和聚焦,促进宿主神经系统受损功能的恢复。这些使得神经系统损伤性疾病的治疗有了新的策略方向,NSCs的研究已成为治疗神经退行性疾病和中枢神经损伤的热点。另外,NSCs也成为了生物医学工程以及体外模型研究中所必须的种子细胞。
NSCs的来源主要包括以下几种:
胚胎源NSCs:包括胚胎干细胞(ESCs)诱导分化得到的NSCs和胚胎来源的NSCs。诱导分化得到的NSCs与直接分离培养得到的NSCs有相似的能力,能在体外扩增、稳定传代,可诱导分化为神经细胞。体外诱导人ESCs分化为NSCs,为帕金森病肌萎缩侧索硬化症、脑和神经损伤等疾病的治疗带来了希望,成为现今研究的热点。胚胎来源的NSCs被应用于移植治疗神经系统疾病的研究,通过移植NSCs至神经受损部位来治疗脊髓损伤、肌肉萎缩等神经损伤引起的疾病。但是人胚NSCs来源十分有限,目前主要是从流产人胚胎组织中获取,一直受到争议。另外,免疫排斥及致癌作用一直限制其使用。因此,胚胎源NSCs应用于临床在来源及效果方面也有很大的障碍。
成体脑源NSCs:脑组织是NSCs的主要来源,胚胎脑和成体脑组织均能分离得到NSCs。然而胚胎脑组织获取NSCs需要分离流产的人胚脑组织,来源及伦理都受到限制。而成体脑组织由于技术限制,难以从自体或异体获取,阻碍了NSCs的临床应用。
成体脊髓源性NSCs:NSCs可以从脊髓中直接分离得到,原代培养的脊髓NSCs在体外可生长为细胞球,诱导分化时贴壁较快,可形成神经元、星形胶质细胞和少突胶质细胞,脊髓源性NSCs虽有多向分化潜能,但分化为星形胶质细胞的潜能最大。
其它的还有骨髓源性NSCs、脐血源性NSCs、脂肪源性NSCs等,限制性因素也较多。
综上NSCs的来源往往受到现有技术或伦理的限制,从而影响NSCs在临床中治疗神经系统损伤性疾病的应用和研究。
技术实现要素:
因此,本发明针对现有技术中NSCs的来源受到限制的技术问题,目的在于提供一种无来源限制,可避免道德争议的基于外周血单核细胞(PBMC)培养神经干细胞的定向分化培养液和增殖培养液。
本发明的基于外周血单核细胞的神经干细胞培养液包括:体积比为1:0.8~1.2的DMEM/F12培养基和神经细胞基础培养基(Neurobasal medium),以及腺苷酸环化酶激活剂、血清替代物、L-抗坏血酸、L-谷氨酰胺衍生物、ALK抑制剂、GSK-3抑制剂、ALK-2,3,6,AMPK抑制剂和ALK-4,5,7抑制剂。
所述培养液的各组分可协同诱导外周血单核细胞定向分化为神经干细胞。其中,DMEM/F12和神经细胞基础培养基混合作为无血清的基础培养基,DMEM/F12含有体积比为1:1的DMEM培养基和F12培养基,营养成分丰富;而神经细胞基础培养基为神经细胞生长提供营养物质。所述腺苷酸环化酶激活剂选用毛喉素(Forskolin,购自MedChem Express),用于通透细胞,激活腺苷酸环化酶,从而升高细胞内的cAMP水平。所述血清替代物可选用N2和/或B27,用于神经干细胞的原代细胞培养中有丝分裂后期神经元的生长和表达。L-抗坏血酸作为培养基中的生长因子。所述L-谷氨酰胺衍生物为GlutaMAX-I二肽(购自Thermo Fisher Scientific)作为培养细胞的能量来源、参与蛋白质的合成和核酸代谢。所述ALK抑制剂可选用LDK378(5-氯-N2-(2-异丙氧基-5-甲基-4-(哌啶-4-基)苯基)-N4-(2-(异丙基磺酰基)苯基)嘧啶-2,4-二胺,又称色瑞替尼,英文名Ceritinib,CAS号为1032900-25-6)和/或GSK1838705A(2-[[2-[[1-[2-(二甲胺基)乙酰基]-5-甲氧基-2,3-二氢吲哚-6-基]氨基]-7H-吡咯并[2,3-D]嘧啶-4-基]氨基]-6-氟-N-甲基苯甲酰胺,CAS号为1116235-97-2),作用于IGF-1R(胰岛素样生长因子1受体)和InsR(胰岛素受体)。所述GSK-3抑制剂可选用CHIR-98014(N6-[2-[[4-(2,4-二氯苯基)-5-(1H-咪唑-2-基)-2-嘧啶]氨基]乙基]-3-硝基-2,6-二氨基吡啶,CAS号为252935-94-7)、CHIR-99021HCl(6-(2-(4-(2,4-二氯苯基)-5-(4-甲基-1H-咪唑-2-基)嘧啶-2-氨基)乙胺基)烟腈盐酸盐,CAS号为252917-06-9)和/或SB216763(3-(2,4-二氯苯基)-4-(1-甲基-1H-吲哚-3-基)-1H-吡咯-2,5-二酮,CAS号为280744-09-4)。所述ALK-2,3,6,AMPK抑制剂可选用Dorsomorphin(6-[4-[2-(1-哌啶基)乙氧基]苯基]-3-(4-吡啶基)吡唑并[1,5-a]嘧啶,CAS号为866405-64-3)、Dorsomorphin 2HCl和/或LDN-193189(6-(4-(2-(哌啶-1-基)乙氧基)苯基)-3-(吡啶-4-基)吡唑并[1,5-A]嘧啶,CAS号为1062368-24-4)。所述ALK-4,5,7抑制剂可选用A83-01(3-(6-甲基-2-吡啶基)-苯基-4-(4-喹啉)-1H-吡唑-1-硫代甲酰胺,CAS号为909910-43-6)和/或SB431542(4-[4-(1,3-苯并二氧戊环-5-基)-5-(2-吡啶基)-咪唑-2-苯甲酰胺,CAS号为301836-41-9)。
所述腺苷酸环化酶激活剂浓度为3~8μmol/L,所述血清替代物浓度为3~9mmol/L,L-抗坏血酸浓度为0.06~0.15mmol/L,所述L-谷氨酰胺衍生物浓度为5~15mmol/L,所述ALK抑制剂浓度为1~3mmol/L,所述GSK-3抑制剂浓度为0.55~0.65mmol/L,所述ALK-2,3,6,AMPK抑制剂浓度为1.5~2.5mmol/L,所述ALK-4,5,7抑制剂浓度为1.6~2.7mmol/L。
进一步的,DMEM/F12培养基和神经细胞基础培养基的体积比优选1:1,所述腺苷酸环化酶激活剂浓度优选4~6μmol/L更优选5μmol/L,所述血清替代物浓度优选5~7mmol/L更优选6mmol/L,L-抗坏血酸浓度优选0.08~0.12mmol/L更优选0.1mmol/L,所述L-谷氨酰胺衍生物浓度优选8~12mmol/L更优选10mmol/L,所述ALK抑制剂浓度优选1.6~2.2mmol/L更优选2mmol/L,所述GSK-3抑制剂浓度优选0.58~0.62mmol/L更优选0.60mmol/L,所述ALK-2,3,6,AMPK抑制剂浓度优选1.8~2.3mmol/L更优选2mmol/L,所述ALK-4,5,7抑制剂浓度优选2.0~2.2mmol/L更优选2mmol/L。
本发明的一较佳实施例中,其还包括青霉素和/或链霉素,青霉素的浓度为50~300μg/mL优选100~150μg/mL更优选100μg/mL,链霉素的浓度为50~400μg/mL优选100~200μg/mL更优选100μg/mL。
本发明的一较佳实施例中,其还包括视黄酸,用于调控基因表达,进一步促进定向分化作用,视黄酸浓度范围为0.05~0.15mmol/L优选0.09~0.12mmol/L更优选0.1mmol/L。
本发明的另一目的在于提供一种由外周血单核细胞培养神经干细胞的方法,包括以下步骤:
1)用所述培养液对外周血单核细胞进行定向分化培养得到原代培养物;
2)原代培养物用所述培养液进行传代培养4~6代得到神经干细胞。
本发明的一较佳实施例的所述方法中,步骤1)具体为,于35~39℃优选37℃、3~7%优选5%CO2条件下,用所述培养液对外周血单核细胞进行定向分化培养4~6天,移除未贴壁的细胞,定向分化培养期间每1~2天优选2天更更换一次培养液;再用所述培养液继续培养2~6天得到原代培养物,继续培养期间所述培养液1~2天优选1天更换一次;
步骤2)具体为,将步骤1)得到的原代培养物消化下来,于35~39℃优选37℃、3~7%优选5%CO2条件下用所述培养液进行传代培养,培养4~5代得到神经干细胞。
所述外周血单核细胞用Ficoll-Paque密度梯度离心法分离患者血样得到。
对培养得到的神经干细胞经过进行细胞类型鉴定后,包括神经干细胞特征性蛋白表达(免疫荧光)及细胞纯度(流式细胞仪)的鉴定,即可低温贮藏或者用于医学研究。
本发明的积极进步效果在于:使用所述培养液,经所述培养方法,可将外周血单核细胞定向分化培养以及传代培养得到纯度较高的神经干细胞。一方面取材方便,所述外周血单核细胞可取自患者血液,且无数量限制,可避免道德争议;另一方面,与现有的动物模型相比,本发明培养得到的神经干细胞提供了最接近人体的体外细胞模型,降低了或无免疫排斥反应。
附图说明
图1为外周血单核细胞的显微镜照片;
图2为实施例1培养得到的神经干细胞的显微镜照片;
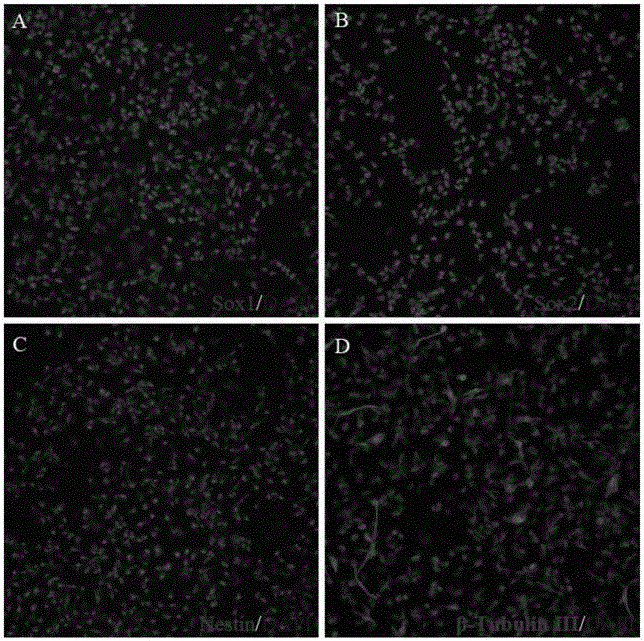
图3为实施例1培养得到的神经干细胞的免疫荧光的显微镜照片;
图4为实施例2培养得到的神经干细胞的免疫荧光的显微镜照片;
图5为实施例3培养得到的神经干细胞的免疫荧光的显微镜照片;
图6为实施例4培养得到的神经干细胞的免疫荧光的显微镜照片;
图7为实施例1培养得到的神经干细胞的流式分析图谱;
图8为实施例2培养得到的神经干细胞的流式分析图谱;
图9为实施例3培养得到的神经干细胞的流式分析图谱;
图10为实施例4培养得到的神经干细胞的流式分析图谱。
具体实施方式
下面将结合具体实施例对本发明作进一步的说明。
实施例1~4利用外周血单核细胞培养成神经干细胞
一、培养液
实施例1~4的培养液包括由DMEM/F12培养基和神经细胞基础培养基(Neurobasal medium)混合而成的基础培养基,以及添加在基础培养基中的添加剂。各实施例的DMEM/F12培养基和神经细胞基础培养基的混合的体积比例、添加剂及其含量如表1所示。
表1培养液的组分及含量
备注:表1所述各物质均为市场上购得
二、培养过程
实施例1~4分别使用表1所示的对应的培养液按照以下步骤培养神经干细胞。
1、通过Ficoll-Paque密度梯度离心法分离外周血单核细胞
通过SepMateTM管中间小孔向管内加入3.5mL Ficoll-Paque(相对密度1.077),液面超过管子内置管,保持SepMateTM管直立放置于离心管架子上。
取5mL DPBS+2%FBS至于15mL离心管中,然后加入5mL外周血血样,盖好后轻轻地来回颠倒4次混匀,混匀后用移液管取10mL沿着SepMateTM管侧壁缓慢地加在Ficoll-Paque上,1200×g离心10分钟。
外周血单核细胞位于SepMateTM管最上层,将最上层细胞悬液缓慢倒入新的15mL离心管,向离心管中加入5mL DPBS+2%FBS,300×g离心8分钟。弃去上清,轻弹离心管底部,再加入5mL DPBS+2%FBS,300×g离心5分钟。弃去上清液,轻弹离心管底部用剩余未吸走的DPBS+2%FBS重悬细胞得到外周血单核细胞,外周血单核细胞的显微镜照片如图1所示。
2、神经干细胞的定向分化培养
将得到的外周血单核细胞平均分到一块12孔板中,并加入培养液(1mL/孔)(若培养液存放于4℃冰箱中,需提前取出室温预热20分钟),于37℃,5%CO2的孵箱里培养n1天,培养液每2天更换一次。
将12孔板置于无菌操作台中,轻轻晃动12孔板,使用吸引泵吸去培养液,用2mL移液管将死细胞以及未贴壁的细胞移除。
用5mL移液管沿着孔壁缓慢加入新鲜的培养液(1mL/孔),继续放入孵箱中培养n2天,培养液每天更换一次。
3、神经干细胞的传代培养
铺好三块传代用的新的12孔板,加入基质胶(BD MatrigelTM hESC-qualified Matrix)(0.5mL/孔),置于37℃孵箱中孵育1个小时备用。
取出孵箱中定向分化培养后的12孔板,轻轻摇晃板,吸去培养液后,每孔加入1mL的DPBS(pH7.4)洗一次,然后每孔加入0.5mL的EDTA,37℃孵箱内消化n3分钟后在倒置显微镜下观察,细胞群中间出现小孔即可停止消化。轻轻晃动12孔板,吸去消化液。然后加入新鲜的培养液(1mL/孔),用1mL的移液枪尽可能的将细胞从板上吹下来(不用反复吹打,避免传代后细胞团过小,影响细胞贴壁生长)。
吸取孔中培养液分配于铺好加有基质胶的12孔板,每孔的培养液分别平均分配至三个含有基质胶的孔中,即传代比例为1:3。分配好后左右摇板各6下使板中细胞分布均匀,然后置于37℃,5%CO2的孵箱里培养。
重复步骤3,继续培养n4代。
其中实施例1~4的培养过程中的时间参数n1~n4如表2所示
表2各实施例的时间参数
效果实施例1免疫荧光法鉴定神经干细胞特征性蛋白表达
分别对实施例1~4所得的细胞按照以下步骤进行鉴定。
1)固定细胞
取培养完成的12孔板,吸去培养液后,沿12孔板板壁缓缓加入1×PBS(pH7.4,下同,1mL/孔),洗2次;然后沿板壁缓慢加入4%的多聚甲醛(PFA)(1mL/孔),室温放置18分钟固定细胞,轻柔地吸去PFA,加入1×PBS洗3次(1mL/孔/次)。
2)一抗孵育
加入0.3%Triton×100(0.5mL/孔),于37℃孵育30分钟;再加入5%的BSA(0.5mL/孔)封闭,于37℃孵育30分钟;直接在封闭液中加入一抗,于37℃孵育1小时;加入1×PBS洗3次(1mL/孔/次)。
其中,一抗为Sox1抗体(山羊来源,购自RD Systems)、Sox2抗体(兔子来源,购自life technologies)、Nestin抗体(老鼠来源,购自BD Biosciences)和/或β-Tubulin III抗体(老鼠来源,购自Sigma),加入后稀释比例分别为1:100、1:100、1:200和1:1000。
3)二抗孵育
加入用1%BSA稀释(稀释比例1:200)后的二抗(0.5mL/孔),37℃避光孵育30分钟;吸去二抗,加入1×PBS洗3次(1mL/孔/次),每次5分钟;然后加入用1×PBS配好的终浓度为1μg/mL的DAPI(0.5mL/孔),染色1分钟,吸去DAPI;加入1×PBS洗2次(1mL/孔/次);最后加入1×PBS(0.5mL/孔),显微镜下观察并拍照处理。
其中,二抗与一抗对应,包括驴抗山羊二抗(对应Sox1)、驴抗兔子二抗(对应Sox2)、驴抗老鼠二抗(对应Nestin)和驴抗老鼠二抗(对应β-Tubulin III)(以上二抗均购自life technologies)。
鉴定结果如图3~6所示,图3中A~D分别显示实施例1培养得到的细胞系表达神经干细胞特征性因子Sox1、Sox2、Nestin和β-Tubulin III;图4中A~D分别显示实施例2培养得到的细胞系表达神经干细胞特征性因子Sox1-Nestin,Sox2-Nestin,Nestin和β-Tubulin III;图5中A~D显示实施例3培养得到的细胞系表达神经干细胞特征性因子Sox1-Nestin,Sox2-Nestin,Sox1和Sox2;图6中A~D显示实施例4培养得到的细胞系表达神经干细胞特征性因子Sox1-Nestin,Sox2-Nestin,Nestin和β-Tubulin III。由此可知以外周血血样为原料分离外周血单核细胞,再使用本发明的培养液和培养方法培养得到的细胞为神经干细胞。
效果实施例2流式纯度分析法分析神经干细胞的纯度
分别对实施例1~4所得的细胞按照以下步骤进行纯度分析。
取培养完成的12孔板,吸去培养液后,加入无Ca2+和Mg2+的DPBS洗1次(1mL/孔);然后加入0.25%的Trypsin-EDTA消化液(1mL/孔),缓慢晃动12孔板,使消化液覆盖整个底部。将12孔板置于37℃、5%CO2孵育5分钟,加入培养液(6mL/孔)终止反应。用5mL移液管轻柔吹打使细胞成单细胞。室温下200×g离心2分钟,吸去上清液,向离心管中加入2mLFACS缓冲液(pH7.4)洗1次,室温下200×g离心2分钟,用吸引泵吸去上清液。向离心管中加入100μL用FACS缓冲液稀释好的一抗,室温孵育1小时后用2mL FACS缓冲液洗1次。室温下200×g离心2分钟,弃去上清液。向离心管中加入100μL用FACS缓冲液稀释好的二抗(二抗稀释比例为1:1000),避光室温孵育30分钟后用2mL的FACS缓冲液洗1次。室温下200×g离心2分钟,弃去上清液。向离心管中加入400μL的FACS缓冲液,将离心管置于冰上进行流式细胞仪分析。
使用的一抗包括Nestin、Sox1、Sox2和β-Tubulin III(来源同效果实施例1),稀释比例分别为1:200,1:100,1:100,1:1000;二抗包括488抗老鼠抗体(对应Nestin)、488抗山羊抗体(对应Sox1)、488抗兔子抗体(对应Sox2)、488抗老鼠抗体(对应β-Tubulin III)(以上二抗均购自life technologies)。
纯度检测结果如图7~10所示,各图中前面的峰为阴性对照,后面的锋即是阳性样本。图7显示实施例1培养得到的细胞系经流式细胞仪分析表达干性基因Nestin,Sox1和Sox2的细胞纯度均达98%以上;图8显示实施例2培养得到的细胞系经流式细胞仪分析表达干性基因Nestin,Sox1和Sox2的细胞纯度均达97%以上;图9显示实施例3培养得到的细胞系经流式细胞仪分析表达干性基因Sox1,Nestin和β-Tubulin III的细胞纯度均达95%以上;图10显示实施例3培养得到的细胞系经流式细胞仪分析表达干性基因Sox1,Nestin和β-Tubulin III的细胞纯度均达94%以上。可见得到的神经干细胞流式分析的纯度较高,可低温贮藏或者用于医学研究。
- 还没有人留言评论。精彩留言会获得点赞!