牙鲆正常和白化皮肤细胞系的构建方法与流程
本发明属于海洋生物细胞培养技术领域,具体涉及牙鲆正常和白化皮肤细胞系的构建方法。
背景技术:
自从1962年第一个硬骨鱼类细胞系—虹鳟鱼性腺细胞系RTG-2(Wolf and Quimby,Science,1962,135:1065-1066)成功构建以来,已有近300株不同的鱼类细胞系相继建立起来,组织来源包括胚胎及成鱼的肾脏、心脏、脾脏、鳍条、性腺等。这些细胞系的应用也已经从病毒分离及鉴定扩展到鱼类胚胎干细胞、免疫学、病原学、遗传育种和基因工程、鱼类资源保护等领域的研究中。然而,鱼类皮肤作为重要的病原防御屏障和色素发生的组织,迄今为止,仅有少数几种鱼类中有皮肤细胞系的报道(Lei et al.,Fish Physiology&Biochemistry,2012,38(4):1175-1182;Ma et al.,Journal of Fish Biology,2013,83(3):560-573)。高通量测序技术以能一次并行对几十万到几百万条DNA分子进行序列测定和一般读长较短等为标志。
牙鲆(Paralichthys olivaceus)是一种冷温性底栖鱼类,具有潜沙习性,广泛分布于中国、日本、韩国沿海。正常牙鲆的有眼侧皮肤为褐色,无眼侧皮肤为白色。而在牙鲆苗种生产过程中经常出现较高比例的体色白化现象,即有眼侧皮肤出现异常的部分白色或全部白色。这种白化现象严重影响了牙鲆鱼苗的市场价值和个体存活能力。迄今为止,有关牙鲆白化机制研究仅仅停留在饵料营养、环境条件及生理因素等方面,鲜有分子机制的研究报道。
技术实现要素:
本发明的目的在于利用牙鲆正常和白化皮肤,提供一种牙鲆皮肤细胞系的构建技术以及其在研究病原及功能基因和microRNA中的应用。
为实现上述技术目的,本发明采用的技术方案如下:
牙鲆正常和白化皮肤细胞系的构建方法,包括以下步骤:
步骤一:配制细胞培养液:配制细胞培养液:取DMEM/F12培养基和Hepes,充分溶解混合均匀4h后,用NaOH调节pH值,然后抽滤,将滤液分装,于4℃保存,使用时,取滤液再加入胎牛血清、50mm的2-巯基乙醇、10ng/ml人碱性成纤维细胞生长因子、100U/ml青霉素、0.1mg/ml硫酸链霉素,并于4℃存放,所述胎牛血清的体积为DMEM/F12培养基总体积的20%;
步骤二:原代培养:首先配置冲洗液,所述的冲洗液包括DMEM/F12培养基、100U/ml青霉素和0.1mg/ml硫酸链霉素,然后分别取体重200克正常牙鲆和白化牙鲆,分别用MS-222麻醉之后,用70%酒精浸泡清洗4min,取正常牙鲆、白化牙鲆的有眼侧皮肤分别置于不同的细胞培养皿中,使用冲洗液冲洗三次,将皮肤组织剪成1mm3的小块后,分别放入25cm2的培养瓶中,向培养瓶中补充细胞培养液至完全覆盖皮肤组织块,并正置于24℃的培养箱中培养,最后每隔5天更换细胞培养液一次;
步骤三:传代培养:原代培养细胞开始迁移增殖后,细胞数目增多,细胞生长成为单层后,采用0.25%胰酶消化法传代悬起细胞,并以1:1—1:2进行传代,以后8-10天传代一次,传至第10代时,细胞培养液中血清含量减为总体积的10%,此时,细胞系建立成功。
采用上述技术方案的发明,从牙鲆白化分子机制着手研究,构建的牙鲆正常和白化皮肤细胞系可连续传代40代或以上,细胞的生长状态良好,能稳定增值,细胞系的主要细胞类型为成纤维样细胞。
作为本发明的一种优选,所述的步骤一中所取的DMEM/F12培养基和Hepes的重量比值为2:1。
作为本发明的另一种优选,所述的步骤一的pH值为7.4。
作为本发明的又一种优选,所述的步骤三以1:2进行传代培养。
作为本发明的又一种优选,所述的步骤三每8天传代一次。
对比现有技术本发明提出的技术方案具有以下有益效果:构建的细胞系可以连续传代,牙鲆正常和白化皮肤细胞传40代以上,从而能提供大量的牙鲆皮肤细胞系,该细胞系可以直接应用于病原特性研究、疫苗研制及功能基因研究。
用上述牙鲆皮肤细胞系的构建方法构建的牙鲆正常皮肤细胞系(JFSK_wt)和白化皮肤细胞系(JFSK_alb),其最适生长温度均为24℃,生长曲线正常,染色体核型2n=48t,可以进行连续传代,也可以对其进行冷冻保存。以石斑鱼神经坏死病毒转染细胞系可以检测到病毒粒子的存在,以pEGFP-N3和Cy3-siRNA进行转染实验,也观察到较强的荧光信号,证实牙鲆皮肤细胞系可以直接应用于病毒感染试验及外源基因功能研究。
本发明牙鲆皮肤细胞系的构建方法重复性强,染色体鉴定方法可信,配制的培养液营养成分全面,取材的牙鲆体重恰当,该构建方法可以适用于构建其他鱼类的皮肤组织来源的鱼类细胞系,应用价值极大。
附图说明
本发明可以通过附图给出的非限定性实施例进一步说明;
图1为本发明培养的牙鲆皮肤细胞系在相差显微镜下的视图:1A.JFSK_wt原代,1B.JFSK_wt第19代,1C.JFSK_alb第3代,1D.JFSK_alb第18代,标尺=50μm;
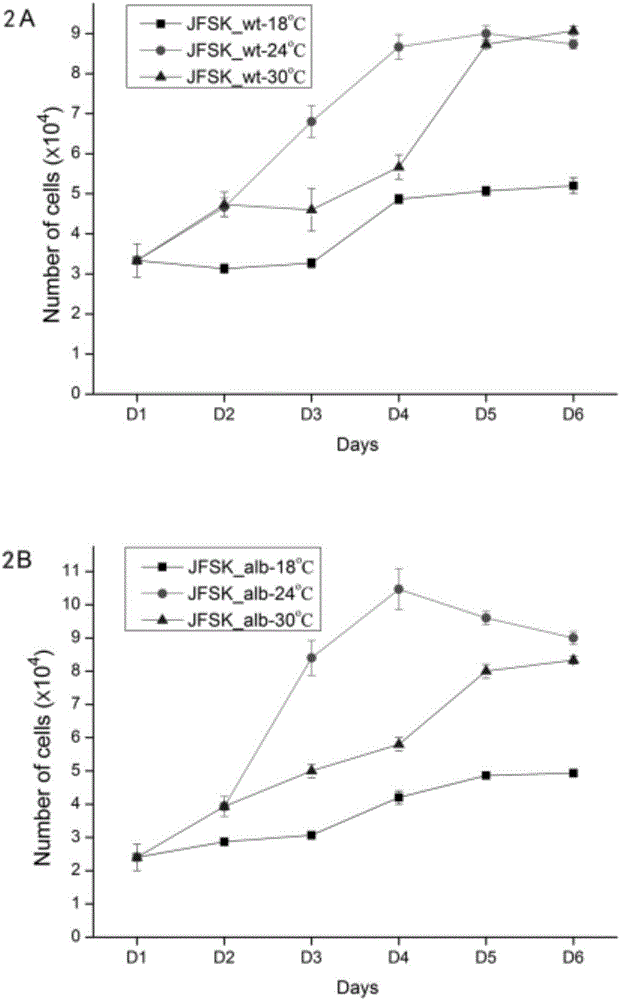
图2为本发明培养的牙鲆正常皮肤细胞系(JFSK_wt)和牙鲆白化皮肤细胞系(JFSK_alb)在不同温度下的生长曲线:2A.牙鲆正常皮肤细胞系(JFSK_wt),2B.牙鲆白化皮肤细胞系(JFSK_alb);
图3为本发明培养的牙鲆正常皮肤细胞系(JFSK_wt)和牙鲆白化皮肤细胞系(JFSK_alb)的牙鲆皮肤细胞系的染色体核型图:3A.JFSK_wt的二倍体中期分裂相,3B.JFSK_wt的核型,3C.JFSK_alb的二倍体中期分裂相,3D.JFSK_alb的核型;
图4为本发明培养的牙鲆皮肤细胞系感染神经坏死病毒的NNV图:4A、4B分别为JFSK_wt、JFSK_alb细胞感染病毒后的细胞病变效应图(CPE),标尺=50μm,4C、4D分别为JFSK_wt、JFSK_alb细胞感染病毒后的细胞电镜切片图,标尺=100nm;
图5为本发明JFSK_wt细胞和JFSK_alb细胞在转染Cy3-siRNA后的图片:5A、5C分别为JFSK_wt第26代细胞在转染Cy3-siRNA后36小时的明场、红色荧光激发光成像结果图,5B、5D分别为JFSK_alb第23代细胞在转染Cy3-siRNA后36小时的明场、红色荧光激发光成像结果,标尺=50μm;
图6为本发明JFSK_wt细胞和JFSK_alb细胞在转染pEGFP-N3后的图片:6A、6C分别为JFSK_wt第9代细胞在转染pEGFP-N3后48小时的明场、绿色荧光激发光成像结果图,6B、6D分别为JFSK_alb第10代细胞在转染pEGFP-N3后48小时的明场、绿色荧光激发光成像结果图,标尺=50μm。
具体实施方式
为了使本领域的技术人员可以更好地理解本发明,下面结合附图和实施例详细叙述本发明牙鲆正常和白化皮肤细胞系的构建、鉴定和应用方法。
一、牙鲆正常皮肤细胞系和白化皮肤细胞系的构建方法
牙鲆正常和白化皮肤细胞系的构建方法,包括三个步骤:
步骤一:配置细胞培养液:分别称取9.6克DMEM/F12培养基和4.76克Hepes,充分溶解混匀4小时后,用NaOH调节pH值至7.4,然后抽滤,将滤液分装,并于4℃保存,使用时,取滤液再加入占DMEM/F12培养基总体积20%的胎牛血清,50mM的2-巯基乙醇,10ng/ml人碱性成纤维细胞生长因子,100U/ml青霉素,0.1mg/ml硫酸链霉素,并于4℃存放。
步骤二:原代培养:取DMEM/F12培养基,向其加入100U/ml青霉素,0.1mg/ml硫酸链霉素作为冲洗液,然后分别取体重约200克正常牙鲆和白化牙鲆,分别用MS-222麻醉之后,用70%酒精浸泡清洗4分钟,然后取正常牙鲆、白化牙鲆的有眼侧皮肤分别置于不同的细胞培养皿中,使用冲洗液冲洗三次后,将皮肤组织剪成大约1mm3的小块,分别放入25cm2的培养瓶中,向培养瓶中补充适量细胞培养液至完全覆盖皮肤组织块,并正置于24℃培养箱中培养,然后每隔5天更换细胞培养液一次。
步骤三:传代培养:原代培养细胞开始迁移增殖后,细胞数目增多,细胞生长成为单层后,此时如图1中的1A所示,采用0.25%胰酶消化法传代悬起细胞,以1:2进行传代,以后每8天传代一次,传至第10代时,细胞培养液中血清含量减为总体积的10%时,已传代40代,细胞已能稳定增值,可定为细胞系,分别命名为牙鲆正常皮肤细胞系(JFSK_wt)和牙鲆白化皮肤细胞系(JFSK_alb)。该细胞系主要细胞类型为成纤维样细胞如图1中的1B、1C、1D所示。
需要指出的是,步骤三以1:2进行传代培养为本发明的一种优选方案,实际细胞培养过程中,可以根据具体情况而定,只要满足以1:1-1:2进行传代培养即可。
另外,步骤三每8天传代一次也为本发明的一种优选方案,实际细胞培养过程中可视具体情况而定,只要满足以8-10天传代一次即可。
二、牙鲆皮肤细胞系的鉴定和应用方法
牙鲆皮肤细胞系的鉴定和应用方法包括:1.细胞的冻存与复苏,2.细胞生长曲线绘制,3.染色体分析,4.病毒感染实验,5.GFP报告基因和siRNA的细胞转染。具体如下:
1.细胞的冻存与复苏
(1)细胞的冻存:选取生长旺盛、处于指数生长期的细胞,即细胞密度为90%以上的一瓶细胞,加入1ml 0.25%胰蛋白酶消化,待细胞收缩变圆时,吸去消化液,用2ml冻存液悬浮细胞,冻存液即含有10%二甲基亚砜的细胞培养液,然后移至冻存管,于4℃放置30分钟,再在-80℃冰箱内放置12小时,然后移至液氮中保存,并做好记录。
(2)细胞的复苏:自液氮中取出保存的冻存管,迅速置于40℃水浴中融化后,2200rpm离心5分钟,弃上清液,然后加入2ml细胞培养液重悬细胞后,转移至培养瓶中,放置于24℃的培养箱中培养,待细胞贴壁后弃上清,再加入3ml细胞培养液。
2.细胞生长曲线绘制
为了分析牙鲆皮肤细胞系的生长情况,取18代JFSK_wt细胞和11代JFSK_alb细胞接种于24孔板,每板3孔接种细胞,每孔密度分别为3.3×104和2.4×104个细胞,将24孔板分别置于18℃,24℃,30℃的培养箱中培养。在接种后的第1,2,3,4,5,6天,在三组24孔板中,每组各取3孔细胞,以0.25%胰蛋白酶消化,细胞计数板计数。以培养时间为横坐标,以每毫升细胞数量为纵坐标,绘制出生长曲线如图2所示。从图2中的2A可以看出,牙鲆正常皮肤细胞系于18℃下培养的细胞生长速率较缓,于30℃下培养的细胞在第四天至第五天的生长速率最快,于24℃下培养的细胞在第二天至第四条的生长速率最快,由此看出,24℃为牙鲆正常皮肤细胞系的最适生长温度;同样地,从图2中的2A可以看出,牙鲆正常白化皮肤细胞系于18℃和30℃下培养的细胞生长速率较缓,于24℃下培养的细胞在第二天至第四条的生长速率最快,由此看出,24℃为牙鲆白化皮肤细胞系的最适生长温度。
3.染色体分析
将第21代JFSK_wt细胞和24代JFSK_alb细胞以4×106个/瓶的密度接种于25cm2的培养瓶中,于24℃培养36h后,加入终浓度为1ug/ml的秋水仙素,3h后,消化离心收集细胞,离心后的细胞沉淀用0.0375M KCl溶液处理30分钟,离心后去上清,加入1ml的卡诺固定液(甲醇:乙酸=3:1),预固定5分钟,离心后细胞沉淀再次用卡诺固定液固定20分钟。最后再次离心,细胞重悬于0.5ml的卡诺固定液中,以冷滴法滴片,风干,用5%吉姆萨染色25分钟,最后用Nikon显微镜观察如图3所示,由图3可以看出,牙鲆JFSK_wt和JFSK_alb的染色体数目分别在29-74和17-79条之间,其中主要的染色体数目均为48条,染色体核型均为2n=48t。
4.病毒感染实验
以第24代JFSK_wt和第16代JFSK_alb细胞为对象,检测石斑鱼神经坏死病毒(NNV)对这两种细胞的敏感程度。细胞接种24小时后,将浓度为103TCID50/ml的病毒溶液加入细胞培养瓶中,1小时后,移去病毒溶液,更换新鲜细胞培养液,继续培养,约5天后,观察到细胞病变效应(CPE)后(如图4中的4A、4B),将细胞做电镜切片观察。
将感染NNV病毒的牙鲆皮肤细胞分别离心后,用2.5%戊二醛4℃固定4小时,0.1M PBS缓冲液冲洗3次,每次10分钟。1%锇酸4℃固定2小时,0.1M PBS缓冲液冲洗3次,每次10分钟。乙醇系列梯度脱水,30%,50%,70%,90%,100%的乙醇每次10分钟,其中100%两次。Epon812环氧树脂包埋,37℃、45℃、65℃温箱固化,每级温度24小时。UltracutE超薄切片机超薄切片,醋酸双氧铀硝酸铅染色。用JEM-1200EX透射电镜结果显示,在JFSK_wt和JFSK_alb细胞中均能观察到NNV病毒粒子(如图4中的4C、4D)。
5.GFP报告基因和siRNA的细胞转染
转染前一天,将JFSK_wt细胞和JFSK_alb细胞接种于12孔板中,24℃培养。转染时,细胞密度超过80%,以Invitrogen公司的Lipofectamine 2000转染pEGFP-N3和Cy3-siRNA。具体步骤为:将2μl Lipofectamine 2000加入到包含48μl细胞培养液(不含血清)的1.5ml离心管中,向另一个离心管中加入4μl pEGFP-N3(400ng/ul)和46μl不含血清的细胞培养液或1μl 50μM Cy3-siRNA和49μl不含血清的细胞培养液,5分钟后,将上述两管溶液混合,室温放置25分钟。将100μl混合液加入到包含1ml不含血清的细胞培养液的12孔板之一孔中,24℃培养6小时,然后,将培养液替换为正常包含血清的细胞培养液。36-48小时后,用Nikon ECLIPSE TE2000-U荧光显微镜观察荧光表达。参见附图5,36小时后转染Cy3-siRNA的两种细胞系中都观察到红色荧光的表达,表达效率约为90%。参见附图6,48小时后,转染pEGFP-N3的两种细胞中都观察到绿色荧光的表达,其中JFSK_alb的转染效率约为60%,明显高于JFSK_wt的转染效率。
本发明建立的牙鲆正常和白化皮肤细胞系已连续传代40代以上,细胞生长状态良好,外源基因转染效率较高,可以作为有效的细胞平台应用于鱼类病原学及功能基因组学。
以上对本发明提供的牙鲆正常和白化皮肤细胞系的构建方法进行了详细介绍。具体实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!