一种提高海藻糖合成酶热稳定的方法与流程
本发明属于生物技术领域或者酶工程技术领域,涉及一种海藻糖合成酶的表达过程,具体涉及在微生物中表达该海藻糖合成酶,并提高其热稳定性的方法。
背景技术:
海藻糖合成酶(EC 5.4.99.16)是一种新型变位酶,通过分子内转塘基作用将α,α-1,4糖苷键连接的麦芽糖一步转化为α,α-1,1糖苷键连接的海藻糖,工艺简单,易于调控,适合工业放大生产。海藻糖合成酶一步酶催化过程既不消耗高能物质(如UDP,二磷酸尿核苷),也不依赖磷酸,且底物麦芽糖目前生产技术成熟,廉价易得,与成品海藻糖相比有较大的价格空间。现已发现的海藻糖合成酶分子量集中在60-80 kDa,报道的麦芽糖转化率在50%-70%左右,其中转化率较高的海藻糖合成酶基因多来自极端微生物和嗜热菌,也体现了海藻糖的抗逆性。
海藻糖是自然界中普遍存在的一种非还原性二糖,作为一种天然的非特异性生物保护剂备受人们的瞩目。随着海藻糖应用范围日益扩大,市场需求不断增加。海藻糖化学性质非常稳定,1,1糖苷键决定海藻糖本身为非还原性,耐水解性,与蛋白质相互作用显示出化学惰性,具有较高的热稳定性和较宽的pH稳定范围,不与蛋白质或氨基酸发生美拉德反应。自然界中,海藻糖可以作为碳源/能源,调节渗透,是细菌细胞壁的结构成分,干燥保护剂,防冻剂,免疫原性(分枝杆菌的索状因子)和植物生长调节剂。海藻糖对多种生物活性物质具有保护作用,可以在高温、高寒、高渗透压及干燥失水等恶劣条件下在细胞表面形成保护膜,有效保护蛋白质分子不变性失活,在科学界素有“生命之糖”的美誉。
蛋白质的质量控制系统,即蛋白质内稳态,包括蛋白质合成、折叠、去折叠和周转。细胞内,分子伴侣不仅可以识别并帮助新合成蛋白的折叠,且对许多错误折叠蛋白的聚集-降解具有调控作用。细胞内大多数天然蛋白质能自发形成比较稳定的天然结构(或配体、代谢因子辅助稳定),但10%-20%新合成的多肽链需要分子伴侣的帮助才能正确折叠。分子伴侣网络和蛋白酶系统是保证蛋白质正常功能的两大质量控制系统。分子伴侣广泛存在于生物体内,保护蛋白质胞内合成与运输,防止其产生聚集;或应激各种外界压力,辅助其合成正确的蛋白质。Drummond及其同事用同位素标记酵母细胞中的蛋白质,高温处理细胞(细胞不致死),紧接着迅速冷冻,获取细胞内源蛋白的实时变性图像并通过质谱分析蛋白质的聚集。研究院推测高温导致蛋白变性的同时,刺激细胞过量表达分子伴侣热激蛋白,协助变性蛋白的复性,蛋白质变性聚集的复合体可能会重塑蛋白合成途径,抑制大多数正在翻译的新蛋白,避免新合成蛋白的变性聚集。蛋白质整体结构上的刚性和催化中心柔性之间的平衡,共同决定了酶的热稳定性。(Edward W.J. WALLACE, et al. Reversible, specific, active aggregates of endogenous proteins assemble upon heat stress [J]. Cell, 2015, 162(6): 1286-1298.)。
本课题组已经在前期研究中构建了一株能产海藻糖合成酶的大肠杆菌工程菌,已于2012.05.22申请了中国发明专利并已授予专利权,专利公开号为CN102690795A,发明名称为“一种灰产色链霉菌海藻糖合成酶及其编码基因和应用”。
目前,通过蛋白质工程对海藻糖合成酶的合成过程进行改造,进一步提高酶的催化效率,具有广阔的前景。
技术实现要素:
本发明所要解决的技术问题在于提高海藻糖合成酶催化麦芽糖生成海藻糖反应中酶的催化效率,以降低催化剂成本。
为了解决本发明的技术问题,本发明提供的技术方案为:
一种提高海藻糖合成酶热稳定的方法,其中,在大肠杆菌中共表达热激蛋白基因和海藻糖合成酶基因,且还包括,在表达海藻糖合成酶的体系中外源添加海藻糖。
本发明所述的方法,其中,所述热激蛋白基因为GroEL/S基因(GENE BANK ID94866/ID948655), DnaK/J基因(GENE BANK ID944750/ID944753), TF基因(GENE BANK ID945081), GrpE基因(GENE BANK ID947097)中的一种或多种。
本发明所述的方法,其中,所述海藻糖的添加浓度为0.25-1mol/L。
本发明所述的方法,其中,所述热激蛋白和海藻糖合成酶通过诱导表达,且在表达过程中,依次诱导表达热激蛋白,海藻糖合成酶;且在海藻糖合成酶诱导表达后外源添加海藻糖。
本发明所述的方法,其中,所述热激蛋白由阿拉伯糖诱导表达,由葡萄糖抑制热激蛋白的表达,阿拉伯糖的诱导浓度为0.5-4 mg/mL,葡萄糖的抑制浓度为0.5-2 mg/mL;海藻糖合成酶由IPTG诱导表达。
本发明所述的方法,其中,诱导表达所述热激蛋白时,大肠杆菌OD600值为在0.2-0.4之间;诱导表达所述海藻糖合成酶时, OD600值为在0.6-0.8,诱导表达的时间为8-12h。
本发明所述的方法,其中,所述海藻糖合成酶基因为Tres基因。
在一个优选的方案中,将灰产色链霉菌海藻糖合成酶pET28a-Tres质粒,与热激蛋白质粒pG-KJE8 (DnaK-DnaJ-GrpE GroES-GroEL), pGro7 (GroES-GroEL),pKJE7 (DnaK-DnaJ-GrpE),pG-TF2 (GroES-GroEL-tig),pTF16 (tig)采用热激法共转化到大肠杆菌BL21(DE3)中共表达。
其中,海藻糖合成酶pET28a-Tres质粒抗性为kan,工作浓度为30-50 ug/mL,使用浓度为0.1-1 mmol/L的 IPTG在OD600 达到0.6-0.8 时诱导;热激蛋白质粒抗性为cmr,工作浓度为20 ug/mL,使用浓度为0.5-4 mg/mL L-阿拉伯糖和或1-10 ng/mL四环素在OD600达到0.2-0.4时诱导热激蛋白的表达,使用浓度为0.5-2 mg/mL葡萄糖抑制热激蛋白的表达。具体的,将具有共表达能力的菌株以1.5%的接种量转接到新的液体LB培养基中。当大肠杆菌工程菌37℃培养1 h左右,OD600达到0.2-0.4,含有pG-KJE8 (DnaK-DnaJ-GrpE GroES-GroEL)使用L-阿拉伯糖和四环素作为诱导剂,pGro7 (GroES-GroEL),pKJE7 (DnaK-DnaJ-GrpE),pTF16 (tig)使用L-阿拉伯糖作为诱导剂,pG-TF2 (GroES-GroEL-tig)使用四环素作为诱导剂。葡萄糖抑制阿拉伯糖操纵子的表达,作为对照。37℃培养2 h左右,OD600 达到0.6-0.8,加入IPTG诱导海藻糖合成酶的表达。
同时,在大肠杆菌的培养过程中的任一时间段加入海藻糖,优选在海藻糖合成酶诱导表达以后加入海藻糖后,使海藻糖在体系中的浓度为0.25-1mol/L。
在本发明的有益效果在于:
(1)通过在培养过程中的措施,有效提高了在高温条件处理后海藻糖合成酶的催化效率,有利于其催化麦芽糖合成海藻糖的过程。
(2)经过改造,海藻糖合成酶耐热温度得到提高,可以抵御环境的恶劣程度,进而降低对生产环境的要求。
(2)本发明的技术原理可能在于:海藻糖作为一种化学分子伴侣,通过维持细胞的渗透压,稳定蛋白质的天然结构,提高蛋白质抵抗外界各种压力的能力,作用方式类似于分子伴侣,是独立于分子伴侣系统的另一种辅助蛋白质正确折叠的系统。海藻糖加入体系后,会明显改变介质粘度和水活度。海藻糖不仅可以协助分子伴侣稳定蛋白质的结构,降低蛋白质的错误折叠和聚集,且作为通用持久存在的伴侣,直接辅助蛋白质折叠过程中形成的柔性通道结构域,增加非天然构象的灵活性,缓解压力条件下蛋白质产生的错误折叠。
(3)本发明的另一技术原理可能在于,热激蛋白可以识别并帮助新合成蛋白的折叠,且对错误折叠蛋白的聚集-降解具有调控作用。胞内新生肽链的成熟是在较高温度和较高蛋白浓度且十分拥挤的环境中,以极快的速度和极高的保真度进行,分子伴侣保护胞内蛋白质的合成与运输,防止其产生聚集;应激各种外界压力,辅助蛋白质正确折叠。
附图说明
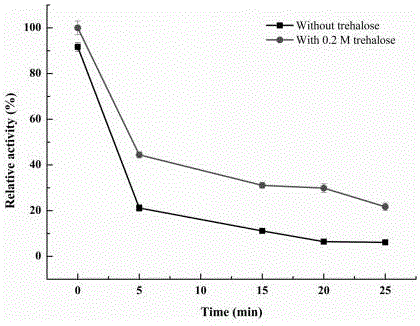
图1为海藻糖合成酶在不添加海藻糖和添加0.2 M海藻糖条件下60℃保温酶活随时间的变化。
图2为海藻糖合成酶表达及与海藻糖合成酶与热激蛋白共表达在高温诱导条件下海藻糖合成酶酶活变化。
图3为化学分子伴侣(海藻糖)与热激蛋白协同作用于50℃诱导下海藻糖合成酶酶活情况。
具体实施方式
下面结合实施例对本发明作进一步说明。所列的实施例仅作阐释之用,并标明本发明的精神和范围并非限于此中的细节及其修改案。
实施例1
本实施例说明各生物材料的来源以及菌株的构建筛选过程
本实施例中所用的表达宿主为E.coli BL21(DE3),为本实验室保藏。所用的海藻糖合成酶基因来源于灰产色链霉菌(Streptomyces griseochromogenes),实验室保存,相关内容已申请专利并授权。来源于灰产色链霉菌海藻糖合成酶基因含有572个氨基酸,分子量约为66 kDa,predict protein预测蛋白质含有22.9% α-螺旋,34.09%暴露在溶剂中。
本实施例中所用的分子伴侣质粒购自TaKaRa的分子伴侣质粒试剂盒,分别是pG-KJE8 (DnaK-DnaJ-GrpE GroES-GroEL), pGro7 (GroES-GroEL),pKJE7 (DnaK-DnaJ-GrpE),pG-TF2 (GroES-GroEL-tig),pTF16 (tig)。该质粒与pET系列质粒可以在大肠杆菌中共同表达,具有质粒相容性。
本实施例中,采用热激法共转化两种质粒的方法构建可同时过表达海藻糖合成酶和分子伴侣蛋白的菌株。
热激法转化质粒方法如下:取50 μl E.coli BL21(DE3)感受态细胞,冰上融化,取1 μl pET28a-Tres和1 μl 五种分子伴侣质粒中的一种加入感受态细胞中,轻轻转动混匀。冰浴30 min,42 oC热激1 min 30 s,冰浴2 min。加入900 μl LB培养基,37 oC培养45 min。取200 μl培养液均匀涂布在Kan+和Cmr+双抗平板上,过夜培养筛选阳性克隆。即可获得同时表达分子伴侣和目的蛋白的表达菌株。
实施例2
本实施例说明外源添加海藻糖的具体步骤以及提高海藻糖合成酶耐热性的效果。
本实施例所用的海藻糖为食品级,有效物质含量98%,白色结晶粉末。
步骤一:诱导灰产色链霉菌海藻糖合成酶在大肠杆菌中大量表达,使用镍柱纯化,获得纯海藻糖合成酶溶解在PBS(Na2HPO4,NaH2PO4,pH 7.0)溶液中。
步骤二:取20毫升海藻糖合成酶酶液,分别添加0 M,0.2 M海藻糖,溶解后,分别置于60℃水浴锅中,转速100 rmp。保证酶均匀受热。
步骤三:保温0 min,5 min,10 min,15 min,20 min,25 min取200 ul酶液加入800 ul麦芽糖底物(浓度:0.15 M,PBS溶解)中,30℃条件下反应30 min测海藻糖合成酶酶活。(注:添加海藻糖保护的海藻糖合成酶酶活已经将酶液中的海藻糖去除,所测酶活为海藻糖合成酶催化。)
海藻糖合成酶酶活测定方法:利用高效液相色谱仪(HPLC)来进行海藻糖合成酶转化麦芽糖后的产物分析,色谱柱为Shodex Sugar SZ5532柱(6.0 mm ID × 150 mm);检测器:Shodex RI101;柱温:60 ℃,压力:30 × 105 Pa;反应样品稀释5倍,进样10 ul;流动相为乙腈:水(75:25);流速1.0 mL/min。酶活力单位定义:在最适条件下,1 min转化1 nmol麦芽糖为海藻糖所需海藻糖合成酶的量为1个酶活单位(U)。
测算后的结果如图1所示,结果显示海藻糖的加入可以提高海藻糖合成酶在高温下酶活保持的时间。
实施例3
本实施例说明海藻糖合成酶与热激蛋白大肠杆菌中共表达可以提高高温诱导条件下海藻糖合成酶的可溶性表达量。
本实施例所用的热激蛋白是pGro7 (GroES-GroEL)质粒,使用终浓度为0.5 mg/mL L-阿拉伯糖诱导热激蛋白的表达,使用终浓度为0.5 mg/mL葡萄糖抑制热激蛋白的表达。葡萄糖抑制热激蛋白表达,0.5 mg/mL的葡萄糖浓度不会影响海藻糖合成酶的表达。
诱导温度选取30℃,35℃,40℃,45℃,分别取同样OD的发酵液,离心收集菌体,超声破碎,按照实施例2步骤三酶活测定方法测定酶活。
测算后的结果如图2所示,结果显示热激蛋白与海藻糖合成酶大肠杆菌中共表达提高了海藻糖合成酶高温诱导条件下相同菌体浓度获得较高的酶活。
实施例4
本实施例说明化学分子伴侣(海藻糖)和热激蛋白协同作用于高温下诱导海藻糖合成酶与热激蛋白大肠杆菌中共表达可以提高高温诱导条件下海藻糖合成酶的催化效率
按照实施例3进行热激蛋白与海藻糖合成酶大肠杆菌中共同表达,协同化学分子伴侣(海藻糖)来提高高温诱导条件下海藻糖合成酶酶活。
分别在大肠杆菌培养4 h时添加化学分子伴侣(海藻糖)。诱导温度为50℃,外源添加海藻糖浓度为0 M,0.05 M,0.1 M,0.15 M,0.2 M,0.25 M。相同菌体浓度下测定海藻糖合成酶酶活。
化学分子伴侣(海藻糖)的加入提高了大肠杆菌在高温条件下的菌体浓度。海藻糖被大肠杆菌高温下利用,测定了菌体破碎液中未检测到海藻糖成分。去除了外源添加海藻糖对海藻糖合成酶酶活测定过程中的影响。
本实施例的结果:L-阿拉伯糖诱导热激蛋白的表达,培养4 h后添加0.15 M的海藻糖,海藻糖合成酶相对酶活最高,菌体浓度也达到最高。葡萄糖抑制热激蛋白的表达,葡萄糖提高了菌体浓度,但海藻糖的加入没有提高菌体浓度,且外源添加0.05 M的海藻糖,海藻糖合成酶酶活较高。结果表明,化学分子伴侣在提高海藻糖合成酶高温诱导条件下酶活是有最适浓度的,浓度太高反而不会提高菌体浓度,也不会提高相对酶活。
- 还没有人留言评论。精彩留言会获得点赞!