一种取代氧化吲哚—苯并咪唑盐类化合物及其制备方法与流程
本发明涉及新型的一种取代氧化吲哚—苯并咪唑盐类化合物及其制备方法,以及该化合物为活性成分的药物组合物在抗肿瘤方面的应用。
背景技术:
癌症是严重威胁人类健康的一类疾病。目前用于治疗癌症的主要手段是化学疗法。临床应用的化疗药物绝大多数都有使患者恶心、呕吐、白细胞下降、骨髓抑制等毒副作用。因此,寻找高活性,无毒或低毒性的抗癌化合物成为新药研究的一项重要课题。
咪唑、氧化吲哚作为重要的杂环化合物广泛存在于天然产物分子中,同时还作为生理活性的重要药效团存在于合成的药物分子中。在咪唑环系基础上合成的咪唑盐类化合物,由于具有多种生物活性而受到国内外有机合成及药物化学研究工作者的重视。迄今为止,研究表明咪唑盐类化合物具有抗肿瘤活性、抗细菌和抗真菌的活性、抗炎活性、抗心率不齐活性、血小板合成酶抑制活性,以及作为口服低血糖剂。本专利涉及的一种取代氧化吲哚—苯并咪唑盐类化合物及其制备方法至今为止文献未见报道。。
技术实现要素:
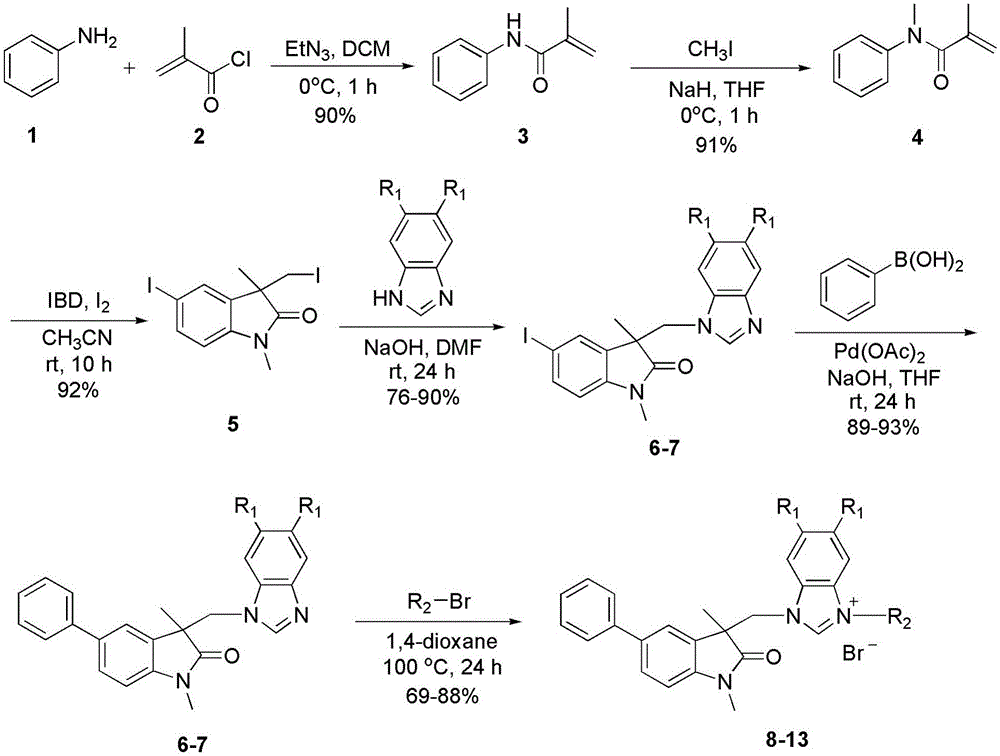
本发明公开了一系列具有结构通式(如图Ⅰ)的取代氧化吲哚—苯并咪唑盐类化合物及其制备方法,以苯胺为原料,经过酰基化、甲基化、碘代关环、接苯并咪唑、偶联和成盐六步反应,准备得到目标化合物。体外抗肿瘤活性细胞毒性测试结果显示,部分化合物具有较好的细胞毒活性。
本发明提供的一种取代氧化吲哚—苯并咪唑盐类化合物用下述结构通式(Ⅰ)表示:
当R1 = H时,R2 = 2-溴苄基,2-萘甲基,4-溴苯甲酰甲基;
当R1 = CH3时,R2 = 2-溴苄基,4-溴苯甲酰甲基,2-萘甲酰甲基;
一种具有结构通式(Ⅰ)的化合物的制备方法,该方法包括以下步骤:
A、以苯胺和甲基丙烯酰氯为原料,在三乙胺条件下和二氯甲烷溶剂中合成N-苯基甲基丙烯酰胺:将苯胺溶于二氯甲烷中,加入三乙胺,在0 ℃和氮气保护下,逐滴加入甲基丙烯酰氯,用量按摩尔数比为苯胺 / 甲基丙烯酰氯 / 三乙胺 = 1 / 1.3 / 1.3,二氯甲烷的用量为20 ml / g苯胺,搅拌1小时后,缓慢加入水(10 ml)淬灭,用饱和食盐水(50 ml)洗,有机相用无水Na2SO4干燥,过滤,减压蒸馏除去溶剂,经硅胶柱层析,石油醚-乙酸乙酯为洗脱剂(石油醚 / 乙酸乙酯 = 3 / 1),制得N-苯基甲基丙烯酰胺;
B、以N-苯基甲基丙烯酰胺和碘甲烷为原料,在氢化钠条件下和无水四氢呋喃溶剂中合成N-甲基-N-苯基甲基丙烯酰胺:在0 ℃和氮气保护下,将N-苯基甲基丙烯酰胺和氢化钠加入无水四氢呋喃溶剂中,再加入碘甲烷,用量按摩尔数比为N-苯基甲基丙烯酰胺 / 氢化钠 / 碘甲烷 = 1 / 2.5 / 2.0,无水四氢呋喃的用量为20 ml / g N-苯基甲基丙烯酰胺,搅拌1小时后,缓慢加入水(10 ml)淬灭,再加入饱和食盐水(50 ml),用乙酸乙酯(50 ml)进行萃取三次,有机相用无水Na2SO4干燥,过滤,减压蒸馏除去溶剂,经硅胶柱层析,石油醚-乙酸乙酯为洗脱剂(石油醚 / 乙酸乙酯 = 5 / 1),制得N-甲基-N-苯基甲基丙烯酰胺;
C、以N-甲基-N-苯基甲基丙烯酰胺和碘为原料,在二醋酸碘苯条件下和乙腈溶剂中合成5-碘-3-碘甲基-1,3-二甲基氧化吲哚:将N-甲基-N-苯基甲基丙烯酰胺溶于乙腈中,加入碘和二醋酸碘苯,用量按摩尔数比为N-甲基-N-苯基甲基丙烯酰 / 碘 / 二醋酸碘苯 = 1 / 1.5 / 1.5,乙腈的用量为50 ml / g N-甲基-N-苯基甲基丙烯酰胺,室温下搅拌10小时后,缓慢加入饱和Na2S2O3(10 ml)淬灭,再加入饱和食盐水(50 ml),用乙酸乙酯(50 ml)进行萃取三次,有机相用无水Na2SO4干燥,过滤,减压蒸馏除去溶剂,经硅胶柱层析,石油醚-乙酸乙酯为洗脱剂(石油醚 / 乙酸乙酯 = 2 / 1),制得5-碘-3-碘甲基-1,3-二甲基氧化吲哚;
D、以5-碘-3-碘甲基-1,3-二甲基氧化吲哚和苯并咪唑或5,6-二甲基苯并咪唑为原料,在氢氧化钠条件下和无水DMF溶剂中合成1-((5-碘-1,3-二甲基氧化吲哚)-3-甲基)苯并咪唑或5,6-二甲基苯并咪唑:将5-碘-3-碘甲基-1,3-二甲基氧化吲哚溶于无水DMF中,加入氢氧化钠,再加入苯并咪唑或5,6-二甲基苯并咪唑,用量按摩尔数比为5-碘-3-碘甲基-1,3-二甲基氧化吲哚 / 苯并咪唑或5,6-二甲基苯并咪唑 / 氢氧化钠 = 1 / 3 / 2,无水DMF的用量为100 ml / g 5-碘-3-碘甲基-1,3-二甲基氧化吲哚,室温下搅拌48小时后,再加入水(20 ml),用乙酸乙酯(20 ml)进行萃取三次,有机相用无水Na2SO4干燥,过滤,减压蒸馏除去溶剂,经硅胶柱层析,石油醚-乙酸乙酯为洗脱剂(石油醚 / 乙酸乙酯 / 三乙胺= 2 / 1 / 0.1),制得1-((5-碘-1,3-二甲基氧化吲哚)-3-甲基)苯并咪唑或5,6-二甲基苯并咪唑;
E、以1-((5-碘-1,3-二甲基氧化吲哚)-3-甲基)苯并咪唑或5,6-二甲基苯并咪唑和苯硼酸为原料,在醋酸钯和氢氧化钠条件下和无水四氢呋喃溶剂中合成1-((5-苯基-1,3-二甲基氧化吲哚)-3-甲基)苯并咪唑或5,6-二甲基苯并咪唑:在氮气保护下,将1-(5-碘-3-甲基-1,3-二甲基氧化吲哚)苯并咪唑或5,6-二甲基苯并咪唑、 苯硼酸、醋酸钯、氢氧化钠加入无水四氢呋喃中,用量按摩尔数比为1-(5-碘-3-甲基-1,3-二甲基氧化吲哚)苯并咪唑或5,6-二甲基苯并咪唑 /苯硼酸 / 醋酸钯 / 氢氧化钠 = 1 / 1.2 / 0.05 / 3,无水DMF的用量为100 ml : 1g 1-(5-碘-3-甲基-1,3-二甲基氧化吲哚)苯并咪唑或5,6-二甲基苯并咪唑,室温下搅拌24小时后,再加入水(20 ml),用乙酸乙酯(20 ml)进行萃取三次,有机相用无水Na2SO4干燥,过滤,减压蒸馏除去溶剂,经硅胶柱层析,石油醚-乙酸乙酯为洗脱剂(石油醚 / 乙酸乙酯 / 三乙胺= 1 / 1 / 0.1),制得1-((5-苯基-1,3-二甲基氧化吲哚)-3-甲基)苯并咪唑或5,6-二甲基苯并咪唑;
F、以1-((5-苯基-1,3-二甲基氧化吲哚)-3-甲基)苯并咪唑或5,6-二甲基苯并咪唑和溴代烷烃为原料,在1-((5-苯基-1,3-二甲基氧化吲哚)-3-甲基)苯并咪唑盐或5,6-二甲基苯并咪唑盐:将1-((5-苯基-1,3-二甲基氧化吲哚)-3-甲基)苯并咪唑或5,6-二甲基苯并咪唑溶于1,4-二氧六环中,搅拌下加入溴代烷烃,用量按摩尔数比为1-((5-苯基-1,3-二甲基氧化吲哚)-3-甲基)苯并咪唑或5,6-二甲基苯并咪唑 / 溴代烷烃 = 1 / 1.5,1,4-二氧六环用量为100 ml / g 1-((5-苯基-1,3-二甲基氧化吲哚)-3-甲基)苯并咪唑或5,6-二甲基苯并咪唑,反应搅拌回流12小时,冷却至室温,有固体沉淀析出,过滤,沉淀用乙酸乙酯(20 ml)洗涤数次,干燥,制备得到1-((5-苯基-1,3-二甲基氧化吲哚)-3-甲基)苯并咪唑盐或5,6-二甲基苯并咪唑盐。
上述具有结构通式(Ⅰ)的化合物与至少一种药物上可接受的赋型剂、稀释剂或载体制得的药物可用于治疗癌症。
附图说明
图1是本发明取代氧化吲哚—苯并咪唑盐类化合物化合物制备的技术路线图。
具体实施方式:
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
实施例1 1-((5-苯基-1,3-二甲基氧化吲哚)-3-甲基)-3-(2-溴苄基)苯并咪唑溴盐
制备过程:详见上述制备方法A、B、C、D、E、F。
白色固体,产率69%,m.p.280-282 oC.
IR νmax (cm-1):3017, 2967, 1705, 1611, 1562, 1478, 1356, 1245, 1200, 1126, 1029, 939.
1H-NMR (300 MHz, DMSO) δ: 9.42 (1H, s), 8.11 (1H, d, J = 7.8 Hz), 8.03 (1H, s), 7.80 (1H, d, J = 7.8 Hz), 7.67-7.54 (6H, m), 7.45 (2H, t, J = 7.2 Hz), 7.37-7.28 (3H, m), 7.01 (2H, d, J = 9.6 Hz), 5.79 (2H, s), 5.20 (1H, d, J = 14.4 Hz), 5.10 (1H, d, J = 14.4 Hz), 2.97 (3H, s), 1.54 (3H, s).
实施例2 1-((5-苯基-1,3-二甲基氧化吲哚)-3-甲基)-3-(2-萘甲基)苯并咪唑溴盐
制备过程:详见上述制备方法A、B、C、D、E、F。
白色固体,产率77%,m.p.171-173 oC.
IR νmax (cm-1):3024, 2968, 1705, 1612, 1558, 1479, 1458, 1359, 1254, 1201, 1123, 1028, 823.
1H-NMR (300 MHz, DMSO) δ: 10.83 (1H, s), 8.35 (1H, d, J = 7.8 Hz), 7.82 (3H, t, J = 8.7 Hz), 7.70-7.61 (3H, m), 7.55-7.41 (8H, m), 7.31 (1H, t, J = 7.5 Hz), 7.23-7.20 (1H, m), 6.92 (1H, d, J = 0.9 Hz), 6.48 (1H, d, J = 8.4 Hz), 5.88-5.67 (2H, m), 5.50 (1H, d, J = 15.0 Hz), 5.00 (1H, d, J = 14.1 Hz), 2.81 (3H, s), 1.68 (3H, s).
实施例3 1-((5-苯基-1,3-二甲基氧化吲哚)-3-甲基)-3-(4-溴苯甲酰甲基)苯并咪唑溴盐
制备过程:详见上述制备方法A、B、C、D、E、F。
白色固体,产率83%,m.p.185-187 oC.
IR νmax (cm-1):3017, 2967, 1705, 1611, 1562, 1478, 1356, 1245, 1200, 1126, 1029, 939
1H-NMR (300 MHz, DMSO) δ: 9.41 (1H, s), 8.16 (1H, d, J = 4.8 Hz), 8.09 (1H, s), 8.04-7.97 (3H, m), 7.87 (2H, d, J = 8.1 Hz), 7.76-7.43 (7H, m), 7.31 (1H, d, J = 8.1 Hz), 7.00 (1H, d, J = 8.1 Hz), 6.46-6.29 (2H, m), 5.36 (1H, d, J = 14.1 Hz), 4.96 (1H, d, J = 14.4 Hz), 3.11 (3H, s ), 1.57 (3H, s).
实施例4 1-((5-苯基-1,3-二甲基氧化吲哚)-3-甲基)-3-(2-溴苄基)-5,6-二甲基苯并咪唑溴盐
制备过程:详见上述制备方法A、B、C、D、E、F。
白色固体,产率69%,m.p. 287-289 oC.
IR νmax (cm-1):3011, 2971, 1709, 1608, 1561, 1478, 1454, 1356, 1331, 1202, 1129, 1033, 943.
1H-NMR (300 MHz, DMSO) δ: 9.22(1H, s), 8.06 (1H, s), 7.87 (1H, s), 7.67 (1H, d, J = 7.5 Hz), 7.61-7.53 (4H, m), 7.45 (2H, t, J = 7.5 Hz), 7.37-7.28 (3H, m), 6.98 (1H, d, J = 8.1 Hz), 6.84 (1H, d, J = 6.6 Hz), 5.71 (2H, s), 5.20 (1H, d, J = 14.4 Hz), 4.99 (1H, d, J = 14.4 Hz), 2.98 (3H, s), 2.27 (6H, s), 1.54 (3H, s).
实施例5 1-((5-苯基-1,3-二甲基氧化吲哚)-3-甲基)-3-(4-溴苯甲酰甲基)-5,6-二甲基苯并咪唑溴盐
制备过程:详见上述制备方法A、B、C、D、E、F。
白色固体,产率83%,m.p. 248-250 oC.
IR νmax (cm-1):3016, 2969, 1703, 1613, 1585, 1480, 1353, 1229, 1116, 1068, 1001, 963.
1H-NMR (300 MHz, DMSO) δ: 9.21 (1H, s), 8.15 (1H, s), 8.00 (2H, d, J = 8.4 Hz), 7.89 (3H, d, J = 9.0 Hz), 7.77 (1H, s), 7.62 (2H, d, J = 7.5 Hz), 7.52-7.43 (3H, m), 7.37-7.32 (1H, m), 6.98 (1H, d, J = 8.1 Hz), 6.36-6.19 (2H, m), 5.30 (1H, d, J = 14.4 Hz), 4.95 (1H, d, J = 14.4 Hz), 3.11 (3H, s ), 2.24 (3H, s), 2.22 (3H, s), 1.57 (3H, s).
实施例6 1-((5-苯基-1,3-二甲基氧化吲哚)-3-甲基)-3-(2-萘甲酰甲基)-5,6-二甲基苯并咪唑溴盐
制备过程:详见上述制备方法A、B、C、D、E、F。
白色固体,产率88%,m.p. 225-227 oC.
IR νmax (cm-1):3068, 2973, 1700, 1616, 1558, 1479, 1354, 1262, 1191, 1121, 1031, 822.
1H-NMR (300 MHz, DMSO) δ: 9.27 (1H , s), 8.88 (1H, s), 8.23-8.02 (5H, m), 7.89 (1H, s), 7.77-7.62 (5H, m), 7.54-7.37 (3H, m), 7.35 (1H, t, J = 7.2 Hz), 7.01 (1H, d, J = 7.8 Hz), 6.51-6.34 (2H , m), 5.30 (1H, d, J = 14.4 Hz), 5.00 (1H, d, J = 14.4 Hz), 3.14 (3H, s), 2.24 (3H, s), 2.22 (3H, s), 1.58 (3H, s).
实施例化合物1-6的体外抗肿瘤细胞毒活性实验
化合物1-6按照MTT方法对白血病、肝癌、肺癌、乳腺癌和结肠癌细胞株进行了细胞毒活性筛选,其半数致死剂量ID50值测定结果与已商品化的抗癌药物——顺铂(DDP)相比较于下表中。
以上数据表明,化合物5对乳腺癌和结肠癌细胞株、化合物6对肝癌、乳腺癌和结肠癌细胞株具有较好的体外抗肿瘤细胞毒活性。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!