一种液态产品中外源DNA内标物的保护方法及其应用与流程
本发明属于防伪鉴定技术领域,尤其涉及一种液态产品中外源DNA内标物的保护方法及其应用。
背景技术:
近年来,由于商品掺假造假的现象层出不穷,消费者对于商品的防伪和溯源尤为重视。尤其是对于食品类产品,由于其关乎国民的身体健康,更是消费者和国家监管部门的关注重点。目前商品的防伪和溯源措施主要是外包装防伪,即将各种特殊标识附于外包装上,或是利用特殊的外包装构造以便消费者和检验机构的识别。然而,由于外包装防伪的易破坏性和易仿造性,给不法分子留下了可乘之机。随着食品产业溯源体系的建立和完善,通过在食品中加入外源核酸作为溯源标记物的新型技术逐渐被开发应用。例如中国专利申请CN 101665825A公开了一种利用核酸检测技术鉴别白酒真伪的方法,其将动物、植物、微生物或人工合成的基因组DNA或基因片段加入到白酒内作为其内标物,再运用PCR技术检测内标物的有无来判断商品的真伪。
然而,由于绝大多数的液态产品尤其是液态食品中存在诸多核酸破坏因子(如核酸酶、自由基和酸等),DNA在液态产品中经长时间存放后会发生脱嘌呤、氧化或断裂等损伤,造成序列信息的丢失,最终导致检测的假阴性,这将大大限制其作为标记物在产品防伪和溯源中的应用。因此,目前亟需一种提高DNA稳定性的方法来实现其在液态产品中的长期稳定存在。目前在实际应用中已有一些提高DNA稳定性的方法。比如,使用Tris-EDTA缓冲液溶解核酸来维持体系的弱碱性环境;在反应体系中加入还原剂(如DTT)来防止核酸被氧化;或是将核酸进行结构改造或修饰来提高其对核酸酶的耐受性等。但由于这些方法需要改变产品的理化性质或加入有毒有害的化学试剂,或需要复杂、造价高的改造或修饰步骤,很难在实际产业中得到应用。
显然,如果能使用简单方便、成本低廉、无毒无害,且不影响DNA结构和性质的方法提高外源DNA在产品中的稳定性,将大大扩大DNA标记物在商品防伪和溯源中的应用范围和前景。
技术实现要素:
针对上述问题,本发明旨在提供一种简单方便、成本低廉、无毒无害,且不影响DNA结构和性质的方法,用以保护液态产品中的外源DNA。
一种液态产品中外源DNA内标物的保护方法,具体如下:将聚阳离子化合物溶液与目的DNA溶液按照氨基磷酸比≥10:1的比例混合,混匀后2-20℃放置0.5-12小时,得到稳定的DNA复合物溶液,可直接添加至液态产品中;所述的氨基磷酸比为聚阳离子所携带的氨基摩尔数与DNA携带的磷酸基团摩尔数的比值。
溶液中,核酸的磷酸基团上的负电荷可与聚阳离子化合物携带的正电荷相互作用,大大减缓DNA在酸性条件下的脱嘌呤反应,从而提高了其对酸性环境的耐受性。此外,由于聚阳离子化合物围绕在DNA的周围,阻碍了核酸酶与DNA的结合,同时也阻碍了自由基对DNA的攻击,从而也提高了DNA对核酸酶和自由基的耐受性。
本发明中将聚阳离子化合物溶液与目的DNA溶液混合后放置的温度控制在2-20℃之间,首先确保溶液处在液体状态以进行DNA与聚阳离子化合物之间的相互作用,但是温度不宜过高,经验证,当温度超过20℃时,聚阳离子化合物对DNA的保护效果不佳,且易导致微生物繁殖。
本发明中将聚阳离子化合物溶液与目的DNA溶液混合后放置的时间控制在0.5-12小时,经验证超过0.5小时时DNA即可与聚阳离子化合物形成复合物,且随着时间延长更有利于DNA与聚阳离子化合物充分作用,但时间过长则易导致微生物繁殖。
进一步地,聚阳离子化合物溶液与目的DNA溶液混匀后放置的温度为2-8℃,时间为6-12小时,在可能的范围内选择低温、长时间,能保证DNA与聚阳离子化合物充分作用,并防止微生物繁殖。
经证实(参见实施例1),氨基磷酸比在1-100:1时,聚阳离子化合物都能够发挥对DNA的保护作用,随着氨基磷酸比的增大,保护作用逐渐增强。但当氨基磷酸比大于10:1时,保护作用基本不变,因此氨基磷酸比的最优选择是10:1。既能达到理想的保护效果,又可有效控制成本。
进一步地,所述的DNA包括但不限于基因组DNA、线粒体DNA、叶绿体DNA、质粒DNA、PCR产物、DNA酶切片段或多聚寡核苷酸中的一种或多种。优选质粒DNA、PCR产物,更易制得,成本相对较低,适于工业化应用。
所述的基因组DNA包括所有生物的基因组DNA,优选鲑鱼精DNA、鲱鱼精DNA或λDNA中的一种或多种,因为这些基因组DNA量大易得,且已商品化,易购买得到。
所述的质粒DNA包括但不限于pUC18、pUC19、pUC57、pBR322、pTZ19R或pET28中的一种或多种。
进一步地,所述的聚阳离子化合物为一类可在溶液中聚集正电荷的化合物,包括但不限于壳寡糖、壳聚糖、精胺、腐胺、尸胺、亚精胺、多肽或碱性蛋白质中的一种或多种。
更进一步地,所述碱性蛋白质包括精蛋白和组蛋白等。
更进一步地,所述壳聚糖的分子量在20-250kDa,一般市售壳聚糖的分子量均在该范围内,因此该类壳聚糖更易得。
进一步地,所述DNA复合物溶液的pH=6-8,避免添加到产品中后影响产品本身的理化性质。
本发明的另一个目的是提供一种上述DNA保护方法的具体应用,即应用到液态产品的防伪和溯源中。
一种液态产品的防伪和溯源方法,具体步骤为:
(1)将聚阳离子化合物溶液与目的DNA溶液按照氨基磷酸比≥10:1的比例混合,混匀后2-20℃放置0.5-12小时,得到稳定的DNA复合物溶液,所述的氨基磷酸比为聚阳离子化合物所携带的氨基摩尔数与DNA携带的磷酸基团摩尔数的比值;
(2)将步骤(1)中得到的DNA复合物溶液添加到液态产品中,添加量以DNA的量计,使液态产品中DNA的含量为1ng/mL-50μg/mL;由于本发明方法对DNA的保护效果优良,DNA在液态产品中可稳定存在,因此加入量只要达到DNA的检出限即可;实际添加的DNA复合物的体积远远小于液态产品的体积,可有效保证产品的品质和外观等;
(3)检测液态产品中是否含有所添加的DNA。
进一步地,步骤(3)中检测DNA的方法包括琼脂糖凝胶电泳、聚丙烯酰胺凝胶电泳、变性聚丙烯酰胺凝胶电泳、常规PCR、实时荧光定量PCR或恒温核酸扩增等方法中的一种或多种。
相比于现有技术的缺点和不足,本发明具有以下有益效果:
(1)本发明使用无毒无害的聚阳离子化合物(如壳寡糖和壳聚糖)对外源DNA进行保护,提高外源DNA对核酸酶、酸和自由基等条件的耐受性,使DNA内标物能够稳定地存在于成分复杂的液态产品中,以应用于液态产品尤其是液态食品的溯源和防伪中。
(2)采用将DNA与聚阳离子化合物混合放置的方式简单方便,技术水平要求低,方便批量生产。
(3)聚阳离子化合物的种类较多,原料易得,成本较低。
(4)由于核酸具有聚阴离子的基本特性,在溶液中,核酸的磷酸基团上的负电荷可与聚阳离子化合物携带的正电荷相互作用,形成相对稳定的复合物。由于聚阳离子化合物是通过正负电荷相互作用与DNA结合,并非共价结合,对DNA的结构和性质都几乎无影响,因此不影响对DNA进行电泳、PCR或其他方式的检测。
附图说明
图1:本发明实施例1-7实施方法的路线示意图;
图2:本发明实施例1的核酸琼脂糖凝胶电泳结果图;其中,数字比值代表聚阳离子化合物与DNA的氨基磷酸比;
图3:本发明实施例1的核酸琼脂糖凝胶电泳结果图;
图4:本发明实施例2的核酸变性聚丙烯酰胺凝胶电泳结果图;
图5:本发明实施例3的实时荧光定量PCR检测结果;
图6:本发明实施例3中,白酒中的DNA在20℃贮藏不同时间后的实时荧光定量PCR检测结果;
图7:本发明实施例4的实时荧光定量PCR检测结果;
图8:本发明实施例5的实时荧光定量PCR检测结果;
图9:本发明实施例6的实时荧光定量PCR检测结果;
图10:本发明实施例7的实时荧光定量PCR检测结果。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图和实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
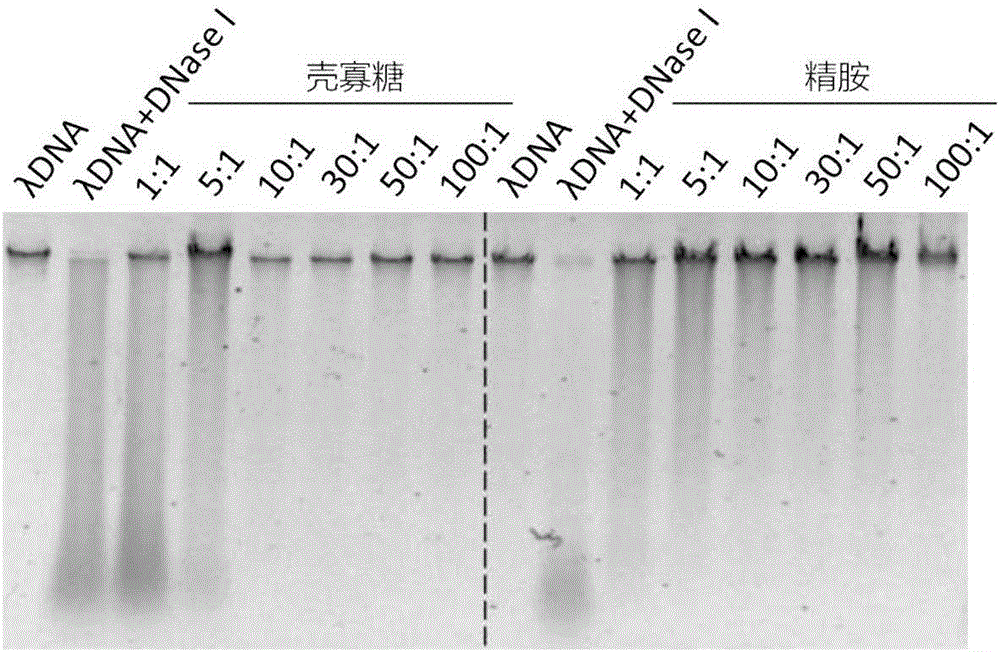
实施例1 壳寡糖和精胺提高λDNA对DNase I的耐受性
1、壳寡糖与精胺溶液的制备
壳寡糖溶液的制备:准确称取150mg壳寡糖(购于山东省莱州市海力生物制品有限公司;批号:HL130317G;分子量:6500Da;脱乙酰度:91.1%),加入8mL pH 2.0的盐酸溶液使壳寡糖完全溶解,然后用0.1M的氢氧化钠溶液调节溶液pH值至7.0。最后,用灭菌超纯水定容至10mL,于4℃保藏。使用时用灭菌超纯水稀释至所需工作液的浓度。
精胺溶液的制备:准确称取100mg精胺(购于Sigma-Aldrich;货号:S3256),用8mL灭菌超纯水溶解后,定容至10mL,于4℃保藏。使用时用灭菌超纯水稀释至所需工作液的浓度。
2、λDNA-壳寡糖复合物与λDNA-精胺复合物的制备
将λDNA与壳寡糖或精胺按照不同的氨基磷酸比(1:1-100:1)的比例混合后,使λDNA的浓度为300ng/μL,将混合物于4℃放置12小时,使λDNA与聚阳离子化合物充分作用,通过静电相互作用形成复合物。
3、复合物对DNase I的耐受性实验
将λDNA-壳寡糖复合物或λDNA-精胺复合物加入到含有DNase I的体系中,20μL体系中含λDNA 600ng,DNase I的含量为0.02U和1×DNase I buffer。37℃反应10min后,在65℃下温浴10min将DNase I灭活。然后通过琼脂糖凝胶电泳的方法对λDNA的完整度进行检测。
图2结果显示,随着氨基磷酸比的增加,聚阳离子化合物对λDNA的保护作用逐渐增强。当氨基磷酸比≥10:1时,壳寡糖和精胺对λDNA的保护效果良好。
4、DNA与聚阳离子化合物复合结构对保护效果的影响
为验证DNA复合物对保护效果的影响,设置未提前形成复合物的对照组,具体为:分别将λDNA、壳寡糖或精胺依次加入到含有DNase I的体系中,使体系中的氨基磷酸比为10:1(比例同实验组)。20μL体系中含λDNA 600ng,DNase I的含量为0.02U和1×DNase I buffer。37℃反应10min后,在65℃下温浴10min将DNase I灭活。通过琼脂糖凝胶电泳的方法对实验组及对照组中λDNA的完整度进行检测。
图3结果显示,对照组中:将DNA与聚阳离子化合物直接依次加入含有DNase I的体系中后,虽然聚阳离子化合物有一定的保护作用,但是DNA仍降解的比较严重。而实验组中:将DNA与聚阳离子化合物预混并4℃放置12小时,使二者形成复合物后再加入反应体系中会明显提高DNA对DNase I的耐受性。
实施例2 乳酸饮品中壳聚糖对多聚寡核苷酸的保护
1、外源单链多聚寡核苷酸与壳聚糖复合物的制备
壳聚糖溶液的制备:准确称取250mg壳聚糖(购于浙江澳兴生物科技有限公司;批号:20140220;分子量:50-100kDa),加入20mL灭菌超纯水,室温下磁力搅拌2h,使壳聚糖粉末充分水合。向水合的壳聚糖溶液逐渐滴加20mL pH 2的盐酸溶液,过夜磁力搅拌使其充分溶解。随后,使用0.1M的氢氧化钠溶液将其pH值调节至7.0。最后用灭菌超纯水定容至100mL,于4℃保藏。使用时用灭菌超纯水稀释至所需工作液的浓度。
将单链多聚寡核苷酸(36mer,序列为GTCTTAAATAGGCCACTAAGTCGTTAATTCGAGACT)与壳聚糖按照氨基磷酸比10:1的比例混合,使DNA的终浓度达到100μM,并于8℃放置8小时,使DNA与壳聚糖充分作用,通过静电相互作用形成复合物。
2、DNA-壳聚糖复合物在乳酸菌饮料中的长期贮藏
取4μL步骤1中制备的复合物加入到396μL乳酸菌饮料(品名:伊利每益添低糖活性乳酸菌饮料;规格:350mL;制造单位:内蒙古伊利实业集团股份有限公司)中,使多聚寡核苷酸的终浓度达到1μM(~10ng/μL),混匀后,用封口膜将EP管口密封并分别置于20℃和37℃下贮藏,一段时间后取出样品并检测DNA的含量。同时设置了不添加壳聚糖的对照组,即将多聚寡核苷酸直接加入到上述乳酸菌饮料中,使DNA的终浓度与复合物中DNA的终浓度相同,其他贮藏条件完全相同。
3、多聚寡核苷酸稳定性的检测—变性聚丙烯酰胺凝胶电泳
为检测步骤2中壳聚糖对多聚寡核苷酸的保护效果,使用变性聚丙烯酰胺凝胶电泳检测长时间贮藏后乳酸菌饮料中的多聚寡核苷酸的含量。为避免乳酸菌饮料中的成分影响电泳,将含有多聚寡核苷酸的乳酸菌饮料稀释10倍后上样。变性PAGE凝胶的浓度为15%,其中含8M尿素。分析结果见图4。
结果表明,单链多聚寡核苷酸在乳酸菌饮料中的稳定性较差,当在20℃贮藏30天或在37℃贮藏5天后,大部分单链多聚寡核苷酸都被降解。将寡核苷酸与壳聚糖的复合物加入乳酸菌饮料中可以大大提高寡核苷酸的稳定性,经过37℃贮藏20天后DNA含量仍然较高。
实施例3 白酒中壳聚糖、壳寡糖和精胺对pUC18质粒DNA的保护
1、外源质粒DNA与壳聚糖、壳寡糖和精胺复合物的制备
壳聚糖溶液的制备:准确称取250mg壳聚糖(购于Sigma-Aldrich;货号:740500;分子量:110-150kDa),加入20mL灭菌超纯水,室温下磁力搅拌2h,使壳聚糖粉末充分水合。向水合的壳聚糖溶液逐渐滴加20mL pH 2的盐酸溶液,过夜磁力搅拌使其充分溶解。随后,使用0.1M的氢氧化钠溶液将pH值调节至7.0。最后用灭菌超纯水定容至100mL,于4℃保藏。使用时用灭菌超纯水稀释至所需工作液的浓度。
壳寡糖溶液的制备:准确称取150mg壳寡糖(购于山东省莱州市海力生物制品有限公司;批号:HL130317G;分子量:6500Da;脱乙酰度:91.1%),加入8mL pH 2.0的盐酸溶液使壳寡糖完全溶解,然后用0.1M的氢氧化钠溶液调节溶液pH值至7.0。最后,用灭菌超纯水定容至10mL,于4℃保藏。使用时用灭菌超纯水稀释至所需工作液的浓度。
精胺溶液的制备:准确称取100mg精胺(购于Sigma-Aldrich;货号:S3256),用8mL灭菌超纯水溶解后,定容至10mL,于4℃保藏。使用时用灭菌超纯水稀释至所需工作液的浓度。
将pUC18质粒DNA分别与壳聚糖、壳寡糖和精胺溶液按照氨基磷酸比10:1的比例混合,使DNA的终浓度达到29ng/μL,并于4℃放置12小时,使DNA与聚阳离子化合物充分作用,通过静电相互作用形成复合物。
2、质粒DNA-壳聚糖、质粒DNA-壳寡糖、质粒DNA-精胺复合物在白酒中的长期贮藏
取4μL步骤1中制备的复合物加入到396μL白酒(品名:三井小刀;酒精度:45%vol;规格:248mL;制造单位:河北三井酒业股份有限公司)中,使质粒DNA的终浓度达到290pg/μL(~108拷贝/μL),混匀后,用封口膜将EP管口密封并分别置于4℃、20℃和37℃下贮藏,一段时间后取出样品并检测质粒DNA的含量。同时设置了不添加聚阳离子化合物的对照组,即将质粒DNA直接加入到上述白酒中,使质粒DNA的终浓度与复合物中质粒DNA的终浓度相同,其他贮藏条件完全相同。
3、质粒DNA稳定性的检测—荧光定量PCR法
为检测步骤2中壳聚糖、壳寡糖和精胺对质粒DNA的保护效果,使用荧光定量PCR法(RT-qPCR)检测长时间贮藏后白酒中质粒DNA的含量。为避免白酒中的成分影响RT-qPCR反应,将含有质粒DNA的白酒稀释100倍后作为RT-qPCR反应的模板。针对pUC18质粒DNA设计的特异性PCR引物见表1,扩增的目的产物长度为170bp。反应中每个体系均含有5μL 2×SYBR Select Master Mix(购于Invitrogen,货号:4472908),0.3μM特异性引物,1μL上述稀释后的含质粒DNA的白酒,用ddH2O补至10μL。反应参数为:95℃预变性2min,95℃变性20s,59℃退火20s,72℃延伸20s,40个循环。分析结果见图5和图6。
图5结果表明,纯质粒DNA在白酒中的稳定性较差,经过37℃、10d的贮藏后,对照组中白酒的DNA含量仅为最初的0.07%。白酒中含乳酸、乙酸、己酸和丁酸等有机酸,总酸度为0.25-0.45g/L,因此外源DNA在白酒中会因脱嘌呤而降解。降低贮藏温度后,DNA的稳定性明显提高,但长时间贮藏后DNA的被破坏程度仍然较大。将质粒DNA-壳聚糖、DNA-壳寡糖和DNA-精胺组成复合物后再加入白酒中可以大大提高DNA的稳定性。其中壳聚糖对DNA的保护效果最好,经过4℃30天、20℃20天和37℃10天的贮藏后,DNA含量没有显著变化。由于精胺和壳寡糖的分子量较小,与DNA形成的复合物较不稳定,因此精胺和壳寡糖对于质粒DNA的保护效果弱于壳聚糖。
图6中表示了白酒中的质粒DNA在20℃贮藏30天中的含量变化。结果显示,纯的DNA在白酒中的稳定性较差,而DNA-壳聚糖复合物和DNA-壳寡糖复合物可在白酒中长期稳定存在。
表1.实施例3中使用的引物序列
实施例4 葡萄酒中亚精胺和壳聚糖对pUC18质粒DNA的保护
1、外源质粒DNA与亚精胺和壳聚糖复合物的制备
亚精胺溶液的制备:准确称取100mg亚精胺(购于Sigma-Aldrich;货号:S2626),用8mL灭菌超纯水溶解后,定容至10mL,于4℃保藏。使用时用灭菌超纯水稀释至所需工作液的浓度。
壳聚糖溶液的制备:准确称取250mg壳聚糖(购于Sigma-Aldrich;货号:740179;分子量:140-220kDa),加入20mL灭菌超纯水,室温下磁力搅拌2h,使壳聚糖粉末充分水合。向水合的壳聚糖溶液逐渐滴加20mL pH 2的盐酸溶液,过夜磁力搅拌使其充分溶解。随后,使用0.1M的氢氧化钠溶液将pH值调节至7.0。最后用灭菌超纯水定容至100mL,于4℃保藏。使用时用灭菌超纯水稀释至所需工作液的浓度。
将pUC18质粒DNA分别与亚精胺、壳聚糖按照氨基磷酸比10:1的比例混合,使DNA的终浓度达到2.9ng/μL,并于2℃放置10小时,使DNA与壳聚糖充分作用,通过静电相互作用形成复合物。
2、质粒DNA-亚精胺、质粒DNA-壳聚糖复合物在葡萄酒中的长期贮藏
取4μL步骤1中制备的复合物加入到396μL葡萄酒(品名:青岛华东干红葡萄酒;酒精度:13%vol;规格:750mL;制造单位:青岛华东葡萄酿酒有限公司)中,使质粒DNA的终浓度达到29pg/μL(~107拷贝/μL),混匀后,用封口膜将EP管口密封并分别置于4℃、20℃和37℃下贮藏,一段时间后取出样品并检测质粒DNA的含量。同时设置了不添加聚阳离子化合物的对照组,即将质粒DNA直接加入到上述葡萄酒中,使DNA的终浓度与复合物中DNA的终浓度相同,其他贮藏条件完全相同。
3、质粒DNA稳定性的检测—荧光定量PCR法
为检测步骤2中亚精胺和壳聚糖对质粒DNA的保护效果,使用荧光定量PCR(RT-qPCR)检测长时间贮藏后葡萄酒中质粒DNA的含量。为避免葡萄酒中的成分影响RT-qPCR反应,将含有质粒DNA的葡萄酒稀释100倍后作为RT-qPCR反应的模板。针对pUC18质粒DNA设计的特异性PCR引物见表2,扩增的目的产物长度为138bp。反应中每个体系均含有5μL 2×SYBR Select Master Mix(购于Invitrogen,货号:4472908),0.3μM特异性引物,1μL上述稀释后的含质粒DNA的葡萄酒,用ddH2O补至10μL。反应参数为:95℃预变性2min,95℃变性20s,59℃退火20s,72℃延伸20s,40个循环。分析结果见图7。
结果表明,纯质粒DNA在葡萄酒中的稳定性较差,经过37℃、10d的贮藏后,对照组中葡萄酒的质粒DNA含量仅为0.08%。葡萄酒的总酸度为1.66-4.52g/L,其中含酒石酸、苹果酸和发酵产生的乳酸、琥珀酸和醋酸等,因此外源DNA在葡萄酒中会因脱嘌呤而降解。将质粒DNA-壳聚糖和DNA-亚精胺组成复合物后再加入葡萄酒中可以大大提高DNA的稳定性。其中壳聚糖对DNA的保护效果要优于亚精胺,经过4℃30天、20℃20天和37℃10天的贮藏后,DNA-壳聚糖复合物中的DNA含量没有显著变化。
表2.实施例4中使用的引物序列
实施例5 牛奶中鱼精蛋白对pUC19质粒DNA的保护
1、外源质粒DNA与鱼精蛋白复合物的制备
鱼精蛋白溶液的制备:准确称取10mg鱼精蛋白(购于Sigma-Aldrich;货号:P4005),加入8mL灭菌超纯水和50μL 0.5M EDTA(pH 8.0),待鱼精蛋白溶解后,用灭菌超纯水定容至10mL,于4℃保藏。使用时用灭菌超纯水稀释至所需工作液的浓度。
将pUC19质粒DNA与鱼精蛋白按照氨基磷酸比10:1的比例混合,使DNA的终浓度达到290pg/μL,并于6℃放置10小时,使DNA与鱼精蛋白充分作用,通过静电相互作用形成复合物。
2、DNA-鱼精蛋白复合物在牛奶中的长期贮藏
取4μL步骤1中制备的复合物加入到396μL牛奶(品名:伊利全脂灭菌纯牛乳;规格:250mL盒装;制造单位:内蒙古伊利实业集团股份有限公司)中,使质粒DNA的终浓度达到2.9pg/μL(~106拷贝/μL),混匀后,用封口膜将EP管口密封并分别置于4℃、20℃和37℃下贮藏,一段时间后取出样品并检测质粒DNA的含量。同时设置了不添加鱼精蛋白的对照组,即将质粒DNA直接加入到上述牛奶中,使DNA的终浓度与复合物中DNA的终浓度相同,其他贮藏条件完全相同。
3、质粒DNA稳定性的检测—荧光定量PCR法
为检测步骤2中鱼精蛋白对质粒DNA的保护效果,使用荧光定量PCR(RT-qPCR)检测长时间贮藏后牛奶中质粒DNA的含量。为避免牛奶中的成分影响RT-qPCR反应,将含有质粒DNA的牛奶稀释100倍后作为RT-qPCR反应的模板。针对pUC19质粒DNA设计的特异性PCR引物见表3,扩增的目的产物长度为154bp。反应中每个体系均含有5μL 2×SYBR Select Master Mix(购于Invitrogen,货号:4472908),0.3μM特异性引物,1μL上述稀释后的含质粒DNA的牛奶,用ddH2O补至10μL。反应参数为:95℃预变性2min,95℃变性20s,59℃退火20s,72℃延伸20s,40个循环。分析结果见图8。
结果表明,37℃时,纯质粒DNA在牛奶中的稳定性较低,经10d贮藏后含量仅为最初的1%。在加入DNA-鱼精蛋白复合物后,DNA的稳定性得到了明显的提高,经过4℃30天、20℃20天和37℃10天的贮藏后DNA含量没有显著变化。
表3.实施例5中使用的引物序列
实施例6 柠檬汁饮料中壳寡糖对pUC19质粒DNA的保护
1、外源质粒DNA与壳寡糖复合物的制备
壳寡糖溶液的制备:准确称取150mg壳寡糖(购于山东省莱州市海力生物制品有限公司;批号:HL130317G;分子量:6500Da;脱乙酰度:91.1%),加入5mL pH 2的盐酸溶液使壳寡糖完全溶解,然后用0.1M的氢氧化钠溶液调节溶液pH值至7.0。最后,用灭菌超纯水定容至10mL,于4℃保藏。使用时用灭菌超纯水稀释至所需工作液的浓度。
将pUC19质粒与壳寡糖按照氨基磷酸比10:1的比例混合,使DNA的终浓度达到290ng/μL,并于4℃放置10小时,使DNA与壳寡糖充分作用,通过静电相互作用形成复合物。
2、DNA-壳寡糖复合物在柠檬汁饮料中的长期贮藏
取4μL步骤1中制备的复合物加入到396μL柠檬汁饮料(品名:美汁源冰桔柠檬;规格:480mL;制造单位:上海申美饮料食品有限公司)中,使质粒DNA的终浓度达到2.9ng/μL(~109拷贝/μL),混匀后,用封口膜将EP管口密封并分别置于4℃、20℃和37℃下贮藏,一段时间后取出样品并检测DNA的含量。同时设置了不添加壳寡糖的对照组,即将质粒DNA直接加入到上述柠檬汁饮料中,使DNA的终浓度与复合物中DNA的终浓度相同,其他贮藏条件完全相同。
3、质粒DNA稳定性的检测—荧光定量PCR法
为检测步骤2中壳寡糖对质粒DNA的保护效果,使用荧光定量PCR(RT-qPCR)检测长时间贮藏后柠檬汁饮料中的质粒DNA含量。为避免柠檬汁饮料中的成分影响RT-qPCR反应,将含有质粒DNA的柠檬饮料稀释100倍后作为RT-qPCR反应的模板。针对pUC19质粒DNA设计的特异性PCR引物见表4,扩增的目的产物长度为208bp。反应中每个体系均含有5μL 2×SYBR Select Master Mix(购于Invitrogen,货号:4472908),0.3μM特异性引物,1μL上述稀释后的含质粒DNA的柠檬汁饮料,用ddH2O补至10μL。反应参数为:95℃预变性2min,95℃变性20s,59℃退火20s,72℃延伸20s,40个循环。分析结果见图9。
37℃时,纯质粒DNA在柠檬汁饮料中的稳定性较差,经贮藏10d后,柠檬汁中的DNA含量仅为最初的0.3%。这是由于柠檬汁的pH值较低,DNA在其中极易发生脱嘌呤反应,由于壳寡糖可在酸性条件下可显著抑制DNA的脱嘌呤,因此体系中加入DNA-壳寡糖复合物后显著提高了DNA在柠檬汁饮料中的稳定性。
表4.实施例6中使用的引物序列
实施例7 白醋中壳聚糖对PCR产物的保护
1、PCR产物与壳聚糖复合物的制备
壳聚糖溶液的制备:准确称取250mg壳聚糖(购于Sigma-Aldrich;货号:740063;分子量:60-120kDa),加入20mL灭菌超纯水,室温下磁力搅拌2h,使壳聚糖粉末充分水合。向水合的壳聚糖溶液逐渐滴加20mL pH 2的盐酸溶液,过夜磁力搅拌使其充分溶解。随后,使用0.1M的氢氧化钠溶液将pH值调节至7.0。最后用灭菌超纯水定容至100mL,于4℃保藏。使用时用灭菌超纯水稀释至所需工作液的浓度。
PCR产物的制备:以pUC18质粒为模板(1010拷贝/μL),引物pUC19-364a/s为引物进行普通PCR反应,引物序列见表5,扩增的目的产物长度为364bp。50μL体系中含有5μL 10×pfu buffer,0.4μM引物pUC19-364a/s,0.2mM dNTPs,2U pfu DNA聚合酶(购于Thermo Scientific)。PCR参数为:72℃引物延伸5min,94℃预变性3min,94℃变性30s,59℃退火30s,72℃延伸90s,35个循环后72℃保温5min。将得到的PCR产物进行醇沉纯化并用nano drop测定PCR产物的浓度。
将PCR产物与壳聚糖按照氨基磷酸比10:1的比例混合,使DNA的终浓度达到4ng/μL,并于2℃放置10小时,使DNA与壳聚糖充分作用,通过静电相互作用形成复合物。
2、DNA-壳聚糖复合物在白醋中的长期贮藏
取4μL步骤1中制备的复合物加入到396μL白醋(品名:海天白米醋;规格:450mL;制造单位:佛山市海天调味食品股份有限公司)中,使PCR产物的终浓度达到40pg/μL(~108拷贝/μL),混匀后,用封口膜将EP管口密封并分别置于4℃、20℃和37℃下贮藏,一段时间后取出样品并检测PCR产物的含量。同时设置了不添加壳聚糖的对照组,即将PCR产物直接加入到上述白醋中,使DNA的终浓度与复合物中DNA的终浓度相同,其他贮藏条件完全相同。
3、PCR产物稳定性的检测—荧光定量PCR法
为检测步骤2中壳聚糖对PCR产物的保护效果,使用荧光定量PCR(RT-qPCR)检测长时间贮藏后白醋中PCR产物的含量。为避免白醋中的成分影响RT-qPCR反应,将含有PCR产物的白醋稀释100倍后作为RT-qPCR反应的模板。针对PCR产物设计的特异性PCR引物pUC18-156a/s的序列见表5,扩增的目的产物长度为156bp。反应中每个体系均含有5μL 2×SYBR Select Master Mix(购于Invitrogen,货号:4472908),0.3μM特异性引物,1μL上述稀释后的含PCR产物的白醋,用ddH2O补至10μL。反应参数为:95℃预变性2min,95℃变性20s,59℃退火20s,72℃延伸20s,40个循环。分析结果见图10。
纯PCR产物在白醋中的稳定性较差,经37℃贮藏10d后,白醋中的DNA含量仅为最初的0.1%。这是由于白醋的pH值较低(~pH 2.2),DNA在其中极易发生脱嘌呤反应,由于壳聚糖在酸性条件下可显著抑制DNA的脱嘌呤,因此体系中加入DNA-壳聚糖复合物后显著提高了DNA在白醋中的稳定性。
表5.实施例7中使用的引物序列
上述的实施例的结果表明本发明的方法可大大提高DNA在液态产品中的稳定性,经高温、长时间贮藏后,产品中外源DNA的含量几乎不变,因此可通过分子生物学手段对内标DNA的有无甚至含量进行检测,从而确定产品的真伪及去向,从而扩大DNA作为商品防伪和溯源内标物的应用范围。
应当理解的是,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,而所有这些改进和变换都应属于本发明所附权利要求的保护范围。
SEQUENCE LISTING
<110> 青岛千卓分子生物科技有限公司
<120> 一种液态产品中外源DNA内标物的保护方法及其应用
<130> 2016
<160> 13
<170> PatentIn version 3.5
<210> 1
<211> 36
<212> DNA
<213> Artificial Sequence
<400> 1
gtcttaaata ggccactaag tcgttaattc gagact 36
<210> 2
<211> 26
<212> DNA
<213> Artificial Sequence
<400> 2
ccgcctccat ccagtctatt aattgt 26
<210> 3
<211> 25
<212> DNA
<213> Artificial Sequence
<400> 3
tcatgtaact cgccttgatc gttgg 25
<210> 4
<211> 22
<212> DNA
<213> Artificial Sequence
<400> 4
acgaaaactc acgttaaggg at 22
<210> 5
<211> 22
<212> DNA
<213> Artificial Sequence
<400> 5
agcattggta actgtcagac ca 22
<210> 6
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 6
tgtggaattg tgagcggata 20
<210> 7
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 7
gttttcccag tcacgacgtt 20
<210> 8
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 8
gcctacatac ctcgctctgc 20
<210> 9
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 9
ggcgctttct catagctcac 20
<210> 10
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 10
cagctcactc aaaggcggta 20
<210> 11
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 11
ttggagcgaa cgacctacac 20
<210> 12
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 12
aagataccag gcgtttcccc 20
<210> 13
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 13
cgaacgacct acaccgaact 20
- 还没有人留言评论。精彩留言会获得点赞!