一种表面正电荷的pH响应性阿霉素纳米药物胶囊的制备方法与流程
本发明属于药物制备领域,特别涉及一种表面正电荷的pH响应性阿霉素纳米药物胶囊的制备方法。
背景技术:
据中国卫生部公布资料显示,2015年中国约有430万人确诊癌症,另外280万人因癌症去。癌症已成为危害人类健康的最主要疾病,癌症的主要治疗方法之一是药物治疗,但目前的抗癌药物大多数都存在着水溶性差、稳定性差、对肿瘤组织的选择性低、疗效差、毒副性强等缺陷。因此,寻找一种可靠的药物载体是解决这些问题的关键。
药物载体中研究和应用最广泛的是聚合物胶束/囊泡(两亲性共聚物、脂质体),但是它的载药量低、稳定性、包封率差,极易在体内循环过程中未到达肿瘤部位时就将抗肿瘤剂泄露出来,对正常的组织产生较为严重的毒副损害。生物可降解聚合物(聚乳酸、乳酸-羟基乙酸共聚物、聚己内酯等)胶体粒子虽然具有较高的载药量和包封率,但是由于聚合物的降解周期和降解效率的问题,抑制了药物的释放效率。另一方面,由于大多数聚合物纳米药物载体不具备“质子海绵效应”,导致其在载入细胞过程中的内涵体、溶酶体逃逸效率低,进而很难将药物有效输送到细胞基质和细胞核而发挥药效。
因此如何在分子结构设计和制备工艺水平上构建具有高细胞载入效率、“质子海绵效应”和环境响应释药性等特性的药物载体是抗癌制剂面临的极具挑战性的问题。
技术实现要素:
本发明的目的是建立一种表面正电荷的pH响应性阿霉素纳米药物胶囊的制备方法,该方法操作简单,不仅可以实现对阿霉素纳米胶囊结构和表面的精确控制,还能实现阿霉素在体内的高效投递。
具体地说,本发明提供一种表面正电荷的pH响应性阿霉素纳米药物胶囊的制备方法,该方法包括如下步骤,
S1提供阿霉素的表面修饰剂丙烯酸酯基辛基苯酚聚乙二醇醚(OP-AC);
S2将包含阿霉素的溶液加入到OP-AC的去离子水溶液中,得到表面修饰有丙烯酸酯基的阿霉素,再加入一定量的中性单体AM、带正电的单体DMAPMA、pH响应降解交联剂以及氧化还原引发剂过硫酸铵/TEMED引发原位自由基聚合;
S3收集S2中包含阿霉素聚合物的液体,透析、冷冻干燥得到阿霉素纳米药物胶囊。
OP-AC的分子结构如下:
阿霉素的表面修饰剂OP-AC是通过如下步骤合成的:
S1.1将OP-10、三乙胺和四氢呋喃按一定比例添加到三口瓶中,将三口瓶置于冰水中,用电磁搅拌器搅拌;
S1.2将一定量的AC溶解在四氢呋喃中,然后逐滴添加到三口瓶中,添加完成后反应5小时,温度保持在0~5℃;
S1.3收集S1.2中的产物,通过旋转蒸发仪除去四氢呋喃;
S1.4收集S1.3中的产物,加入适量的丙酮,分离得到含有OP-AC的上清液,再利用旋转蒸发仪除去丙酮,离心分离得到OP-AC。
S1.5收集S1.4中的产物,在真空干燥箱中干燥,得到OP-AC。
包含阿霉素的溶液为阿霉素在二甲基亚砜中的溶液。
OP-AC的去离子水溶液中的OP-AC和阿霉素的质量比为1/5;二甲基亚砜和去离子水的体积比为1/25。
交联剂为pH响应降解交联剂二甲基丙烯酸甘油酯(GDM)或非可降解交联剂N'N-甲叉双丙烯酰胺(BIS),优选GDM;
阿霉素/(单体+交联剂)为1/0.1~1/0.03(质量比),优选1/0.1;单体和交联剂的质量比为1/1~1/0.1,优选1/0.4;带正电的单体DMAPMA和中性单体AM的质量比为1/3~3/1,优选1/1。
所述的阿霉素和过硫酸铵的质量比为1/0.04,单体和TEMED的比例为1/5;
所述制备方法制得的阿霉素纳米药物胶囊,阿霉素1的表面有一层聚合物载体2,聚合物载体2的表面带有正电荷3;阿霉素纳米药物胶囊的平均粒径在200nm~400nm、分散性较好;溶出速率和溶出度较大,具有pH响应释药性。
与现有技术相比,本发明具有如下有益效果。
采用本发明的方法,可通过改变单体和交联剂的用量、对比使用非可降解交联剂BIS后所得实验结果等,能够得到平均粒径较小、分散均匀、溶出速率较快和溶出度较大等性能更优的阿霉素纳米药物胶囊。
该药物胶囊的结构是阿霉素的表面有一层聚合物载体,且表面带有正电荷;阿霉素纳米药物胶囊的平均粒径在200nm~400nm、分散性较好;溶出速率和溶出度较大,具有pH响应释药性。
附图说明
图1是实施例1中制得的OP-AC的核磁图。
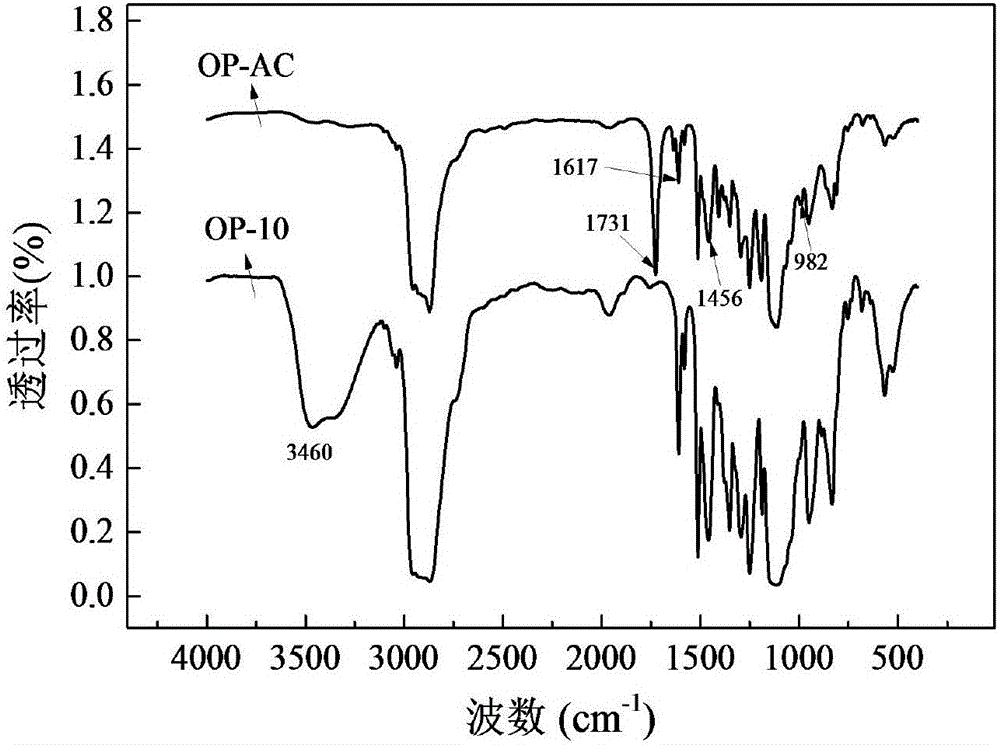
图2是实施例1中制得的OP-AC的红外光谱图。
图3是实施例2中制得的阿霉素药物胶囊的扫描电镜照片(a)和粒径分布图(b)。
图4是实施例3中制得的阿霉素药物胶囊的扫描电镜照片(a)和粒径分布图(b)。
图5是实施例4中制得的阿霉素药物胶囊的扫描电镜照片(a)和粒径分布图(b)。
图6是实施例5中制得的阿霉素药物胶囊的扫描电镜照片(a)和粒径分布图(b)。
图7是实施例6中制得的阿霉素药物胶囊的扫描电镜照片(a)和粒径分布图(b)。
图8是实施例7中制得的阿霉素药物胶囊的扫描电镜照片(a)和粒径分布图(b)。
图9是实施例8中制得的阿霉素药物胶囊的扫描电镜照片(a)和粒径分布图(b)。
图10是实施例9中制得的阿霉素药物胶囊的扫描电镜照片(a)和粒径分布图(b)。
图11是实施例7~9(a)以及实施例4~6(b)中制得的阿霉素药物胶囊在pH=7.4的磷酸盐缓冲溶液中的溶出曲线。
图12是实施例7~9(a)以及实施例4~6(b)中制得的阿霉素药物胶囊在pH=6.0的磷酸盐缓冲溶液中的溶出曲线。
图13是实施例7~9(a)以及实施例4~6(b)中制得的阿霉素药物胶囊在pH=4.0的磷酸盐缓冲溶液中的溶出曲线。
图14是实施例10中制得的阿霉素药物胶囊的扫描电镜照片(a)和粒径分布图(b)。
图15是实施例11中制得的阿霉素药物胶囊的扫描电镜照片(a)和粒径分布图(b)。
图16是实施例12中制得的阿霉素药物胶囊的扫描电镜照片(a)和粒径分布图(b)。
图17是阿霉素药物胶囊的结构示意图。
具体实施方式
实施例1
将0.1molOP-10、0.12mol三乙胺和80mL四氢呋喃添加到三口瓶中,将三口瓶置于冰水中,用电磁搅拌器搅拌。将0.12molAC溶解在四氢呋喃中,然后逐滴添加到三口瓶中,添加完成后反应5小时,温度保持在0~5℃。反应产物通过旋转蒸发仪除去四氢呋喃,设置温度为50℃。再加入200mL丙酮,分离得到含有OP-AC的上清液,再利用旋转蒸发仪(设置温度为40℃)除去丙酮,离心分离得到OP-AC。在真空干燥箱中干燥,得到OP-AC。
从图1所示的核磁图中可以看出,在3.5ppm附近有明显的特征峰,说明实验合成的OP-AC中是有双键的。
从图2所示的红外光谱图中可以看出,由1640cm-1(伸缩振动,C=C),1733cm-1(伸缩振动,C=O)、986cm-1(平面外弯曲振动,=CH)和1400cm-1(剪切振动,=CH2)可以说明实验合成的OP-AC中是有双键的。
实施例2
称取5mg盐酸阿霉素,在室温下溶解于1mL二甲基亚砜中,按照三乙胺:盐酸阿霉素的摩尔比为3:1加入4μL三乙胺脱除盐酸,反应10min,记为混合液①。将1mgOP-AC溶解于25mL去离子水中,搅拌10min,记为混合液②。将混合液①加入到混合液②中,反应20min,记为混合液③。按照阿霉素/(AM+GDM)为1/0.03(质量比)、AM和GDM的质量比为1/0.4的比例,向混合液③中加入AM,10min后加入GDM,10min后再加入0.2mg过硫酸铵,按照单体和TEMED的质量比为1/5加入TEMED,反应1.5h,记为混合液④。将混合液④装入透析袋(MW=3500)中,用去离子水透析,4℃下避光储存,每隔4h换一次去离子水,重复三次。透析后冷冻干燥即得到阿霉素药物胶囊。
从图3所示的扫描电镜照片和粒径分布图中可以看出,阿霉素药物胶囊为平均粒径219.3nm、形貌较规则的球形颗粒,分散性差,易团聚,粒度分布均匀。
实施例3
称取5mg盐酸阿霉素,在室温下溶解于1mL二甲基亚砜中,按照三乙胺:盐酸阿霉素的摩尔比为3:1加入4μL三乙胺脱除盐酸,反应10min,记为混合液①。将1mgOP-AC溶解于25mL去离子水中,搅拌10min,记为混合液②。将混合液①加入到混合液②中,反应20min,记为混合液③。按照阿霉素/(AM+GDM)为1/0.05(质量比)、AM和GDM的质量比为1/0.4的比例,向混合液③中加入AM,10min后加入GDM,10min后再加入0.2mg过硫酸铵,按照单体和TEMED的质量比为1/5加入TEMED,反应1.5h,记为混合液④。将混合液④装入透析袋(MW=3500)中,用去离子水透析,4℃下避光储存,每隔4h换一次去离子水,重复三次。透析后冷冻干燥即得到阿霉素药物胶囊。
从图4所示的扫描电镜照片和粒径分布图中可以看出,阿霉素药物胶囊为平均粒径247.7nm、形貌较规则的球形颗粒,分散性差,易团聚,粒度分布均匀。
实施例4
称取5mg盐酸阿霉素,在室温下溶解于1mL二甲基亚砜中,按照三乙胺:盐酸阿霉素的摩尔比为3:1加入4μL三乙胺脱除盐酸,反应10min,记为混合液①。将1mgOP-AC溶解于25mL去离子水中,搅拌10min,记为混合液②。将混合液①加入到混合液②中,反应20min,记为混合液③。按照阿霉素/(AM+GDM)为1/0.1(质量比)、AM和GDM的质量比为1/0.4的比例,向混合液③中加入AM,10min后加入GDM,10min后再加入0.2mg过硫酸铵,按照单体和TEMED的质量比为1/5加入TEMED,反应1.5h,记为混合液④。将混合液④装入透析袋(MW=3500)中,用去离子水透析,4℃下避光储存,每隔4h换一次去离子水,重复三次。透析后冷冻干燥即得到阿霉素药物胶囊。
从图5所示的扫描电镜照片和粒径分布图中可以看出,阿霉素药物胶囊为平均粒径263.4nm、形貌较规则的球形颗粒,分散性较好,粒度分布均匀。
实施例5
称取5mg盐酸阿霉素,在室温下溶解于1mL二甲基亚砜中,按照三乙胺:盐酸阿霉素的摩尔比为3:1加入4μL三乙胺脱除盐酸,反应10min,记为混合液①。将1mgOP-AC溶解于25mL去离子水中,搅拌10min,记为混合液②。将混合液①加入到混合液②中,反应20min,记为混合液③。按照阿霉素/(AM+GDM)为1/0.1(质量比)、AM和GDM的质量比为1/0.1的比例,向混合液③中加入AM,10min后加入GDM,10min后再加入0.2mg过硫酸铵,按照单体和TEMED的质量比为1/5加入TEMED,反应1.5h,记为混合液④。将混合液④装入透析袋(MW=3500)中,用去离子水透析,4℃下避光储存,每隔4h换一次去离子水,重复三次。透析后冷冻干燥即得到阿霉素药物胶囊。
从图6所示的扫描电镜照片和粒径分布图中可以看出,阿霉素药物胶囊为平均粒径227.3nm、形貌较规则的球形颗粒,分散性差,易团聚,粒度分布均匀。
实施例6
称取5mg盐酸阿霉素,在室温下溶解于1mL二甲基亚砜中,按照三乙胺:盐酸阿霉素的摩尔比为3:1加入4μL三乙胺脱除盐酸,反应10min,记为混合液①。将1mgOP-AC溶解于25mL去离子水中,搅拌10min,记为混合液②。将混合液①加入到混合液②中,反应20min,记为混合液③。按照阿霉素/(AM+GDM)为1/0.1(质量比)、AM和GDM的质量比为1/1的比例,向混合液③中加入AM,10min后加入GDM,10min后再加入0.2mg过硫酸铵,按照单体和TEMED的质量比为1/5加入TEMED,反应1.5h,记为混合液④。将混合液④装入透析袋(MW=3500)中,用去离子水透析,4℃下避光储存,每隔4h换一次去离子水,重复三次。透析后冷冻干燥即得到阿霉素药物胶囊。
从图7所示的扫描电镜照片和粒径分布图中可以看出,阿霉素药物胶囊为平均粒径352.6nm、形貌较规则的球形颗粒,分散性差,易团聚,粒度分布均匀。
实施例7
称取5mg盐酸阿霉素,在室温下溶解于1mL二甲基亚砜中,按照三乙胺:盐酸阿霉素的摩尔比为3:1加入4μL三乙胺脱除盐酸,反应10min,记为混合液①。将1mgOP-AC溶解于25mL去离子水中,搅拌10min,记为混合液②。将混合液①加入到混合液②中,反应20min,记为混合液③。按照阿霉素/(AM+BIS)为1/0.1(质量比)、AM和BIS的质量比为1/0.1的比例,向混合液③中加入AM,10min后加入BIS,10min后再加入0.2mg过硫酸铵,按照单体和TEMED的质量比为1/5加入TEMED,反应1.5h,记为混合液④。将混合液④装入透析袋(MW=3500)中,用去离子水透析,4℃下避光储存,每隔4h换一次去离子水,重复三次。透析后冷冻干燥即得到阿霉素药物胶囊。
从图8所示的扫描电镜照片和粒径分布图中可以看出,阿霉素药物胶囊为平均粒径215.9nm、形貌较规则的球形颗粒,分散性差,易团聚,粒度分布均匀。
实施例8
称取5mg盐酸阿霉素,在室温下溶解于1mL二甲基亚砜中,按照三乙胺:盐酸阿霉素的摩尔比为3:1加入4μL三乙胺脱除盐酸,反应10min,记为混合液①。将1mgOP-AC溶解于25mL去离子水中,搅拌10min,记为混合液②。将混合液①加入到混合液②中,反应20min,记为混合液③。按照阿霉素/(AM+BIS)为1/0.1(质量比)、AM和BIS的质量比为1/0.4的比例,向混合液③中加入AM,10min后加入BIS,10min后再加入0.2mg过硫酸铵,按照单体和TEMED的质量比为1/5加入TEMED,反应1.5h,记为混合液④。将混合液④装入透析袋(MW=3500)中,用去离子水透析,4℃下避光储存,每隔4h换一次去离子水,重复三次。透析后冷冻干燥即得到阿霉素药物胶囊。
从图9所示的扫描电镜照片和粒径分布图中可以看出,阿霉素药物胶囊为平均粒径273.7nm、形貌较规则的球形颗粒,分散性较好,粒度分布均匀。
实施例9
称取5mg盐酸阿霉素,在室温下溶解于1mL二甲基亚砜中,按照三乙胺:盐酸阿霉素的摩尔比为3:1加入4μL三乙胺脱除盐酸,反应10min,记为混合液①。将1mgOP-AC溶解于25mL去离子水中,搅拌10min,记为混合液②。将混合液①加入到混合液②中,反应20min,记为混合液③。按照阿霉素/(AM+BIS)为1/0.1(质量比)、AM和BIS的质量比为1/1的比例,向混合液③中加入AM,10min后加入BIS,10min后再加入0.2mg过硫酸铵,按照单体和TEMED的质量比为1/5加入TEMED,反应1.5h,记为混合液④。将混合液④装入透析袋(MW=3500)中,用去离子水透析,4℃下避光储存,每隔4h换一次去离子水,重复三次。透析后冷冻干燥即得到阿霉素药物胶囊。
从图10所示的扫描电镜照片和粒径分布图中可以看出,阿霉素药物胶囊为平均粒径346.2nm、形貌较规则的球形颗粒,分散性差,易团聚,粒度分布均匀。
如图11所示,交联剂量越多,交联程度越高,溶出速率越慢;BIS作交联剂的阿霉素药物胶囊(a)和GDM作交联剂的阿霉素药物胶囊(b)在pH=7.4的磷酸盐缓冲溶液中的溶出没有明显差距。
如图12所示,与BIS作交联剂的阿霉素药物胶囊(a)相比,GDM作交联剂的阿霉素药物胶囊(b)的溶出速率和溶出度明显提高,说明它具有pH响应;同阿霉素药物胶囊在pH=7.4磷酸盐缓冲溶液中的溶出情况相比,GDM作交联剂的阿霉素药物胶囊的溶出速率和溶出度都有很大的提高。
如图13所示,同阿霉素药物胶囊在pH=6.0磷酸盐缓冲溶液中的溶出情况相比,BIS作交联剂的阿霉素药物胶囊(a)的溶出速率和溶出度没有明显变化,而GDM作交联剂的阿霉素药物胶囊(b)的溶出速率和溶出度都有很大的提高。
实施例2~9中制得的阿霉素药物胶囊的Zeta电位均为负值。
实施例10
称取5mg盐酸阿霉素,在室温下溶解于1mL二甲基亚砜中,按照三乙胺:盐酸阿霉素的摩尔比为3:1加入4μL三乙胺脱除盐酸,反应10min,记为混合液①。将1mgOP-AC溶解于25mL去离子水中,搅拌10min,记为混合液②。将混合液①加入到混合液②中,反应20min,记为混合液③。按照阿霉素/(AM+GDM)为1/0.2(质量比)、AM和GDM的质量比为1/0.4、DMAPMA和AM的质量比为1/3的比例,向混合液③中每隔10min加入AM、DMAPMA、GDM,10min后再加入0.2mg过硫酸铵,按照单体和TEMED的质量比为1/5加入TEMED,反应1.5h,记为混合液④。将混合液④装入透析袋(MW=3500)中,用去离子水透析,4℃下避光储存,每隔4h换一次去离子水,重复三次。透析后冷冻干燥即得到阿霉素药物胶囊。
从图14所示的扫描电镜照片和粒径分布图中可以看出,阿霉素药物胶囊为平均粒径278.3nm、形貌较规则的球形颗粒,分散性差,易团聚,粒度分布均匀。
实施例11
称取5mg盐酸阿霉素,在室温下溶解于1mL二甲基亚砜中,按照三乙胺:盐酸阿霉素的摩尔比为3:1加入4μL三乙胺脱除盐酸,反应10min,记为混合液①。将1mgOP-AC溶解于25mL去离子水中,搅拌10min,记为混合液②。将混合液①加入到混合液②中,反应20min,记为混合液③。按照阿霉素/(AM+GDM)为1/0.2(质量比)、AM和GDM的质量比为1/0.4、DMAPMA和AM的质量比为1/1的比例,向混合液③中每隔10min加入AM、DMAPMA、GDM,10min后再加入0.2mg过硫酸铵,按照单体和TEMED的质量比为1/5加入TEMED,反应1.5h,记为混合液④。将混合液④装入透析袋(MW=3500)中,用去离子水透析,4℃下避光储存,每隔4h换一次去离子水,重复三次。透析后冷冻干燥即得到阿霉素药物胶囊。
从图15所示的扫描电镜照片和粒径分布图中可以看出,阿霉素药物胶囊为平均粒径265.3nm、形貌较规则的球形颗粒,分散性一般,部分发生团聚现象,粒度分布均匀。
实施例12
称取5mg盐酸阿霉素,在室温下溶解于1mL二甲基亚砜中,按照三乙胺:盐酸阿霉素的摩尔比为3:1加入4μL三乙胺脱除盐酸,反应10min,记为混合液①。将1mgOP-AC溶解于25mL去离子水中,搅拌10min,记为混合液②。将混合液①加入到混合液②中,反应20min,记为混合液③。按照阿霉素/(AM+GDM)为1/0.2(质量比)、AM和GDM的质量比为1/0.4、DMAPMA和AM的质量比为3/1的比例,向混合液③中每隔10min加入AM、DMAPMA、GDM,10min后再加入0.2mg过硫酸铵,按照单体和TEMED的质量比为1/5加入TEMED,反应1.5h,记为混合液④。将混合液④装入透析袋(MW=3500)中,用去离子水透析,4℃下避光储存,每隔4h换一次去离子水,重复三次。透析后冷冻干燥即得到阿霉素药物胶囊。
从图16所示的扫描电镜照片和粒径分布图中可以看出,阿霉素药物胶囊为平均粒径247.6nm、形貌较规则的球形颗粒,分散性一般,部分发生团聚现象,粒度分布均匀。
实施例10~12中制得的阿霉素药物胶囊的Zeta电位均为正值。
- 还没有人留言评论。精彩留言会获得点赞!