一种生物催化剂及其制备方法和应用与流程
本发明属于生物工程技术领域,具体涉及一种生物催化剂及其制备方法和应用。
背景技术:
(R)-3-奎宁醇(分子式C7H13NO,分子量为127.18,CAS号:25333-42-0)是合成阿地溴铵、索利那新、瑞伐托酯和他沙利定等药物的关键中间体。目前工业上主要是利用手性催化剂不对称还原3-奎宁酮合成(R)-3-奎宁醇,如:XylSkewphos/PICA-Ruthenium(II)复合物或BINAP/IPHAN-Ru(II)复合物等。但该化学合成方法需筛选手性配体;所使用的过渡金属价格昂贵、毒性较大、难以从产物中去除;而且制备的产物光学纯度较低,需进一步纯化。另一种方法是外消旋拆分,该方法的缺陷在于其理论产率最大只有50%。
相对于化学合成方法,以酶做催化剂的生物合成法具有底物特异性;高度化学选择性、区域选择性和立体选择性;反应条件温和;催化活性高;原子经济性好等独特优势。生物方法合成(R)-3-奎宁醇涉及两个过程:一是借助羰基还原酶利用NADH或NADPH将3-奎宁酮还原为(R)-3-奎宁醇;二是借助辅酶再生酶将氧化型NAD+或NADP+转化为还原型NADH或NADPH,实现双酶偶联不对称还原合成(R)-3-奎宁醇。具体过程如下:
生物催化不对称还原合成(R)-3-奎宁醇过程。
无论是用野生型微生物还是重组大肠杆菌作为生物催化剂,由于细胞本身结构的限制致使底物/产物、辅酶在细胞内外交换受阻,导致生物转化时间长、催化效率低。而游离酶作催化剂,酶稳定性和由酶纯化所致的高成本,都是酶作为生物催化剂必须解决的问题。此外,这两种生物催化剂都难以回收和循环利用。
实际应用中,为了提高酶的稳定性、催化活性和选择性,可将酶与特定载体结合形成固定化酶,而固定化酶生物催化剂易于从反应混合物中分离、可循环再利用和实现连续反应(Robert Dicosimo,Joseph Mcauliffe,Ayrookaran J.Pouloseb and Gregory Bohlmann,Industrial use of immobilized enzymes,Chem.Soc.Rev.,2013,42,6437-6474;Joshua Britton,Colin L.Raston and Gregory A.Weiss,Rapid protein immobilization for thin film continuous flow biocatalysis,Chem.Commun.,2016,52,10159-10162)。常规酶固定化方法包括物理吸附、化学结合、包埋和形成交联酶聚集体。物理方法简单、快速、不易致酶失活,但酶易泄露,而载体本身也容易遮蔽酶活性位点,妨碍底物结合。化学方法有利于增加酶稳定性,但易致酶失活(Suwan Myung,Chun You and Y.-H.Percival Zhang,Recyclable cellulose-containing magnetic nanoparticles:immobilization of cellulose-binding module-tagged proteins and a synthetic metabolon featuring substrate channeling,J.Mater.Chem.B,2013,1,4419-4427;Wen Wang,Daniel I.C.Wang and Zhi Li,Facile fabrication of recyclable and active nanobiocatalyst:purification and immobilization of enzyme in one pot with Ni-NTA functionalized magnetic nanoparticle,Chem.Commun.,2011,47,8115–8117;Fuhua Zhao,Hui Li,Yijun Jiang,Xicheng Wang and Xindong Mu,Co-immobilization of multi-enzyme on control-reduced graphene oxide by non-covalent bonds:an artificial biocatalytic system for the one-pot production of gluconic acid from starch,Green Chem.,2014,16,2558-2565)。
技术实现要素:
为了解决现有技术中的问题,根据本发明的第一方面,本发明的目的在于提供一种生物催化剂,该生物催化剂稳定性好,催化活性好,具有长期操作稳定性和可循环再利用。
本发明的目的是这样实现的:
一种生物催化剂,包含NADH依赖的特异性3-奎宁酮还原酶(QNR)、葡萄糖脱氢酶(GDH)、Ni2+功能化琼脂糖微球,其特征在于:在衍射角度2θ为27.5±0.2°、31.7±0.2°、45.5±0.2°、52.1±0.2°、66.4±0.2°、75.8±0.2°处有衍射峰。
根据本发明的一个实施方案,上述生物催化剂还含有氯化钠和磷酸二氢钠。
根据本发明的一个实施方案,上述生物催化剂具有泡沫样多孔结构,孔径为10nm-2.5μm。
根据本发明的一个实施方案,上述生物催化剂酶负载量为5-15%。
根据本发明的第二方面,本发明的另一目的在于提供上述生物催化剂的制备方法。
根据本发明的一个实施方案,上述生物催化剂的制备方法,其特征在于,采用如下步骤:
步骤(1)
用缓冲溶液A平衡Ni2+功能化琼脂糖微球,加入含带组氨酸标签的3-奎宁酮还原酶(His-QNR)和带组氨酸标签的葡萄糖脱氢酶(His-GDH)的细胞裂解混合上清液,用含5-15mM咪唑的缓冲溶液A稀释成混悬液;
步骤(2)
将步骤(1)制备的混悬液以转速30~100rpm在温度4~30℃、pH5.0~10.0的条件下连续搅拌1~3h;然后离心,收集载酶琼脂糖微球,用步骤(1)的缓冲溶液A洗涤;
步骤(3)
将洗涤后的载酶琼脂糖微球分散在步骤(1)的缓冲溶液A中,置于2~8℃冰箱孵育1~5天;既得;
所述缓冲溶液A的pH值为7.8-8.2。
根据本发明的一个实施方案,上述缓冲溶液A含50mM磷酸二氢钠和300mM氯化钠。
根据本发明的第三方面,本发明的再一目的在于提供上述生物催化剂在合成(R)-3-奎宁醇中的应用。
根据本发明的第四方面,本发明的再一目的在于提供一种(R)-3-奎宁醇的合成方法,该方法使用上述生物催化剂进行酶催化反应,合成(R)-3-奎宁醇。
根据本发明的一个实施方案,一种(R)-3-奎宁醇的合成方法,其特征在于:
将生物催化剂分散在缓冲溶液B中,加入3-奎宁酮,葡萄糖、NAD+和NADH,在室温条件下,pH为7.5-8.0,以50~150rpm转速振荡,生物转化时间为1-12h;所述缓冲溶液B的pH值为7.2-7.4。
根据本发明的一个实施方案,所述缓冲溶液B为10mM磷酸缓冲盐溶液(PBS),含NaCl 137mM,KCl 2.7mM,Na2HPO410mM,KH2PO42mM。
具体的,一种(R)-3-奎宁醇的生物催化合成方法,包括如下步骤:
步骤(1)
用缓冲溶液A平衡Ni2+功能化琼脂糖微球,加入含带组氨酸标签的3-奎宁酮还原酶(His-QNR)和带组氨酸标签的葡萄糖脱氢酶(His-GDH)的细胞裂解混合上清液,用含5-15mM咪唑的缓冲溶液A稀释成混悬液;
步骤(2)
将步骤(1)制备的混悬液以转速30~100rpm在温度4~30℃、pH5.0~10.0的条件下连续搅拌1~3h;然后离心,收集载酶琼脂糖微球,用步骤(1)的缓冲溶液A洗涤;
步骤(3)
将洗涤后的载酶琼脂糖微球分散在步骤(1)的缓冲溶液A中,置于2~8℃冰箱孵育1~5天;制得生物催化剂;
步骤(4)
将生物催化剂分散在缓冲溶液B中,加入3-奎宁酮,葡萄糖、NAD+和NADH,在室温条件下,pH为7.5-8.0,以50~150rpm转速振荡,生物转化时间为1-12h;
所述缓冲溶液A含50mM磷酸二氢钠和300mM氯化钠,pH值为7.8-8.2;
所述缓冲溶液B为10mM磷酸缓冲盐溶液(PBS),含NaCl 137mM,KCl 2.7mM,Na2HPO410mM,KH2PO42mM,pH值为7.2-7.4。
有益效果:
1、本发明基于Ni2+和多聚组氨酸标签间的强亲和作用直接从细胞裂解液中同时纯化和固定化His-QNR和His-GDH,制备的生物催化剂在衍射角度2θ为27.5±0.2°、31.7±0.2°、45.5±0.2°、52.1±0.2°、66.4±0.2°、75.8±0.2处有衍射峰。该生物催化剂具有泡沫样多孔结构,孔径为10nm-2.5μm,酶负载量高达5-15%,催化活性好。
2、使用本发明生物催化剂作为固定化酶催化剂,用于(R)-3-奎宁醇的生物催化合成,可同时实现羰基还原和辅酶原位再生,无需添加昂贵的辅酶NADH。同时本发明的生物催化剂可回收和循环再利用,且具有长期操作稳定性。
3、本发明酶固定化方法不需要预纯化目标蛋白,能同时完成目标蛋白的纯化和固定化;同时能特异性富集目标蛋白的活性;制备的固定化酶稳定性好,方法操作简单,不需要特殊设备,工艺条件温和,成本低,适合工业化。
4、使用本发明生物催化剂不对称合成(R)-3-奎宁醇,收率高达70-85%,转化率为100%,对映体值为100%,同时可循环使用15次以上,经济效益大。本发明生物催化不对称合成(R)-3-奎宁醇所用介质为水,可以节约资源,不污染环境,符合绿色化学的要求。
附图说明
图1是生物催化剂的SDS-PAGE分析;
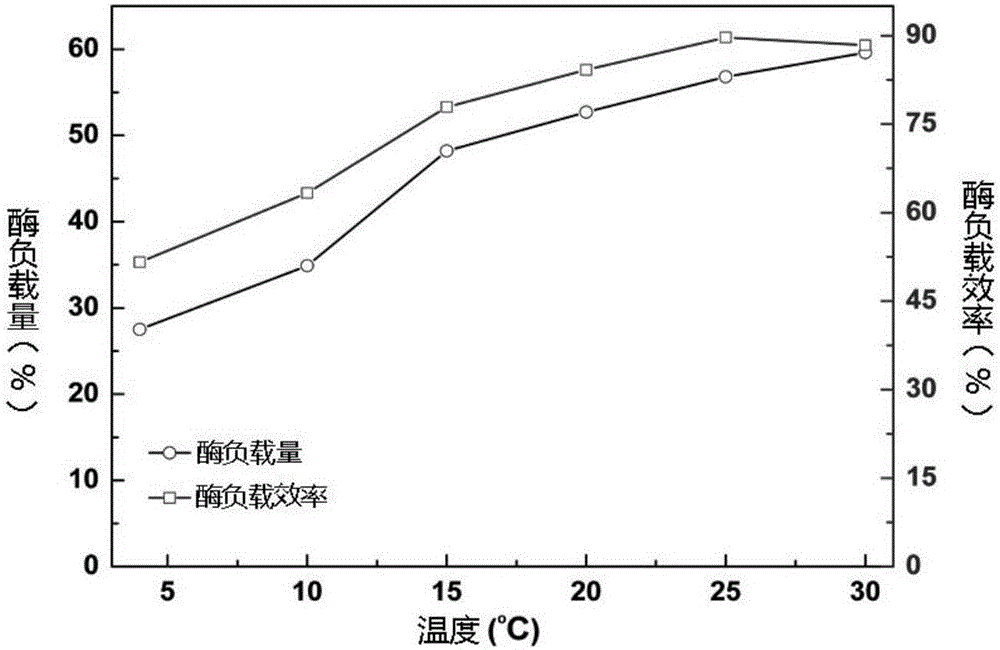
图2是温度对Ni2+功能化琼脂糖微球酶负载量的影响;
图3是pH值对Ni2+功能化琼脂糖微球酶负载量的影响;
图4是Ni2+功能化琼脂糖微球和总蛋白质量比对酶特异性活性和活性回收率的影响;
图5是生物催化剂的扫描电镜分析;
图6是生物催化剂的粉末X衍射分析;
图7是生物催化剂的热重分析;
图8是3-奎宁酮和(R)-3-奎宁醇的红外光谱分析;
图9是生物催化剂的循环再利用;
图10是不同循环批次的生物催化剂的SDS-PAGE分析。
具体实施方式
下面通过具体实施例对本发明进行具体描述,在此指出以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,本领域的技术熟练人员可以根据上述发明内容对本发明作出一些非本质的改进和调整。本发明所有原料及试剂均为市售产品。本发明所用羰基还原酶为NADH依赖的特异性的3-奎宁酮还原酶(QNR,Accession No:AB733448),辅酶再生酶为葡萄糖脱氢酶(GDH,Accession No:AY930464)。
实施例1
酶活性测定
QNR酶活性测定:
标准反应混合体系:缓冲溶液B(PBS,pH7.2-7.4),3μmol 3-奎宁酮,0.3μmol NADH,适量的酶QNR,总体积1mL。在λ=340nm处测定吸光度值变化。酶活性单位定义:25℃,1min内转化1μmol NADH所需的酶量。
GDH酶活性测定:
标准反应混合体系:缓冲溶液B(PBS,pH7.2-7.4),10μmol葡萄糖,1μmol NAD+,适量的酶GDH,总体积1mL。在λ=340nm处测定吸光度值变化。酶活性单位定义:25℃,1min内转化1μmol NAD+所需的酶量。
实施例2
共固定His-QNR和His-GDH
取50mg Ni2+功能化琼脂糖微球,用缓冲溶液A(含50mM磷酸二氢钠和300mM氯化钠,pH值为7.8-8.2)平衡;然后加入2mL含奎宁酮还原酶(His-QNR)和葡萄糖脱氢酶(His-GDH)的细胞裂解混合上清液,用含10mM咪唑的缓冲溶液A稀释至5mL。在温度25℃,pH8.0,转速50rpm,连续搅拌上述混悬液2h。将上述混悬液离心,收集载酶琼脂糖微球,用缓冲溶液A洗涤两次。将洗涤后的载酶琼脂糖微球重新分散在缓冲溶液A中,置于4℃冰箱孵育4天。
对实施例2制备的生物催化剂进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分析
SDS-PAGE分析结果见附图1。图中M为标准蛋白质分子量;L1为表达His-QNR的重组大肠杆菌和表达His-GDH的重组大肠杆菌;L2为两种重组大肠杆菌的细胞裂解混合上清液;L3、L4、L5和L6为用10mM、250mM、500mM和1M洗脱生物催化剂的收集液。在分子量35-25kDa之间,出现两个明显的蛋白质条带,分别对应QNR(25.74kDa)和GDH(28.25kDa),目标蛋白纯度均在90%以上,证实本发明提供的亲和固定化方法能直接从细胞裂解液中同时纯化和固定化His-QNR和His-GDH。
参照实施例2的制备方法,考察温度、pH值对Ni2+功能化琼脂糖微球酶负载量和酶负载效率的影响;考察Ni2+功能化琼脂糖微球和总蛋白质量比对酶特异性活性和活性回收率的影响。
温度对Ni2+功能化琼脂糖微球酶负载量和负载效率的影响结果见附图2。当温度从4℃上升到25℃时,酶负载量从27.5增加到59.6mg/g(Ni2+功能化琼脂糖微球),负载效率从51.6%增加到89.7%。当温度超过30℃时,酶负载量和负载效率并没有增加,表明固定化的最佳温度为25℃。
pH对Ni2+功能化琼脂糖微球酶负载量和负载效率的影响结果见附图3。温度25℃,当pH值为8.0时,酶负载量达到最大值为60.8mg/g(Ni2+功能化琼脂糖微球),而酶负载效率达到最大值为92.3%。因此,固定化的最佳pH值为8.0.
Ni2+功能化琼脂糖微球和总蛋白质量比对酶特异性活性和活性回收率的影响见附图4。Ni2+功能化琼脂糖微球和总蛋白质量比从4/1增加到8/1时,QNR和GDH的特异性活性分别为从5.3U/mg增加到8.4U/mg和5.6U/mg增加到11.5U/mg,活性回收率分别从61.2%增加到94.6%和64.2%增加到98.6%。但质量比从8/1增加到10/1时,特异性活性和活性回收率变化不大。酶固定化时,Ni2+功能化琼脂糖微球和总蛋白质量比以8/1为宜。
对实施例2制备的生物催化剂进行扫描电镜分析
将样品溶液滴加于洁净的盖玻片上,40℃真空干燥,喷金覆盖样品,用扫描电镜(SEM,S-3000N型)和场发射扫描电镜(FE-SEM,FEI NOVA NanoSEM 400)成像,分析结果见附图5。附图5a为Ni2+功能化琼脂糖微球,表面光滑。附图5b为固定酶以后的Ni2+功能化琼脂糖微球,即生物催化剂,其表面形态与附图5a所示完全不同,出现尺度和形态不规则且相互紧密连接的小球。将生物催化剂进一步用FE-SEM分析发现,生物催化剂表面为泡沫样多孔结构,孔径在10nm-2.5μm之间(附图5c,d),这种多孔结构有利于局部富集高浓度底物/辅酶和物质快速交换,既能提高反应速度又能提高催化效率。
对实施例2制备的生物催化剂进行粉末X衍射(XRD)分析
使用普析XD-2X-ray衍射仪测定样品晶体衍射峰,测试条件:Cu靶电压30kV,电流15mA,扫描速度2°/min,步长0.02°,扫描范围5°to 50°,分析结果见附图6。从图中可见:生物催化剂的XRD谱中,2θ在27.5±0.2°、31.7±0.2°、45.5±0.2°、52.1±0.2°、66.4±0.2°和75.8±0.2°处出现特征峰,强度分布为845、1450、1005、850、800和830。而蛋白质和Ni2+功能化琼脂糖微球的XRD谱图中,并没有出现相应的特征峰。
对实施例2制备的生物催化剂进行热重分析(TGA)
使用Mettler 1100SF系统测定生物催化剂的酶负载量。将约2mg样品置于铝锅中,按20mL/min通入氮气,加热速度为15℃/min,扫描范围为30-600℃。TGA分析结果见附图7。根据失重计算,生物催化剂酶负载量为5.94%。
实施例3
生物催化剂催化不对称合成(R)-3-奎宁醇:
反应体系:50mg生物催化剂,5mM 3-奎宁酮,9mM葡萄糖,0.05mM NAD+和0.05mM NADH,缓冲溶液B(10mM磷酸缓冲盐溶液,PBS),含NaCl 137mM,KCl 2.7mM,Na2HPO410mM,KH2PO42mM,pH值为7.2-7.4),总体积10mL。反应温度25℃,以100rpm连续搅拌,反应过程中pH控制在7.5-8.0.用TLC监控反应,流动相为V二氯甲烷/V甲醇=9/1。生物转化完成后,将反应混合物离心分离生物催化剂。上清液用高浓度NaOH调节至pH值大于12,然后在80℃减压浓缩至总体积的1/4。加入等体积的正丁醇抽提3次,收集有机相,减压浓缩蒸干。在90℃,用甲苯溶解固体,难溶物趁热过滤,滤液冷却,有白色针状晶体出现,过滤,得白色固体(1H-NMR(400MHz,DMSO):δ4.946(s,1H),δ3.879(q,1H),δ2.531-3.164(m,6H),δ1.392-2.014(m,5H),产物的理论分子量为:127.18,质谱测定为:127)。
对实施例3制备的白色固体进行红外光谱分析以及构型分析
红外光谱分析:采用KBr压片法制备样品,范扫波长描围4000~400cm-1,底物和产品的红外光谱图见附图8。结果显示3-奎宁酮在1747cm-1左右的羰基特征峰消失,而在3103cm-1出现羟基特征峰,表明3-奎宁酮被还原成3-奎宁醇。
构型分析
用Clarus580GC系统(Perkin Elmer,USA)测定对映体值,手性柱为(HYDRODEX-β-6-TBDM,25m×0.25mm×0.25μm,Macherey-Nagel),使用火焰离子检测器。从60℃程序升温至180℃,升温速度为5℃/min,保持3min.进样器和检查器的温度分别为220℃和250℃。以标准品(R)和(S)-奎宁醇做对照,测得产品的对映体值为100%,其构型R型。
参照实施例3,考察底物和催化剂的用量对转化时间、转化率和对映体值的影响,具体见下表1。
当生物催化剂用量为底物的6.12%时,随底物量增大,生物转化时间从1.0h增加到4.5h,转化率和对映体值均为100%。当底物量为204g/L,催化剂减半时,转化时间为9.5h,催化活性明显降低,转化率小于100%,对映体值仍为100%。表明底物用量影响生物催化剂的活性,转化时间延长,但不影响其立体选择性。
实施例4
生物催化剂的回收和循环再利用。
反应体系:100mg生物催化剂,10mM奎宁酮,18mM葡萄糖,0.05mM NAD+和0.05mM NADH,缓冲溶液B(PBS,pH7.2-7.4),总体积10mL。反应温度25℃,以100rpm.连续搅拌,反应过程中控制pH在7.5-8.0.TLC监控反应完成后,离心收集催化剂,直接用于下一次转化。发现本发明提供的生物催化剂可循环15次,单次循环的转化率和对映体值均为100%,结果见附图9。循环15次以后,催化效率明显降低。在生物催化剂循环再利用过程中,分别在第2次、4次、6次....20次转化完成后,取少量催化剂进行SDS-PAGE分析,结果见附图10。发现生物催化剂在循环使用过程中,固定化的酶量没有明显减少,表明本发明提供的生物催化剂具有长期操作稳定性。
实施例5(对比实施例)
在不经过本发明生物催化剂处理,直接用表达His-QNR和表达His-GDH的重组大肠杆菌处理实验,以作对比。反应体系:0.1g混合湿细胞作生物催化剂,5mM 3-奎宁酮,9mM葡萄糖,0.05mM NAD+和0.05mM NADH,缓冲溶液B(PBS,pH7.2-7.4),总体积10mL。反应温度25℃,以100rpm连续搅拌,反应过程中控制pH在7.5-8.0.用TLC监控反应,流动相为V二氯甲烷/V甲醇=9/1。转化时间明显延长(5.5h),转化率为95%,对映体值100%,不能回收和循环利用。
- 还没有人留言评论。精彩留言会获得点赞!