水稻基因OsDF1及抗病调控功能的应用的制作方法
本发明属生物技术领域,涉及一个水稻基因OsDF1及其抗病调控功能的应用。
背景技术:
1、植物基因克隆技术
植物基因克隆方法有很多种,随着基因组序列测定完成的植物物种的增多,基于数据库序列的植物基因克隆方法得到越来越广泛的应用。该方法操作步骤主要包括基于保守序列的引物设计,目的植物组织RNA提取,反转录酶-聚合酶链式反应(RT-PCR),PCR产物与载体的连接,连接产物的细菌转化,质粒提取,酶切检验,测序分析等。
2、植物基因表达控制和基因功能分析技术
植物基因的功能通过基因表达和蛋白积累来执行。因此,基因功能通常通过比较分析基因的超常规表达与正常表达情况下的表型(Phenotype)或功能发挥情况来判断和明确。基因的超常规表达包括高于正常水平的表达和低于正常水平的表达两大类。高于正常水平的表达主要为超表达/过表达(Over-expression),主要通过连接一个强启动子来驱动目的基因表达的方式来达到。低于正常水平的表达主要通过RNA干扰(RNA interfering,RNAi)、基因敲除(Knock-out)等方式来达到。RNAi通过构建和转化一个含有同一序列片段相反方向插入一个内含子或其它不表达的序列形成的发卡结构来实现,结果是目的基因表达的降低。基因敲除(Knock-out)则通过在植物基因组中的目的基因中插入一个长的非植物序列或切除目的基因等方式来达到,结果是目的基因表达的完全或近乎完全的抑制。构建基因超表达植株和/或RNAi植株、基因敲除突变体,比较这些植株的表型和性状与野生型/正常植株的差异,就能明确目的基因对该性状的调节功能。
3、植物转基因技术
用于将外源基因导入目的植物,从而获取携带外源基因的转基因植物。包括基因枪法,农杆菌介导法等。农杆菌介导法包括将目的基因克隆入植物表达载体,表达载体对农杆菌的转化,携带表达载体的农杆菌对目的植物组织的感染,转基因植株的再生以及植株中基因转化和表达情况的检测分析等步骤。
4、植物抗病性检测分析技术
植物病原物包括真菌、卵菌、细菌、菌原体、病毒和线虫等多种类型。不同类型病原物的接种方法各不相同。对于真菌,能产生分生孢子的,通常以分生孢子悬浮液喷雾接种植物。不产生分生孢子的,则以菌丝块等接种植物。对于卵菌,一般先培养产生大量孢子囊,而后低温培养使之释放游动孢子,最后以游动孢子悬浮液接种植物。对于细菌,常以菌体悬浮液剪叶、针刺、注射、喷雾等法接种植物。对于病毒,常以提纯的病毒粒子或人工体外转录产物摩擦、注射、或通过昆虫等传播媒介接种植物。对于菌原体,常通过传播介体接种或者嫁接接种。对于线虫,常以一定数量的二龄幼虫接触植物根部茎基部或根围土壤中接种植物。多数情况下,接种后需要保持较高的相对湿度,合适的温度和光照条件。接种后按不同时间点连续观察病害发生症状,统计发病率和发病严重度,计算病情指数,采用RT-PCR检测病原物生物量。通过与感病对照植物发病情况的对比分析,明确目标植物的抗病性。
5、植物抗病育种技术
主要可以分为传统抗病育种和通过基因工程抗病育种两大类。传统抗病育种因为有天然遗传隔离现象使抗病资源可用范围受到显著限制,只能应用遗传关系较近的抗病资源,而且需要多次杂交和回交等,因此选育周期长,且需要大量人力物力。而基因工程育种方法是通过将外源的抗病调控基因通过农杆菌介导的方法等技术导入植物,使其获得原来不具有的抗病性。因此,基因工程育种方法打破了天然遗传隔离现象的限制,拓宽了抗病资源可用范围,而且具有操作相对简单方便、培育周期短、无需大量人工物力的特点。另外,可通过导入一个广谱抗病调控基因,或者多个不同抗病谱的基因,创制具有广谱抗病的品种。因此具有特别适宜培育广谱、持久抗病品种等优点。
技术实现要素:
本发明的目的是提供一个水稻(Oryza sativa)基因,是对水稻细菌性病害抗性的调控作用以及由此确定对该基因的命名OsDF1。本发明克隆的OsDF1基因的核苷酸序列如SEQ ID:1所示,该基因的开放阅读框(ORF)长1512bp,编码的蛋白由503个氨基酸组成,其序列如SEQ ID:2所示。该基因编码产物不包含任何已知功能的结构域。本发明克隆的序列与水稻品种日本晴的基因组注释的LOC_Os07g01060.3有很高的相似性,仅有5个碱基的区别:LOC_Os07g01060.3序列的G148替换为A;T407替换为G;T427替换为C;A1171替换为C;G1309替换为T。这些点突变导致氨基酸产生相应的变化:LOC_Os07g01060.3序列的V50替换为I;V136替换为G;C143替换为R;T391替换为P;V437替换为F。在本发明之前,该基因没有任何名称,也没有关于其功能的任何公开报告。本发明首次通过构建该基因的超表达转基因水稻及其抗病分析,阐明了该基因对水稻细菌性病害抗性的调控作用。结果显示,超表达转基因水稻植株广泛降低了对水稻细菌性条斑病(Xanthomonas oryzae pv.oryzicola,Xoc)和水稻白叶枯病菌(Xanthomonas oryzae pv.oryzae,Xoo)的抗性。本发明揭示了该基因对水稻细菌病害抗性的广谱负调控功能(具体见实施例1中的说明)。因此,本发明将该基因命名为Oryza sativa defense-related 1(简称OsDF1)。
本发明的另一个目的是提供所述的水稻OsDF1基因通过创制转基因水稻来获取抗病性得到改变的水稻材料中的应用,包括(1)在通过创制超表达OsDF1的转基因水稻纯合系来获得降低对水稻细菌性病害抗性的水稻材料中的应用(具体见实施例1中的说明);以及(2)在通过创制OsDF1-RNAi的转基因水稻纯合系来获得增高对水稻细菌性病害广谱抗性的水稻材料中的应用(具体见实施例2中的说明)。
1.水稻OsDF1基因在通过创制超表达OsDF1的转基因水稻纯合系来获得降低对水稻细菌性病害抗性的水稻材料中的应用。通过以下步骤实现:
(1)OsDF1基因超表达结构的构建和获取
将OsDF1基因开放阅读框(ORF)克隆入一个植物表达载体,使其受强启动子的驱使表达。
(2)转化OsDF1基因超表达结构的农杆菌的获取
将构建好的OsDF1基因超表达结构通过电击等方法转化对水稻具有强侵染能力的农杆菌菌株。
(3)超表达OsDF1的转基因水稻创制和获取
通过农杆菌介导法将OsDF1基因超表达结构导入水稻,获取转OsDF1基因超表达结构的水稻。
(4)超表达OsDF1的转基因水稻纯合系的获取
分别以抗生素抗性和OsDF1基因表达为检测指标,检测转基因植株后代的性状分离情况,获取后代性状不再分离的、并能稳定遗传的超表达OsDF1的转基因水稻纯合系。
(5)对细菌病害抗性下降的超表达OsDF1的转基因水稻纯合系筛选鉴定和获取
以超表达OsDF1的转基因水稻纯合系为材料,检测分析对各类水稻细菌病害的抗性,获取抗细菌病害能力下降的转OsDF1基因水稻。
2.水稻OsDF1基因在通过创制OsDF1-RNAi的转基因水稻纯合系来获得增高对水稻细菌性病害广谱抗性的水稻材料中的应用。通过以下步骤实现:
(1)OsDF1基因RNAi结构的构建和获取
将OsDF1基因的一个特异性序列片段克隆入中间表达载体pENTR,再将重组结构pENTR-OsDF1与RNAi载体(pANDA载体)进行LR酶反应,获取RNAi结构pANDA-OsDF1。
(2)转化OsDF1基因RNAi结构的农杆菌的获取
将OsDF1基因RNAi结构(pANDA-OsDF1)通过电击等方法转化对水稻具有强侵染能力的农杆菌菌株。
(3)转OsDF1基因RNAi结构水稻的创制和获取
通过农杆菌介导法将OsDF1基因RNAi结构导入水稻,获取转OsDF1基因RNAi结构的水稻。
(4)转OsDF1基因RNAi结构水稻纯合系的获取
分别以抗生素抗性和OsDF1基因表达为检测指标,检测转基因植株后代的性状分离情况,获取后代性状不再分离的、并能稳定遗传的转OsDF1基因RNAi结构的水稻纯合系。
(5)抗细菌病害的转OsDF1基因RNAi结构水稻纯合系的筛选鉴定和获取
以转OsDF1基因RNAi结构(pANDA-OsDF1)的水稻纯合系为材料,检测分析对各类细菌病原物所致病害的抗性,获取抗细菌病害的OsDF1基因RNAi水稻。
本发明的优点:(1)本发明提供的OsDF1基因是优质抗细菌病害调控基因资源,利用该基因获取的抗病材料具有抗病谱广等优点。水稻对细菌性条斑病菌(Xoc)和水稻白叶枯病菌(Xoo)的抗性机制有明显差异,因此,同时兼抗Xoc和Xoo的基因资源很少。另外,水稻对Xoc的抗性还没有显性主效的抗病基因(Resistance gene)被发现和鉴定,目前尚缺乏高抗的抗性品种和资源。本发明提供的OsDF1基因此前功能完全未知,本发明研究发现该基因兼具对Xoc和Xoo的负调控作用,可通过构建OsDF1-RNAi水稻创制和获取兼具对Xoc和Xoo广谱抗性的新材料。因此,OsDF1基因是一种适用于创制和选育广谱抗细菌病害的水稻新材料和新品种的全新基因资源。(2)获取抗病材料周期短。获取抗病植物材料和品种的方法主要有常规的传统育种方法和利用抗病调控基因的基因工程育种方法。传统育种方法具有可用抗病资源范围受天然遗传隔离限制,选育周期长,需要大量人工物力等缺点。而基因工程育种方法则具有可用抗病资源范围广、操作相对简单方便、培育周期短、无需大量人工物力、特别适宜培育广谱、持久、高抗病性品种等优点。本发明利用抗病调控基因OsDF1,采用基因工程方法,创制培育强烈抗细菌病害的水稻材料,具有周期短,选育快速等特点。
附图说明
图1为OsDF1超表达水稻纯合系及其亲本水稻叶片接种水稻细菌性条斑病菌后的症状和菌量检测分析结果比较图。OsDF1超表达水稻纯合系69-1及其亲本水稻叶片采用针筒浸润法接种水稻细菌性条斑病菌(Xoc)菌株oxy04和ROS105。左:接种Xoc菌株10天后的症状;右:接种后叶片内的Xoc菌量检测结果。结果表明,与亲本相比,OsDF1超表达水稻纯合系69-1形成更长的病斑,菌量也显著增加。表明OsDF1基因的超表达降低了对水稻细菌性条斑病的抗性,揭示OsDF1对水稻细菌性条斑病抗性起负调控作用。
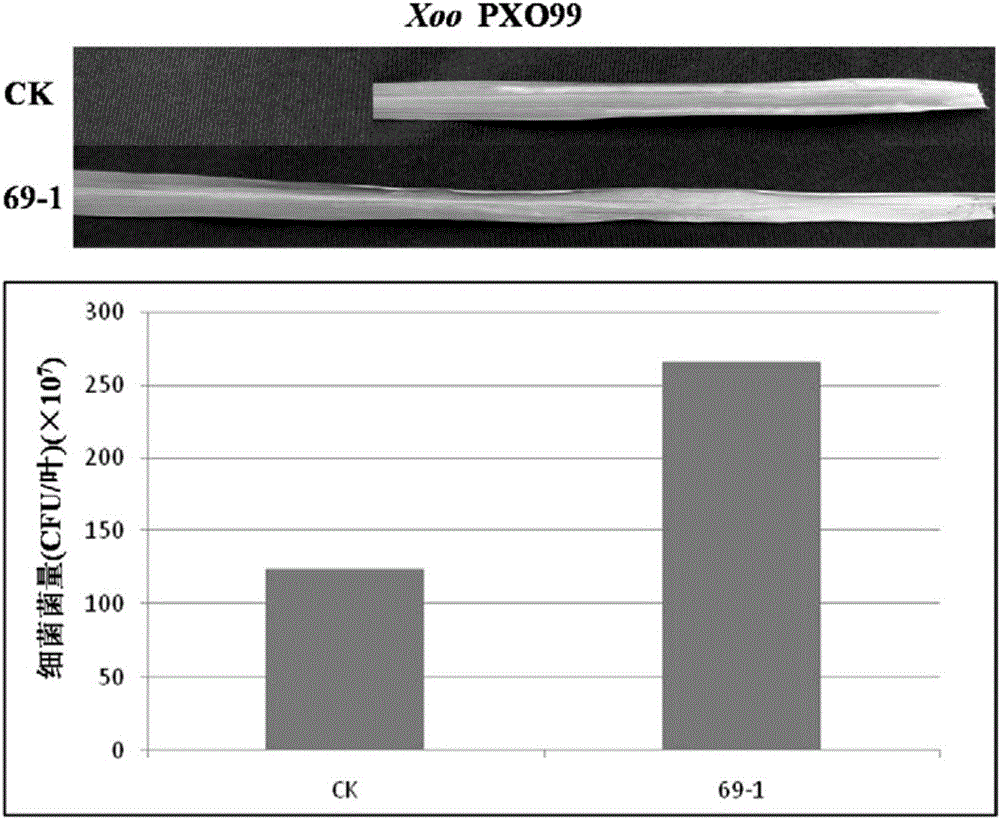
图2为OsDF1超表达水稻纯合系及其亲本水稻叶片接种水稻白叶枯病菌后的症状和菌量检测分析结果比较图。OsDF1超表达水稻纯合系69-1及其亲本水稻叶片采用剪叶法接种水稻白叶枯病菌(Xoo)菌株PXO99。上:接种Xoo菌株14天后的症状;下:接种后叶片内的Xoo菌量检测结果。结果表明,与亲本相比,OsDF1超表达水稻纯合系69-1形成更长的枯死病斑,菌量也显著增加。表明OsDF1基因的超表达降低了对水稻白叶枯病的抗性,揭示OsDF1对水稻白叶枯病抗性起负调控作用。
具体实施方式
本发明结合附图和实施例作进一步的说明。
实施例1
本发明克隆了一个水稻基因,首次通过构建超表达转基因水稻,阐明了该基因的广谱抗细菌调控功能,揭示了该基因对水稻细菌病害抗性具有广谱负调控功能。因此,本发明将该基因命名为Oryza sativa defense-related 1(简称OsDF1)。因为OsDF1基因的超表达导致水稻对细菌病害抗性的显著下降,因此,可以通过构建OsDF1基因的超表达水稻纯合系来创建获取对水稻细菌病害抗性下降的水稻新材料,用于基因功能分析等用途。OsDF1基因的克隆和功能分析、对水稻细菌病害抗性下降的水稻新材料创制和获取的主要步骤包括:
1)水稻OsDF1基因的克隆和保存
本发明提供的水稻OsDF1基因通过以下步骤克隆获得。先根据水稻基因组数据库中OsDF1序列设计了引物OsDF1-F(5’-caggcgcgcc atg tgc att atc ttt gct ggt-3’,斜体部分为AscⅠ酶切位点)(序列如SEQ ID:3所示),以及OsDF1-R2(5’-caggtacc cat gct ctg aaa atg ctg ctg-3’,斜体部分为KpnⅠ酶切位点)(序列如SEQ ID:4所示)。采用TRIZOL试剂提取水稻叶片总RNA,采用RT-PCR方法扩增获取OsDF1cDNA,通过1%琼脂糖凝胶电泳后割胶纯化回收PCR产物,连接pMD19-mT载体,热击转化大肠杆菌DH5α,在LB培养基中摇菌培养过夜,提取质粒,采用AscⅠ/KpnⅠ酶切的方法和以OsDF1-F/OsDF1-R2为引物对的PCR方法分别检验所提取的质粒是否包含OsDF1基因,最后送公司测序验证,从而成功克隆和获取OsDF1基因cDNA全长序列。OsDF1核苷酸序列如SEQ ID:1所示,该基因的开放阅读框(ORF)长1512bp,编码的蛋白由503个氨基酸组成,其序列如SEQ ID:2所示。该基因编码产物不包含任何已知功能的结构域。经过BLASTn分析发现,本发明克隆获得的OsDF1基因水稻品种日本晴的基因组注释的LOC_Os07g01060.3有很高的相似性,仅有5个碱基的区别:LOC_Os07g01060.3序列的G148替换为A;T407替换为G;T427替换为C;A1171替换为C;G1309替换为T。这些点突变导致氨基酸产生相应的变化:LOC_Os07g01060.3序列的V50替换为I;V136替换为G;C143替换为R;T391替换为P;V437替换为F。在本发明之前,该基因功能没有任何公开报告。
转化了携带有OsDF1基因序列的载体的大肠杆菌,保存于-80℃冰箱。因此,可随时通过活化菌株,提取质粒,通过PCR扩增和酶切,将OsDF1基因亚克隆至目的载体中,用于转基因等研究。
2)OsDF1基因超表达结构的构建和获取
对上述1)中获取的pMD19-OsDF1质粒以及植物超表达载体pCZD分别先进行Kpn I酶切、随后进行Asc I酶切,将酶切后的目的基因与同样酶切后的pCZD载体进行连接、连接产物进行大肠杆菌转化、氨苄抗生素培养基平板筛选、酶切和PCR鉴定等步骤获取OsDF1基因超表达结构pCZD-OsDF1。超表达载体pCZD以玉米Ubq启动子驱动目的基因的表达,同时携带HA标签,便于分子鉴定和基因功能研究。
3)转化OsDF1基因超表达结构pCZD-OsDF1的农杆菌的获取
将OsDF1基因超表达结构pCZD-OsDF1通过电击等方法转化对水稻具有强侵染力的农杆菌菌株,如EHAl05,在含链霉素和卡那霉素的YEP培养基上筛选转化子,再通过Asc I+Kpn I双酶切和PCR鉴定,获取携带OsDF1基因超表达结构pCZD-OsDF1的农杆菌。用于下一步水稻的遗传转化。
4)转OsDF1基因超表达结构pCZD-OsDF1水稻的创制和获取
通过农杆菌介导法将OsDF1基因超表达结构pCZD-OsDF1导入水稻。分为水稻愈伤组织的诱导、携带pANDA-OsDF1的农杆菌感染水稻愈伤组织、潮霉素抗性植株的再生和鉴定等几大步骤,最后获取再生的转pCZD-OsDF1的水稻T0代。具体操作步骤如下:
(i)水稻愈伤组织的诱导
种胚表面的消毒和清洗:取成熟完好的日本晴水稻种子,剥去种皮,留下完整的种胚。用70%乙醇溶液浸泡种胚1min,倒掉乙醇后用50%次氯酸钠溶液浸泡种胚,放在摇床上28℃,180rpm消毒40min。倒掉次氯酸钠溶液,用灭菌的ddH2O洗涤种胚至少10次,直至液体干净透明为止。用灭菌的滤纸风干种胚后,用镊子小心把种胚放入NB1固体培养基上,每个培养皿约30粒种子。之后用保鲜膜密封,置于培养箱中28℃暗培养。
愈伤组织的诱导:将种胚放在NB1上培养15天后,将分化出的愈伤组织转移到新鲜的NB2培养基上,在28℃黑暗条件下再培养10天。将健康亮黄的愈伤组织转移到NB3上培养大约10天。注意,为了提供充足营养,一个NB2板转成2个NB3板进行培养。
愈伤组织的继代培养:将健康的愈伤组织从NB3换至NB4上,在28℃黑暗条件下培养9天,此时的愈伤组织最适合农杆菌感染。
(ii)水稻愈伤组织的农杆菌感染
农杆菌的培养:将携带有OsDF1基因RNAi结构pANDA-OsDF1的根癌农杆菌EHA105菌株从-80℃中取出,在含链霉素和卡那霉素的LB平板上划线,置于28℃恒温箱内培养(约2d),长出菌落后挑取单菌落,分别接种于含相应抗生素的50mL YEP培养液中,27℃恒温摇床(180rpm)培养约48h至OD600为0.5-0.8,转入无菌离心管中,室温条件下5000×g离心10min,去掉上清液,菌体用25mL AAM-AS培养液重新悬浮清洗后,再在相同的条件下离心一次,最后用约50mL AAM-AS培养液重新悬浮菌体到OD600为0.05-0.1(约109个细胞/mL),置于冰上即可用于水稻的转化。
农杆菌侵染:选择生长健康带亮黄色的愈伤组织,用勺子小心地刮进无菌的的小培养皿中,然后将重悬好的农杆菌液倒入培养皿中,尽量使菌液浸没所有愈伤组织,保持浸泡约30min,期间不时地轻轻摇晃。之后用灭菌的胶头滴管将菌液尽可能多地吸出。
共培养:将侵染过的愈伤组织放入NB-AS培养基上22℃黑暗培养3d。
带菌愈伤组织在抗性筛选前的清洗:共培养3d后,将带菌的愈伤组织集中放到500mL无菌瓶中,用灭菌的蒸馏水清洗愈伤组织8~10次直到液体透明,然后加入200mL含Amp(200mg/mL)和Cef(300mg/mL)的ddH2O,将其放到摇床,180rpm、27℃恒温下摇动30min,然后用灭菌的胶头滴管将洗出液吸出,最后将清洗干净的愈伤转入NB-CHA培养基,在28℃黑暗下培养14d后用于抗性筛选。
(iii)潮霉素抗性植株的再生
抗性筛选培养:将愈伤组织分系转入含抗生素(Cef,300mg/mL;Hyg,50mg/mL)的NB-CH1筛选培养基上,在28℃黑暗下培养,进行抗生素抗性筛选;
继代培养:将NB-CH1上经抗性筛选再生的潮霉素抗性愈伤组织,以系的方式转入含抗生素(Cef,300mg/mL;Hyg,50mg/mL)的NB-CH2筛选培养基上,在28℃黑暗下继代培养一次,培养时间大约1周。
抗性愈伤组织的预分化培养:将具有抗潮霉素的愈伤组织以系的方式转入含抗生素(Hyg,50mg/mL)预分化培养基Pre-H上,在28℃黑暗下培养15d。
抗性愈伤组织的再分化培养:将预分化充分的抗性愈伤以系的方式转入含抗生素(Hyg,50mg/mL)再分化培养基R-50上,在27℃光条件下培养大约3周。
生根培养:待潮霉素抗性愈伤组织分化出小根和绿色小芽,且小根长到1cm以上进行生根培养。用镊子将变绿的抗性芽从分化培养基上挑出,转入到含有抗生素(Hyg,50mg/mL)的1/2MS生根培养基上进行生根培养。
土壤种植:等潮霉素抗性苗长到根系完全后,将T0代无菌小苗在27℃下开盖培养锻炼2d,然后移栽到水田取回的熟土中,置于温室中进行常规管理,最后收获得到T0种子。
5)转OsDF1基因超表达结构pCZD-OsDF1的水稻纯合系的筛选鉴定和获取
分别以潮霉素抗性和OsDF1基因表达为检测指标,检测转基因植株后代的性状分离情况。潮霉素抗性筛选在含潮霉素的平板上针对水稻种子开展进行,观察能否在潮霉素抗性平板上正常生长成健康小苗。基因表达采用实时荧光定量PCR等方法进行检测。获取后代性状不再分离的、并能稳定遗传的转OsDF1基因超表达结构pCZD-OsDF1的水稻纯合系。这些水稻纯合系在潮霉素抗性平板上全部能正常生长成健康小苗、且OsDF1基因表达水平显著高于转空载体的对照。
6)OsDF1基因超表达水稻纯合系的抗病性检测分析
以5)中获取的OsDF1基因超表达水稻纯合系为材料,检测分析其对水稻细菌病原物所致病害的抗性,从而明确OsDF1基因对水稻细菌病害抗性的调控作用,为利用该基因创建和获取抗细菌病害水稻奠定基础。
检测分析的病原物包括:水稻细菌性条斑病菌(Xanthomonas oryzae pv.oryzicola,Xoc)菌株oxy04和ROS105、水稻白叶枯病菌(Xanthomonas oryzae pv.oryzae,Xoo)菌株PXO99。对于Xoc,采用浸润法接种。先摇菌制成浓度为OD600=1.0的Xoc细菌悬浮液,再以无菌一次性针筒浸润水稻叶片。对于Xoo,采用剪叶法接种。先摇菌制成浓度为OD600=1.0的Xoo细菌悬浮液,再以无菌剪刀蘸取菌液,在离叶尖3cm处剪叶,置于大塑料筐中覆膜保湿48h。
接种结果显示,亲本对照水稻叶片在浸润接种Xoc菌株oxy04和ROS105后10天,分别形成长度达10.1mm和6.7mm的沿维管束扩展的水渍状病斑,上面还形成菌脓。OsDF1基因超表达水稻纯合系69-1叶片在浸润接种这两个Xoc菌株后,形成的水渍状病斑平均长达28.8mm和9.7mm,为对照的2.9倍和1.5倍。而且接种oxy04菌株的69-1叶片形成的菌脓显著多于对照叶片(图1左)。菌量检测分析结果显示,亲本对照水稻叶片在接种Xoc菌株oxy04和ROS105的发病区域菌量分别为9.42×108cfu/叶和2.80×108cfu/叶。而OsDF1超表达水稻纯合系69-1叶片的菌量平均高达2.95×109cfu/叶和5.13×108cfu/叶,分别为亲本对照的3.13倍和1.83倍(图1右)。对水稻白叶枯病菌Xoo菌株PXO99的类似分析结果显示,亲本对照水稻叶片在剪叶接种后14天,形成长度达16.2cm的枯死病斑,主要沿叶片两侧扩展。而OsDF1基因超表达水稻纯合系69-1叶片则形成了平均长达23.6cm的枯死病斑,长度为对照的1.5倍,而且枯死病斑是整叶向前扩展(图2上)。菌量检测分析结果显示,亲本对照水稻叶片的发病区域菌量分别为1.24×109cfu/叶。而OsDF1超表达水稻纯合系69-1叶片的菌量平均高达2.65×109cfu/叶,为亲本对照的2.14倍(图2下)。
这些结果表明,OsDF1超表达水稻纯合系69-1对Xoc菌株oxy04和ROS105、Xoo菌株PXO99的抗性显著低于亲本对照。OsDF1基因的超表达导致水稻对这些菌株抗性的显著下降,因此,OsDF1对水稻抗细菌性条斑病和白叶枯病均起负调控作用。可以通过构建OsDF1-RNAi水稻纯合系来创建获取高抗水稻细菌性条斑病的水稻新材料和新品种。
实施例2
根据如上所述的本发明阐明的水稻基因OsDF1的抗细菌负调控功能,建立了一套利用构建该基因的RNAi转基因水稻、采用基因工程技术创制和获取广谱抗水稻细菌性病害水稻新材料的技术体系。主要步骤包括:
(1)OsDF1基因RNAi结构的构建和获取
根据本发明克隆的OsDF1序列设计引物OsDF1-F2(5’-ttggatcc gaa tct ttg gtt gag aga agc-3’,斜体部分为Bam HI酶切位点)(序列如SEQ ID:5所示),以及OsDF1-R3(5’-ttctcgag cat gct ctg aaa atg ctg ctg-3’,斜体部分为XhoI酶切位点)(序列如SEQ ID:6所示)。以实施例1中的1)中获取的pMD19-OsDF1质粒为模板,OsDF1-F2/OsDF1-R3为引物对,通过PCR扩增获取长为300bp的OsDF1片段,然后通过Bam HI/XhoI双酶切、连接、转化、卡那霉素培养基平板筛选、酶切和PCR鉴定等步骤获取亚克隆了300bp OsDF1片段的中间表达载体pENTR(pENTR-OsDF1)。再将重组结构pENTR-OsDF1与RNAi载体(带有水稻ubi启动子、GUS Linker序列和T-NOS终止子的pANDA载体)进行LR酶反应过夜,加蛋白激酶K后37℃反应10min以充分终止反应,反应产物转化大肠杆菌后用含卡那霉素的培养基筛选阳性克隆,然后用SacI+KpnI双酶切和PCR鉴定是否在pANDA载体的GUS Linker两端正反双向插入了300bp的OsDF1片段,从而获取RNAi结构pANDA-OsDF1。
(2)转化OsDF1基因RNAi结构的农杆菌的获取
将OsDF1基因RNAi结构(pANDA-OsDF1)通过电击等方法转化对水稻具有强侵染能力的农杆菌菌株,如EHAl05,在含链霉素和卡那霉素的YEP培养基上筛选转化子,再通过SacI+KpnI双酶切和PCR鉴定,获取携带OsDF1基因RNAi结构pANDA-OsDF1的农杆菌。用于下一步水稻的遗传转化。
(3)转OsDF1基因RNAi结构水稻的创制和获取
通过农杆菌介导法将OsDF1基因RNAi结构pANDA-OsDF1导入水稻。主要步骤包括水稻愈伤组织的诱导、携带pANDA-OsASR2的农杆菌感染水稻愈伤组织、潮霉素抗性植株的再生和鉴定等,最后获取再生的转pANDA-OsDF1的水稻T0代。具体操作步骤同实施例1中的4)中如述。
(4)转OsDF1基因RNAi结构水稻纯合系的获取
分别以抗生素抗性和OsDF1基因表达为检测指标,检测转基因植株后代的性状分离情况。潮霉素抗性筛选在含潮霉素的平板上针对水稻种子开展进行,观察能否在潮霉素抗性平板上正常生长成健康小苗。基因表达采用实时荧光定量PCR等方法进行检测。获取后代性状不再分离的、并能稳定遗传的转OsDF1基因RNAi结构pANDA-OsDF1的水稻纯合系。这些水稻纯合系在潮霉素抗性平板上全部能正常生长成健康小苗、且OsDF1基因表达水平显著低于转空载体的对照。
(5)广谱抗细菌病害的转OsDF1基因RNAi结构水稻纯合系的筛选鉴定和获取
以转OsDF1基因RNAi结构(pANDA-OsDF1)的水稻纯合系为材料,检测分析对各类细菌病原物所致病害的抗性,检测分析的病原物包括:水稻细菌性条斑病菌(Xanthomonas oryzae pv.oryzicola,Xoc)、水稻白叶枯病菌(Xanthomonas oryzae pv.oryzae,Xoo)等。接种方法和抗病性评价同实施例1)中的6)中所述。
通过上述接种分析和抗病评价,筛选和获取对Xoc和Xoo多个菌株均表现出抗性的、广谱抗细菌病害的OsDF1基因RNAi水稻。
本发明结合图1和图2的结果,首次揭示了OsDF1对水稻细菌性病害抗性起广谱的负调控作用。
<110> 浙江大学
<120> 水稻基因OsDF1及抗病调控功能的应用
<160> 6
<210> 1
<211> 1512
<212> DNA
<213> 水稻(Oryza sativa)
<220>
<221> CDS
<222> (1)…(1512)
<400> 1
atgtgcatta tctttgctgg tgatgatggt cattcggagc aactagctct cctgaacaat 60
gaccatgaag tttcagaagt ttgtgttgaa gaaatttcag ctgataatac aggacgatct 120
ttcctcatca ggatttcaga atctaaaatt ttttactatt ggtgtgctga gaagtcaaag 180
aaacacggga tggaccttct tgcaaagatg aaaaatctac tgcagggaag gccaacactc 240
tctgatctca caggcatctc agattcacga ctggatgctt ttgccactca tctacacgct 300
tatcttgttg catcaagtat tggagatgtt aaatcgctgg gatcacttaa tgacttcctg 360
ggcgcttcaa gcccacaaga tcaatattta cagccctcat cagttggttc caagtcttca 420
cgcttccgca cctctgcagc taatgcagca aaagcaagtt ctgtctacca aactagtctg 480
agtcccagat gtggtgcttt taaagatgga gtgccaagga tgtcgtgtgc aaagattgct 540
ggaagagaca agctgaagcg acgtggggac tggctgagct catcaactgg tcctgatgac 600
gcaaatcttt tgacaccgaa gattgttagc tctgattctg ccagtgagaa gtgtggtggg 660
gactgttctg aaaacagtgc taattcacct cctctagact tgcctctttc atttcccttg 720
ttgccatctc tgtttcctct tgcgactcaa tatccacttc ctaaggattc tacagagcaa 780
ccatttaagc cttactattg ctggtgccca ccatgcccat cttctctgca gtacagtgta 840
acccctctgc atatgccagt tacatctgta gaaccactgc ccttgccgcc tttgagttct 900
ctgctatcaa atgatcagcc gccgacttca acagtttctg caaagatgga tacaactgat 960
ctcccgtcac ttaatcttcc atcgatactg cgtgatcctt tacttcacct gccgcttcct 1020
acttcaccac ttgtatcctt gcatggttca caagttccaa cattcacacc attgatgtct 1080
gaccccattg tgcatgtccc ggtcattgat gtgtgttcct ctggccaggc ttacctggtg 1140
agttgcgggc cttctatgtc tgcgactgtt cccctgctcc ctagcttgaa gcccctgatt 1200
ccagaaacag aatctttggt tgagagaagc gctagggaaa cactaatgag gcttatagcc 1260
tcaacaccat ctgcaagtaa tccccagctg gtgaacattc tccctgcatt ccttactgac 1320
gtgcctgaaa tgaatgtgag gaaacatctt ggtgtccatc caggcgacag gctaagctca 1380
tcttgtagcg tcgatgtgat tggacctggg tttgccgtca cagaggatga tgcatctgtt 1440
ggagatgggg ctcacgcaac ttttgcggaa tatgatgata tcggcgatca gcagcatttt 1500
cagagcatgt ag 1512
<210> 2
<211> 503
<212> PRT
<213> 水稻(Oryza sativa)
<400> 2
Met Cys Ile Ile Phe Ala Gly Asp Asp Gly His Ser Glu Gln Leu Ala
1 5 10 15
Leu Leu Asn Asn Asp His Glu Val Ser Glu Val Cys Val Glu Glu Ile
20 25 30
Ser Ala Asp Asn Thr Gly Arg Ser Phe Leu Ile Arg Ile Ser Glu Ser
35 40 45
Lys Ile Phe Tyr Tyr Trp Cys Ala Glu Lys Ser Lys Lys His Gly Met
50 55 60
Asp Leu Leu Ala Lys Met Lys Asn Leu Leu Gln Gly Arg Pro Thr Leu
65 70 75 80
Ser Asp Leu Thr Gly Ile Ser Asp Ser Arg Leu Asp Ala Phe Ala Thr
85 90 95
His Leu His Ala Tyr Leu Val Ala Ser Ser Ile Gly Asp Val Lys Ser
100 105 110
Leu Gly Ser Leu Asn Asp Phe Leu Gly Ala Ser Ser Pro Gln Asp Gln
115 120 125
Tyr Leu Gln Pro Ser Ser Val Gly Ser Lys Ser Ser Arg Phe Arg Thr
130 135 140
Ser Ala Ala Asn Ala Ala Lys Ala Ser Ser Val Tyr Gln Thr Ser Leu
145 150 155 160
Ser Pro Arg Cys Gly Ala Phe Lys Asp Gly Val Pro Arg Met Ser Cys
165 170 175
Ala Lys Ile Ala Gly Arg Asp Lys Leu Lys Arg Arg Gly Asp Trp Leu
180 185 190
Ser Ser Ser Thr Gly Pro Asp Asp Ala Asn Leu Leu Thr Pro Lys Ile
195 200 205
Val Ser Ser Asp Ser Ala Ser Glu Lys Cys Gly Gly Asp Cys Ser Glu
210 215 220
Asn Ser Ala Asn Ser Pro Pro Leu Asp Leu Pro Leu Ser Phe Pro Leu
225 230 235 240
Leu Pro Ser Leu Phe Pro Leu Ala Thr Gln Tyr Pro Leu Pro Lys Asp
245 250 255
Ser Thr Glu Gln Pro Phe Lys Pro Tyr Tyr Cys Trp Cys Pro Pro Cys
260 265 270
Pro Ser Ser Leu Gln Tyr Ser Val Thr Pro Leu His Met Pro Val Thr
275 280 285
Ser Val Glu Pro Leu Pro Leu Pro Pro Leu Ser Ser Leu Leu Ser Asn
290 295 300
Asp Gln Pro Pro Thr Ser Thr Val Ser Ala Lys Met Asp Thr Thr Asp
305 310 315 320
Leu Pro Ser Leu Asn Leu Pro Ser Ile Leu Arg Asp Pro Leu Leu His
325 330 335
Leu Pro Leu Pro Thr Ser Pro Leu Val Ser Leu His Gly Ser Gln Val
340 345 350
Pro Thr Phe Thr Pro Leu Met Ser Asp Pro Ile Val His Val Pro Val
355 360 365
Ile Asp Val Cys Ser Ser Gly Gln Ala Tyr Leu Val Ser Cys Gly Pro
370 375 380
Ser Met Ser Ala Thr Val Pro Leu Leu Pro Ser Leu Lys Pro Leu Ile
385 390 395 400
Pro Glu Thr Glu Ser Leu Val Glu Arg Ser Ala Arg Glu Thr Leu Met
405 410 415
Arg Leu Ile Ala Ser Thr Pro Ser Ala Ser Asn Pro Gln Leu Val Asn
420 425 430
Ile Leu Pro Ala Phe Leu Thr Asp Val Pro Glu Met Asn Val Arg Lys
435 440 445
His Leu Gly Val His Pro Gly Asp Arg Leu Ser Ser Ser Cys Ser Val
450 455 460
Asp Val Ile Gly Pro Gly Phe Ala Val Thr Glu Asp Asp Ala Ser Val
465 470 475 480
Gly Asp Gly Ala His Ala Thr Phe Ala Glu Tyr Asp Asp Ile Gly Asp
485 490 495
Gln Gln His Phe Gln Ser Met
500
<210> 3
<211> 31
<212> DNA
<213> 人工序列
<220>
<223> 根据水稻基因组数据库提供的水稻基因序列设计和人工合成,用作引物
<400> 3
caggcgcgcc atg tgc att atc ttt gct ggt
<210> 4
<211> 29
<212> DNA
<213> 人工序列
<220>
<223> 根据水稻基因组数据库提供的水稻基因序列设计和人工合成,用作引物
<400> 4
caggtacc cat gct ctg aaa atg ctg ctg
<210> 5
<211> 29
<212> DNA
<213> 人工序列
<220>
<223> 根据克隆的水稻基因序列设计和人工合成,用作引物
<400> 5
ttggatcc gaa tct ttg gtt gag aga agc
<210> 6
<211> 29
<212> DNA
<213> 人工序列
<220>
<223> 根据克隆的水稻基因序列设计和人工合成,用作引物
<400> 6
ttctcgag cat gct ctg aaa atg ctg ctg
- 还没有人留言评论。精彩留言会获得点赞!