一种制备C1‑膦酰化四氢异喹啉衍生物的方法与流程
本发明属于有机化学领域,涉及一种四氢异喹啉衍生物,具体来说是一种制备c1-膦酰化四氢异喹啉衍生物的方法。
背景技术:
过去的几十年中,在有机化学和药物化学的研究中,科学工作者对α-氨基膦酸酯以及其衍生物表现出相当大的兴趣,这是因为它们是天然或非天然的α-氨基羧酸的功能性替代物。它有着广阔的应用前景,这归因于它特殊的结构特点和在农业化学品和药物中丰富的生物多样性,像除草剂、植物病毒、杀菌剂、酶抑制剂和催化抗体活性剂等。在这些α-氨基膦酸酯中,c1-膦酰化四氢异喹啉类物质作为α-氨基酸类似物已经引起化学家的显著关注。它既是α-氨基膦酸酯又是生物碱类物质,含有潜在生物活性的四氢异喹啉的部分,从而可能表现出有趣的生物学活性。目前,关于c1-膦酰化四氢异喹啉化合物的报道几乎都需要化学计量的氧化剂来促进反应,而且首先通过过渡金属催化n-未保护的四氢异喹啉来准备n-保护的四氢异喹啉,底物范围也局限于n-芳基取代的四氢异喹啉。因此,一种高效的合成c1-膦酰化四氢异喹啉化合物的方法是具有很大价值的。
技术实现要素:
针对上述技术问题,本发明提供了一种制备c1-膦酰化四氢异喹啉衍生物的方法,所述的这种制备c1-膦酰化四氢异喹啉衍生物的方法要解决现有技术中的制备c1-膦酰化四氢异喹啉衍生物的方法工艺复杂的技术问题。
本发明提供了一种制备c1-膦酰化四氢异喹啉衍生物的方法,包括如下步骤:
1)称取银催化剂、无取代基或带取代基的四氢异喹啉、无取代基或带取代基的苯甲醛、亚磷酸三酯化合物,所述的带取代基的四氢异喹啉为7-硝基-1,2,3,4-四氢异喹啉、6,7-二甲氧基-1,2,3,4-四氢异喹啉中、或者6-溴-1,2,3,4-四氢异喹啉中的任意一种;所述的带取代基的苯甲醛为2-氯苯甲醛、2-溴苯甲醛、2-碘苯甲醛、3-氯苯甲醛、4-氯苯甲醛、4-氟苯甲醛、4-溴苯甲醛、2,4-二氯苯甲醛、2-溴-4-氟-苯甲醛、2-溴-5-氟-苯甲醛、2-溴-6-氟-苯甲醛、2-溴-5-氯-苯甲醛、3-硝基苯甲醛、对氰基苯甲醛、4-甲氧基苯甲醛、对甲基苯甲醛、或者对乙基苯甲醛中的任意一种;所述的亚磷酸三酯为亚磷酸三甲酯、或者亚磷酸三乙酯中的任意一种;所述无取代基或带取代基的四氢异喹啉、无取代基或带取代基的苯甲醛、亚磷酸三酯的摩尔比为1~1.2:1~1.2:1~1.2,所述的银催化剂的摩尔数为无取代基或带取代基四氢异喹啉摩尔数的5%~10%;
2)在一个反应容器中加入银催化剂、活化4å分子筛,所述的4å分子筛与四氢异喹啉的物料比为100g:0.2~0.4mol,氮气置换后加入无取代基或带取代基四氢异喹啉、无取代基或带取代基苯甲醛、亚磷酸三酯,然后加入有机溶剂,加入完毕后在80℃~120℃下,反应6h~12h,反应进程用薄层色谱进行跟踪;
3)反应结束后,将反应液直接浓缩,然后进行柱层析分离,得到最终产物c1-膦酰化四氢异喹啉衍生物。
进一步的,所述的银催化剂为agoac、agno3、或者ag2co3中的任意一种。
进一步的,所述的有机溶剂为1,4-dioxane、四氢呋喃、甲苯中的任意一种。
进一步的,步骤2)中,所述的有机溶剂的加入量与四氢异喹啉的比值为1l:0.3mol。
进一步的,步骤2)中,所述的4å分子筛与四氢异喹啉的物料比为100g:0.3mol,
本发明的反应方程式如下描述:
本发明采用四氢异喹啉、苯甲醛和亚磷酸酯一步反应法,得到带有不同取代基的膦酰化的化合物。反应在金属银催化剂的催化下,氮气保护下,有机溶剂1,4-dioxane中加热得到膦酰化产物。
本发明的取代基:r1主要是甲氧基、硝基等吸电子基;r2主要有甲基、乙基、甲氧基、氟、氯、溴、碘、硝基、对氰基等供电子基和吸电子基;r3主要是甲基、乙基等供电子基。
本发明和已有技术相比,其技术进步是显著的。本发明采用了“一锅法”制备c1-膦酰化四氢异喹啉衍生物,后处理简单,具有较好的工业化应用前景。
附图说明
图1为(2-苄基-1,2,3,4-四氢异喹啉-1-基)-膦酸二甲酯的核磁共振氢谱。
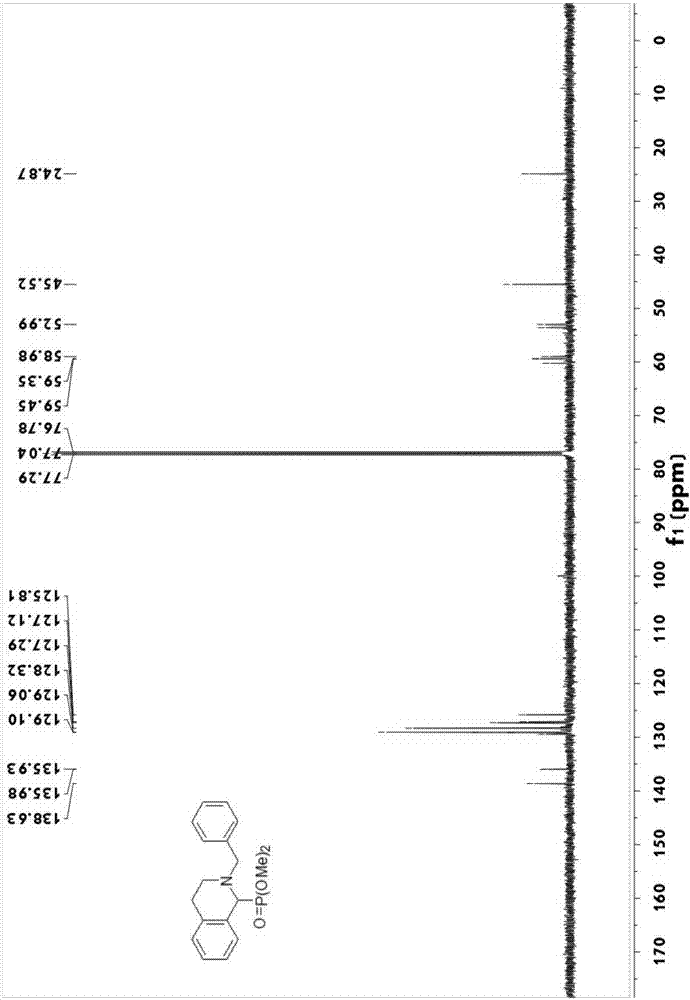
图2为(2-苄基-1,2,3,4-四氢异喹啉-1-基)-膦酸二甲酯的核磁共振碳谱。
图3为(2-苄基-1,2,3,4-四氢异喹啉-1-基)-膦酸二甲酯的核磁共振磷谱。
具体实施方式
下面通过实施例对本发明进一步阐述,但并不限制本发明。
实施例1
在10ml的反应管中加入agoac催化剂10mg,活化4å分子筛100mg,氮气置换后将四氢异喹啉40mg、苯甲醛36μl和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物(2-苄基-1,2,3,4-四氢-异喹啉-1-基)-膦酸二甲酯,产率为85%。
1hnmr(500mhz,cdcl3):δ7.37(d,j=7.2hz,2h),7.32(t,j=7.4hz,2h),7.27(d,j=7.2hz,2h),7.22–7.13(m,3h),4.19(d,j=21.8hz,1h),3.92(d,j=13.2hz,1h),3.84(d,j=13.6hz,1h),3.67(d,j=10.4hz,3h),3.64(d,j=10.5hz,3h),2.97–2.91(m,1h),2.88–2.84(m,1h),2.72–2.68(m,1h);13cnmr(125mhz,cdcl3):δ138.63,135.96(d,jc-p=6.0hz),129.44,129.12,129.10(overlapped),129.06,128.32,127.29,127.11(d,jc-p=3.5hz),125.80(d,jc-p=3.2hz),59.61(d,jc-p=158.0hz),59.40(d,jc-p=12.9hz),53.57(d,jc-p=7.5hz),53.02(d,jc-p=7.4hz),45.52,24.87;31pnmr(202mhz,cdcl3):δ25.54.
实施例2
在10ml的反应管中加入agoac催化剂5mg,活化4å分子筛100mg,抽真空充氮气处理后将四氢异喹啉40mg、2-氯苯甲醛40μl和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物[2-(2-氯-苄基)-1,2,3,4-四氢异喹啉-1-基]-膦酸二甲酯,产率为87%。
1hnmr(500mhz,cdcl3):δ7.55(d,j=7.3hz,1h),7.35(d,j=7.7hz,1h),7.29(d,j=7.3hz,1h),7.24–7.14(m,5h),4.22(d,j=22.0hz,1h),4.02(d,j=12.9hz,1h),3.93(d,j=14.2hz,1h),3.74–3.67(m,1h),3.65(d,j=10.6hz,3h),3.63(d,j=10.7hz,3h),3.07–2.96(m,1h),2.95–2.89(m,1h),2.76–2.69(m,1h);13cnmr(125mhz,cdcl3):δ134.39,130.76,129.50,129.20(d,jc-p=2.5hz),129.06(d,jc-p=4.1hz,),128.43,127.22,126.77,125.84(d,jc-p=2.7hz),59.89(d,jc-p=157.6hz),56.18(d,jc-p=10.4hz),53.68(d,jc-p=7.0hz),52.95(d,jc-p=7.0hz),45.75,24.82;31pnmr(202mhz,cdcl3):δ25.46.
实施例3
在10ml的反应管中加入agoac催化剂5mg,活化4å分子筛100mg,氮气置换后将四氢异喹啉40mg、3-氯苯甲醛40μl和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物[2-(3-氯-苄基)-1,2,3,4-四氢异喹啉-1-基]-膦酸二甲酯,产率为89%。
1hnmr(500mhz,cdcl3):δ7.44(s,1h),7.26(d,j=19.2hz,4h),7.22–7.11(m,3h),4.14(d,j=21.5hz,1h),3.90(d,j=13.5hz,1h),3.81(d,j=13.4hz,1h),3.69(d,j=10.4hz,3h),3.65(d,j=10.6hz,3h),3.62(d,j=4.9hz,1h),2.97–2.89(m,1h),2.86–2.81(m,1h),2.75–2.68(m,1h);13cnmr(125mhz,cdcl3):δ140.91,135.80(d,jc-p=5.7hz),134.28,129.56,129.20,129.14(d,jc-p=2.1hz,overlapped),129.08(d,jc-p=4.1hz,overlapped),128.99,127.46,127.22(d,jc-p=3.6hz),126.98,125.87(d,jc-p=3.0hz),59.63(d,jc-p=163.3hz),58.89,53.51(d,jc-p=7.2hz),53.12(d,jc-p=7.3hz),45.71,25.00;31pnmr(202mhz,cdcl3):δ25.31.
实施例4
在10ml的反应管中加入agoac催化剂5mg,活化4å分子筛100mg,氮气置换后将四氢异喹啉40mg、4-氯苯甲醛40μl和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物[2-(4-氯-苄基)-1,2,3,4-四氢异喹啉-1-基]-膦酸二甲酯,产率为78%。
1hnmr(500mhz,cdcl3):δ7.31(q,j=8.4hz,4h),7.22–7.12(m,4h),4.15(d,j=21.1hz,1h),3.90(d,j=13.4hz,1h),3.80(d,j=12.6hz,1h),3.68(d,j=10.5hz,3h),3.64(d,j=10.5hz,3h),3.62–2.56(m,1h),2.96–2.87(m,1h),2.83–2.76(m,1h),2.75–2.67(m,1h);13cnmr(125mhz,cdcl3):δ137.24,135.87(d,jc-p=6.1hz),132.97,130.29,129.35,129.10(d,jc-p=2.6hz),129.02(d,jc-p=4.2hz),128.47,127.19(d,jc-p=3.5hz),125.85(d,jc-p=3.0hz),59.76(d,jc-p=157.6hz),58.82(d,jc-p=11.8hz),53.45(d,jc-p=7.4hz),53.11(d,jc-p=7.2hz),45.58,25.17;31pnmr(202mhz,cdcl3):δ25.35.
实施例5
在10ml的反应管中加入agoac催化剂5mg,活化4å分子筛100mg,氮气置换三次后将四氢异喹啉40mg、2-溴苯甲醛42μl和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物[2-(2-溴-苄基)-1,2,3,4-四氢异喹啉-1-基]-膦酸二甲酯,产率为82%。
1hnmr(500mhz,cdcl3):δ7.59–7.50(m,2h),7.33–7.28(m,2h),7.24–7.11(m,4h),4.22(d,j=21.9hz,1h),4.01(d,j=14.0hz,1h),3.92(d,j=14.1hz,1h),3.79(d,j=11.2hz,1h),3.65(d,j=10.7hz,3h),3.63(d,j=10.8hz,3h),3.05–2.91(m,2h),2.74(d,j=15.7hz,1h);13cnmr(125mhz,cdcl3):δ137.91,135.78(d,jc-p=3.2hz),132.80,130.82,129.36(d,jc-p=4.6hz,),129.21(d,jc-p=2.6hz),129.06(d,jc-p=4.2hz),128.69,127.38,127.21(d,jc-p=3.3hz),125.82(d,jc-p=2.9hz),124.68,59.86(d,jc-p=156.4hz),58.73(d,jc-p=12.5hz),53.65(d,jc-p=7.4hz),52.93(d,jc-p=7.4hz),45.75,24.92;31pnmr(202mhz,cdcl3):δ25.51.
实施例6
在10ml的反应管中加入agoac催化剂5mg,活化4å分子筛100mg,氮气置换后将四氢异喹啉40mg、2-碘苯甲醛83mg和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物[2-(2-碘-苄基)-1,2,3,4-四氢异喹啉-1-基]-膦酸二甲酯,产率为81%。
1hnmr(500mhz,cdcl3):δ7.83(d,j=7.8hz,1h),7.49(s,1h),7.37–7.28(m,2h),7.25–7.14(m,3h),6.97(t,j=7.1hz,1h),4.22(d,j=21.7hz,1h),3.90(q,j=14.2hz,2h),3.75–3.67(m,1h),3.64(d,j=10.5hz,3h),3.62(d,j=10.7hz,3h),3.05–2.94(m,2h),2.74(d,j=15.2hz,1h);13cnmr(125mhz,cdcl3):δ140.81,139.54,135.75(d,jc-p=4.2hz),130.36,129.23(d,jc-p=2.3hz),129.07(d,jc-p=4.1hz),128.96,128.19,127.22(d,jc-p=2.7hz),125.80(d,jc-p=2.7hz),100.53,63.35(d,jc-p=12.2hz),59.65(d,jc-p=154.8hz),53.65(d,jc-p=7.3hz),52.92(d,jc-p=7.0hz),45.74,25.02;31pnmr(202mhz,cdcl3):δ25.69.
实施例7
在10ml的反应管中加入agoac催化剂5mg,活化4å分子筛100mg,氮气置换后将四氢异喹啉40mg、4-氟苯甲醛39μl和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物[2-(4-氟-苄基)-1,2,3,4-四氢异喹啉-1-基]-膦酸二甲酯,产率为84%。
1hnmr(500mhz,cdcl3):δ7.34(q,j=7.8hz,2h),7.25(s,1h),7.23–7.12(m,3h),7.01(t,j=8.5hz,1h),4.16(d,j=21.3hz,1h),3.90(d,j=13.1hz,1h),3.81(d,j=13.0hz,1h),3.68(d,j=10.5hz,3h),3.64(d,j=10.5hz,3h),3.62–3.59(m,1h),2.96–2.89(m,1h),2.86–2.80(m,1h),2.75–2.67(m,1h);13cnmr(125mhz,cdcl3):δ162.16(d,jc-f=245.3hz),135.87(d,jc-p=5.7hz),134.25(d,jc-f=1.7hz),130.54(d,jc-f=8.0hz),129.27,129.10(d,jc-p=2.6hz),129.03(d,jc-p=4.3hz),127.20(d,jc-p=3.5hz),125.85(d,jc-p=2.8hz),115.13(d,jc-f=21.2hz),59.55(d,jc-p=158.0hz),58.68(d,jc-p=12.3hz),53.51(d,jc-p=7.3hz),53.11(d,jc-p=7.4hz),45.53,25.03;31pnmr(202mhz,cdcl3):δ25.31.
实施例8
在10ml的反应管中加入agoac催化剂5mg,活化4å分子筛100mg,氮气置换后将四氢异喹啉40mg、4-溴苯甲醛67mg和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物[2-(4-溴-苄基)-1,2,3,4-四氢异喹啉-1-基]-膦酸二甲酯,产率为80%。
1hnmr(500mhz,cdcl3):δ7.45(d,j=8.2hz,2h),7.28(s,1h),7.26–7.24(m,2h),7.23–7.12(m,3h),4.15(d,j=21.0hz,1h),3.89(d,j=13.4hz,1h),3.79(d,j=12.7hz,1h),3.68(d,j=10.5hz,3h),3.64(d,j=10.5hz,3h),3.62–3.58(m,1h),2.96–2.88(m,1h),2.84–2.78(m,1h),2.72(dd,j=16.3,3.6hz,1h);13cnmr(125mhz,cdcl3):δ137.75,135.85(d,jc-p=6.0hz),131.44,130.65,129.33,129.09(d,jc-p=2.7hz),129.01(d,jc-p=4.2hz),127.20(d,jc-p=3.5hz),125.85(d,jc-p=3.0hz),121.08,59.79(d,jc-p=158.1hz),58.88(d,jc-p=12.0hz),53.44(d,jc-p=7.4hz),53.11(d,jc-p=7.3hz),45.61,25.20;31pnmr(202mhz,cdcl3):δ25.32.
实施例9
在10ml的反应管中加入agoac催化剂5mg,活化4å分子筛100mg,氮气置换后将四氢异喹啉40mg、2,4-二氯苯甲醛63mg和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物[2-(2,4-二氯-苄基)-1,2,3,4-四氢异喹啉-1-基]-膦酸二甲酯,产率为88%。
1hnmr(500mhz,cdcl3):δ7.54(d,j=8.3hz,1h),7.36(d,j=1.8hz,1h),7.30–7.26(m,1h),7.26–7.13(m,4h),4.18(d,j=21.2hz,1h),3.98(d,j=14.5hz,1h),3.91(d,j=14.5hz,1h),3.78(d,j=11.2hz,1h),3.66(d,j=10.5hz,3h),3.63(d,j=10.6hz,3h),2.96(m,1h),2.89–2.83(m,1h),2.74(m,1h);13cnmr(126mhz,cdcl3):δ135.73(d,jc-p=5.8hz),135.05,134.82,133.35,131.46,129.37,129.25,129.20,128.98(d,jc-p=4.2hz),127.28(d,jc-p=3.6hz),127.12,125.88(d,jc-p=2.8hz),60.10(d,jc-p=157.6hz),55.83(d,jc-p=12.6hz),53.57(d,jc-p=6.6hz),53.05(d,jc-p=7.6hz),45.78,25.15;31pnmr(202mhz,cdcl3):δ25.30.
实施例10
在10ml的反应管中加入agoac催化剂5mg,活化4å分子筛100mg,氮气置换后将四氢异喹啉40mg、2-溴-4-氟苯甲醛53mg和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物[2-(2-溴-4-氟-苄基)-1,2,3,4-四氢异喹啉-1-基]-膦酸二甲酯,产率为83%。
1hnmr(500mhz,cdcl3):δ7.55(dd,j=8.4,6.4hz,1h),7.29(dd,j=8.0,2.3hz,2h),7.21–7.15(m,3h),7.03(td,j=8.3,2.5hz,1h),4.19(d,j=21.4hz,1h),3.93(q,j=14.3hz,2h),3.78(d,j=11.1hz,1h),3.66(d,j=10.5hz,3h),3.63(d,j=10.6hz,3h),3.03–2.94(m,1h),2.92–2.86(m,1h),2.77–2.71(m,1h);13cnmr(126mhz,cdcl3):δ161.48(d,jc-f=249.8hz),135.77(d,jc-f=5.6hz),133.92(d,jc-p=3.5hz),131.64(d,jc-f=8.2hz),129.36,129.20(d,jc-p=2.5hz),129.01(d,jc-p=4.1hz),127.24(d,jc-p=3.6hz),125.84(d,jc-p=3.0hz),124.37(d,jc-f=9.5hz),119.87(d,jc-f=24.3hz),114.49(d,jc-f=20.6hz),59.94(d,jc-p=156.9hz),58.12(d,jc-p=12.2hz),53.55(d,jc-p=7.2hz),52.99(d,jc-p=7.5hz),45.71,25.13;31pnmr(202mhz,cdcl3):δ25.39.
实施例11
在10ml的反应管中加入agoac催化剂5mg,活化4å分子筛100mg,氮气置换后将四氢异喹啉40mg、2-溴-5-氟苯甲醛53mg和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物[2-(2-溴-5-氟-苄基)-1,2,3,4-四氢异喹啉-1-基]-膦酸二甲酯,产率为81%。
1hnmr(500mhz,cdcl3):δ7.50(m,1h),7.45(d,j=10.3hz,1h),7.30(d,j=7.4hz,1h),7.28–7.15(m,4h),4.19(d,j=21.1hz,1h),3.95(q,j=15.3hz,2h),3.82(d,j=11.2hz,2h),3.68(d,j=10.2hz,3h),3.66(d,j=10.0hz,3h),3.02–2.99(m,1h),2.93–2.86(m,1h),2.81–2.71(m,1h);13cnmr(126mhz,cdcl3):δ162.29(d,jc-f=246.4hz),135.64(d,jc-f=6.1hz),133.72(d,jc-p=7.9hz),129.21(d,jc-p=2.7hz),129.03(d,jc-p=4.1hz),127.32(d,jc-p=3.6hz),125.89(d,jc-p=3.1hz),117.96(d,jc-p=2.9hz),117.39(d,jc-f=23.9hz),116.71(d,jc-f=22.6hz),115.79(d,jc-f=40.0hz),115.78(d,j=7.3hz),60.24(d,jc-p=157.0hz),58.85(d,jc-p=11.8hz),53.50(d,jc-p=7.3hz),53.04(d,jc-p=7.5hz),45.91,25.22;31pnmr(202mhz,cdcl3):δ25.26.
实施例12
在10ml的反应管中加入agoac催化剂5mg,活化4å分子筛100mg,氮气置换后将四氢异喹啉40mg、2-溴-6-氟苯甲醛53mg和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物[2-(2-溴-6-氟-苄基)-1,2,3,4-四氢异喹啉-1-基]-膦酸二甲酯,产率为90%。
1hnmr(500mhz,cdcl3):δ7.39(d,j=8.0hz,1h),7.31(d,j=7.3hz,1h),7.21–7.12(m,4h),7.03(t,j=8.8hz,1h),4.24(d,j=24.8hz,1h),4.01(d,j=12.9hz,1h),3.92(d,j=12.9hz,1h),3.86–3.77(m,1h),3.62(d,j=10.4hz,3h),3.60(d,j=10.6hz,3h),3.12–3.04(m,2h),2.72–2.65(m,1h);13cnmr(125mhz,cdcl3):δ161.92(d,jc-f=250.2hz),135.48(d,jc-f=6.0hz),129.81(d,jc-f=9.5hz),129.31,129.16(d,jc-p=3.9hz),128.77(d,jc-p=3.4hz),127.13(d,jc-p=3.5hz),126.81(d,jc-p=4.9hz),126.49,126.36,125.79(d,jc-p=3.1hz),114.69(d,jc-f=23.2hz),59.51(d,jc-p=157.6hz),54.16(d,jc-p=6.9hz),52.59(d,jc-p=7.4hz),51.56(d,jc-p=16.5hz),45.73,23.70;31pnmr(202mhz,cdcl3):δ25.12.
实施例13
在10ml的反应管中加入agoac催化剂5mg,活化4å分子筛100mg,氮气置换后将四氢异喹啉40mg、2-溴-5-氯苯甲醛79mg和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物[2-(2-溴-5-氯-苄基)-1,2,3,4-四氢异喹啉-1-基]-膦酸二甲酯,产率为53%。
1hnmr(501mhz,cdcl3)δ7.55–7.52(m,2h),7.29(dd,j=8.2,2.1hz,2h),7.23–7.15(m,3h),4.18(d,j=21.1hz,1h),3.96(d,j=14.6hz,1h),3.90(d,j=14.5hz,1h),3.79(d,j=11.2hz,1h),3.66(d,j=10.5hz,3h),3.63(d,j=10.6hz,3h),3.02–2.94(m,1h),2.91–2.85(m,1h),2.77–2.71(m,1h);13cnmr(126mhz,cdcl3):δ136.70,135.75(d,jc-p=5.9hz),133.46,132.34(d,jc-p=16.4hz),131.42130.07,129.26(d,jc-p=17.0hz),128.98(d,jc-p=4.0hz),127.79(d,jc-p=35.2hz),127.27(d,jc-p=3.5hz),125.86(d,jc-p=3.2hz),124.64,60.10(d,jc-p=156.9hz),58.34(d,jc-p=12.0hz),53.54(d,jc-p=7.1hz),53.01(d,jc-p=7.3hz),45.77,25.25;31pnmr(202mhz,cdcl3):δ25.37.
实施例14
在10ml的反应管中加入agoac催化剂5mg,活化4å分子筛100mg,氮气置换后将四氢异喹啉40mg、3-硝基苯甲醛54mg和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物[2-(3-硝基-苄基)-1,2,3,4-四氢异喹啉-1-基]-膦酸二甲酯,产率为83%。
1hnmr(500mhz,cdcl3):δ8.35(s,1h),8.13(d,j=8.1hz,1h),7.71(d,j=7.5hz,1h),7.49(t,j=7.9hz,1h),7.24–7.14(m,4h),4.13(d,j=20.7hz,1h),4.06(d,j=14.0hz,1h),3.93(d,j=13.6hz,1h),3.72(d,j=10.5hz,3h),3.67(d,j=10.5hz,3h),3.65–3.61(m,1h),2.98–2.90(m,1h),2.86–2.79(m,1h),2.79–2.72(m,1h);13cnmr(125mhz,cdcl3):δ148.54,141.27,135.70(d,jc-p=5.7hz),134.76,129.21,129.15(d,jc-p=2.7hz,overlapped),129.10,129.02(d,jc-p=4.2hz,overlapped),127.34(d,jc-p=3.5hz),125.96(d,jc-p=3.2hz),123.64,122.40,60.05(d,jc-p=158.3hz),58.91(d,jc-p=11.6hz),53.48(d,jc-p=7.1hz),53.23(d,jc-p=7.5hz),45.92(d,jc-p=2.2hz),25.40;31pnmr(202mhz,cdcl3):δ25.05.
实施例15
在10ml的反应管中加入agoac催化剂5mg,活化4å分子筛100mg,氮气置换后将四氢异喹啉40mg、4-氰基苯甲醛47mg和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物[2-(4-氰基-苄基)-1,2,3,4-四氢异喹啉-1-基]-膦酸二甲酯,产率为86%。
1hnmr(500mhz,cdcl3):δ7.58(d,j=40.8hz,4h),7.26–7.13(m,4h),4.14(d,j=19.9hz,1h),4.04(d,j=13.9hz,1h),3.90(d,j=11.9hz,1h),3.68(d,j=10.4hz,3h),3.65(d,j=14.2hz,3h),3.61–3.53(m,1h),2.84(d,j=69.8hz,3h);13cnmr(125mhz,cdcl3):δ144.53,135.72(d,jc-p=5.4hz),132.20,129.39,129.10,128.93(d,jc-p=4.1hz),127.36(d,jc-p=2.9hz),125.94,118.91,111.12,60.21(d,jc-p=158.0hz),59.38(d,jc-p=10.0hz),53.34(d,jc-p=6.1hz),53.24(d,jc-p=7.2hz),45.87,25.61;31pnmr(202mhz,cdcl3):δ25.08.
实施例16
在10ml的反应管中加入agoac催化剂5mg,活化4å分子筛100mg,氮气置换后将四氢异喹啉40mg、4-乙基苯甲醛49μl和亚磷酸三甲酯42μl滴加入反应管,然后加入1,4-dioxane1ml。反应混合物在120℃加热8h,反应结束后,将反应液直接浓缩,然后进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1~1/1)400ml,得到最终产物[2-(4-乙基-苄基)-1,2,3,4-四氢异喹啉-1-基]-膦酸二甲酯,产率为55%。
1hnmr(500mhz,cdcl3):δ7.28(d,j=7.7hz,3h),7.22–7.12(m,5h),4.20(d,j=22.1hz,1h),3.87(d,j=13.0hz,1h),3.81(d,j=14.1hz,1h),3.67(d,j=10.4hz,3h),3.64(d,j=10.5hz,3h),2.98–2.91(m,1h),2.90–2.84(m,1h),2.73–2.68(m,1h),2.67–2.62(q,j=7.6hz,2h),1.24(t,j=7.6hz,3h);13cnmr(125mhz,cdcl3):δ143.32,135.81(d,jc-p=26.4hz),129.43,129.10,127.81,127.10(d,jc-p=2.7hz),125.80(d,jc-p=2.8hz),59.45(d,jc-p=158.4hz),59.02(d,jc-p=12.3hz),53.61(d,jc-p=7.3hz),53.02(d,jc-p=7.1hz),45.45,28.55,24.71,15.57;31pnmr(202mhz,cdcl3):δ25.64.
- 还没有人留言评论。精彩留言会获得点赞!