人前蛋白转化酶枯草溶菌素9免疫原性肽段及其载体疫苗的制作方法
本发明涉及生物技术领域,具体地指一种人前蛋白转化酶枯草溶菌素9免疫原性肽段及其载体疫苗。
背景技术:
低密度脂蛋白胆固醇(ldl-c)或总胆固醇(tc)升高是引起动脉粥样硬化性心血管病的重要危险因素,人群血清胆固醇水平的升高将导致2010年-2030年期间中国心血管病事件约增加920万,降低人群胆固醇水平非常重要,他汀被推荐为主要降低胆固醇的药物。虽然他汀类药物能有效降低低密度脂蛋白胆固醇和心血管事件,他汀联合胆固醇吸收抑制剂治疗对于降脂达标和减少心血管事件也展现出光明前景,但他汀类降脂药仍存在不足:
1)高危患者接受最大剂量他汀治疗后仍存在较高的心血管风险,在prove-it研究中,强化他汀治疗患者仍有较大的心血管残余风险,在2年中发生风险达22.4%;
2)家族性高胆固醇血症患者ldl-c显著升高50%患者服用最大剂量的最强效他汀后ldl-c未达标;
3)他汀的副作用(如肌痛和横纹肌溶解)使得部分患者不能耐受他汀治疗;
4)meta分析显示,强化剂量他汀治疗会增加新发糖尿病的发生率,限制了最大剂量他汀的使用;
5)他汀给药周期短、频次高、病人依从性差。考虑到心血管病治疗的经济负担及他汀治疗的不足,我们需要进一步探索安全有效地降脂且预防心血管疾病的新型治疗药。
近年来,前蛋白转化酶枯草溶菌素9(pcsk9)作为降低胆固醇治疗新靶点已经得到公认。pcsk9基因是近年发现与血脂代谢密切相关的基因。人群中存在两种突变:功能获得型可导致常染色体显性的家族性高胆固醇血症,与早发心血管病密切相关;功能缺失型可出现低水平的血浆ldl-c和载脂蛋白b,与心血管事件减少密切相关。pcsk9主要通过降解低密度脂蛋白胆固醇受体(ldl-r),升高ldl-c水平,引起高胆固醇血症。人类pcsk9分子成为高胆固醇血症和心血管病防治的重要靶标。目前针对pcsk9分子的单克隆抗体药物(安进的alirocumab和赛诺菲的evolocumab)在临床试验中显示出强效的降低ldl-c作用,已在美国批准上市。pcsk9单克隆抗体通过结合pcsk9酶,抑制该酶降解ldl-r,发挥降低ldl-c作用。高脂血症及动脉粥样硬化性心血管病需要长期治疗,由于前蛋白转化酶枯草溶菌素9单抗价格极为昂贵,极大制约了其临床应用。同时,单克隆抗体药物也存在随时间药效衰减、高免疫原性(产生抗抗体)等缺陷,使得临床应用受限。这些原因导致了制药巨头辉瑞公司终止极富有前景的pcsk9抑制性单克隆抗体bococizumab的全球开发。
因此,开展新的前蛋白转化酶枯草溶菌素9抑制剂如疫苗研究很有必要,疫苗给药剂量小,制备成本低,药品经济负担降低,作用持续时间长,可用于高脂血症及动脉粥样硬化性心血管病的长期治疗。
选择合适的靶点和载体是高脂血症等治疗性疫苗研制成功的关键,可选择的靶点理论上有前蛋白转化酶枯草溶菌素9与低密度脂蛋白受体相互结合区域或影响两者结合的所有氨基酸序列。pcsk9结构区域可分为:n端前结构域、催化结构域及c端v结构域。前结构域主要阻断pcsk9的激活及pcsk9与ldlr的结合,催化结构域主要发挥pcsk9对ldlr的降解作用,为主要功能区,c端v结构域的研究数据有限,多数认为对pcsk9与ldlr的结合无明显影响,但新近的研究发现,c端v结构域也参与结合ldlr,且影响pcsk9降解ldlr。因此,pcsk9靶点肽段的选择以催化结构域为主,同时适当兼顾前结构域及v结构域。
目前已在我国申请专利的几项pcsk9降脂疫苗(专利申请号:201080049440.6,201280044571.4,201380040051.0、201510017173.9、201510017534.x和201580015813.0),所选择靶点肽段均来自于催化结构域,且集中于pcsk9催化域起始段(150-170)及中间段(205-225)。但是,上述肽段降脂疫苗也存在一些弊端:
1、肽段序列普遍偏长,空间构象变得复杂,这不仅会导致肽段与载体耦联难度增加,且会使耦联率下降,影响疫苗免疫应答效应;
2、肽段序列过长,所产生的抗体就更为多样,抗体特异性差,针对治疗靶点的精确性差,也会导致疫苗效果大打折扣,这也是目前尚无类似疫苗上市的重要原因之一;
3、肽段序列过长会激活t细胞,可能诱导th1和杀伤性cd8+t细胞激活,导致自身免疫性损害,这在阿尔茨海默病等慢性疾病疫苗的研制过程中得到印证。在对降脂疫苗的研究过程中;
上述专利中的肽段在耦联载体时难度普遍增高,动物体系中抗体效价普遍不高,且降脂效果有限,直接制约降脂疫苗的临床应用价值。
技术实现要素:
本发明的第一目的是针对现有短肽的缺陷,提供了一种人前蛋白转化酶枯草溶菌素9免疫原性肽段,其基于分析pcsk9的结构布局及功能特征,筛选pcsk9的三大结构域,从而优化筛选了一段既针对pcsk9前结构域又针对催化结构域的肽段,其利于耦联或嵌合,靶向性更强,以提高效应能力,且最大程度减少自身免疫性损害的可能。
本发明还提供了一种载体疫苗,该载体疫苗是由肽段与疫苗载体qβ-2aa噬菌体病毒样颗粒蛋白经过化学耦联制备而成,其应用于高脂血症的治疗。
为实现上述第一目的,本发明提供的一种人前蛋白转化酶枯草溶菌素9免疫原性肽段,所述人前蛋白转化酶枯草溶菌素9免疫原性肽段的氨基酸序列选自seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9seqidno.10、seqidno.11、seqidno.12、seqidno.13、seqidno.14和seqidno.15。
优选地,所述人前蛋白转化酶枯草溶菌素9免疫原性肽段的氨基酸序列选自seqidno.1、seqidno.2、seqidno.3、seqidno.4和seqidno.5。
为了筛选更短的更精确的短肽序列,本发明立足于pcsk9的结构及序列特征,综合现有筛选技术及本研究团队发明的筛选技术,筛选了15段短肽,每个短肽的序列长度以7-10个氨基酸为宜,虽然短肽序列主要分布在pcsk9的催化结构域,但在前结构域及c端v结构域也有分布。最终,筛选出5段短肽,其中一段短肽跨越前结构域及催化结构域起始部分,既能抑制pcsk9的催化活性,又能抑制pcsk9催化活性的转换,是现有专利所不具备的特征。
本发明的第二个目的是提供了一种载体疫苗,其包括与免疫原性载体连接的至少一种上述免疫原性肽段。
优选地,所述免疫原性肽段选自seqidno.1、seqidno.2、seqidno.3、seqidno.4和seqidno.5。
优选地,所述免疫原性载体为qβ-2aa噬菌体病毒样颗粒蛋白或钥孔血蓝蛋白。
本发明还提供了一种上述载体疫苗在制备治疗高脂血症药物中的应用。
本发明还提供了一种药物组合物,所述药物组合物包括权利要求3~4中任一项的载体疫苗和药物可接受的佐剂。所述佐剂为氢氧化铝。
本发明的有益效果在于:
1、根据pcsk9的氨基酸序列、亲水性、抗原性、可及性等特性,综合生物信息学、药理学方法,本发明设计出了针对pcsk9的15条肽段,并通过验证出这些肽段能有效诱导pcsk9抗体产生并降低总胆固醇及低密度脂蛋白胆固醇的效应。
2、将设计出的针对pcsk9的15个肽段分别与载体偶联成功制备成15种载体疫苗,并将这15种载体疫苗分别免疫雄性balb/c小鼠,免疫得到血清,利用elisa法测定血清抗体滴度,筛选出抗体滴度在1:40000以上的pcsk9免疫原性载体疫苗,对应15条肽段中筛选出5条肽段,由这5条肽段制备而成的pcsk9免疫原性载体疫苗的抗体滴度均不小于1:20000。
3、选择合适的载体是研制疫苗成功的关键。本发明选用qβ-2aa噬菌体病毒样颗粒蛋白或klh,选优选用qβ-2aa噬菌体病毒样颗粒蛋白。
4、将制备得到的载体疫苗免疫小鼠,研究pcsk9免疫原性载体疫苗是否降低小鼠的总胆固醇及低密度脂蛋白胆固醇,实验结果表明pcsk9免疫原性载体疫苗能降低小鼠的总胆固醇及低密度脂蛋白胆固醇,因此,此类载体疫苗可以应用于制备治疗高脂血症药物。
附图说明
图1为实施例2中载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ的sds-page凝胶电泳检测图;
图中,泳道1为qβ-2aa噬菌体病毒样颗粒蛋白单体、泳道vaccine1为疫苗pcsk9cn9-qβ,泳道vaccine2为疫苗pcsk9ce11-qβ、泳道vaccine3为疫苗pcsk9ck9-qβ、泳道vaccine4为疫苗pcsk9cg10-qβ、泳道vaccine5为疫苗pcsk9cp10-qβ。
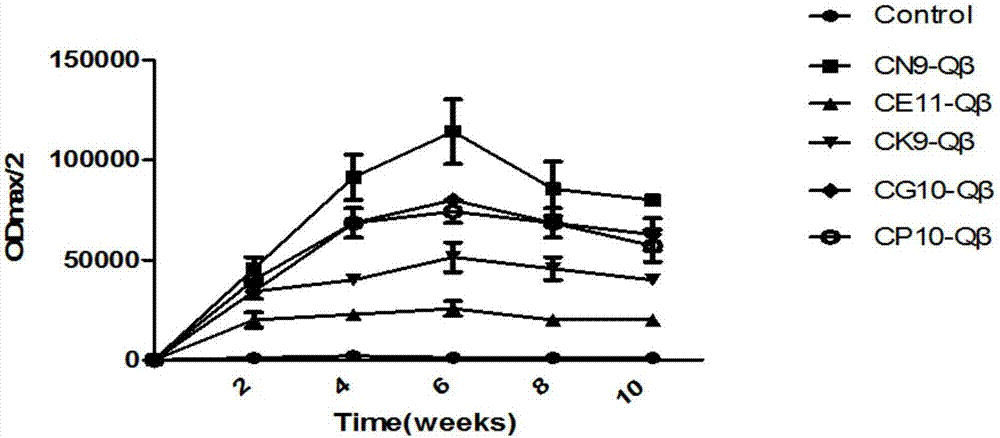
图2为实施例4中载体疫苗免疫雄性balb/c小鼠后产生的抗pcsk9-cn9、抗pcsk9-ce11、抗pcsk9-ck9、抗pcsk9-cg10、抗pcsk9-cp10短肽抗体滴度图,
图中cn9、ce11、ck9、cg10、cp10分别对应代表抗pcsk9-cn9、抗pcsk9-ce11、抗pcsk9-ck9、抗pcsk9-cg10、抗pcsk9-cp10短肽抗体;
图3为实施例4(一)中测量载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ对雄性balb/c小鼠血脂水平的影响图;
其中,a为实施例4(一)中测量载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ对雄性balb/c小鼠血浆总胆固醇水平的影响图;
b为实施例4(一)中测量载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ对雄性balb/c小鼠血浆低密度脂蛋白胆固醇水平的影响图;
c为实施例4(一)中测量载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ对雄性balb/c小鼠血浆血浆甘油三酯水平的影响图;
d为实施例4(一)中测量载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ对雄性balb/c小鼠血浆高密度脂蛋白胆固醇水平的影响图;
图中,tc指血浆总胆固醇;ldl-c指血浆低密度脂蛋白胆固醇,tg指血浆甘油三酯,hdl-c指血浆高密度脂蛋白胆固醇。cn9-qβ、ce11-qβ、ck9-qβ、cg10-qβ、cp10-qβ分别代表载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ;**p<0.01、***p<0.001vs空白对照组。共分为两组:(1)control(n=8):不做任何处理;(2)疫苗组(每种疫苗免疫8只):载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ,100ug/只,于0,14,28,42天皮下多点免疫共四次,图中为第四次免疫后血脂水平;
图4为实施例4(二)中载体疫苗免疫雄性ldlr+/-小鼠后产生的抗pcsk9cn9-qβ、短肽抗体滴度图,
图中,cn9对应代表抗pcsk9-cn9短肽抗体;
图5为实施例4(二)中测量载体疫苗pcsk9cn9-qβ对雄性ldlr+/-小鼠血脂水平的影响图;
其中,a为实施例4(二)中测量载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ对雄性balb/c小鼠血浆总胆固醇水平的影响图;
b为实施例4(二)中测量载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ对雄性balb/c小鼠血浆低密度脂蛋白胆固醇水平的影响图;
c为实施例4(二)中测量载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ对雄性balb/c小鼠血浆血浆甘油三酯水平的影响图;
d为实施例4(二)中测量载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ对雄性balb/c小鼠血浆高密度脂蛋白胆固醇水平的影响图;图中,tc指血浆总胆固醇;ldl-c指血浆低密度脂蛋白胆固醇,tg指血浆甘油三酯,hdl-c指血浆高密度脂蛋白胆固醇。cn9-qβ代表载体疫苗pcsk9cn9-qβ;*p<0.05、**p<0.01、***p<0.001vs空白对照组。共分为两组:(1)control(n=8):不做任何处理;(2)疫苗组(免疫8只):载体疫苗pcsk9cn9-qβ,100ug/只,于0,14,28,42天皮下多点免疫共四次,图中为第四次免疫后血脂水平。
图6为实施例5中测量pcsk9cn9-qβ+ck9-qβ联合疫苗对雄性ldlr+/-小鼠血脂水平的影响图。
其中,a为实施例5中测量pcsk9cn9-qβ+ck9-qβ联合疫苗对雄性balb/c小鼠血浆总胆固醇水平的影响图;
b为实施例5中测量pcsk9cn9-qβ+ck9-qβ联合疫苗对雄性balb/c小鼠血浆低密度脂蛋白胆固醇水平的影响图;
c为实施例5中测量pcsk9cn9-qβ+ck9-qβ联合疫苗对雄性balb/c小鼠血浆甘油三酯水平的影响图;
d为实施例5中测量pcsk9cn9-qβ+ck9-qβ联合疫苗对雄性balb/c小鼠血浆高密度脂蛋白胆固醇水平的影响图。
图中,tc指血浆总胆固醇;ldl-c指血浆低密度脂蛋白胆固醇,tg指血浆甘油三酯,hdl-c指血浆高密度脂蛋白胆固醇。cn9-qβ代表载体疫苗pcsk9cn9-qβ;ck9-qβ代表载体疫苗pcsk9ck9-qβ。*p<0.05、**p<0.01、***p<0.001vs.空白对照组。图中为第3次免疫后血脂水平。
具体实施方式
为了更好地解释本发明,以下结合具体实施例进一步阐明本发明的主要内容,但本发明的内容不仅仅局限于以下实施例。
人前蛋白转化酶枯草溶菌素9免疫原性载体疫苗以下简称pcsk9免疫原性载体疫苗,人前蛋白转化酶枯草溶菌素9以下简称pcsk9。
实施例1:pcsk9免疫原性肽段的制备
根据生物信息学技术如氨基酸亲水性、抗原性及序列空间构象等进行b细胞表位预测,是研究中常用的方法,但这些方法的准确率及成功率仍然很低,靶点序列的筛选仍然是巨大的挑战。为了提高靶点序列筛选的成功率,综合序列低相似性特征,设计出针对pcsk9氨基酸序列的pcsk9免疫原性肽段15条,分别命名为cn9、ce11、ck9、cg10、cp10、cf10、it9、cr9、cg9、cv9、cp10、cr10、cg11、cg10、ce9,具体氨基酸序列为,cn9:seqidno.1;ce11:seqidno.2;ck9:seqidno.3;cg10:seqidno.4;cp10:seqidno.5;cf10:seqidno.6;it9:seqidno.7;cr9:seqidno.8,cg9:seqidno.9、cv9:seqidno.10、cp10:seqidno.11、cr10:seqidno.12、cg11:seqidno.13、cg10:seqidno.14、ce9:seqidno.15。
采用pssm-8型肽自动合成仪(日本shimadzu公司)合成上述的15条肽段,合成的15条肽段经高效液相色谱分析15条肽段的纯度,经检测15条肽段的纯度均达到95%以上。将得到的15条肽段冻干,分装后置于冻存管中,-80℃冻存备用。
实施例2:制备pcsk9免疫原性载体疫苗
一、利用qβ-2aa噬菌体病毒样颗粒蛋白,制备15种载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ、pcsk9cf10-qβ、pcsk9it9-qβ、pcsk9cr9-qβ、pcsk9cg9-qβ、pcsk9cv9-qβ、pcsk9cp10-qβ、pcsk9cr10-qβ、pcsk9cg11-qβ、pcsk9cg10-qβ、pcsk9ce9-qβ。具体制备过程如下:
1)制备qβ-2aa噬菌体病毒样颗粒蛋白:qβ-2aa噬菌体病毒样颗粒蛋白的英文缩写为:qβ-2aavlp,以下均用qβ-2aavlp表示qβ-2aa噬菌体病毒样颗粒蛋白。
qβ-2aavlp的制备方法为:
1a)获取表达qβ-2aavlp的重组菌株:该重组菌株为大肠杆菌dh5α/pgexqβ-a1,此重组菌株能诱导产生qβ-2aa病毒样颗粒蛋白。大肠杆菌dh5α/pgexqβ-a1的保藏号为cctccno:m209282,具体的制备过程参见中国专利:一种qβ-2aa噬菌体病毒样颗粒蛋白的制备方法及其用途,授权公开日为cn101921733b授权公告日2013.06.05。
1b)诱导表达qβ-2aavlp:首先从液氮罐中取出保藏的大肠杆菌dh5α/pgexqβ-a1重组菌株,将该重组菌株活化后,涂布至lb固体培养基平板上,37℃温箱培养过夜,挑取单个菌落培养于lb液体培养基,37℃恒温摇床培养5h后,加入0.2m的iptg诱导重组菌株表达qβ-2aavlp,诱导6小时,收集菌液并进行超声裂解,获取裂解上清液;
1c)qβ-2aavlp的纯化:裂解上清液经过硫酸铵沉淀,酸化处理,疏水层析,凝胶层析后得到纯化后的qβ-2aavlp;
1d)qβ-2aavlp的鉴定:将纯化后的qβ-2aavlp用二硫苏糖醇(dtt)进行解配处理,将解配后的qβ-2aavlp凝胶电泳鉴定其分子量,电镜观测其形态大小和粒径;最后通过试验结果确定得到的蛋白即为qβ-2aavlp;
2)制备载体:取步骤1c)纯化后qβ-2aavlp375μg与佐剂:cpg-odn2od配制成为装配体系(其中,cpg-odn购自由上海生工生物工程公司),室温放置60小时,qβ-2aavlp将进行自组装,同时包裹装配体系内的cpg-odn,装配完成后用凝胶层析纯化,得到载体:qβ-2aa-cpg-odnvlp;
3)pcsk9免疫原性载体疫苗的制备:将实施例1中得到的15条肽段分别与载体qβ-2aa-cpg-odnvlp进行偶联反应,偶联反应采用异双功能交联剂(sulfo-smcc),得到15种pcsk9免疫原性载体疫苗,分别为pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ、pcsk9cf10-qβ、pcsk9it9-qβ、pcsk9cr9-qβ、pcsk9cg9-qβ、pcsk9cv9-qβ、pcsk9cp10-qβ、pcsk9cr10-qβ、pcsk9cg11-qβ、pcsk9cg10-qβ、pcsk9ce9-qβ。
4)将步骤3)得到的载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ进行sds-page凝胶电泳检测,检测结果如图1所示。
实施例3pcsk9免疫原性载体疫苗针对性抗体研究
pcsk9免疫原性肽段的筛选:优选pcsk9免疫原性肽段为cn9、ce11、ck9、cg10、cp10。具体试验过程为:
将实施例2得到的15种pcsk9免疫原性载体疫苗:pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ、pcsk9cf10-qβ、pcsk9it9-qβ、pcsk9cr9-qβ、pcsk9cg9-qβ、pcsk9cv9-qβ、pcsk9cp10-qβ、pcsk9cr10-qβ、pcsk9cg11-qβ、pcsk9cg10-qβ、pcsk9ce9-qβ在第0、14、28天皮下多点免疫雄性balb/c小鼠,其中,作为对照组,6只雄性balb/c小鼠免疫载体qβ-2aa-cpg-odnvlp,每种pcsk9免疫原性载体疫苗免疫6只雄性balb/c小鼠,一共96只被免疫的雄性balb/c小鼠,免疫剂量为100ug/只。第19、26、33、40天取血用elisa法测定抗体滴度,筛选出抗体滴度在1:40000以上的pcsk9免疫原性载体疫苗为pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ,因此,优选pcsk9免疫原性肽段为cn9、ce11、ck9、cg10、cp10。
实施例4:pcsk9免疫原性载体疫苗对两种不同模型小鼠血脂水平的影响。
一、pcsk9免疫原性载体疫苗对balb/c小鼠血脂水平的影响
将载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ免疫雄性balb/c小鼠探讨pcsk9免疫原性载体疫苗是否降低balb/c小鼠的血脂水平。具体试验过程为:
1)实验分组,具体分为2组如下:
第一组:空白对照组(control组):不给予任何干预措施;
第二组:疫苗组:载体疫苗pcsk9cn9-qβ、pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ、pcsk9cp10-qβ在0、2、4、6、8周时分别在背部皮下多点免疫,剂量为100ug/只。
2)采血:分别在第-7、7、19、33、47、61天鼠尾采血,rt3000rpm10min离心取上清,-80℃保存备用。
3)elisa免疫印迹实验
由于免疫动物时所选用的载体为qβ-2aa-cpg-odnvlp,为了避免交叉反应,采用klh作为载体与短肽偶联成疫苗后包板测定相应抗体的滴度,klh作为载体与短肽偶联成疫苗的具体过程见实施例2。
3a)包板:将载体疫苗pcsk9cn9-klh、pcsk9ce11-klh、pcsk9ck9-klh、pcsk9cg10-klh、pcsk9cp10-klh各取100ug,分别加入到10ml包被稀释液(ph9.60.05mnaco3-nahco3缓冲液)中混匀后加入96孔板中,100ul/孔,4℃湿盒孵育过夜;
3b)封闭:第二天弃包被液,加入浓度为1%bsa的pbs缓冲液,100ul/孔,37℃封闭2h;
3c)封膜:封闭后弃封闭液,拍干并室温晾干后,贴上elisa包被膜;
4)将上述血清取出,冰上解冻后,用elisa法测定相应抗体滴度,具体步骤如下:
4a)倍比稀释:将血清上清用浓度为10%fbs的pbs缓冲液作为稀释液,做1:100,1:1000,1:5000,1:10000的梯度倍比稀释;
4b)孵育一抗:用移液器将1:1000倍比稀释后的血清标本加入到步骤1)中的96孔板中,37℃温箱、孵育2h;
4c)孵育二抗:一抗孵育完成后,弃液体并用洗涤液(0.03%pbstph7.4)洗3遍,拍干,然后加入辣根过氧化物酶标记的山羊抗小鼠的二抗(1:3000稀释稀释液为10%fbs的pbs缓冲液),37℃温箱中孵育0.5h;
4d)显色:二抗孵育完成后弃液体并用洗涤液(0.03%pbstph7.4)洗3遍,拍干,然后加入tmd显色液,100ul/孔,室温观察颜色变化;
4e)终止反应:待空白对照孔颜色开始变绿后,加入终止液(1m稀盐酸),100ul/孔;
4f)读数:加入终止液后,放在酶标仪上在450nm波长下读出吸光度(od)值;
4g)结果分析:以od值不小于空白对照组的2.1倍作为待测标本阳性的标准,然后计算出相应标本的抗体滴度值。结果如图2,结果显示各载体疫苗免疫小鼠后均产生了抗特定人前蛋白转化酶枯草溶菌素9免疫原性肽段的抗体。5)血脂水平检测
检测血脂水平以总胆固醇(tc)、甘油三酯(tg)、低密度脂蛋白胆固醇(ldl-c)、高密度脂蛋白胆固醇(hdl-c)这四项指标为主,由相应的总胆固醇测定试剂盒、甘油三酯测定试剂盒、低密度脂蛋白胆固醇测定试剂盒、高密度脂蛋白胆固醇测定试剂盒用生化分析仪测量完成。具体实验过程为:
5a)总胆固醇检测
(1)工作液制备:试剂际直接使用,按下表加样
(2)计算:
tc(mmol/l)=a样本/a校准×校准液浓度
5b)甘油三酯检测
(1)工作液制备:试剂际直接使用,按下表加样
(2)计算:
tg(mmol/l)=b样本/b校准×校准液浓度
5c)低密度脂蛋白胆固醇检测
(1)工作液制备:试剂际直接使用,按下表加样
(2)计算:
ldl-c(mmol/l)=c样本/c校准×校准液浓度
5d)高密度脂蛋白胆固醇检测
(1)工作液制备:将试剂r1与试剂r2按3:1比例混合均匀,按下表加样
(2)计算:
hdl-c(mmol/l)=d样本/d校准×校准液浓度
(3)结果分析:统计学分析数据以均数±标准差表示,用spss23.0软件进行统计处理,组间差异比较采用方差分析(anova),以p<0.05具有显著性差异,*p<0.05、**p<0.01、***p<0.001vscontrol组,结果如图3。
二、pcsk9免疫原性载体疫苗对ldlr+/-小鼠血脂水平的影响
将载体疫苗pcsk9cn9-qβ免疫雄性ldlr+/-小鼠探讨pcsk9免疫原性载体疫苗是否降低ldlr+/-小鼠的血脂水平。具体试验过程为:
1)实验分组,具体分为2组如下:
第一组:空白对照组(control组):不给予任何干预措施;
第二组:疫苗组:载体疫苗pcsk9cn9-qβ在0、2、4、6、8周时分别在背部皮下多点免疫,剂量为100ug/只。
2)采血:分别在第-7、7、19、33、47、61天鼠尾采血,rt3000rpm10min离心取上清,-80℃保存备用。
3)elisa免疫印迹实验
具体实施方法同前,结果分析以od值不小于空白对照组的2.1倍作为待测标本阳性的标准,然后计算出相应标本的抗体滴度值。结果如图4,结果显示该载体疫苗免疫小鼠后产生了抗特定人前蛋白转化酶枯草溶菌素9免疫原性肽段的抗体。
4)血脂水平检测
检测血脂水平以总胆固醇(tc)、甘油三酯(tg)、低密度脂蛋白胆固醇(ldl-c)、高密度脂蛋白胆固醇(hdl-c)这四项指标为主,由相应的总胆固醇测定试剂盒、甘油三酯测定试剂盒、低密度脂蛋白胆固醇测定试剂盒、高密度脂蛋白胆固醇测定试剂盒用生化分析仪测量完成。具体实验过程同前。实验结果统计学分析数据以均数±标准差表示,用spss23.0软件进行统计处理,组间差异比较采用方差分析(anova),以p<0.05具有显著性差异,*p<0.05、**p<0.01、***p<0.001vscontrol组,结果如图5。
实施例5:pcsk9免疫原性载体联合疫苗对ldlr+/-模型小鼠血脂水平的影响
将载体疫苗pcsk9cn9-qβ分别与pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ及pcsk9cp10-qβ两两联合,以联合疫苗形式免疫雄性balb/c小鼠,探讨以pcsk9cn9-qβ为基础疫苗,分别联合使用pcsk9ce11-qβ、pcsk9ck9-qβ、pcsk9cg10-qβ及pcsk9cp10-qβ疫苗是否进一步降低balb/c小鼠的血脂水平。
小鼠分为以下10组,给予3次疫苗免疫,每次疫苗剂量为100ug/只:
1)control组(对照组);
2)pcsk9cn9-qβ疫苗组;
3)pcsk9ce11-qβ疫苗组;
4)pcsk9ck9-qβ疫苗组;
5)pcsk9cg10-qβ疫苗组;
6)pcsk9cp10-qβ疫苗组;
7)pcsk9cn9-qβ+ce11-qβ疫苗组;
8)pcsk9cn9-qβ+ck9-qβ疫苗组;
9)pcsk9cn9-qβ+cg10-qβ疫苗组;
10)pcsk9cn9-qβ+cp10-qβ疫苗组。
除分组外,具体实验方式与实施例4一致。
血脂测定发现,除pcsk9cn9-qβ+ck9-qβ联合疫苗组进一步降低血脂水平外(具体结果如图6所示),其余组无进一步降低血脂的作用。因此,pcsk9cn9-qβ与pcsk9ck9-qβ的联合疫苗也是值得开发的,对于心血管疾病的高危患者更为适用。
其它未详细说明的部分均为现有技术。尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
<110>邱志华
<120>人前蛋白转化酶枯草溶菌素9免疫原性肽段及其载体疫苗
<210>1
<211>9
<212>prt
<213>人工合成
<400>1
cysphealaglnserileprotrpasn
15
<210>2
<211>11
<212>prt
<213>人工合成
<400>2
cysilethrproproargtyrargalaaspglu
15
<210>3
<211>9
<212>prt
<213>人工合成
<400>3
cysglyargaspalaglyvalalalys
15
<210>4
<211>10
<212>prt
<213>人工合成
<400>4
cyslysserglnleuvalglnprovalgly
15
<210>5
<211>10
<212>prt
<213>人工合成
<400>5
cysprovalleuargproargglyglnpro
15
<210>6
<211>10
<212>prt
<213>人工合成
<400>6
cysvalproglugluaspglythrargphe
15
<210>7
<211>9
<212>prt
<213>人工合成
<400>7
ileglyalaserseraspcysserthr
15
<210>8
<211>9
<212>prt
<213>人工合成
<400>8
cysseralahisserglyprothrarg
15
<210>9
<211>9
<212>prt
<213>人工合成
<400>9
cysserargserglylysargarggly
15
<210>10
<211>9
<212>prt
<213>人工合成
<400>10
cysasnalapheglyglygluglyval
15
<210>11
<211>10
<212>prt
<213>人工合成
<400>11
cysvalgluaspleuglythrhislyspro
15
<210>12
<211>10
<212>prt
<213>人工合成
<400>12
cysglualatrppheprogluaspglnarg
15
<210>13
<211>11
<212>prt
<213>人工合成
<400>13
cysalaleuproproserthrhisglyalagly
15
<210>14
<211>10
<212>prt
<213>人工合成
<400>14
cysalaproproalaglualasermetgly
15
<210>15
<211>9
<212>prt
<213>人工合成
<400>15
cyshisglyileproalaproglnglu
- 还没有人留言评论。精彩留言会获得点赞!
- 用前蛋白转化酶枯草溶菌素9(pcsk9)抑制剂降低残余胆固醇及其他脂蛋白组分含量的方法
- 治疗和/或预防心血管疾病的抗pcsk9化合物和方法
- Pcsk9抗体、其药物组合物及其用图
- 调节血清低密度脂蛋白(LDL)水平的前蛋白转化酶枯草杆菌蛋白酶/Kexin 9 型(PCSK9 ...的制作方法
- 一种含天然高活性枯草菌脂肽钠的叶面肥及其制备方法
- 具有二苄胺结构的嘧啶化合物的新形态的制作方法
- 抗前蛋白转化酶枯草杆菌蛋白酶Kexin 9型(抗PCSK9)化合物及其用于治疗和/或预防心 ...的制作方法
- 一种抗化脓隐秘杆菌plo蛋白单克隆抗体及其识别的抗原表位和应用
- 一种具有多重效果的复合菌酶体系及其应用
- 枯草杆菌酶变体的制作方法
- 一种高效表达β-甘露聚糖酶的枯草芽孢杆菌及其酶产品和生产方法
- 转芽孢杆菌源α-淀粉酶基因重组乳酸杆菌及制品和应用的制作方法
- 一种以豆饼粉为主要原料生产枯草芽孢杆菌菌剂的方法
- 产酶芽孢杆菌菌株的制作方法
- 枯草芽孢杆菌编码PRPP转酰胺酶突变基因purF及应用的制作方法
- 一株类芽孢杆菌及其用于κ-卡拉胶酶的制备方法
- 一种含枯草芽孢杆菌菌株xp的菌酶联合制剂及其在加速烟草薄片中淀粉降解方面的应用的制作方法
- 枯草芽孢杆菌菌株xp、菌酶联合制剂及其在降解烟草制品中淀粉类化合物方面的应用的制作方法
- 一种含枯草芽孢杆菌菌株xp的菌酶联合制剂及其在加速烟梗中淀粉降解方面的应用的制作方法
- 含抗氧化酶的黄孢原毛平革菌提取液和制备方法