构建体的制作方法
本申请是申请日为2012年10月26日,申请号为201280064927.0(pct申请号为pct/gb2012/052668)、发明名称为“构建体”的中国专利申请的分案申请。本发明涉及一种包含编码参与多巴胺合成途径的酶活性的核苷酸序列的构建体。可操作地连接至少两条核苷酸序列使得它们编码一种融合蛋白。本发明也提供包含所述核苷酸序列的病毒载体基因组、载体生产系统和病毒载体颗粒。核苷酸序列在体内的表达,例如通过使用病毒载体颗粒的基因治疗,导致多巴胺的合成,这在治疗和/或预防以产生多巴胺的神经元的减少或损失为特征的神经系统疾病,如帕金森氏(parkinson’sdisease)病中是有用的。
背景技术:
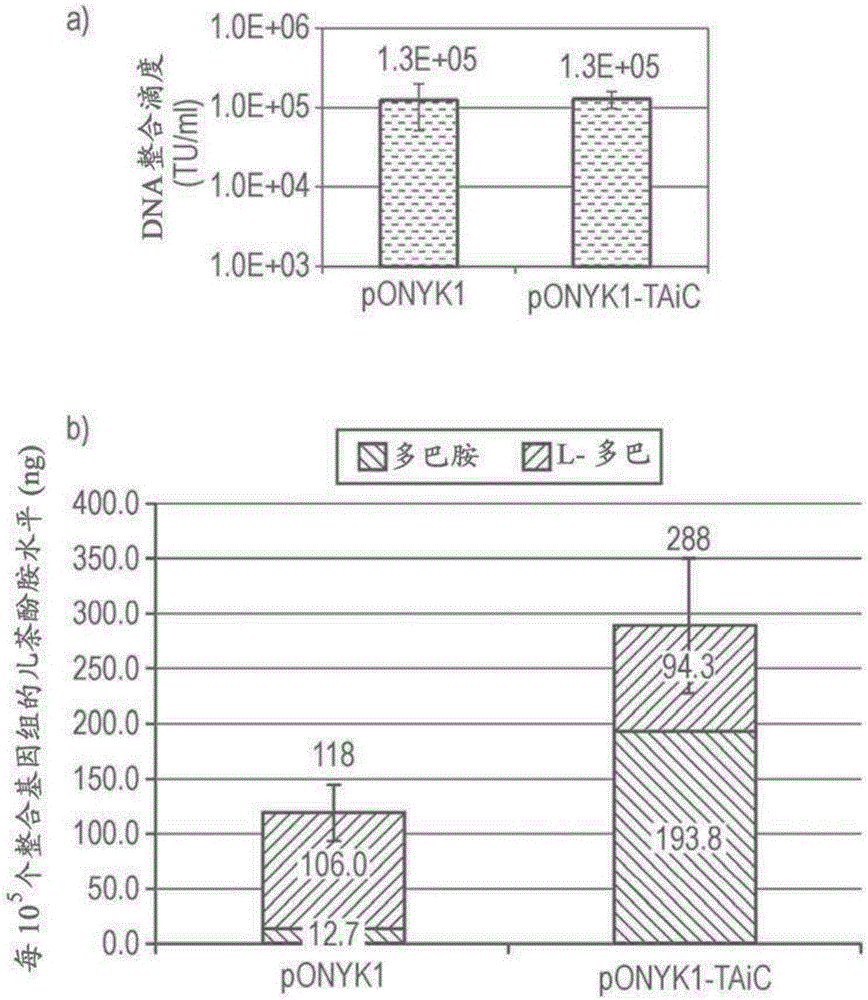
:帕金森氏病(pd)是一种神经变性疾病,其是以黑质区产多巴胺的神经元的损失为特征的。这最终导致在纹状体中多巴胺的耗竭,引起严重的运动障碍。帕金森氏病的一种治疗方法是口服给药l-dopa,即多巴胺的前体,这可以恢复一定程度的运动功能。然而,随着病情的发展,在运动障碍的治疗中l-dopa治疗变得不那么有效,需要使用更高的剂量,这具有严重的副作用。可以通过将多巴胺直接释放到纹状体来实现pd的改善治疗。这可以通过基因治疗来实现。基因治疗对于pd治疗是有吸引力的,因为特定蛋白质的产生可以靶向cns(中枢神经系统)的特定区域,如纹状体。从氨基酸酪氨酸的多巴胺合成涉及酶酪氨酸羟化酶(th),其催化从酪氨酸的l-dopa合成,和芳香族氨基酸脱羧酶(aadc),其将l-dopa转化为多巴胺。th步骤被认为是限速的。th发挥功能需要辅因子四氢生物蝶呤(bh4),其合成是由酶gtp-环化水解酶1(ch-1)催化的。在pd动物模型中,已经研究了使用腺伴随病毒(aav)载体从多巴胺生物合成途径递送单一基因的基因治疗方法具有一些行为益处(leff等人,1999neuroscience92,185-196;bankiewicz等人,2006molther14,564-570)。进一步的方法表明,在pd动物模型中同时递送两种或更多种介导多巴胺合成的酶表现出更大的功效(fan等人,1998humgenether9,2527-2535.;shen等人,2000humgenether11,1509-1519.;muramatsu等人,2002humgenether13,345-354)。这导致了以下理论,如果所有三种多巴胺合成酶共同并在同一细胞中表达,那么多巴胺合成会更高,并会导致在pd中更有效。然而,由于aav载体有限的包装能力,可以被递送的基因数量是有限的。因此,决定使用慢病毒载体(lv)用于此目的,因为这些载体的包装容量要大得多。因为它们稳定转导非分裂细胞类型,例如神经元的能力,慢病毒载体(lv)用于对中枢神经系统(cns)的基因治疗方法是特别有利的。已经开发了衍生自非灵长类慢病毒的,尚未知道对于人类是感染性或病原性的lv,如马传染性贫血病毒(eiav),而且确定了其转导非分裂细胞的能力。是一种用于pd治疗的基于马传染性贫血病毒(eiav)的lv。的基因组是三顺反子构建体,其包含由两个内部核糖体进入位点(ires)可操作地连接的三种关键的多巴胺合成酶,即th、aadc和ch1的编码序列。目前正在i/ii期临床试验中进行评估,其中使用在包括三种质粒瞬时共转染hek293t细胞的流程中产生的载体材料(mitrophanous等人,1999genether6,1808-1818)。任何基因治疗方法的一个目标是提高载体的滴度,从而能使用体积更小的载体制备物。这在型治疗中是特别理想的结果,其中将所述载体直接注射到脑中,因此需要使用小体积。ires元件的复杂二级结构可能成为有效逆转录的阻碍。因此,本发明人假设ires元件的去除应该增加载体的滴度。其中一个方案是以编码短肽序列(接头)的序列取代ires元件以产生包含多巴胺合成所需的三种酶活性中的两种或更多种的融合蛋白。然而,因为th的天然形式以同源四聚体存在(goodwill等人,1997natstructbiol4,578-585),而ch1的天然形式以同源十聚体存在(nar等人,1995structure3,459-466;steinmetz等人,1998jmolbiol279,189-199),这些酶彼此或与其它酶,如aadc的融合可能阻止了酶的正确的三级结构形成,然后这可能抑制酶的功能或阻止其以最大的能力发挥功能。支持这一点,先前已经报道,th和β-半乳糖苷酶之间的融合是无酶活性的(wu和cepko(1994),jneurochem62:863-72)。令人惊奇的是,本发明人发现对于导致升高的l-dopa和/或多巴胺产生水平的一些构建体,两种或全部三种多巴胺合成酶的融合导致i)功能性酶;和ii)增强的多巴胺生物合成途径。特别的是,与使用具有以ires序列分隔的编码多巴胺合成酶的全部三种基因的构建体获得的水平相比时,对于一些构建体观察到增强的多巴胺的产生。与预期相反,对于许多构建体,这些融合设计带来的改善与载体滴度的增加没有关联,表明ires序列对滴度不具有抑制作用。此外,l-dopa和多巴胺升高的水平并不是由于来自融合设计载体的蛋白表达的增加引起的,表明融合设计具有更高的比活性。附图说明图1-编码多巴胺酶融合体的基因组的示意图。图2-ponyk-taic的载体产量和hek293t细胞中整合的载体的儿茶酚胺产量a)dna整合分析评估载体滴度的结果b)hplc分析评估儿茶酚胺产量的结果。图3-载体和儿茶酚胺产量a)dna整合分析评估载体滴度的结果b)hplc分析评估hek293t细胞中产量的结果。图4-通过western印迹分析检测产多巴胺通路中的蛋白。图5-五个融合构建体的载体和儿茶酚胺产量a)dna整合分析评估载体滴度的结果b)hplc分析评估hek293t细胞中儿茶酚胺产量的结果。图6-通过western印迹分析检测产多巴胺通路中的蛋白。a)western印迹分析检测th的表达b)western印迹分析检测ch1的表达c)western印迹分析检测aadc的表达。图7-显示th的截短形式通过gs15接头与aadc连接的图。图8-通过western印迹分析检测hek293t转导细胞的产多巴胺通路中的蛋白。a)western印迹分析检测th的表达b)western印迹分析检测ch1的表达c)western印迹分析检测aadc的表达。*th融合ch1的正确条带的大小为68kda,而且虽然在这些泳道中可以看到条带,在这个大小在所有其它泳道中存在一条非特异性条带。然而,条带在强度上比非特异性条带更暗。图9-dna整合分析评估未浓缩和浓缩的融合载体制备物的载体滴度的结果。图10-以moi1用eiav载体转导的纹状体神经元a)经eiav-gfp转导的纹状体神经元(moi1)b)经载体转导的纹状体神经元的儿茶酚胺产量。图11-tciamod的载体产量和整合的载体的儿茶酚胺产量a)dna整合分析评估载体滴度的结果b)hplc分析评估hek293t细胞中儿茶酚胺产量的结果。图12–用ponyk1、融合体和gfp载体对人原代皮质神经元的转导a)来自以moi2和10用eiav-gfp载体转导的人原代皮质神经元的图像b)以moi0.4用eiav载体转导的人原代皮质神经元的儿茶酚胺产量(减去gfp背景水平)-收获1(转导后5天)。图13-通过western印迹分析对经转导的人皮质神经元的多巴胺合成酶的检测a)western印迹分析检测th的表达b)western印迹分析检测aadc的表达。图14-显示在第1天立体定位载体给药后的临床评价分数(最高14)的图。图15–在基线(基线)、mptp损伤后(mptp),和最后oxb-102载体给药后3个月(mptp3mpi)的猕猴脑的pet图像。在不同的时机用放射性示踪剂18f-fmt(18f-fmtyr)和18f-fallypride(18f-fallypride)治疗动物。技术实现要素:本发明人已经测试了大量包含多巴胺合成酶酪氨酸羟化酶(th)、gtp-环化水解酶i(ch1)、芳香族氨基酸多巴脱羧酶(aadc)的构建体,所述构建体包含3种基因中的至少2种的融合体。作为本研究的结果,出现了两个明显的主题:(i)具有以所述顺序连接(即形成th-ch1融合蛋白)的th和ch1的构建体给出高的儿茶酚胺产量绝对水平;及(ii)具有以任何顺序(即形成aadc-th或th-aadc融合蛋白)连接的aadc和th的构建体给出l-dopa到多巴胺的高效转化。与这样的构建体相关的多巴胺:l-dopa的比值是较高的。在本发明的第一方面的第一实施方案中,本发明提供一种构建体,其包含(i)编码酪氨酸羟化酶(th)的核苷酸序列,(ii)编码gtp-环化水解酶i(ch1)的核苷酸序列和(iii)编码芳香族氨基酸多巴脱羧酶(aadc)的核苷酸序列,其中编码th的核苷酸序列与编码ch1的核苷酸序列相连,使得它们编码融合蛋白th-ch1。所述构建体可以选自如下:th-l-ch1-ires-aadc;aadc-l-th-l-ch1;th-l-ch1-l-aadc;和th-l-ch1-p-aadcl=接头编码序列ires=内部核糖体进入位点p=启动子所述构建体可以不包含启动th-ch1融合蛋白翻译且在th-ch1编码序列上游的ires。在本发明的第一方面的第二实施方式中,本发明提供一种构建体,其包含(i)编码酪氨酸羟化酶(th)的核苷酸序列,(ii)编码gtp-环化水解酶i(ch1)的核苷酸序列和(iii)编码芳香族氨基酸多巴脱羧酶(aadc)的核苷酸序列,其中编码aadc的核苷酸序列可操作地与编码th的核苷酸序列相连,使得它们编码aadc-th或th-aadc融合蛋白。所述构建体可以选自如下:th-l-aadc-ires-ch1aadc-l-th-ires-ch1aadc-l-th1-l-ch1th1-l-aadc-l-ch1l=接头编码序列ires=内部核糖体进入位点所述构建体可以包含不是为人类使用而密码子优化的接头。所述构建体可以包含接头,其包含如seqidno.1所示的序列或如seqidno.3所示的序列。所述构建体可以具有序列aadc-l1-th-l2-ch1或th-l1-aadc-l2-ch1,其中l1和l2是两个不同的接头序列。l1和l2的核酸序列可以是不同的,但是l1和l2的氨基酸序列可以是相同的。在替代方案中,l1和l2可以具有相同的核苷酸序列。l1和l2可以选自seqidno.1或seqidno.3。在所述构建体包含启动子的情况中,所述启动子可以例如是组成型启动子或组织特异性启动子。组成型启动子的例子包括cmv启动子、磷酸甘油酸激酶启动子和胸苷激酶启动子。在第二方面中,本发明提供一种包含根据本发明第一方面的构建体的病毒载体基因组。所述病毒载体基因组可以例如是慢病毒载体基因组或腺伴随病毒载体基因组。在第三方面中,本发明提供一种包含根据本发明第二方面的基因组的病毒载体系统。所述病毒载体系统可以例如是慢病毒载体系统或腺伴随病毒载体系统。慢病毒载体系统可以包含:(i)根据本发明第二方面的基因组;(ii)编码gag和pol蛋白的一个或多个核苷酸序列;(iii)编码未由ii)的核苷酸序列编码的其它必需的病毒包装组件的核苷酸序列。在第四方面中,本发明提供一种生产慢病毒颗粒的方法,所述方法包括将对生产细胞导入:i)根据本发明第二方面的基因组,ii)编码gag和pol蛋白的一个或多个核苷酸序列;和(iii)编码未由ii)的一个或多个核苷酸序列编码的其它必需的病毒包装组件的核苷酸序列。在第五方面中,本发明提供通过本发明第三方面的系统或通过本发明第四方面的方法产生的病毒颗粒,其包含编码多巴胺合成酶gtp-环化水解酶i(ch1)、酪氨酸羟化酶(th)和芳香族氨基酸多巴脱羧酶(aadc)的nois,其中的至少两种以融合蛋白存在。也提供一种根据本发明第五方面的病毒载体颗粒,其是eiav载体颗粒并是用vsv-g假型化过的(psedotyped)。在第六方面中,本发明提供一种药物组合物,其包含根据本发明第五方面的病毒颗粒,以及药学上可接受的载体或稀释剂。在第七方面中,本发明提供一种在体内生产多巴胺的方法,所述方法包括在受试者中从根据本发明第一方面的构建体表达多巴胺合成酶gtp-环化水解酶i(ch1)、酪氨酸羟化酶(th)和芳香族氨基酸多巴脱羧酶(aadc)的步骤。在第八方面中,本发明提供一种用于治疗和/或预防神经变性疾病或多巴胺水平在受试者中降低的疾病的方法,其包含对受试者给药根据本发明第五方面的病毒颗粒或根据本发明第六方面的药物组合物的步骤。在第九方面中,本发明提供根据本发明第五方面的病毒颗粒或根据本发明第六方面的药物组合物,其用于通过诱导体内多巴胺合成在受试者中治疗和/或预防神经变性疾病。所述神经变性疾病可以是帕金森氏病。多巴胺水平降低的疾病可以是lesch-nyhan综合征。在第十方面中,本发明提供核苷酸序列,其编码具有如seqidno.2所示氨基酸序列的接头,但是该核苷酸序列与seqidno.3所示的序列具有不同的序列。所述核苷酸序列可以缺少密码子对ggaggc。所述核苷酸序列可以包含如seqidno.1所示的序列。具体实施方式构建体本发明的第一方面涉及构建体。所述核苷酸序列包含感兴趣的核苷酸序列(noi),其中每一个均编码酶活性。所述构建体可以是dna或rna序列,例如合成的rna/dna序列、重组rna/dna序列(即通过使用重组dna技术准备的)、cdna序列或部分基因组dna序列,包括其组合。本发明还包括载体,例如包含本发明的构建体的质粒。noi在所述构建体中的每个noi编码参与多巴胺合成的酶。noi编码酪氨酸羟化酶(th)、gtp-环化水解酶i(ch1)和芳香族氨基酸多巴脱羧酶(aadc)。全部三种酶的序列可获得:分别为登录号x05290、u19523和m76180。noi可编码全部或部分的多巴胺合成酶。例如,noi可编码保留酶活性的蛋白的截短形式。全长th包含催化域、四聚化域和n-端调节域。本发明的载体的th-编码noi可编码包含催化和四聚化域,但缺少功能性n-端调节域的截短th。这种形式的th避免了可能限制全长酶的活性的多巴胺反馈抑制。noi可编码多巴胺合成酶的突变体,同系物或变体。术语“突变体”包括包含野生型序列的一个或多个氨基酸变异的酶。例如,突变体可以包括一个或多个氨基酸添加、缺失或取代。突变可能自然地产生,也可以人工创造(例如通过定点诱变)。本文中,术语“同系物”是指与多巴胺合成酶具有一定同源性的蛋白。本文中,术语“同源性”可等同于“同一性”。在本文中,同源序列可以是在氨基酸或核苷酸水平与目标序列至少75、85或90%相同或至少95或98%相同。通常地,同系物会与目标序列包含或编码相同的活性位点等。可以例如使用blast软件进行同一性比较。noi可以进行密码子优化。接头本发明的慢病毒载体基因组包含3个编码多巴胺合成酶的noi。至少2个noi通过接头编码序列(l)连接,使得所述基因组编码包含所述酶氨基酸序列的融合蛋白。合适的接头可包含氨基酸重复,如甘氨酸-丝氨酸重复。接头的目的是允许酶的正确形成和/或发挥功能。它应具有足够的柔性和足够的长度以达到该目的。由于noi编码不同的酶,需要选择接头以允许两种酶发挥功能。可选择柔性接头的编码序列以使得其促进翻译暂停以及由此的noi的蛋白产物的独立折叠。本领域技术人员能够设计出适用于本发明的核苷酸序列的接头编码序列。合适的接头的一些特定的例子在下文给出,但本发明并不局限于这些特定的接头。1.如somia等人,1993pnas90,7889描述的(gly-gly-gly-gly-ser)3。2.(gly-gly-gly-gly-ser)5。3.来自酵母hsf1的(asn-phe-ile-arg-gly-arg-glu-asp-leu-leu-glu-lys-ile-ile-arg-gln-lys-gly-ser-ser-asn),参见wiederrecht等人,1988cell54,841。4.来自pou特异性oct-1的(asn-leu-ser-ser-asp-ser-ser-leu-ser-ser-pro-ser-ala-leu-asn-ser-pro-gly-ile-glu-gly-leu-ser),参见dekker等人,1993nature362,852和sturm等人,1988genesanddev.2,1582。5.来自含rgd的层粘连蛋白肽的(gln-gly-ala-thr-phe-ala-leu-arg-gly-asp-asn-pro-glngly),参见aumailly等人,1990feeslett.262,82。6.来自含ldv的接头的(ser-gly-gly-gly-glu-ile-leu-asp-val-pro-ser-thr-gly-glyser-ser-pro-gly),参见wickham等人,genetherapy19952,750。可以使用于下面的gs15柔性接头:(gly-gly-gly-gly-ser)3。gs5、gs15、gs30接头也可以是合适的。在包含两个接头的构建体中,即连接所有三种酶以作为一个融合蛋白表达,可以选择两个不同的接头编码序列,或者接头序列可以是相同的。接头序列在氨基酸水平上可以是相同的,但由于遗传密码上的简并性,它们的编码核酸序列可能不同。如下面的实施例所示,在th和ch1基因之间使用经修饰的gs15接头编码序列(gs15mod)导致用两种构建体的儿茶酚胺产量的增加,尽管没有蛋白表达增加的证据。在本发明的核苷酸序列中使用的接头编码序列可以是未为人类使用而密码子优化的接头编码序列的修饰形式,例如编码gs5、gs15和gs30的。接头编码序列可以包含以下序列:ggaggtggcgggtccgggggcgggggtagcggtggcgggggctcc(seqidno.1)。本发明的第十个方面涉及编码具有如seqidno.2所示氨基酸序列的接头的核苷酸序列,但所述核苷酸序列具有与seqidno.3所示不同的序列。(gly-gly-gly-gly-ser)3(seqidno.2)。gggggaggcggtagcggcggagggggctccggcggaggcgggagc(seqidno.3)。所述构建体可以包含如seqidno.1所示序列(见上文)。ires在mrna中当位于开放阅读框之间,ires通过促进在ires元件的核糖体进入及随后翻译的下游起始而允许下游开放阅读框的翻译。在逆转录病毒载体中ires元件的使用已经进行了研究(参见,例如wo93/0314)。适于在慢病毒载体中使用的ires序列描述于wo02/29065中。启动子可以以启动子替换ires,特别是为了控制aadc基因的表达。在aadc的表达是在ires的控制下的构造中,aadc水平可能限制多巴胺的产生。noi的表达可用控制序列进行控制,这些控制序列包括启动子/增强子和其他表达调节信号。可以使用原核启动子和在真核细胞中有功能的启动子。可以使用组织特异性启动子或刺激特异性启动子。还可使用包含来自两种或更多种不同启动子的序列元件的嵌合启动子。合适的启动序列是强启动子,包括那些衍生自病毒(如多瘤病毒、腺病毒、禽痘病毒、牛乳头状瘤病毒、禽肉瘤病毒、巨细胞病毒(cmv)、逆转录病毒和猿病毒40(sv40))的基因组的启动子,或者衍生自哺乳动物细胞启动子(如肌动蛋白启动子或核糖体蛋白启动子)的启动子。可通过将增强子序列插入到载体中,来进一步提高基因的转录。增强子是相对取向和位置独立的;但是,可以采用来自真核细胞病毒的增强子,如在复制起点的后期侧(lateside)的sv40增强子(bp100-270)和cmv早期启动子增强子。增强子可在相对于启动子的5’或3’的位置剪接到载体中,但优选位于相对于启动子的5’位点。启动子可另外包括用以确保或提高在合适宿主中的表达的特征。例如,特征可以是保守区域,例如pribnow框或tata框。启动子可甚至含有用以影响(如维持、增强、降低)核苷酸序列的表达水平的其他序列。合适的其他序列包括sh1内含子或adh内含子。其他序列包括可诱导元件,如温度、化学、光和应激可诱导元件。还可存在用以增强转录或翻译的合适元件。例如启动子可以是组成型或组织特异的。组成型启动子合适的组成型启动子的例子包括cmv启动子、rsv启动子、磷酸甘油酸激酶(pgk)和胸苷激酶(tk)启动子。组织特异性启动子合适的组织特异性启动子的例子包括突触素(synapsin)1、烯醇化酶、α-钙/钙调蛋白依赖性蛋白激酶ii和gfap融合本发明的构建体包含编码th、aadc和ch1的noi。三种中的两种,或所有三种酶可以是融合的,例如通过使用柔性接头。若两种酶是融合的,编码第三种酶的noi可以可操作地与编码融合蛋白的核苷酸序列连接,例如通过ires。ires可以位于编码融合蛋白的核苷酸序列的5’或3’。或者,编码第三种酶的noi可以可操作地与启动子连接。本发明人发现了:(i)具有以所述顺序(即以形成th-ch1融合蛋白)与ch1连接的th的构建体给出高的儿茶酚胺产量绝对水平;及(ii)具有以任何顺序(即形成aadc-th或th-aadc融合蛋白)连接的aadc和th的构建体给出l-dopa到多巴胺的高效转化。考虑每种构建体产生的蛋白(即酶)的量是重要的。对于一些构建体,产生的蛋白的绝对水平较低,但l-dopa和/或多巴胺的水平相对较高。这表明在所述特定构造中的酶的效率是高的,因为较低量的酶产生相当量的l-dopa/多巴胺。表1显示了转导神经元细胞后每种构建体的总儿茶酚胺产量。根据总儿茶酚胺产量排名构建体。在相同的实验中ponyk1的儿茶酚胺生产显示在括号中。构建体儿茶酚胺产量(ng/ml)神经元细胞类型图tcia80.1(0.5)大鼠纹状体神经元10batcmod25.6(0.5)大鼠纹状体神经元10btctka25.5(0.6)原代皮质神经元(人)12bctia10.8(0.5)大鼠纹状体神经元10batc8.6(0.5)大鼠纹状体神经元10btciamod5.6(0.6)原代皮质神经元(人)12btaic5.2(0.5)大鼠纹状体神经元10btacmod2.9(0.6)原代皮质神经元(人)12btcamod2(0.5)大鼠纹状体神经元10btca1.6(0.5)大鼠纹状体神经元10batic0.7(0.5)大鼠纹状体神经元10b表2显示了转导神经元细胞后每种构建体的多巴胺:l-dopa比率。根据多巴胺:l-dopa比率排名构建体。在相同的实验中ponyk1的多巴胺:l-dopa比率显示在括号中。构建体多巴胺:l-dopa比率神经元细胞图tacmod28(-)*原代皮质神经元(人)12batcmod5.2(0.7)大鼠纹状体神经元10batc3.5(0.7)大鼠纹状体神经元10btciamod2.7(-)*原代皮质神经元(人)12btaic1.7(0.7)大鼠纹状体神经元10batic1.3(0.7)大鼠纹状体神经元10btcamod1(0.7)大鼠纹状体神经元10btca0.5(0.7)大鼠纹状体神经元10btcia0.1(0.7)大鼠纹状体神经元10bctia0.01(0.7)大鼠纹状体神经元10btctka0.01(-)*原代皮质神经元(人)12b*背景水平修正后对于ponyk没有检测到l-dopa构建体ctia没有显示改进的性能。不希望受理论的束缚,本发明人认为,tcia表现出改进的性能,而ctia却没有的原因是因为在tc融合中酶的顺序是重要的。因此本发明的构建体以tc而不是ct的顺序编码th和ch1的融合体。所述构建体可以选自以下:th-l-ch1-ires-aadc;aadc-l-th-l-ch1;th-l-ch1-l-aadc;和th-l-ch1-p-aadcth-l-aadc-ires-ch1aadc-l-th-ires-ch1th1-l-aadc-l-ch1l=接头编码序列ires=内部核糖体进入位点p=启动子如上述的,th包含催化域、四聚化域和n-端调节域。th-编码noi可编码包含催化和四聚化域,但缺少功能性n-末端调节域的截短的th。图7显示了构建体的序列,其中通过gs15接头将th的截短形式的c-末端与aadc的n-末端融合。或者,ch1可通过其n末端融合,使其c-末端游离。病毒载体本发明还提供了包含根据本发明第一方面的核苷酸序列的病毒载体基因组,例如慢病毒载体基因组或腺伴随病毒载体基因组。本发明还提供了病毒载体生产系统和包含所述基因组的载体颗粒。本发明的病毒载体可以衍生自任何合适的病毒。重组病毒颗粒能够用感兴趣的核苷酸序列(noi)转导靶细胞。对于逆转录病毒颗粒,一旦在细胞内,载体颗粒的rna基因组逆转录成dna并整合到靶细胞基因组中。慢病毒载体慢病毒是较大的逆转录病毒组的一部分。慢病毒的详细列表可见于coffin等人.(1997)“retroviruses”coldspringharborlaboratorypress,编辑:jmcoffin,smhughes,hevarmus,第758-763页)。简言之,慢病毒可分成灵长类和非灵长类组。灵长类慢病毒的例子包括但不限于:人免疫缺陷病毒(hiv)(获得性免疫缺陷综合征(aids)的致病因子)和猿免疫缺陷病毒(siv)。非灵长类慢病毒组包括原型“慢病毒”即绵羊髓鞘脱落/梅迪病毒(visan/maedivirus,vmv)以及相关的山羊关节炎-脑炎病毒(caev)、马传染性贫血病毒(eiav)和猫免疫缺陷病毒(fiv)和牛免疫缺陷病毒(biv)。慢病毒与逆转录病毒家族的其它成员的不同之处在于慢病毒具有感染分裂细胞和非分裂细胞两者的能力(lewis等人.(1992);lewis和emerman(1994))。相反,其他逆转录病毒如mlv不能够感染非分裂细胞或者缓慢分裂细胞,如那些构成例如肌肉、眼、脑、肺和肝组织的细胞。本文所用的慢病毒载体是包含至少一个可衍生自慢病毒的组成部分的载体。优选地,该组成部分参与载体感染细胞、表达基因或进行复制的生物学机制。逆转录病毒和慢病毒基因组的基本结构共享许多共同的特征,如5’ltr和3’ltr(其间或其内定位有包装信号以使得基因组能够被包装)、引物结合位点、附着位点(以使得能够整合到宿主细胞基因组中)和编码包装成分的gag、pol和env基因(这些是病毒颗粒的装配需要的多肽)。慢病毒具有额外的特征,如hiv中的rre序列和rev序列,它们使得整合的原病毒的rna转录物能够有效地从受感染目标细胞的细胞核输出到细胞质。在原病毒中,病毒基因在其两端侧接有称为长末端重复(ltr)的区域。ltr负责转录,其通过充当增强子-启动子序列和多聚腺苷酸化信号,由此控制病毒基因的表达进行。ltr本身是相同的序列,可分成称为u3、r和u5的三个元件。u3衍生自rna的3’端所特有的序列。r衍生自在rna的两端重复的序列,而u5衍生自rna的5’端所特有的序列。在不同的病毒当中,这三个元件的大小可相差甚大。在复制缺陷型慢病毒载体基因组中,gag、pol和env可不存在或者没有功能。在本发明的典型慢病毒载体中,一个或多个对复制必需的蛋白质编码区域的至少一部分可从该病毒去除。这使得该病毒载体成为复制缺陷型。病毒基因组的一些部分还可被noi替代,以产生包含能够转导非分裂靶标宿主细胞和/或能够将其基因组整合到宿主基因组中的noi的载体。在一个实施方案中,逆转录载体是如wo2007/071994中所述的非整合型载体。在另一个实施方案中,载体具有递送没有或缺乏病毒rna的序列的能力。在另一个实施方案中,可使用位于要递送的rna上的异源结合域(异源于gag)和gag或pol上的关联结合域来确保要递送的rna的包装。这两种载体在wo2007/072056中均有描述。慢病毒载体可为“非灵长类”载体,即衍生自主要不感染灵长类(特别是人类)的病毒。病毒载体可以衍生自eiav。除了gag、pol和env基因之外,eiav还编码其他三种基因:tat、rev和s2。tat作用为病毒ltr的转录激活物(derse和newbold(1993)virology194(2):530-536和maury等人,(1994)virology200(2):632-642),而rev通过rev应答元件(rre)调节和协调病毒基因的表达(martarano等人,(1994)jvirol68(5):3102-3111)。s2的功能未知。另外,已鉴定了eiav蛋白ttm,它由被剪接到跨膜蛋白起始处的env编码序列的tat的第一个外显子编码(beisel等人,(1993)jvirol67(2):832-842)。术语“重组慢病毒载体”指这样的载体,其具有足够的慢病毒遗传信息,以让rna基因组在包装成分存在下得以包装到能够感染靶标细胞的病毒颗粒中。靶标细胞的感染可包括逆转录和整合到靶标细胞基因组中。重组慢病毒载体携带着要通过载体递送到靶标细胞的非病毒编码序列。重组慢病毒载体不能够进行独立复制以在最终的靶标细胞中产生传染性慢病毒颗粒。通常,重组慢病毒载体缺乏复制所必需的功能性gag-pol基因和/或env基因和/或其他基因。本发明的载体可构造成分裂-内含子载体(split-intronvector)。分裂-内含子载体在pct专利申请wo99/15683中有描述。本发明的重组慢病毒载体可以具有最低限度的病毒基因组。本文所用的术语“最低限度的病毒基因组”意指病毒载体已经过操纵,从而去除非必需元件,并保留必需元件,以提供感染、转导和递送目的核苷酸序列到靶标宿主细胞所需的功能性。这个策略的更多细节可见于本申请人的wo98/17815。在本发明的一个实施方案中,载体是自身失活型载体(self-inactivatingvector)。举例说,已通过缺失掉转录增强子或者3’ltr的u3区域中的增强子和启动子,构建了自身失活型逆转录病毒载体。经过一轮的载体逆转录和整合之后,这些变化被拷贝到5’和3’ltr中,从而产生无转录活性的原病毒(yu等人,(1986)proc.natl.acad.sci.83:3194-3198;dougherty和temin(1987)proc.natl.acad.sci.84:1197-1201;hawley等人,(1987)proc.natl.acad.sci.84:2406-2410;yee等人,(1987)proc.natl.acad.sci.91:9564-9568)。但是,在这种载体中位于ltr内部的任何启动子将仍是具有转录活性。这个策略已被应用于消除病毒ltr中的增强子和启动子对内部放置的基因的转录的影响。这种影响包括转录增加(jolly等人,(1983)nucleicacidsres.11:1855-1872)或者转录抑制(emerman和temin(1984)cell39:449-467)。这个策略还可用于消除从3’ltr向基因组dna中的下游转录(herman和coffin(1987)science236:845-848)。这在人类基因疗法中是特别值得关注的,在人类基因疗法中非常重要的是防止内源癌基因的偶发性激活。然而,用于在宿主细胞/包装细胞当中产生病毒基因组的质粒载体也将包括转录调节控制序列,这些转录调节控制序列被可操作连接到慢病毒基因组以指导基因组在宿主细胞/包装细胞中的转录。这些调节序列可以是与被转录的慢病毒序列即5’u3区域联合的天然序列,或者它们可以是异源启动子,如另一病毒启动子,例如cmv启动子。一些慢病毒基因组要求额外的序列以便有效产生病毒。例如,在hiv的情况中,优选包括rev和rre序列。但是,通过gag-pol的密码子优化(如wo01/79518中描述的)和/或在ltr下游且内部启动子上游包括开放阅读框(如wo03/064665中描述的)可减少或消除对rev和rre的要求,例如已经在如图1所示的构建体中使用neo,但是本领域技术人员会使用任意合适的开放阅读框。执行与rev/rre系统相同的功能的备选序列也是已知的。例如,rev/rre系统的功能性类似物存在于masonpfizer猴病毒中。这被称为组成型转运元件(cte),包含基因组中据认为与受感染细胞中的某种因子发生相互作用的rre型序列。该细胞因子可认为是rev类似物。因此,cte可用作rev/rre系统的替代物。任何其他已知的或可获得的功能等同物也可以是与本发明相关的。例如,还已知htlv-i的rex蛋白能在功能上替代hiv-1的rev蛋白。还已知rev和rex具有与ire-bp相似的作用。根据本发明的慢病毒载体可以由自身失活型最小限度慢病毒载体组成,该自身失活型最小限度慢病毒载体衍生自马传染性贫血病毒(eiav),优选编码三个参与多巴胺合成途径的酶。由这种载体编码的蛋白质可包含人酪氨酸羟化酶基因的截短形式(其缺乏参与th的反馈调节的n端160个氨基酸)、人芳香族l-氨基酸脱羧酶(aadc)和人gtp-环化水解酶1(gtp-ch1)基因。该载体可通过用三个质粒对细胞(例如hek293t细胞)进行瞬时转染来产生,所述质粒编码:(1)如本文中描述的载体基因组、(2)合成的eiavgag/pol表达载体(pesgpk,wo01/79518、wo05/29065)和(3)vsv-g包膜表达载体(phgk)。包装序列术语“包装信号”可与“包装序列”或“psi”互换使用,是用来指在病毒颗粒形成过程中慢病毒rna链的包壳作用所需的非编码性顺式作用序列。在hiv-1中,这个序列已被定位于从主要剪接供体位点(sd)的上游延伸到至少gag起始密码子的基因座。本文所用的术语“延伸的包装信号”或“延伸的包装序列”指在psi序列的周围使用进一步延伸到gag基因中的序列。包含这些额外的包装序列可提高载体rna向病毒颗粒中的插入效率。假型化本发明的逆转录载体可以是假型化的。在这点上,假型化可赋予一个或多个优点。例如,对于慢病毒载体,基于hiv的载体的env基因产物会使这类载体局限于仅感染能表达称为cd4的蛋白质的细胞。但如果这些载体中的env基因已被来自其他病毒的env序列替换,则它们可具有更广的感染谱(verma和somia(1997)nature389(6648):239-242)。举例说,miller等人用来自双嗜性逆转录病毒4070a的包膜对momlv载体假型化(mol.cell.biol.5:431-437),其他工作者用来自vsv的糖蛋白对基于hiv的慢病毒载体假型化(verma和somia(1997)nature389(6648):239-242)。在另一种备选中,env蛋白可以是修饰的env蛋白,如突变体或工程改造的env蛋白。可作出或选择修饰,以引入靶向能力或者减少毒性或者为了别的目的(valsesia-wittman等人,(1996)jvirol70(5):2957-2962;nilson等人,(1996)genether3(4):280-286;和fielding等人,(1998)blood91(5):1802-1809及其中引用的参考文献)。例如,可以用编码狂犬病g蛋白或vsv-g蛋白的至少一部分的基因对载体假型化。vsv-g水疱性口炎病毒(vsv,一种弹状病毒(rhabdovirus))的包膜糖蛋白(g)是已被证实能够对某些逆转录病毒(包括慢病毒)进行假型化的包膜蛋白。emi等人,(1991)j.virol.65:1202-1207)第一次显示了它在不存在任何逆转录病毒包膜蛋白的情况下对基于momlv的逆转录病毒载体进行假型化的能力。wo94/294440教导了逆转录病毒载体可成功地用vsv-g进行假型化。这些经假型化的vsv-g载体可用于转导很多种哺乳动物细胞。更近期,abe等人,(1998)j.virol.72(8):6356-6361教导了可通过加入vsv-g使非传染性逆转录病毒颗粒变成传染性的。burns等人,(1993)proc.natl.acad.sci.usa90:8033-7)成功地用vsv-g对逆转录病毒mlv进行假型化,这导致产生与天然形式的mlv相比具有改变的宿主范围的载体。已证实vsv-g假型化的载体不仅感染哺乳动物细胞,而且感染衍生自鱼类、爬行动物和昆虫的细胞系(burns等人,(1993)出处同上)。还证实了它们对于多种细胞系而言比传统的双嗜性包膜更有效(yee等人,(1994)proc.natl.acad.sci.usa91:9564-9568,和emi等人,(1991)j.virol.65:1202-1207)。vsv-g蛋白还可用于对某些慢病毒和逆转录病毒进行假型化,因为它的胞质尾区能够与逆转录病毒核心发生相互作用。非慢病毒假型化包膜如vsv-g蛋白的提供可得到这样的优点,即载体颗粒能被浓缩至高滴度而不损失传染性(akkina等人,(1996)j.virol.70:2581-5)。慢病毒和逆转录病毒包膜蛋白显然不能够承受超离心法过程中的剪切力,大概是因为它们由两个非共价连接的亚单位组成。离心可破坏亚单位之间的相互作用。相比之下,vsv糖蛋白由单一单位组成。vsv-g蛋白假型化因此可提供潜在的优点。wo00/52188描述了从具有水疱性口炎病毒g蛋白(vsv-g)作为膜缔合性病毒包膜蛋白的稳定的生产细胞系产生假型化的逆转录病毒载体,并提供了vsv-g蛋白的基因序列。罗斯河病毒(rossrivervirus)罗斯河病毒包膜已被用于对非灵长类动物慢病毒载体(fiv)进行假型化,经全身给予后主要转导肝脏(kang等人,(2002)jvirol76(18):9378-9388.)。据报道效率比用vsv-g假型化载体获得的效率大20倍,并且造成更低的细胞毒性,细胞毒性是通过提示肝毒性的肝酶类的血清水平来测量。罗斯河病毒(rrv)是一种由蚊子传播的甲病毒(alphavirus),其是在澳大利亚的热带和温带地区地方性和流行性的。温带沿海地区正常人口中的抗体比率往往较低(6%至15%),但在墨累河流域(murrayvalleyriversystem)的平原中血清流行率达到27至37%。在1979到1980年,罗斯河病毒在太平洋诸岛流行开来。这种疾病在人群中没有传染性且决不会致命,在大约一半的患者中初始症状为关节痛伴疲乏和嗜眠(fieldsvirologyfifthedition(2007)eds.knipe和howley.lippincottwilliams和wilkins)。杆状病毒gp64对于用于大规模生产临床和商业应用所需的高滴度病毒的病毒载体而言,已证实杆状病毒gp64蛋白是vsv-g的引人注目的替代物(kumarm,bradowbp,zimmerbergj(2003)hum.genether.14(1):67-77)。与vsv-g假型化载体相比,gp64假型化的载体具有相似的广泛向性和相似的天然滴度。由于gp64表达不会杀死细胞,可产生出组成型表达gp64的基于293t的细胞系。狂犬病g在本发明中,可用狂犬病g蛋白或其突变体、变体、同源物或其片段的至少一部分对载体进行假型化。有关狂犬病g蛋白及其突变体的教导可见于wo99/61639以及rose等人,(1982)j.virol.43:361-364,hanham等人,(1993)j.virol.67:530-542,tuffereau等人,(1998)j.virol.72:1085-1091,kucera等人,(1985)j.virol.55:158-162,dietzschold等人,(1983)pnas80:70-74,seif等人,(1985)j.virol.53:926-934,coulon等人,(1998)j.virol.72:273-278,tuffereau等人,(1998)j.virol.72:1085-10910,burger等人,(1991)j.gen.virol.72:359-367,gaudin等人,(1995)j.virol.69:5528-5534,benmansour等人,(1991)j.virol.65:4198-4203,luo等人,(1998)microbiol.immunol.42:187-193,coll(1997)arch.virol.142:2089-2097,luo等人,(1997)virusres.51:35-41,luo等人,(1998)microbiol.immunol.42:187-193,coll(1995)arch.virol.140:827-851,tuchiya等人,(1992)virusres.25:1-13,morimoto等人,(1992)virology189:203-216,gaudin等人,(1992)virology187:627-632,whittetal(1991)virology185:681-688,dietzschold等人,(1978)j.gen.virol.40:131-139,dietzschold等人,(1978)dev.biol.stand.40:45-55,dietzschold等人,(1977)j.virol.23:286-293和otvos等人,(1994)biochim.biophys.acta1224:68-76。狂犬病g蛋白在ep0445625也有描述。另选的包膜其他可用于对逆转录病毒载体进行假型化的包膜包括mokola、ebola、4070a和lcmv(淋巴细胞性脉络丛脑膜炎病毒)。腺伴随病毒载体本领域已知腺伴随病毒(aav)载体具有有限的包装能力,因此对可以有效递送的基因数目有负面影响。然而,现在已经知道这种限制依赖于aav血清型。例如,aav5和7血清型的衣壳可以包装高达8kb的基因组。这项工作描述于us7,943,374。此外,us2009/0214478描述了包装容量高达9kb的aav2/5重组载体。aav载体的特征是本领域普通技术人员公知的。例如,aav载体具有广泛的宿主范围并以相对低的免疫原性转导分裂和非分裂的细胞。如何以遗传盒替换所有aav病毒基因,在原位留下唯一的顺式作用aav元件、反向末端重复(itr)、dna包装信号、和复制起点也是众所周知的。参见例如,musatov等人,j.virol.,dec2002,76(24)。当aav基因产物,rep和cap,以及其他辅助蛋白以反式提供时,在生产细胞中可以包装腺伴随病毒。已经描述了aav包装系统。参见例如,us5,139,941。非aav辅助功能可以由任何已知的辅助病毒,如腺病毒、单纯疱疹病毒、以及牛痘病毒提供。已经描述了这样的aav包装系统,例如,在us4,797,368;us5,139,941;us5,866,552;us6,001,650;us6,723,551中。密码子优化本发明中所用的多核苷酸(包括noi和/或载体成分)可经过密码子优化。密码子优化之前在wo99/41397和wo01/79518中已有描述。不同的细胞在它们对具体密码子的用法上存在差异。这个密码子偏向对应于具体trna在该细胞类型中的相对丰度的偏向。通过改变序列中的密码子,从而将它们定制成匹配相应的trna的相对丰度,则有可能提高表达。相似地,通过有意选择已知其相应的trna在特定细胞类型中稀有的密码子,有可能降低表达。因此,可得到额外的转录控制程度。许多病毒(包括hiv和其他慢病毒)使用大量的稀有密码子,通过将这些改变为对应于常用的哺乳动物密码子,可实现目的基因(例如目的核苷酸或包装成分)在哺乳动物生产细胞中的表达增加。本领域已知哺乳动物细胞以及多种其他生物的密码子选择表。病毒载体成分的密码子优化具有许多其他优点。对于编码为病毒颗粒在生产细胞/包装细胞中的装配所必需的病毒颗粒包装成分的核苷酸序列,通过在它们的序列中作出变更,可使rna不稳定性序列(ins)从中去除。同时,包装成分的氨基酸序列编码序列得以保持,使得由所述核苷酸序列编码的病毒成分保持相同或至少充分相似,从而包装成分的功能不受损害。在慢病毒载体中,密码子优化还能克服输出对rev/rre的需求,从而使得经优化的序列不依赖于rev。密码子优化还能减少载体系统当中的不同构建物之间(例如gag-pol开放阅读框和env开放阅读框中的重叠区域之间)的同源重组。因此,密码子优化的总体效果是病毒滴度明显提高和安全性改善。在一个实施方案中,仅对与ins相关的密码子进行密码子优化。但是,在更为优选和实用的实施方案中,序列全部都进行密码子优化,但有一些例外,例如涵盖gag-pol的移码位点的序列(见下文)。gag-pol基因包含编码gag-pol蛋白的两个重叠阅读框。两种蛋白质的表达都依赖于翻译过程中的移码。这个移码是因为核糖体在翻译过程中“滑动”而产生。这个滑动据认为至少部分上由核糖体失速(ribosome-stalling)rna二级结构造成。这种二级结构存在于gag-pol基因中的移码位点的下游。对于hiv,重叠区域从gag始端下游的核苷酸1222(其中核苷酸1为gagatg的a)延伸至gag的末端(nt1503)。因此,横跨两个阅读框的移码位点和重叠区域的281bp片段优选不进行密码子优化。保留这个片段将使得能够更有效地表达gag-pol蛋白。对于eiav,重叠的始端据认为是nt1262(其中核苷酸1为gagatg的a)。重叠的末端在1461bp。为了确保移码位点和gag-pol重叠得到保存,已保持了野生型序列的nt1156至1465。可作出与最佳密码子选择的偏差,例如以适应便利的限制位点,并且可将保守氨基酸变化引入到gag-pol蛋白中。在一个实施方案中,密码子优化是基于少量表达的(lightlyexpressed)哺乳动物基因。可改变第三个碱基,有时可改变第二和第三个碱基。由于遗传密码的简并性,应理解,技术人员可实现许多个gag-pol序列。另外,有许多逆转录病毒变体得到了描述,它们可用作产生经密码子优化的gag-pol序列的起始点。慢病毒基因组可以是十分易变的。例如,存在着许多仍有功能的hiv-1准种。对于eiav情况也是一样。这些变体可用于增强转导过程的各个具体部分。hiv-1变体的例子可在losalamosnationalsecurity,llc运行的hiv数据库(http://hiv-web.lanl.gov)中找到。有关eiav克隆的细节可在美国国家生物技术信息中心(ncbi)数据库(位于http://www.ncbi.nlm.nih.gov)中找到。用于密码子优化的gag-pol序列的策略可针对任何逆转录病毒使用。这将适用于所有的慢病毒,包括eiav、fiv、biv、caev、vmr、siv、hiv-1和hiv-2。另外,这个方法可用于提高来自htlv-1、htlv-2、hfv、hsrv和人内源逆转录病毒(herv)、mlv及其他逆转录病毒的基因的表达。密码子优化可使gag-pol表达不依赖于rev。但是,为了使得能够在慢病毒载体中使用抗rev或rre因子,有必要使病毒载体产生系统完全不依赖于rev/rre。因此,基因组还需要加以修饰。这通过优化载体基因组成分来实现。有利地,这些修饰还导致产生出在生产细胞和在被转导的细胞中都没有所有附加蛋白质的更安全的系统。活性本发明的融合构建体产生功能性多巴胺合成酶并当与使用含有如wo02/29065中描述的以ires序列分离的所有三个编码多巴胺合成酶基因的构建体获得的水平相比时,可导致多巴胺生产的增加。在细胞内表达时本发明的载体可导致比wo2001/04433描述的载体ponyk1增加的l-dopa和/或多巴胺产量。在多巴胺和/或l-dopa生产上,本发明的载体可给予至少2、3、5、10、15、20、30、40、50、60、80、80、90、100、120、130、140、150、160、200、500、1000倍的增加。在例如,hek293t细胞或pc-12细胞中表达时,本发明的载体可导致比ponyk1增加的l-dopa和/或多巴胺产量。可通过任何数量的本领域已知的方法,如高效液相色谱(hplc)测定多巴胺或l-dopa的产生。不希望受理论的束缚,本发明人表明融合蛋白增加了l-dopa和/或多巴胺的合成,因为编码的蛋白物理上接近在一起,从而利于它们之间的相互作用。这对多巴胺生物合成途径的酶是特别有利的,因为每种酶的物理接近可能利于从一种酶流到其他酶的有效代谢,使得l-dopa或多巴胺生产最大化。如实施例中所示和表1(上述)所总结,一些融合构建体给予了改善的l-dopa产生而一些给予改善的多巴胺产生。药物组合物本发明的慢病毒载体可以以药物组合物的形式提供。所述药物组合物可通过基因治疗用于治疗个体,其中所述组合物包含治疗有效量的慢病毒载体。可以通过超速离心浓缩病毒制备物。或者,wo2009/153563描述了慢病毒载体下游加工的方法。所得的药物组合物可具有至少107tu/ml,例如从107到109tu/ml,或至少109tu/ml。(如对标准d17或hek293t细胞系滴定的,滴度表示为转导单位每ml(tu./ml)。所述药物组合物可用于治疗人类。所述组合物可以任选地包含药学上可接受的载体、稀释剂、赋形剂或佐剂。药物载体、赋形剂或稀释剂的选择可根据给药的预期途径和标准药物实践选择。所述药物组合物可包含作为载体、赋形剂或稀释剂(在其之外)的任何适当的粘合剂、润滑剂、悬浮剂、包衣剂、增溶剂和其他可有助于或增加病毒进入靶部位的载体试剂(例如脂质递送系统)。疾病所述病毒载体可用于治疗神经病学状况。例如,载体可用于治疗和/或预防神经变性疾病。通过受试者中l-dopa和/或多巴胺的产生,所述疾病是可治疗的。所述疾病可以是帕金森(parkinson)氏病。通过用能够递送例如th、gtp-ch1和aadc的载体的基因疗法的治疗,可能对口服l-dopa治疗已经变得难治的晚期阶段pd患者特别有用。本文描述的某些构建体增加了l-dopa的产生,而其他增加了多巴胺的产生。l-dopa增加的产量可能在保留剩余的aadc酶活性并因此至少部分地能够将l-dopa向多巴胺转换的患者中是有用的。这些患者都可能受到常规的l-dopa治疗。例如,th-l-ch1-ires-aadc构建体产生高水平的多巴胺和l-dopa两者,而th-l-aadc-ires-ch1和aadc-l-th-l-ch1产生了相对于l-dopa更高水平的多巴胺。多巴胺增加的产量可能在缺乏足够的内源性aadc活性以处理l-dopa并因此对传统l-dopa治疗不太敏感的晚期患者中是有用的。本发明还提供了用于为帕金森氏病患者选择治疗的方法,其包括基于其产生l-dopa和多巴胺的相对能力选择根据本发明的载体的步骤。给药在本发明中使用的病毒载体是给药到脑,例如通过注射到尾状壳核(caudateputamen)中。载体可以通过每半球一个、两个、三个、四个、五个、六个或更多个道(tract)给药。在先前描述的慢病毒载体给药系统(jarraya等人,(2009)scitranslmed14:1(2)2-4)中,以一种不连续的或“点状”的方式给药所述载体的组合物,通过在道的底部给药一个等分试样(4μl),抽出针不远,然后给药第二个等分试样(3μl),并再抽出针不远,(第二次);然后给药第三个等分试样(3μl),因此沿各针道等份存放在3个点递送共10μl。备选地,如共同未决的英国专利申请第1009052.0号中描述的,可以连续地输注载体。现在本发明将通过实施例进一步地描述,其意在用于帮助本领域普通技术人员实施本发明,而不打算以任何方式限制本发明的范围。实施例实施例1-从ponyk-taic产生载体和从整合的载体产生儿茶酚胺要产生并检测以期与ponyk1相比改善滴度的第1个融合构建体是ponyk-taic(图1)。一式三份使用ponyk-taic或ponyk1基因组产生了慢病毒载体(lv)制备物并通过dna整合分析定量由此产生的载体的滴度(图2a)。这些数据令人惊奇地表明,从ponyk-taic产生的载体的滴度与ponyk1相同,即去除1个ires元件没有改善滴度。以转导的hek293t细胞上清液进行hplc分析以检查产生的l-dopa和多巴胺水平。hplc结果(图2b)表明ponyk1载体转导的细胞相比,ponyk-taic载体转化的细胞在总儿茶酚胺水平上产生2.4倍的增加。两种基因组之间l-dopa水平相当,然而,ponyk-taic的多巴胺水平比ponyk1高15.3倍。因此儿茶酚胺产量得到了改善。总的来说,这意味着与ponyk1载体相比,当用ponyk-taic载体转导细胞时,多巴胺生物合成途径更有效。实施例2-载体产生和从整合的载体产生儿茶酚胺与ponyk-taic和ponyk1一起,测试了另外3种多巴胺酶融合质粒(ponyk-atic、ponyk-tcia、ponyk-atc(图1)。一式三份使用不同基因组质粒的每一种产生了lv制备物并通过dna整合分析定量由此产生的载体的滴度(图3a)。结果表明,所有载体的滴度是相似的,滴度范围从1.3e+05tu/ml至4.0e+05tu/ml。有趣的是,缺少两个ires元件的ponyk-atc在滴度上没有显示出增加,这表明融合构建体不改变载体生产,并且转基因重排gs15接头的存在不影响滴度。hplc分析结果表明用每一种不同载体转导的hek293t细胞导致了不同的儿茶酚胺产量(图3b)。此外,在不同载体之间转化为多巴胺的l-dopa的量显著变化。ponyk1载体表现出最低的多巴胺产生水平和最低的l-dopa向多巴胺的转换。使用ponyk-tcia产生的载体表现出最高的儿茶酚胺产量(比ponyk1高4.8倍),多巴胺水平比ponyk1高13.2倍。因此,似乎当th和ch1作为单独单元表达时,产生了最高的儿茶酚胺水平。有趣的是,将所有三个基因融合在一起以产生三重融合构建体(ponyk-atc),产生一种蛋白,证明与ponyk1相比,多巴胺产量增加了(9.3倍)。实施例3-评估在不同融合质粒转染的hek293t细胞中的多巴胺酶水平为了研究蛋白表达水平,从已用每种融合基因组质粒转染的hek293t细胞的细胞裂解物进行了每种转基因产物(aadc、ch1和th)的western印迹分析(图4)。结果表明,对于每一种不同的融合构建体,存在每一种多巴胺合成酶并具有预测的大小。这表明每种基因组构建体能够表达带gs15接头的多巴胺合成酶,包括三重融合盒(ponyk-atc),因为在所有三个western印迹中可见124kda条带,这是包含所有三种连接的多巴胺酶蛋白的融合蛋白预期的大小。由不同的基因组构建体表达的每种不同蛋白的水平有很大的不同。所有三种蛋白的最高水平似乎表达自ponyk1、ponyk-taic和ponyk-tcia。从ponyk-atc看到蛋白的最低水平。western印迹和hplc结果没有表明蛋白强度之间有直接关系。ponyk1表现出蛋白表达的最高水平之一,但从该质粒制备的载体转化的hek293t细胞中表现出最低的多巴胺产量。实施例4-从5个5融合构建体生成载体和儿茶酚胺如上讨论的,当th和ch1作为单独单元表达时,产生了最高的儿茶酚胺水平。由于使用ponyk-tcia时的l-dopa的水平非常高,aadc的表达水平可能限制l-dopa向多巴胺的转换。因为当基因置于ires序列后其表达降低是已知的,通过增加l-dopa向多巴胺的转化扭转这种构造的方向可能会导致最大化的多巴胺水平,因此首先将aadc基因放置在表达盒中(cmv启动子的下游以最大化其表达,接着是ires,然后th:ch1融合)。因此产生了这个基因组构建体(ponyk-atc,图1)。用ponyk-atc转染的细胞的western印迹结果表明了大融合蛋白的低水平(实施例3)。然而,尽管有这些明显的低水平,从ponyk-atc制备的载体转导的细胞显示了高水平的l-dopa向多巴胺的转化,导致高水平的多巴胺产生。这是令人惊讶的,如果所有这三个编码序列连接在一起,产生一个表达相对较差的大蛋白(124kda)。鉴于使用ponyk-tcia生成的载体表现出最高水平的多巴胺产量和众所周知的事实,ires序列降低基因的表达,可能是以这个相同顺序(th:ch1:aadc)设置的转基因三重融合将导致从转导细胞的增加水平的多巴胺产生。因此,产生了进一步的三重融合构建体ponyk-tca(图1)。产生了修饰的gs15接头,其中氨基酸序列保持不变,而改变了dna序列。将此接头克隆到ponyk-atc和ponyk-tca中,代替th和ch1基因之间的原始gs15接头。这产生了ponyk-atcmod和ponyk-tcamod(图1)。重复生成了用每个不同的基因组质粒得到的载体并通过dna整合分析定量了由此产生的载体(图5)。从结果可以看出,所有构建体的载体滴度是相似的,滴度范围从1.2e+05tu/ml至5.3e+05tu/ml。因此,新的构建体不改变载体的产量,所以转基因的重排和gs15接头和/或修饰的gs15接头的存在不影响滴度。通过hplc分析进行了从转导的hek293t细胞产生的儿茶酚胺,而结果如图5b所示。从新修饰的三重融合构建体(atcmod和tcamod)产生的载体表现出儿茶酚胺水平的进一步增加。两种三重融合构建体转导的细胞的多巴胺产量水平比l-dopa水平高得多,表明对于这些构建体,l-dopa向多巴胺的转化是非常有效的。atcmod载体转导的细胞表现出最高的儿茶酚胺产量水平,与ponyk1转导的细胞相比,在多巴胺产量上有整体6.5倍的增加。具有进一步意义的发现是从修饰的三重融合构建体(在th和ch1之间使用修饰的接头)产生的载体转导的细胞产生的多巴胺水平明显高于使用两个gs15接头具有相同的核苷酸序列的三重融合基因生成的载体产生的细胞。实施例5-评估在用9种不同融合质粒转染的hek293t细胞中的多巴胺酶水平为了检查每个载体基因组的蛋白表达水平,从已被转染了各种载体基因组的hek293t细胞的细胞裂解物进行每种转基因产物(aadc、ch1和th)的western印迹分析(图6)。结果表明,对于所有载体基因组,存在每一种多巴胺合成酶并具有预测的大小,这取决于酶是否融合表达。这对于以前没有测试过的新的构建体(ponyk1-ctia、ponyk1-aitc、ponyk1-tca。ponyk1-atcmod和ponyk1-tcamod)是最重要的。这表明每个基因组构建体均能够在gs15接头的情况下表达多巴胺合成酶。这包括三重融合盒(tca和atc),其中在所有三个western印迹中看到了预期大小(124kda)的蛋白条带。所有三种蛋白的最高水平表达自ponyk1、ponyk1-taic和ponyk1-tcamod(图5)。从ponyk1-atc看到了蛋白的最低水平,其与先前的结果相当(图4)。实施例6-评估在用9种不同融合载体转导的hek293t细胞中的多巴胺酶水平如上所述,从用融合质粒转染的细胞的细胞裂解物进行western分析(图4和6)。接着分析从用每个融合载体转导的细胞的多巴胺合成酶水平。转导细胞的蛋白水平分析对表达自产生的功能性载体的蛋白水平给出了更好的观察。通过对每种多巴胺合成酶的蛋白表达的western印迹分析了已转导每种融合构建体的hek293t细胞,结果如图8所示。印迹表明对于每种载体基因组盒表达了正确大小的蛋白。该数据表明当编码序列被置于ires元件下游时,蛋白水平降低。与带有未修饰的接头(atc和tca)的构建体生成的载体转导的细胞相比,在三重融合构建体中使用修饰的接头(atcmod和tcamod)生成的载体转导的细胞表现出更高水平的多巴胺产量(图3b和图5b)。实施例7–用融合构建体转导大鼠纹状体神经元决定用每种融合载体转导大鼠纹状体神经元,多巴胺替代治疗的目标细胞群,并评估这些原代细胞的儿茶酚胺产量。使用eiav-gfp载体进行初步实验以建立神经元的最佳转导条件(数据未显示)。使用先前描述的每种载体基因组进行载体制造并通过dna整合分析定量未浓缩的载体上清和浓缩的最终载体(图9)。浓缩的载体制备物用于以moi1且一式三份转导纹状体神经元。平行地,以moi1用eiav-gfp载体转导纹状体神经元。进行这步以充当转导的对照,因为通过gfp阳性细胞的存在可以容易地观察到转导的可视化,并且也可作为hplc分析的阴性对照。如从图10a可见的,以moi1用eiav-gfp成功转导了神经元细胞。hplc分析表明使用moi1转导足以检测纹状体培养物中多巴胺和l-dopa的水平(图10b)。图10b表明tcia载体转导的神经元证明了最大的儿茶酚胺产量(80ng/ml),这比ponyk1载体转导的神经元高160倍。然而,大多数检测到的儿茶酚胺(73ng/ml)是l-dopa而不是多巴胺。因此从tcia的l-dopa向多巴胺的转换是低效的。从tcia转导细胞中观察到的l-dopa向多巴胺的低效转换是已经在迄今为止所有的实验中观察到的结果(图3b、图5b、图6b和图10b)。如前面讨论的,由于aadc的限制性表达这几乎是肯定的。为tcia载体更有效地工作,在多巴胺生产方面需要增加aadc的表达水平。然而,将aadc放置于iresth-ch1融合构建体(aitc)之前没有提供一个解决方案,因为用该载体转导的神经元的儿茶酚胺水平较低(图10b),据推测是由于在ires后放置th-ch1导致低的l-dopa水平。在构造上首先与aadc一起将所有三种转基因融合确实改善了l-dopa向多巴胺的转换(参见atc和atcmod转导的神经元的结果),但是与tcia相比,整体儿茶酚胺产量是较低的。然而,用该载体基因组实现的多巴胺水平(21.5mg/ml)是评估的所有构建体中最高的。这代表了与ponyk1转导的神经元相比,在多巴胺水平上107.5倍的增加。用atcmod转导的神经元的多巴胺对l-dopa的比例非常高(5.2),表示l-dopa几乎完全转化为多巴胺。这种l-dopa向多巴胺的高效转化也在用atc载体转导的神经元中观察到,但总儿茶酚胺产量较低。这个结果是从先前的atc和atcmod载体转导的hek293t细胞观察到的(图3b和图5b),并确认了将修饰接头(gs15mod)添加到atcmod赋予了更高的儿茶酚胺产生。实施例8-tciamod的评估如所讨论的,在atcmod和tcamod三重融合基因组中用于连接th和ch1的修饰的gs15接头(gs15mod)已经证明了与从亲本基因组产生的载体转导的细胞(其包含相同的gs15接头)相比,从这些构建体制备的载体转导的细胞(神经元和hek293t)表明了更高的多巴胺产生。决定确定是否该修饰的gs15接头会导致从单一融合基因组制备的载体的儿茶酚胺产生的增加。因为已经从tcia载体转导的细胞观察到最高的儿茶酚胺产生,决定以修饰的接头替换tcia中未修饰的gs15接头以产生tciamod(图1)。如图11a所示,相对于ponyk1和tcia,来自tciamod的载体滴度更低(分别低3.4倍和2.2倍),但是这可能是由载体产生和检测变化引起的。通过hplc分析进行了从转导的hek293t细胞的儿茶酚胺产量的测定和结果如图11b所示。与ponyk1基因组转导的细胞相比,tciamod载体转导的细胞在儿茶酚胺产生上表现出7倍的增加。此外,tcia载体转导的细胞相比,从tciamod载体转导的细胞的儿茶酚胺的产量增加了1.75倍。这证实gs15mod接头比未修饰的gs15接头提供了一个优势,而这种现象并不仅仅涉及三重融合构建体。据报道,先前tcia已显示出高的儿茶酚胺产生,但多巴胺和l-dopa的相对量是可比较的,表明aadc将l-dopa转化成多巴胺是受限制的。对于tciamod,这种趋势也很明显,可能因为aadc仍在ires下游表达而因此不受接头变化的影响。总结构建了表达aadc、ch1和th的融合基因组。五种包含gs15接头替换ires元件之一(tcia、taic、atic、ctia和aitc)。剩下的四种构建体是三重融合构建体,其中gs15接头已经替换了两个ires元件。这些构建体中两种包含相同的gs15接头(atc和tca),而其他两种三重构建体包含相同的基因重排,但在th和ch1基因之间放置修饰的接头(gs15mod)(atcmod和tcamod)。此gs15mod接头编码相同氨基酸序列,但具有不同于原始gs15接头的dna序列。gs15mod接头也插入tcia,替换未修饰的接头以产生tciamod。这些研究测试了通过去除包含于被认为阻碍有效逆转录的ires元件之内的复杂结构,从ponyk1三顺反子基因组去除ires元件,并以接头序列替换可改善载体滴度的假设。推翻了这一理论,因为来自不同融合基因组的载体滴度与ponyk1给出了相似的滴度。实验中滴度不尽相同,但所有分析的比较没有确定始终给予最低滴度的融合载体,表明没有特定的融合基因组赋予低的载体产生。western印迹分析(图4和8)表明表达了每种儿茶酚胺酶并且对于每种不同的融合构建体具有正确的预测大小。western分析也表明当将转基因置于ires元件的下游时,蛋白水平降低了。出乎意料的是,构建体的评价表明th和ch1的融合提供了增加总儿茶酚胺产生最好的机制,这可能是由于此th:ch1融合对酪氨酸向l-dopa的高效催化。与ponky1相比,使用gs15接头的两个拷贝构建三重融合基因组(atc和tca)没有危害载体产量和增加的儿茶酚胺产量。在th和ch1基因之间使用修饰的gs15接头(gs15mod)也导致用两种构建体得到的儿茶酚胺产量的增加,尽管没有证据表明在蛋白表达增加。当应用到tcia构造(tciamod)时,也证明了修饰的接头介导增加的儿茶酚胺的增加的效率。总体上,数据表明,与ponyk1相比,tciamod和atcmod基因组均能够介导改善的多巴胺产生。tciamod通常介导最高的l-dopa和多巴胺综合水平,而atcmod通常介导最高的多巴胺水平。实施例9-以组成型启动子替换ires由于使用tciamod构造的多巴胺产生受到ires介导的aadc表达的限制,以组成型启动子替换ires可能会导致增加的addc表达并在转导细胞中实现更高水平的多巴胺产生。因此创造了两种可供选择的基因组,以pgk或tk启动子替换tciamod中的ires元件(参见图1)。实施例10-原代皮质神经元的转导三种融合载体(tacmod、tciamod和tctka)用于一式三份以moi0.4转导人原代皮质神经元(innoprot,目录编号p10151)。这些载体与ponyk1具有相似的滴度(ponyk11.5e+08tu/ml,tacmod7.4e+07tu/ml,tciamod8.4e+07tu/ml,tctka1.2e+08tu/ml)。作为对照,gfp载体用于以moi2和10转导人神经元。为确保发生了转导,评估了gfp转导的细胞的gfp荧光,并在研究结束(转导9天后)时拍照并显示在图12a中。在moi2和10均看到高百分比的gfp荧光细胞,表明在两个moi的gfp载体转导均已经成功。转导后5天(收获1)和9天(收获2)收获细胞上清液以进行儿茶酚胺的hplc分析。在收获1的hplc分析结果显示于图12b。从收获2的hplc数据与从收获1看到的那些相当(数据未显示)。用tctka转导的细胞显示显著的l-dopa产量(比ponyk1高>25倍),但低的多巴胺产量(比ponyk1更低),表明l-dopa向多巴胺的低效转化。从用tciamod转导的细胞观察到最高水平的多巴胺产生,这表明与用ponyk1转导的细胞相比,多巴胺产量上的7.4倍的改善。此外,l-dopa水平没有超过多巴胺的产量,表明l-dopa向多巴胺的高效转化。除了hplc分析,进行了western印迹以评估表达自用不同载体转导的人皮质神经元的th和aadc蛋白水平。这些结果显示于图13a和b。western印迹表明,从用不同载体转导的人神经元表达了正确大小的多巴胺合成酶(th和aadc)。几乎无法从tctka转导的细胞检测到aadc(图13b),这也许可以解释如上所述的此构建体转导细胞的高的l-dopa:多巴胺比例。实施例11-在帕金森氏病的非人类灵长类模型中tcia(mod)和ponyk1的行为(behavioural)和pet成像评估正在进行的研究的目的是在两个tcia(mod)剂量水平与单一ponyk1剂量水平在mptp处理的非人类灵长类的行为恢复上进行比较;此外,在手术前和注射3个月后再次在所有稳定的帕金森动物进行18f-fmt和18f-fallypridepet成像以分别评估aadc或d2/d3受体水平,健康的动物用作对照以确定每个放射性示踪剂的正常基线水平。如下所述用病毒载体处理4只mptp损伤的猕猴中的每只(mptp损伤和载体给药详述在材料和方法)。载体给药后每组都随访长达六个月:组1组2组3组4ponyk1(全强度剂量)2只动物2只动物tcia(mod)(全强度剂量)2只动物2只动物tcia(mod)(1/5剂量)2只动物2只动物lacz2只动物2只动物第1组的4只动物接受基线18f-fmt和18f-fallypridepet扫描。此外,所有组的每只动物进行(参见材料和方法的详细说明):·1次mri基线扫描·1个月对基线自发活动(locomotoractivity)的基于视频的表征(ethovision评估)·2个月mptp中毒和自发活动的基于视频的评估(ethovision)·1次mptp后18f-fmtpet扫描·1次mptp后18f-fallypridepet扫描·根据需要,1次口服l-dopa考验和1次口服对照考验,各自接着进行ethovision分析(超过6小时的录影)·病毒给药前采集的1份血样·1次手术程序以将载体递送到脑·行为随访(behaviouralfollow-up)(ethovision),治疗后3个月(0-3个月)·在治疗后3个月的1次mri扫描·在治疗后3个月1次18f-fmtpet扫描·在治疗后3个月1次18f-fallypridepet扫描·根据需要1次口服l-dopa考验和1次口服对照考验,各自接着在治疗后3个月进行ethovision分析(超过6小时的录影)·治疗后行为随访(ethovision)再3个月(3-6个月)·安乐死之前采集的1份血样·安乐死(经心脏灌注和脑提取)死后组织学分析,包括neun、gfap、lba1、aadc、ch1和th或βgal染色。图14显示了:tcia(oxb-102)的1/5剂量在改善帕金森氏症状上比ponyk1更有效,通过临床评估得分评估。到这些时间点,对照eiav-lacz治疗的动物仍然严重受损。图15的fallypridepet图像显示了与基线相比,mptp损伤后的多巴胺d2/d3受体的相对增加,其用oxb-102载体治疗后降低。fmtpet图像显示了与基线相比,mptp损伤后的壳中aadc的表达的相对降低,其用oxb-102载体治疗后增加。材料和方法细胞系用于瞬时转染的hek293t细胞获自mcalos(stanforduniversity)。hek293t细胞保存于包含获自paa的10%(v/v)胎牛血清(fcs)并补充有2mml-谷氨酰胺(sigma,cat.g7531)和1%非必需氨基酸(sigma,m7145)的dulbecco氏改良eagle氏培养基(dmem)(sigma,poole,uk,cat.d5671)。大鼠纹状体神经元如前所述(mazarakis等人,2001)从wistar大鼠(胚胎第18天)去除纹状体并汇集纹状体,并如前所述(azzouz等人,2002)制备培养物。将所得的培养物在500μl的neurobasal培养基中以每孔7.5e+04个细胞的密度接种到24孔板中,并保持在含有5%co2的37℃培养箱中。转导前从各孔去除培养基并合并,并每孔中加回250μl,这确保了每孔含有等体积的条件培养基。一式两份或一式三份将实现moi1的载体需要量加入到每个孔中。对于阴性对照,两孔纹状体神经元以moi1用gfp表达载体(ponyk-gfp,lot:kg120310)转导。转导后3-6小时将250μl培养基加入到各孔中。为了测量儿茶酚胺产量,当以100μm的终浓度将l-酪氨酸溶液加入到各孔中时,转导后将神经元培养物培养4天并培养物孵育过夜。次日上午,收获400μl神经元的培养上清并置入含有40μl2m高氯酸和40μl焦亚硫酸钠的管中,将样品处理并通过hplc检测分析儿茶酚胺,如前面讨论的。人原代皮质神经元人冷冻保存的神经元获得自innoprot(cat.p10151,lot.6195,5e+06个细胞/瓶)。24孔板以2ug/cm2用聚-l-赖氨酸(pll)包被(innoprot,cat.pll)。人神经元解冻并在补充有神经元生长添加物(ngs)和青霉素/链霉素溶液(innoprot,cat.p60157)的无血清神经元培养基中重悬到1.2e+06个细胞/ml的密度。稀释后的神经元悬液以6e+04个细胞/孔,以50μl的总体积加入到pll包被板的中心。将板置于37℃下孵育30分钟以使神经元贴壁,之后将孔用0.5ml完全神经元培养基冲洗。转导前细胞在37℃孵育4天。转导前从各孔去除培养基并合并,并每孔中加入250μl,这确保了每孔含有等体积的条件培养基。一式三份将实现moi0.4的载体需要量加入到每个孔中。作为对照,以moi2和10用gfp表达载体(ponyk-gfp,lot:kg290711)转导神经元。转导后3-6小时将250μl培养基加入到各孔中。为了测量儿茶酚胺产量,当以100μm的终浓度将l-酪氨酸加入到各孔中时,转导后神经元培养物培养了4天并培养物孵育过夜。次日上午,收获300μl神经元培养上清并置入含有30μl2m高氯酸和40μl焦亚硫酸钠的管中,将样品处理并通过hplc检测分析儿茶酚胺,如前面讨论的。已用gfp载体转导的对照神经元样品进行gfp荧光分析以确保发生转导,捕获图像并记录。质粒最近,最小的ponyk1基因组质粒已被描述为pony8.9.4ty(含kanr基因)(jarraya等人,2009sciencetranslationalmedicine1,2ra4)。该质粒是基于pony8.0t,azzouzm等人(azzouz等人,2002jneurosci22,10302-10312)中对此有更详细的描述。简言之,ponyk1是eiavsin载体基因组,在其中插入含有(按顺序):neo、内部cmv启动子、截短的密码子优化的人酪氨酸羟化酶(th)、emcv内部核糖体进入位点(ires)、密码子优化的人芳香族氨基酸多巴脱羧酶(aadc)、脊髓灰质炎病毒ires、gtp-环化水解酶i(gtp-ch1)、和土拨鼠肝炎病毒(woodchuckhepatitisvirus)转录后调控元件(wpre)的盒。通过将合成的dna区域(geneart,germany)插入三顺反子盒,替换emcvires区以及带有gs15接头的第一基因的终止密码子生成包含两个融合基因和一个pvires元件的融合质粒(图1:ponyk-atic、ponyk-taic、ponyk-tcia、ponyk-ctia和ponyk-aitc)。gs15接头编码4个甘氨酸氨基酸及其接着的1个丝氨酸氨基酸,重复三次,这产生15个氨基酸的接头。gs15接头的dna序列如下:gggggaggcggtagcggcggagggggctccggcggaggcgggagc。当生成三重融合构建体(图1:ponyk-atc和ponyk-tca)时,以第二个gs15接头替换pvires元件。也修饰gs15接头(gs15mod),使得氨基酸序列保持不变而dna序列不同。新的gs15mod接头dna序列如下:ggaggtggcgggtccgggggcgggggtagcggtggcgggggctcc。将这gs15mod接头克隆到三重融合构建体中,替换未修饰的gs15接头中的一个(图1:ponyk-atcmod和ponyk-tcamod)。本研究中使用的vsv-g包膜和eiav合成的gag/pol质粒分别是phg和pesgpk。病毒载体生产转染前24小时以3.5×106个细胞/皿的密度将hek293t细胞接种到10cm皿中。按照制造商的说明通过lipofectaminetm2000cd(invitrogen,cat.12566-101)介导载体的生产。简言之,将下述量的质粒加入到340μloptiprotm(gibco,cat.12309-019):4μg基因组质粒(见图1),2μgpesgpk和0.08μgphg。然后将该dna混合物加入到含有25μllipofectaminetmcd2000和315μloptiprotm的混合物中。转染后14-18h,加入丁酸钠到10mm的终浓度。丁酸钠诱导后6-8h更换培养基,并且21-23h后收获载体并通过0.45μm注射器滤器过滤。通过整合(integration)(dna)滴度测定估计载体滴度,以转导单位/毫升(tu/ml)计。生化分析为了测试不同融合构建体编码的儿茶酚胺酶的功能,使用高效液相色谱(hplc)进行了测量酪氨酸向多巴胺转化的生化分析。为进行此分析,在10μgml-1聚凝胺(polybrene)(sigma,cat.no.h9268)存在下,用测试载体和ponyk1对照转导hek293t细胞。将这些细胞培养3天,然后将细胞的十分之一用于接种细胞,用于儿茶酚胺生化分析。剩余的细胞进一步传代以进行整合(dna)滴度分析(见上文)。两天后将为生化分析接种的细胞上的培养基更换为以100mm终浓度添加l-酪氨酸(sigma,cat.no.t1145)的培养基,并将细胞培养过夜。次日早晨,收获800μl细胞培养物上清并置于含有80μl2m高氯酸(sigma,cat.no.244252)和80μl焦亚硫酸钠(sigma,cat.no.s9000)的管中。将样品充分混合,并且一旦形成沉淀,以10,000×g离心10分钟离心样品以去除任何碎片。然后将上清液取到分离管并在-80℃冰箱冻存,直到可以进行hplc分析。进一步确定收获时细胞数。在hplc分析前,融化样品并通过0.2μmultrapureptfe滤器(millipore,cat.no.ufc30lg25)过滤。上清液,以及hplc儿茶酚胺标准品,加样到装备esacoulochemii电化学检测器(esaanalytical)的hplc系统(dionex)。使用用cat-a-相(esaanalytical)平衡的c-18反相柱(esaanalytical)以1.5ml/min的流速分离儿茶酚胺,然后电化学检测。此hplc分析是为l-dopa、二羟基苯乙酸(dopac)和多巴胺(da)检测优化的,并且结果表示为每105个完整载体基因组拷贝的l-dopa、dopac或dang数。通过western印迹分析的儿茶酚胺酶检测在分级缓冲液(0.1mtris.cl,ph7.3,0.2%(v/v)nonidetp40(bds,cat.no.56009)中裂解瞬时转染载体组分的hek293t细胞。确定总蛋白浓度并将10ug加载到4-20%聚丙烯酰胺变性胶(invitrogen,cat.no.ec60285box)。使用下列之一进行western印迹:抗-ch1抗体(获得自dre.wrner,austria),抗th抗体(chemicon,livingstone,uk,cat.ab152)或抗aadc抗体(chemicon,cat.ab136)。一抗温育继之以与缀合有过氧化物酶的抗兔二抗(dako,ely,uk,cat.p0448)孵育。以ecl高级western印迹检测试剂盒(gehealthcareukltd.,littlechalfont,cat.rpn2135)进行可视化。视频记录和ethovision分析对视频笼(不需要胶卷)的习惯化在三段时间里实施,每次30分钟。使用媒体记录仪获得软件(mediarecorderacquisitionsoftware)(noldus)通过五个30分钟的在定制的视频笼中记录的视频评估基线运动量化。使用视频追踪软件(videotrackingsotware),ethovision(noldus)分析所有视频。每只动物的基线自发活动由mptp中毒开始前获得的最后三段视频上总行进距离(totaldistancetraveled,tdt)计算的平均自发活动组成。mptp中毒口服前不在基线进行口服l-dopa的考验。mptp中毒动物(在同一时间最多四只)经肌肉内给药以0.2mg/kgmptp的剂量治疗7天,开始新的mptp周期之前至少休息五天。重复mptp周期直至自发活动降低到平均基线活性的80-90%和临床分数是至少8/14。进行pet扫描和/或病毒载体治疗之前需要至少三周的稳定的帕金森行为得分。临床评分改编自papa和chase(papa和chase1996ann.neurol39,574-578),并用于从mptp中毒开始后及直至病毒载体治疗为止,每天监测mptp诱导的运动障碍。从最后的mptp注射后三天开始每周录制三十分钟的视频以量化自发活动。一旦动物被评估为稳定帕金森三周(tdt变化≤15%),进行l-dopa考验和根据需要的单独的阴性对照考验,而且为了确定与关闭时间的30分钟视频比较的最佳的30分钟开放期,为ethovision分析拍摄动物六小时。如果体重减轻超过12%,通过灌胃(经口)对动物进行调养和营养补充。成像研究mri:在手术前获得使用3dt2加权图像的立体定向mri以建立注射坐标。所有图像都在7tesla水平系统(varian-agilenttechnologies,usa)获得,该系统装备了达到100mt/m(300μs上升时间)的梯度线圈和圆形射频1h线圈(12cm内径)。pet:一旦如上所述的那样根据稳定帕金森评估动物,对所有动物进行18f-fmt和18f-fallypride扫描。最初4只健康对照动物进行18f-fmt和18f-fallypride成像以建立整个研究采用的定量方法。在异丙酚麻醉下使用focus220pet扫描仪(siemens)以1.5mm轴向分辨率和4%灵敏度进行扫描。动物在不同的日期成对成像以允许不同示踪剂之间的放射性衰变。手术将载体注入到每个半球的壳核中(如从猕猴脑图计算)。对于每个半球,第一次注射的50μl距离前连合(anteriorcommissure)后面1mm。第二次注射的50μl距离前连合后面4mm。使用与100μlhamilton玻璃注射器连接28号51mm长度钝头不锈钢针头在异丙酚麻醉下以3μl/min的流速进行2次50μl沉积物(depositis)/半球的注射。还使用导向管来确保载体沉积物的正确定位。治疗后的行为随访在必要时继续护理。在手术后3周开始且在手术后3个月结束每周拍摄30分钟的视频记录。手术后3和6个月之间,每两周拍摄30分钟视频记录。手术后0和3个月之间每周,且手术后3和6个月之间每两周实施临床评分。临床评价分数评估记载于jarraya等人2009年,sciencetranslationalmedicine1:2ra4。mri扫描、18f-fmt和18f-fallypridepet扫描均在手术后3个月进行。l-dopa考验也在手术3个月后进行并拍摄动物6小时进行ethovision分析。根据需要,实施阴性对照考验,接着进行ethovision分析。死后分析安乐死后,将脑取出并加工,之后用抗体和βgal染色。以上说明书中提及的全部出版物在本文中通过引用的方式并入。本发明描述的方法和系统的各种修改和变化对于本领域技术人员将是显而易见的,而不脱离本发明的范围和精神。虽然已经联系具体的优选实施方案描述本发明,应当理解的是,如要求保护的本发明不应过度限于此类具体的实施方案。实际上,用于实施本发明的所述模式的各种修改,其对于分子生物学、病毒学和神经生物学或相关领域的技术人员是显而易见的,意在在所附权利要求书的范围内。本发明提供了以下内容:1.一种构建体,其包含(i)编码酪氨酸羟化酶(th)的核苷酸序列,(ii)编码gtp-环化水解酶i(ch1)的核苷酸序列和(iii)编码芳香族氨基酸多巴脱羧酶(aadc)的核苷酸序列,其中编码th的核苷酸序列与编码ch1的核苷酸序列相连,使得它们编码融合蛋白th-ch1。2.根据项1所述的构建体,其选自:th-l-ch1-ires-aadc;aadc-l-th-l-ch1;th-l-ch1-l-aadc;和th-l-ch1-p-aadcl=接头编码序列,ires=内部核糖体进入位点,p=启动子。3.根据项2所述的构建体,其是th-l-ch1-ires-aadc。4.根据前述项中任一项所述的构建体,其包含不是为人类使用而密码子优化的接头。5.根据项1-3任一项所述的构建体,其包含含有如seqidno.1所示序列的接头。6.根据项1或2所述的构建体,其具有序列aadc-l1-th-l2-ch1或th-l1-ch1-l2-aadc,其中l1和l2是两个不同的接头序列。7.根据项6所述的构建体,其中l1和l2的核酸序列是不同的,但是l1和l2的氨基酸序列是相同的。8.根据项7所述的构建体,其中l1和l2的核酸序列是不同的并选自seqidno.1和seqidno.3。9.根据项2所述的构建体,其具有序列th-l-ch1-p-aadc,其中所述启动子是组成型启动子或组织特异性启动子。10.根据项9所述的构建体,其中所述启动子是组成型启动子,其是cmv启动子、磷酸甘油酸激酶启动子或胸苷激酶启动子。11.一种病毒载体基因组,其包含根据前述项中任一项所述的构建体。12.根据项11所述的病毒载体基因组,其是慢病毒载体基因组或腺伴随病毒载体基因组。13.一种病毒载体系统,其包含根据项11或12所述的基因组。14.根据项13所述的病毒载体系统,其是慢病毒载体系统或腺伴随病毒载体系统。15.根据项14所述的慢病毒载体系统,其包含:(i)根据项11所述的基因组;(ii)编码gag和pol蛋白的一个或多个核苷酸序列;(iii)编码未由ii)的核苷酸序列编码的其它必需的病毒包装组件的核苷酸序列。16.一种生产慢病毒载体颗粒的方法,所述方法包括对生产细胞导入:i)根据项11所述的基因组,ii)编码gag和pol蛋白的一个或多个核苷酸序列;和iii)编码未由ii)的一个或多个核苷酸序列编码的其它必需的病毒包装组件的核苷酸序列。17.由项13-15任一项所述的系统或通过项16所述的方法产生的病毒颗粒,其包含多巴胺合成酶gtp-环化水解酶i(ch1)、酪氨酸羟化酶(th)、和芳香族氨基酸多巴脱羧酶(aadc),其中th和ch1以th-ch1融合蛋白存在。18.根据项17所述的病毒载体颗粒,其是eiav载体颗粒并且经过vsv-g假型化。19.一种药物组合物,其包含根据项17或18所述的病毒颗粒,以及药学上可接受的载体或稀释剂。20.一种在体内生产多巴胺的方法,所述方法包括在受试者中从根据项1-10任一项所述的构建体表达多巴胺合成酶gtp-环化水解酶i(ch1)、酪氨酸羟化酶(th)、和芳香族氨基酸多巴脱羧酶(aadc)的步骤。21.一种用于在受试者中治疗和/或预防神经变性疾病的方法,其包含对受试者给药根据项17或18所述的病毒颗粒或根据项18所述的药物组合物的步骤。22.根据项17或18所述的病毒颗粒或根据项19所述的药物组合物,其用于通过诱导体内多巴胺合成在受试者中治疗和/或预防神经变性疾病。23.根据项21或22所述的方法、病毒颗粒或药物组合物,其中所述神经变性疾病是帕金森氏病。序列表<110>牛津生物医学(英国)有限公司(oxfordbiomedica(uk)limited)<120>构建体<130>p042870pct<150>gb1118636.8<151>2011-10-28<160>10<170>patentin版本3.5<210>1<211>45<212>dna<213>人工序列<220><223>接头编码序列<400>1ggaggtggcgggtccgggggcgggggtagcggtggcgggggctcc45<210>2<211>15<212>prt<213>人工序列<220><223>接头<400>2glyglyglyglyserglyglyglyglyserglyglyglyglyser151015<210>3<211>45<212>dna<213>人工序列<220><223>接头编码序列<400>3gggggaggcggtagcggcggagggggctccggcggaggcgggagc45<210>4<211>25<212>prt<213>人工序列<220><223>接头<400>4glyglyglyglyserglyglyglyglyserglyglyglyglysergly151015glyglyglyserglyglyglyglyser2025<210>5<211>21<212>prt<213>人工序列<220><223>接头<400>5asnpheileargglyarggluaspleuleuglulysileilearggln151015lysglyserserasn20<210>6<211>23<212>prt<213>人工序列<220><223>接头<400>6asnleuserseraspserserleuserserproseralaleuasnser151015proglyilegluglyleuser20<210>7<211>14<212>prt<213>人工序列<220><223>接头<400>7glnglyalathrphealaleuargglyaspasnproglngly1510<210>8<211>18<212>prt<213>人工序列<220><223>接头<400>8serglyglyglygluileleuaspvalproserthrglyglyserser151015progly<210>9<211>148<212>dna<213>人工序列<220><223>通过gs15接头将截短形式的th结合至aadc<400>9ggcgctccctggagggtgtccaggatgagctggacacccttgcccatgcgctgagcgcca60tcggcgggggaggcggtagcggcggagggggctccggcggaggcgggagcatggacgcca120gtgagttccgaaggcgcggcaaggagat148<210>10<211>50<212>prt<213>人工序列<220><223>通过gs15接头将截短形式的th结合至aadc<400>10argargserleugluglyvalglnaspgluleuaspthrleualahis151015alaleuseralaileglyglyglyglyglyserglyglyglyglyser202530glyglyglyglysermetaspalaserglupheargargargglylys354045glumet50当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1