猪链球菌2型divIVA基因敲除突变株及其应用的制作方法
本发明属于基因工程领域,涉及猪链球菌2型diviva基因敲除突变株及其应用。
背景技术:
猪链球菌(streptococcussuis,s.suis)是一种世界范围内流行的人畜共患病病原菌,不仅可致猪脑膜炎、败血症、关节炎、肺炎及心内膜炎等,而且还可感染人并导致多种严重的疾病,给相关从业者和广大群众的生命安全造成严重威胁。根据荚膜多糖的抗原性,s.suis可分为35个血清型,其中2型(streptococcussuisserotype2,s.suis2)毒力最强,临床检出率最高。近年我国南方省份的猪群中s.suis2流行日趋严重,时有较大规模暴发,每年造成的经济损失达数十亿元。1998和2005年分别在我国江苏省和四川省暴发了大规模s.suis2感染人的事件,造成了重大生命财产损失,并且病人中出现了高比例的、国内外罕见的中毒性休克综合征,病情凶险,病死率高(60%~80%),引发严重的公共卫生事件。同时,近年来国际上关于s.suis感染和致病的报道也显著增多,并有报道显示在我国香港已经检测出该菌多重耐药菌株的存在,给s.suis2的预防和控制带来了新的挑战。因此,开展s.suis2的相关基础和应用研究,对于防控s.suis2感染在人畜中的流行,进一步提高我国s.suis预防和治疗水平具有重要意义。
在过去的近半个世纪中,针对s.suis2的研究主要集中于细菌毒力因子、表面蛋白成分以及信号调控元件等,已发现了包括荚膜多糖(cps)、溶菌酶释放蛋白(muraminidasereleasedprotein,mrp)、胞外因子(extracellularfactor,ef)、溶血素(suilysin,sly)、谷氨酸脱氢酶(glutamatedehydrogenase,gdh)、分选酶a(sortasea)、二肽酶ⅳ(dipeptidylpeptidaseiv)、烯醇化酶(enolase)以及猪链球菌组氨酸三聚体蛋白(histidinetriadproteinofs.suis,htps)等多个与细菌致病性相关的因子。这些毒力因子的发现对理解s.suis2的致病过程有一定的帮助。但是对细菌自身生命和代谢活动分子机制的研究较少,尤其在s.suis细胞分裂机制方面的研究鲜有报道。细胞分裂、增殖是病原菌感染宿主的基础,参与细胞分裂的蛋白种类很多,不同细菌中又不尽相同。因此,对s.suis细胞分裂机制的研究对于深入揭示其生理代谢过程,从而促进针对性预防措施的研发具有重要意义。
diviva蛋白是在多种革兰氏阳性菌中发现的由diviva基因编码的细胞分裂相关蛋白。近年来在枯草芽孢杆菌、耻垢分枝杆菌、粪肠球菌、单核细胞增多性李斯特氏菌和肺炎链球菌中均发现该蛋白参与调控细菌的正常细胞分裂。课题组通过对s.suis2人源分离的强毒株05zyh33的基因组分析,发现了1个diviva蛋白编码基因。据报道,单核细胞增多性李斯特氏菌该基因的缺失会导致细菌的泳动性变差、生物被膜形成受阻以及对细胞的侵染能力减弱,影响细菌毒力及致病性。但目前为止尚无人对s.suis2中该基因功能及其参与细菌细胞分裂和致病性进行研究。
开展对s.suis2致病菌致病机理及预防和控制的研究已成为国内外相关领域许多学者的共同选择。疫苗作为一种安全有效的病原菌防控手段成为当今应对s.suis2感染的研究热点。减毒活疫苗是传统的疫苗,以全菌体为基础,接种剂量小,免疫效果较好,免疫力较持久。因此减毒活疫苗研究成为s.suis2新型疫苗研发的一个重要方向。本发明的突变菌株为减毒疫苗的开发提供了重要价值。
技术实现要素:
本发明的目的是针对现有技术的上述不足,提供一株猪链球菌2型(streptococcussuisserotype2,s.suis2)diviva基因敲除突变株。
本发明的另一目的是提供该突变株的应用。
本发明的目的可通过如下技术方案实现:
s.suis2的diviva基因敲除突变株,将2型猪链球菌05zyh33菌株中的diviva基因从第1位至690位之间的全长编码序列用壮观霉素抗性基因盒(spectinomycinresistancecassette,以下简称spcr)代替。
其中所述的05zyh33菌株中的diviva基因全长编码序列如seqidno.1所示。
所述的壮观霉素抗性基因盒序列如seqidno.2所示。
构建所述的s.suis2diviva基因敲除突变株的方法,包含以下步骤:
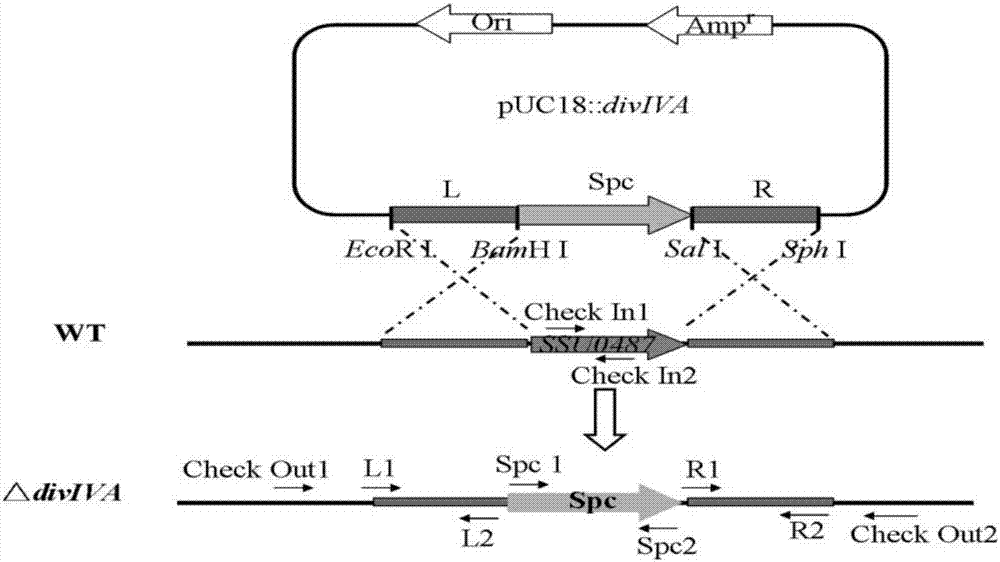
(1)根据如seqidno.3所示的s.suis2野生株05zyh33基因组diviva编码基因的上游dna序列,设计pcr特异引物l1和l2;根据如seqidno.4所示的s.suis2野生株05zyh33基因组diviva编码基因的下游dna序列,设计pcr特异引物r1和r2;以pset2质粒为模板,设计一对特异引物spc1和spc2;其中引物l1序列如seqidno.5所示,引物l2序列如seqidno.6所示,引物r1序列如seqidno.7所示,引物r2序列如seqidno.8所示,引物spc1序列如seqidno.9所示,引物spc2序列如seqidno.10所示;
(2)以05zyh33基因组dna为模板,分别以l1/l2和r1/r2为引物,扩增得到两端分别含ecori/bamhi酶切位点的目的基因diviva上游dna序列la片段和两端分别含sali/sphi酶切位点的目的基因diviva下游dna序列ra片段;以pset2质粒为模板,以spc1/spc2为特异引物扩增得到两端分别含bamhi/sali酶切位点的壮观霉素抗性基因盒;
l1/l2、r1/r2和spc1/spc2三对引物扩增所得pcr产物经1%琼脂糖电泳检测分别获得的目的片段大小为1000bp(la片段)、961bp(ra片段)和1130bp(spcr)。pcr产物回收、纯化,分别用ecori/bamhi、sali/sphi和bamhi/sali进行双酶切,将双酶切产物回收、纯化,冻存备用。
(3)基因敲除载体puc::diviva的构建:将所述的la片段-壮观霉素抗性基因盒-ra片段插入puc18载体的ecori/bamhi酶切位点间得基因敲除载体puc::diviva;具体包含如下步骤:
(a)la的克隆:将ecori/bamhi双酶切后的la片段与用同样内切酶双酶切处理过的重组质粒puc18进行连接,16℃过夜后将连接产物转化dh5a大肠杆菌感受态细胞,经氨苄青霉素筛选后,挑取lb平板上的克隆培养于lb液体培养基中37℃振荡过夜。次日提取质粒dna,用ecori/bamhi进行双酶切鉴定,筛选出有1000bp左右大小dna片段出现的阳性质粒,命名为puc18-l。
(b)壮观霉素抗性基因spcr的克隆:将bamhi/sali双酶切后的产物与用同样内切酶双酶切处理过的重组质粒puc18-lr进行连接,16℃过夜后将连接产物转化dh5a大肠杆菌感受态细胞,经壮观霉素和氨苄青霉素双重筛选后,挑取lb平板上的克隆培养于lb液体培养基中37℃振荡过夜。次日提取质粒dna,用bamhi/sali进行双酶切鉴定,筛选出有1100bp左右大小dna片段出现的阳性质粒,命名为puc18-ls。
(c)ra的克隆:将sali/sphi双酶切后的ra片段与用同样内切酶双酶切处理过的puc18-ls载体进行连接,16℃过夜后将连接产物转化dh5a大肠杆菌感受态细胞,经壮观霉素和氨苄青霉素双重筛选后,挑取lb平板上的克隆培养于lb液体培养基中37℃振荡过夜。次日提取质粒dna,用sali/sphi进行双酶切鉴定,筛选有960bp左右大小dna片段出现的重组质粒;并分别用l1/l2、r1/r2、spc1/spc2、l1/spc2、spc1/r2、l1/r2六对引物分别做质粒pcr鉴定。得到的阳性重组质粒命名为puc::diviva。
(4)基因敲除载体puc::diviva的鉴定:将得到的阳性重组基因敲除载体puc::diviva进行测序(华大基因科技股份有限公司),测序结果表明在spcr基因两侧具有同源序列的diviva目的基因,基因敲除载体puc::diviva的构建完全正确。
(5)基因敲除载体puc::diviva电转化入05zyh33感受态
(a)s.suis2野生株05zyh33感受态细胞的制备:挑取05zyh33单菌落接种于3mlthb培养基,37℃摇床震荡培养过夜,次日1:50转接到含有dl-苏氨酸的thy中37℃摇床震荡培养至od600为0.3左右,取出菌液冰浴30min,4℃离心低速收菌,并用预冷的10%甘油洗菌3次,每次不少于25ml,最后用0.5ml含有15%甘油的0.3m蔗糖重悬细菌沉淀,并分装50μl/管,保存于-80℃备用。
(b)电转化:在50μl按上述方法制备的感受态中加入10μl的puc::diviva质粒后加入电转杯中(冰上操作),22.5kv/cm、200ω和25μf电转后,加入0.3m蔗糖的thb(37℃预热)培养基940μl,37℃,160rpm震荡培养2h后涂布于含有壮观霉素抗性的thb平板上,37℃培养24-48h,挑取单菌落进行鉴定;
(6)05zyh33△diviva突变株的初步筛选:从壮观霉素thb平板上挑选猪链球菌菌落,分别培养于2ml液体thb(100mg/mlspcr)培养基。取菌液作为模板,用引物checkin1(序列如seqidno.11所示)和checkin2(位于diviva基因内部,序列如seqidno.12所示)进行pcr初步筛选。
如果diviva基因被敲除,pcr扩增将会得到阴性结果,如果仍能扩增出预期大小(452bp)的产物,说明diviva基因未被敲除。通过这种方法,初步筛选获得diviva基因敲除突变株,将其命名为05zyh33δdiviva。
(7)05zyh33△diviva突变株的鉴定:
①组合pcr鉴定:在diviva敲除目的基因上下游同源序列的la和ra的两外侧再设计一对引物checkout1/checkout2,序列如seqidno.13/seqidno.14所示;
基因敲除载体puc::diviva与细菌的染色体若发生重组,将会出现3种情况出现:a.双交换同源重组事件(doublecross-over),即等位基因置换,此时spcr基因取代diviva基因;b.3′端单交换重组事件(3′singlecross-over),此时整个载体dna序列随着3′端同源序列而整合到细菌的染色体上;c.5′端单交换重组事件(5′singlecross-over),此时载体序列随着5′端同源序列而整合到细菌染色体上。若发生等位基因置换,用引物checkout1/spc2进行pcr能够扩增出2373p的片段,用引物spc1/checkout2进行pcr能扩增出2344bp的片段,用引物spc1/spc2进行pcr能扩增出spcr基因,而在05zyh33中,用以上引物进行pcr都应得到阴性结果。而以05zyh33基因组为模板,用引物checkin1/2能扩增出的452bp的目的片段,结果各pcr产物的大小与理论值相符,并经dna测序验证(华大基因科技股份有限公司),在基因水平证实△diviva突变株构建成功。
②rt-pcr鉴定:为了进一步对△diviva突变株进行验证,利用checkin1/2引物分别对突变株和野毒株反转录得到的cdna进行pcr扩增。野生株05zyh33中结果为阳性,说明diviva正常转录;而在突变株δdiviva中为阴性。经过转录水平的鉴定,成功获得diviva基因敲除突变株,命名为δdiviva。
所述的s.suis2diviva基因敲除突变株在制备s.suis2减毒疫苗中的应用。
本发明s.suis2diviva基因敲除载体puc::diviva在构建s.suis2diviva基因敲除突变株中的应用。
本发明s.suis2diviva基因敲除载体puc::diviva在制备s.suis2减毒疫苗中的应用。
有益效果:
1.本发明运用同源重组的原理,构建中间为壮观霉素抗性基因,两侧为diviva基因上下游同源序列的基因敲除载体,将构建的puc::
diviva基因敲除质粒电转化入s.suis2强致病株05zyh33感受态细胞,通过体内同源重组,经基因水平、转录水平和dna测序筛选和鉴定,成功获得突变株,命名为δdiviva突变株。
2.本发明对diviva基因敲除突变株的相关生物学特性和致病性进行了分析,明确了diviva基因与s.suis2致病性的关系。通过绘制野生株05zyh33与δdiviva菌株生长曲线发现,δdiviva菌株生长缓慢明显滞后于野生株;双氧水耐受实验表明,δdiviva菌株对双氧水更敏感;细胞显微结构观察结果表明,δdiviva菌株分裂异常,分裂隔膜错乱,容易形成细胞团块聚集,无明显链状细胞结构,细胞荚膜变薄,变稀疏等现象;体外细胞实验表明,δdiviva菌株对小鼠巨噬细胞的抗吞噬能力减弱;小鼠体内致病性实验表明,δdiviva菌株对小鼠不致病。该突变菌株为s.suis2减毒疫苗的开发筛选提供了重要线索,可应用于s.suis2减毒疫苗的开发。
3.本发明构建的δdiviva,为进一步研究s.suis2的细胞分裂和致病机制奠定了基础,为更有效的防控猪链球菌病提供了技术支持。
附图说明:
图1为基因敲除载体puc::diviva交叉pcr鉴定结果图。
泳道1,2,3,4,5,6分别是以l1/l2、spc1/spc2、r1/r2、l1/spc2、spc1/r2、l1/r2为引物对的pcr产物,泳道7为dnamarker。
图2为基因同源重组示意图。
图3δdiviva突变株的组合pcr鉴定结果图。
泳道1-8分别是以引物checkin1/2、spc1/spc2、checkout1/spc2、spc1/checkout2为引物对的pcr产物。1,3,5,7是以05zyh33为模板的pcr,泳道2,4,6,8是以δdiviva突变株为模板的pcr,泳道m为dnamarker。
图4为δdiviva突变株的rna提取图及逆转录pcr鉴定图
a图为δdiviva突变株的rna提取图,其中泳道1为野生株05zyh33rna,泳道2为δdiviva突变株rna;泳道m为dnamarker。
b图为δdiviva突变株的逆转录pcr鉴定图,其中泳道m为dnamarker,泳道1是以δdivivacdna突变株为模板,以checkin1/2为引物的pcr产物,2是以05zyh33cdna为模板,以checkin1/2为引物的pcr产物。
具体实施方法:
实施例1:基因敲除载体的构建
⑴根据s.suis2野生株05zyh33基因组diviva编码基因的上下游dna序列,设计pcr特异引物,碱基序列如下:
l1:5′-cgaattcgctttgctaagttggttt-3′(seqidno.5,下划线处为引入的ecori酶切位点)
l2:5′-cggatccctttcctcctaagttttaac-3′(seqidno.6,下划线处为引入的bamhi酶切位点)
r1:5′-cgtcgacattttaagcgagtaggag-3′(seqidno.7,下划线处为引入的sali酶切位点)
r2:5′-gcatgcagacttgctcaatagga-3′(seqidno.8,下划线处为引入的sph1酶切位点)
根据pset2质粒序列,设计一对特异引物spc1/spc2,以pset2质粒为模板扩增整个的壮观霉素抗性基因盒,引物序列为:
spc1:5’-ggatccgttcgtgaatacatgttata-3’(seqidno.9,下划线处为引入的bamhi酶切位点)
spc2:5’-gtcgacgttttctaaaatctgat-3’(seqidno.10,下划线处为引入的sali酶切位点)
pcr反应体系为:
pcr反应条件为:95℃预变性5min,94℃50s,54℃60s,72℃1min,30个循环,最后72℃延伸10min,以双蒸水为阴性对照。
l1/l2、r1/r2和spc1/spc2三对引物扩增所得pcr产物经1%琼脂糖电泳检测分别获得的目的片段大小为1000bp(la)、961bp(ra)和1130bp(spcr)。pcr产物回收、纯化,分别用ecori/bamhi、sali/sphi和bamhi/sali进行双酶切,将双酶切产物回收、纯化,冻存备用。
(2)la的克隆:将ecori/bamhi双酶切后的la片段与用同样内切酶双酶切处理过的重组质粒puc18进行连接,16℃过夜后将连接产物转化dh5a大肠杆菌感受态细胞,经氨苄青霉素筛选后,挑取lb平板上的克隆培养于lb液体培养基中37℃振荡过夜。次日提取质粒dna,用ecori/bamhi进行双酶切鉴定,筛选出有1000bp左右大小dna片段出现的阳性质粒,命名为puc18-l。
(3)壮观霉素抗性基因spcr的克隆:将bamhi/sali双酶切后的产物与用同样内切酶双酶切处理过的重组质粒puc18-l进行连接,16℃过夜后将连接产物转化dh5a大肠杆菌感受态细胞,经壮观霉素和氨苄青霉素双重筛选后,挑取lb平板上的克隆培养于lb液体培养基中37℃振荡过夜。次日提取质粒dna,用bamhi/sali进行双酶切鉴定,筛选出有1100bp左右大小dna片段出现的阳性质粒,命名为puc18-ls。
(4)ra的克隆:将sali/sphi双酶切后的ra片段与用同样内切酶双酶切处理过的puc18-ls载体进行连接,16℃过夜后将连接产物转化dh5a大肠杆菌感受态细胞,经壮观霉素和氨苄青霉素双重筛选后,挑取lb平板上的克隆培养于lb液体培养基中37℃振荡过夜。次日提取质粒dna,用sali/sphi进行双酶切鉴定,筛选有960bp左右大小dna片段出现的重组质粒;并分别用l1/l2、r1/r2、spc1/spc2、l1/spc2、spc1/r2、l1/r2六对引物分别做质粒pcr鉴定。得到的阳性重组质粒命名为puc::diviva。
(5)基因敲除载体puc::diviva的鉴定:将得到的阳性重组基因敲除载体puc::diviva进行测序(华大基因科技股份有限公司),测序结果表明在spcr基因两侧具有同源序列的diviva目的基因,基因敲除载体puc::diviva的构建完全正确。
实施例2:变株的筛选与鉴定
(1)基因敲除载体puc::diviva电转化入05zyh33感受态
①s.suis2野生株05zyh33感受态细胞的制备:挑取05zyh33单菌落接种与3mlthb培养基,37℃摇床震荡培养过夜,次日1:50转接到含有dl-苏氨酸的thy中37℃摇床震荡培养至od600为0.3左右,4℃离心低速收菌,并用预冷的10%甘油洗菌4次,每次不少于25ml,最后用0.5ml含有15%甘油的0.3m蔗糖重悬细菌沉淀,并分装50μl/管,保存于-80℃备用。
②电转化:在50μl按上述方法制备的感受态中加入10μl的puc::diviva质粒后加入电转杯中(冰上操作),22.5kv/cm、200ω和25μf电转后,加入0.3m蔗糖的thb(37℃预热)培养基940μl,37℃,160rpm震荡培养2h后涂布于含有壮观霉素抗性的thb平板上,37℃培养24-48h,挑取单菌落进行鉴定;
(2)05zyh33△diviva突变株的初步筛选:从壮观霉素thb平板上挑选猪链球菌菌落,分别培养于2ml液体thb(100mg/mlspcr)培养基。取菌液作为模板,用引物checkin1和checkin2(位于diviva基因内部)进行pcr初步筛选。其引物序列为:
checkin1:5′-gacgcagatgaagttgatgactt-3′(seqidno.11)
checkin2:5′-tgaatgtaacttgctgttgggc-3′(seqidno.12)
如果diviva基因被敲除,pcr扩增将会得到阴性结果,如果仍能扩增出预期大小(452bp)的产物,说明diviva基因未被敲除。通过这种方法,初步筛选获得diviva基因敲除突变株,将其命名为05zyh33δdiviva。
(3)05zyh33△diviva突变株的鉴定:
①组合pcr鉴定:在diviva敲除目的基因上下游同源序列的la和ra的两外侧再设计一对引物checkout1/checkout2,其引物序列为:
out1:5′-atatgtcggagcaacaagcaagac-3′(seqidno.13)
out2:5′-ttcgatttcagcttctgcaagg-3′(seqidno.14)
基因敲除载体puc::diviva与细菌的染色体若发生重组(图2),将会出现3种情况出现:a.双交换同源重组事件(doublecross-over),即等位基因置换,此时spcr基因取代diviva基因;b.3′端单交换重组事件(3′singlecross-over),此时整个载体dna序列随着3′端同源序列而整合到细菌的染色体上;c.5′端单交换重组事件(5′singlecross-over),此时载体序列随着5′端同源序列而整合到细菌染色体上。若发生等位基因置换,用引物checkout1/spc2进行pcr能够扩增出2373bp的片段,用引物spc1/checkout2进行pcr能扩增出2344bp的片段,用引物spc1/spc2进行pcr能扩增出spcr基因,而在05zyh33中,用以上引物进行pcr都应得到阴性结果。而以05zyh33基因组为模板,用引物checkin1/2能扩增出的452bp的目的片段,结果各pcr产物的大小与理论值相符(图3),并经dna测序验证(华大基因科技股份有限公司),在基因水平证实△diviva突变株构建成功。
②rt-pcr鉴定:为了进一步对△diviva突变株进行验证,利用checkin1/2引物分别对突变株和野毒株反转录得到的cdna进行pcr扩增。野生株05zyh33中结果为阳性,说明htpsa正常转录;而在突变株δdiviva中为阴性(图4)。经过转录水平的鉴定,成功获得diviva基因敲除突变株,命名为δdiviva。
实施例3:体外实验
(1)革兰氏染色
根据北京索莱宝科技有限公司生产的革兰氏染色液的说明书操作,分别给05zyh33和δdiviva进行革兰染色,发现突变株δdiviva相比野生株的链状排列更加散在,大多数菌体聚集成团,无明显的链状结构,说明突变株δdiviva的成链能力减弱。
(2)生长特性
在相同培养条件下,分别挑取δdiviva和野生株05zyh33单菌落分别接种于3mlthb培养基中,37℃振荡培养过夜。次日取出过夜培养的细菌,测定600nm处吸光度值,用thb培养基将两者稀释至约1×108cfu/ml浓度。然后分别取60μl突变株和野生株分别接种于thb培养基3ml中,于37℃,200r/min振荡培养,,每隔1h分别取样测定od600,以培养时间为横坐标,od600值为纵坐标,绘制突变株和野生株生长曲线,结果发现05zyh33在接种后的4h细胞增殖缓慢为生长迟缓期,而δdiviva生长迟缓期较长在接种后第6h开始进入对数生长期。在进入对数生长期后05zyh33开始快速增殖,活菌数成几何倍数增加,生长曲线呈现“j”型,而δdiviva活菌数也开始增加但没有05zyh33增加速度快。在接种第11h后05zyh33和δdiviva进入平台期od600值达到最大分别为1.05±0.05、0.43±0.03,活菌数量也达到最高值分别为39.5±1.15×107cfu/ml、20.12±1.25×107cfu/ml。从第13h后05zyh33和δdiviva逐渐进入衰亡期,od600和活菌数都开始下降。
(3)抗巨噬细胞吞噬实验
把用cfse染料标记的05zyh33和δdiviva(107cfu)加入到巨噬细胞raw264.7(10:1)中,800g,离心10min后避光轻柔振荡共孵作用2h,用温和pbs洗涤3次,后再加入100μg/ml庆大霉素和5μg/ml青霉素双抗的新鲜培养基作用1h,最后加入等体积的多聚甲醛(4%)固定,流式细胞术检测胞内cfse荧光强度。流式细胞术检测显示,δdiviva与05zyh33相比,其抗巨噬细胞吞噬杀伤能力降低。
(4)h2o2耐受实验
将野生株和突变株δdiviva与梯度浓度h2o2共孵育,稀释涂平板计数后与不加h2o2孵育的实验对照组进行比较,计算细菌的存活率。结果如图5.3,发现在20~100mm浓度梯度下δdiviva突变株存活率均低于野生株,且其差异显著具有统计学意义;突变株在60mmh2o2浓度以上时存活率为0,表明δdiviva突变株抗氧化能力减弱,对h2o2表现敏感。
实施例4:动物致病性实验
为了检测突变株05zyh33δdiviva的致病性,在平板上分别挑取05zyh33和突变株δdiviva的单个菌落,于thb培养基中37℃振荡培养至对数生长中期(od600≈0.4,约108cfu剂量)离心收集菌体,用无菌pbs缓冲液重悬细菌。spf级4周龄balb/c小鼠30只,随机分为3组,分别腹腔注射野生型和突变株菌液1ml(约108cfu/只),并设thb阴性对照组(1ml/只),及时观察记录小鼠发病及存活时间有无明显变化。结果发现,用致死剂量的野生株05zyh33攻击小鼠12h后死亡7只,24h后10只小鼠全部死亡,而用相同剂量敲除株δdiviva攻击的小鼠至7天实验结束时,全部存活,并未发现有任何发病症状。阴性对照组10只状态均良好。说明diviva基因敲除的05zyh33细菌致病性显著下降,可将其应用于s.suis2减毒疫苗的研制。
序列表
<110>中国人民解放军南京军区军事医学研究所
<120>猪链球菌2型diviva基因敲除突变株及其应用
<160>14
<170>siposequencelisting1.0
<210>1
<211>690
<212>dna
<213>猪链球菌05zyh33(streptococcussuis05zyh33)
<400>1
atggcacttacagcattagaattaaaagataaaacctttgctacaaaatttagaggatac60
gacgcagatgaagttgatgactttttggacattgtaacacgtgattatgaggatttaatt120
cgtaaaaatcatgaccaagagttagaattgaaaaatttgcgagaacgtttggcttatttt180
gatgagatgaaagaatcattgagtaaatcagttcttttagctcaagatacagctgagaaa240
gtaaaggttgcggctgaagatcaagcggcaaatattattaaacaagctgactatgatgcg300
gcaacattgttacatgaagctaaagataaggcaaatgaaattcttcgtaatgcgactgac360
aacgcgaaaaaagttgtcattgaaactgaagaattaaaaaaccagacacgtattttccat420
cagcgtctaaaatcaacagtagaaagccaattatcactggttaattcatctgaatgggag480
gaaatcctccgcccaacagcaagttacattcaaacaagtgacgaagcctttcgtgatgtt540
cttcataaggctttggatgaagaattacctgttgaagaagaaagtttggattatacacgt600
caattgacaccagaagagattgcagaattaactcgtcaggcagcagcttttgagagtgga660
gaatctgtagtactttcaatagaagaataa690
<210>2
<211>1130
<212>dna
<213>人工序列(artificialsequence)
<400>2
gttcgtgaatacatgttataataactataactaataacgtaacgtgactggcaagagata60
tttttaaaacaatgaataggtttacacttactttagttttatggaaatgaaagatcatat120
catatataatctagaataaaattaactaaaataattattatctagataaaaaatttagaa180
gccaatgaaatctataaataaactaaattaagtttatttaattaacaactatggatataa240
aataggtactaatcaaaatagtgaggaggatatatttgaatacatacgaacaaattaata300
aagtgaaaaaaatacttcggaaacatttaaaaaataaccttattggtacttacatgtttg360
gatcaggagttgagagtggactaaaaccaaatagtgatcttgactttttagtcgtcgtat420
ctgaaccattgacagatcaaagtaaagaaatacttatacaaaaaattagacctatttcaa480
aaaaaataggagataaaagcaacttacgatatattgaattaacaattattattcagcaag540
aaatggtaccgtggaatcatcctcccaaacaagaatttatttatggagaatggttacaag600
agctttatgaacaaggatacattcctcagaaggaattaaattcagatttaaccataatgc660
tttaccaagcaaaacgaaaaaataaaagaatatacggaaattatgacttagaggaattac720
tacctgatattccattttctgatgtgagaagagccattatggattcgtcagaggaattaa780
tagataattatcaggatgatgaaaccaactctatattaactttatgccgtatgattttaa840
ctatggacacgggtaaaatcataccaaaagatattgcgggaaatgcagtggctgaatctt900
ctccattagaacatagggagagaattttgttagcagttcgtagttatcttggagagaata960
ttgaatggactaatgaaaatgtaaatttaactataaactatttaaataacagattaaaaa1020
aattataaaaaaattgaaaaaatggtggaaacacttttttcaatttttttgttttattat1080
ttaatatttgggaaatattcattctaattggtaatcagattttagaaaac1130
<210>3
<211>1000
<212>dna
<213>人工序列(streptococcussuis05zyh33)
<400>3
gctttgctaagttggtttcctagcctatacacaagctcgattggtcgtttgattcaatgg60
ctggtagcaccgattttaaaaccctttaggcggttaaatctgcagtttatggggttggat120
tggaccgtaatggcagccatgattgcgcttaatatgggaacacgcttcttggttcaatta180
ttgctcctgttagcatagttatgaaaaatgacaaaaacttattgcaacatttttctaggg240
aagaaagagagtttgtagagaaaataatggatatgtgtcagcaagttgaagatacgtatt300
catacagattaactcactttttacatcctagacaagatgaaattgtatgcaaaattgcta360
actactaccagttacaaacgttttctagtcgtgaccttgtttcgacagaacattcgcggg420
ttattattgccccgacttattatgagttggacatcaaggactttgagttaaccgctcttc480
atttgtcctatgctagaaaatttcacaccttatcccattcacaagttcttggaacttttc540
tcaatcaactagggattaaaagggagtatttgggtgatattttgattgatgatgaacgat600
tgattgtctttatcgatcagaaatttgggcagattgccttacaatctatcactaaagttg660
ctcgtgtccctgttaagggaaaggaagaagaatggacgactgttcgactaccgattggac720
aggaatggcgttcaaaggatgtgttggtttctagtatgagattggataaattgatttcgg780
tcgcatttaatctttcaagggcaactgcaaacaagttgattgaggctggacatgtgaagt840
tggattatgttctgacagaacaaaccagtaaattagttgaaatagggcaattaattagtg900
ttaggagatatggtagagttcgcctaaatgaatttttaggtttttctaagcaagggaaga960
taaaattaaagttagacattgttaaaacttaggaggaaag1000
<210>4
<211>961
<212>dna
<213>人工序列(streptococcussuis05zyh33)
<400>4
attttaagcgagtaggagatggtggaagccctacaatctctttctatggatcatcacttt60
gtttgatctttcctgaaaatagtaaggagagacgtccgttcacgttacgaacatagaggg120
atagaggaaactctatctaaactaaggtggtaccacgaactttcgtccttatttggcggg180
agttttttatttttatgatacgattagaattagtaaacaaggataactttgaagtagtgt240
tacaagttcaacttgcatctgaggaccaacgccgagtggcatcggttgaatattctttag300
cccaagcttggttatataaagattcggggatgattctaccatatgctgtggtatctggca360
gaaaagttgttggttttgcaatgttatctattgaacccaaagataatagttattatttat420
ggcgcttgttgattgataaggattttcaaaatcgtggatgcggaaaagaagccatccagc480
aaataattggaaaggcgaaggcggatccgctttgtcataaaatttcgataaattatgtca540
ttggcaatcataaaatgcggtacattttagaaaaaattggttttcaatccgttggtttag600
aaggccaagaaatgaaaatggaattaattataaaataaaggagttatgatgaaactaaaa660
gaaacactcaatttaggtaagacagcatttcctatgcgtgcaggcttaccaacacgtgag720
ccagaatggcaaaaggcctgggatgaagcaaacttgtatgctcgtcgccaagaactcaat780
gaaggcaaaccagccttccacctccacgatggccctccatatgctaacggaaatatccac840
gttggacatgctttaaacaagatttctaaagatattatcgttcgctctaagtcaatgtct900
ggtttccgtgctccatttgtaccgggttgggatacacacggccttcctattgagcaagtc960
t961
<210>5
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>5
cgaattcgctttgctaagttggttt25
<210>6
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>6
cggatccctttcctcctaagttttaac27
<210>7
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>7
cgtcgacattttaagcgagtaggag25
<210>8
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>8
gcatgcagacttgctcaatagga23
<210>9
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>9
ggatccgttcgtgaatacatgttata26
<210>10
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>10
gtcgacgttttctaaaatctgat23
<210>11
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>11
gacgcagatgaagttgatgactt23
<210>12
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>12
tgaatgtaacttgctgttgggc22
<210>13
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>13
atatgtcggagcaacaagcaagac24
<210>14
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>14
ttcgatttcagcttctgcaagg22
- 还没有人留言评论。精彩留言会获得点赞!