一种原位制备纳米酶膜的方法与流程
本发明涉及一种原位制备纳米酶膜的方法。
背景技术:
酶是一类高效的生物催化剂,具有催化效率高、专一性强、反应条件温和、无污染等优点。但游离酶存在稳定性差、难回收的弊端,限制了其在水处理领域的广泛应用。酶固定化技术的出现,为酶的应用开辟了广阔的前景,更加促进了酶在水处理领域的应用。以多孔性分离膜为载体,将酶分子固定在膜表面或孔道中可制备兼备优良的分离性能与生化特性的酶膜,因此酶膜的制备成为研究的热点。目前,国内外研究人员主要采用吸附法、交联法、共价结合法等方法在膜表面进行酶的固定化。虽然取得了不错的进展,但这些方法制备的酶膜仍然存在一些不足。例如,吸附法制得的酶膜表面酶的负载量较小,且酶与膜的结合不牢,酶易受外界条件影响;共价结合法制得的酶膜会影响酶的活性基团,制备条件相对苛刻。
本发明所述纳米酶是指用金属有机骨架材料(mofs)负载生物酶。近年来,由于mofs材料具有结构均一、孔隙率高、比表面积大、结构可控性强等优良的物理特性而受到研究者的广泛关注。利用mofs负载生物酶,强大的吸附能力和发达的孔道骨架结构可以保护酶的3d构型又不限制酶与底物的传质,有助于提高酶活性和稳定性。但mofs固定化酶应用在废水处理中依然存在着难以回收、难重复利用的问题。
因此,开发一种新型高效的纳米酶膜,弥补目前酶固定化方法存在的不足,具有重要的科学和工程意义。
技术实现要素:
本发明将酶、mofs与聚合物膜有机结合,实现纳米酶在膜表面的原位生长。为了保证纳米酶与膜表面形成牢固的化学键,采用低温等离子强化接枝共聚技术,在膜表面修饰羧基基团,然后与mofs前躯物中金属离子配位自组装,在加入有机配体溶液与酶液后酶包裹在mofs骨架结构中的同时,实现纳米酶在膜表面的原位生长。这种原位合成法步骤简单,且合成周期短、制备条件易于控制;制备的纳米酶膜不但能够改善原膜的亲水性能,实现较高的水通量,而且赋予原聚合物膜以吸附、生物催化和光催化降解等多种功能。
本发明提供了一种原位制备纳米酶膜的方法,包括以下步骤:原膜的预处理:将原膜在氮气氛围下进行等离子体处理,使膜表面产生相对稳定的自由基和活性位点;膜表面的接枝聚合:将预处理之后的膜放入丙烯酸溶液中浸渍一段时间,然后取出置于两片玻璃板中间,于真空干燥箱中进行热聚合反应,得到膜表面接枝了聚丙烯酸的膜;膜表面纳米酶的配位自组装和原位生长:将接枝了聚丙烯酸的膜在mofs前驱体溶液中浸渍一段时间,使前驱体溶液中的金属离子通过与聚丙烯酸上羧基的配位作用组装至膜表面,然后向前驱体溶液中加入有机配体溶液与酶液,一段时间后将膜取出;纳米酶膜的后处理:用缓冲液冲洗膜表面上未参与反应的单体,将膜放入冻干仪中冻干或自然干燥,得到负载纳米酶的纳米酶膜。
在上述方法中,其中,所述原膜为聚四氟乙烯(ptfe)膜、聚偏氟乙烯(pvde)膜、聚偏二氟乙烯(pvdf)膜、聚砜(ps)膜或聚醚砜(pes)膜,且不限于中空纤维膜、平板膜、管式膜。
在上述方法中,其中,所述等离子体处理的功率为40w至200w,时间为1分钟至10分钟,氮气流量为0.1l·min-1至0.5l·min-1。
在上述方法中,其中,其中,mofs为类沸石咪唑骨架材料(zifs),孔、通道式骨架材料(pcns),网状金属、有机骨架材料(irmofs),或莱瓦希尔骨架材料(mils)。
在上述方法中,其中,所述酶包含氯过氧化物酶、辣根过氧化物酶、漆酶、细胞色素c、葡萄糖氧化酶或脂肪酶。
在上述方法中,其中,膜在mofs前驱体溶液中的浸渍时间≥5分钟,浸渍为静态浸渍或浸渍时振荡。
在上述方法中,其中,共沉淀时间≥5分钟,共沉淀时的搅拌速度≥100rpm。
在上述方法中,其中,干燥温度≤20℃。
在上述方法中,其中,有机配体包括咪唑配体、芳香羧酸配体、或二元羧酸配体。
在上述方法中,其中,所述缓冲液为磷酸缓冲液。
本发明的膜表面纳米酶的负载率在30%至50%(以质量计);纯水接触角为40°~60°;纯水通量在0.1mpa压力下测定,30分钟后能稳定在100~500l·m-2·h-1范围内;对1g/l的牛血清蛋白废水的截留率在60%~100%的范围内;酶膜表面酶的活性在50u/mg~300u/mg的范围内。
本发明通过共沉淀法将酶与有机配体共同结合到金属离子修饰的有机膜表面,在膜表面形成mofs有序孔道结构的同时,将生物酶固定在mofs发达的孔道结构中,实现了纳米酶在有机膜表面的原位生长,大大提高了酶活性和稳定性,也提高了酶的负载率,并且降低了原膜的水接触角,实现较高的水通量,而且赋予聚合物膜以耐污染、生物催化和光催化降解污染物等多种功能。
附图说明
图1为原位制备纳米酶膜的流程图。
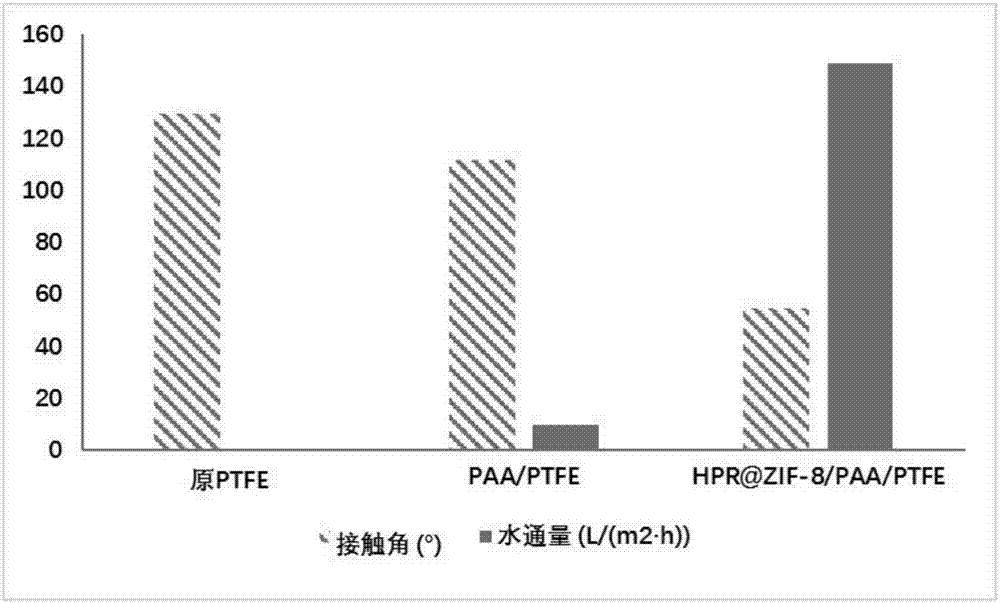
图2为未改性膜和具体实施例1-2得到的膜的表面纯水接触角和纯水通量比较图。
图3为依次按照实施例1-2步骤制得的hpr@zif-8/paa/ptfe改性膜在10k放大倍数下的膜表面扫描电镜(sem)照片。
图4为实施例5中的原膜与hpr@zif-8/paa/ptfe改性膜的光催化亚甲基蓝溶液的效果比较图。
图5为实施例6中的hpr@zif-8/paa/ptfe改性膜在两种条件下对苯酚的去除效果比较图。
图6为实施例7中的hpr@zif-8/paa/ptfe改性膜对双酚a的吸附和降解效果图。
具体实施方式
本发明的纳米酶膜的制备方法包括以下步骤:
原膜的预处理:将原膜(原膜为聚四氟乙烯(ptfe)膜、聚偏氟乙烯(pvde)膜、聚偏二氟乙烯(pvdf)膜、聚砜(ps)、聚醚砜(pes)膜等,且不限于中空纤维膜、平板膜、管式膜)在氮气氛围下进行等离子体处理,使膜表面产生相对稳定的自由基和活性位点,其中,等离子体处理的时间为1分钟至10分钟,氮气流量为0.1l·min-1至0.5l·min-1;
膜表面的接枝聚合:将预处理之后的膜放入丙烯酸溶液中静态浸渍一段时间,然后取出置于两片玻璃板中间,于真空干燥箱中进行热聚合反应,得到膜表面接枝了聚丙烯酸的膜;
膜表面纳米酶的原位生长:将接枝了聚丙烯酸的膜在mofs前驱体溶液中浸渍一段时间,使溶液中的金属离子通过与聚丙烯酸上羧基的配位作用组装至膜表面,其中,mofs为类沸石咪唑骨架材料(zifs)、孔、通道式骨架材料(pcns)、网状金属、有机骨架材料(irmofs)或莱瓦希尔骨架材料(mils),在mofs前驱体溶液中浸渍的时间≥5min,浸渍为静态浸渍或浸渍时振荡;之后向前驱体溶液中加入有机配体溶液与酶液,共沉淀一段时间后将膜取出,其中,酶为过氧化物酶、漆酶、葡萄糖氧化酶和细胞色素c等,共沉淀时间≥5分钟,共沉淀时的搅拌速度≥100rpm;
膜的后处理:用缓冲液冲洗膜表面上未参与反应的单体,将膜放入冻干仪中冻干或自然干燥,得到负载纳米酶的膜,其中,干燥温度≤20℃。
上述方法制备的酶膜,膜表面纳米酶的负载率在10%至50%(以质量计);纯水接触角为40°~60°;纯水通量在30分钟后能稳定在100~500l·m-2·h-1范围内;对1g/l的牛血清蛋白废水的截留率在60%~100%的范围内;酶膜表面酶的活性在50u/mg~300u/mg的范围内。
本发明利用等离子体作为预处理手段,在膜的疏水表面引入自由基和活性位点,从而使丙烯酸单体溶液在膜表面进行热聚合接枝,利用聚丙烯酸上羧基与mofs前驱体溶液中金属离子的配位键合,在与有机配体溶液和酶液的混合液接触后,将酶包裹在mofs骨架结构中,实现纳米酶在聚合物膜表面的原位生长。本发明采用共沉淀方法制备的纳米酶膜不仅能够保留原膜原有的优良特性,而且大大提高了聚合物膜的过滤性能、亲水性能、并赋予膜较高的酶活性,生物催化性和光催化性。
本发明的纳米酶膜的具体性能指标为:(a)亲水性能:改性后,膜的接触角由原膜的129.8°降至40°~60°;(b)过滤性能:纳米酶膜的纯水通量(0.1mpa压力下测定)在30分钟后能稳定在100~500l·m-2·h-1范围内;(c)光催化性能:纳米酶膜在全谱氙灯光照45min内,对10-50ppm的亚甲基蓝(mb)光降解率可达70%以上(单位膜面积所处理的含mb的溶液体积:3-10ml/cm2);(d)污染物去除效率:纳米酶膜对50-150ppm苯酚的去除效率在1h内可达70%以上(单位膜面积所处理的含苯酚的溶液体积:3-10ml/cm2);对10-50ppm内分泌干扰物——双酚a的去除效率在5分钟内可达45%以上,2h内可达90%以上(单位膜面积所处理的含双酚a的溶液体积:3-10ml/cm2)。
下面结合附图和具体实施例进行说明以更好地理解本发明。
参见图1,本发明的原位制备纳米酶膜的方法主要包括以下步骤:
(1)聚四氟乙烯膜预处理的步骤;
(2)活性单体在聚四氟乙烯膜表面接枝聚合的步骤;
(3)接枝膜表面纳米酶原位生长的步骤:将制得的paa/ptfe接枝膜在mofs前驱体溶液中浸渍,通过硝酸锌溶液中的锌离子与聚丙烯酸上羧基的配位作用组装到膜的表面。向前驱体溶液中加入有机配体溶液与酶液,共沉淀一段时间后将膜取出;
(4)改性膜的后处理步骤,用磷酸缓冲液将膜表面的未参与反应的单体冲洗后冻干,得到负载纳米酶的聚四氟乙烯膜。
本发明中的前驱体和有机配体也可换成其他合适的前驱体和有机配体,不同的前驱体和有机配体组合可得不同的mofs,实现对不同大小的酶的负载。
以下实施例中均以0.5μm的聚四氟乙烯微滤膜作为聚四氟乙烯膜使用,以硝酸锌为前驱体,浓度范围0.1225~0.5325mol/l;二甲基咪唑为有机配体,浓度范围0.5~2.4mol/l;使用的酶为辣根过氧化物酶(hpr),浓度范围2~10mg/l。其他高分子分离膜的亲水改性方式均与孔径为0.5μm的聚四氟乙烯微滤膜相同。
实施例1:前驱体溶液、有机配体溶液配制方法
配制硝酸锌液:0.372g六水合硝酸锌溶于4ml水中,超声波浴5min混匀;配制二甲基咪唑溶液:4.1g二甲基咪唑溶于40ml纯水,超声波5min混匀。
实施例2:聚四氟乙烯膜表面纳米酶的配位自组装和原位生长
将图1中所制得的paa/ptfe聚四氟乙烯接枝膜在4ml浓度为0.3125mol/l的硝酸锌溶液中浸渍20分钟,利用zif-8前躯物中金属离子zn2+与膜表面羧基的配位作用组装至接枝膜表面。向前驱体溶液中加入40ml浓度为1.25mol/l的二甲基咪唑溶液,然后立即加入4ml浓度为7.5mg/ml的辣根过氧化物酶液,200rpm下共沉淀20分钟后将膜取出。
实施例3:改性膜的后处理
用ph为7,浓度为50mmol/l的磷酸缓冲液冲洗实施例2的膜表面,以冲洗掉膜表面的未参与反应的单体。将膜放入冻干仪中在-40℃下冻干。
所得hpr@zif-8/paa/ptfe改性膜相对于paa/ptfe膜的表面增重率为33.44%,即膜表面纳米酶的负载率为33.44%。纯水接触角下降至50.8°,纯水通量增加至214l·m-2·h-1。所得的hpr@zif-8/paa/ptfe膜经过扫描电镜的表征,如图3所示。
实施例4:hpr@zif-8/paa/ptfe膜的酶活性评价
本实施例中,以abts(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)作为酶催化的底物,在h2o2存在的条件下,测定酶膜的活性,以每分钟催化1molabts所消耗的hpr的量,实施例3得到的hpr@zif-8/paa/ptfe膜具有酶的催化活性,酶活性为178u/mg。
实施例5:hpr@zif-8/paa/ptfe膜的光催化性能评价
本实施例中,将依次按照实施例1-3步骤所制备得到的酶膜在500瓦强度的氙灯全谱光照下降解亚甲基蓝(mb)溶液,以评价膜的光催化活性。改性之前的膜均无光催化活性。结果为:在全谱光照条件下,13cm2酶膜hpr@zif-8/paa/ptfe对50ml、10ppm亚甲基蓝去除效率在45分钟后可达到70%以上。
实施例6:hpr@zif-8/paa/ptfe膜对苯酚去除效率的评价
本实施例中,将依次按照实施例1-3步骤所制备得到的酶膜在h2o2存在条件下或在500瓦强度的氙灯全谱光照下降解苯酚溶液,以评价膜对苯酚的去除效率。结果为:在h2o2存在条件下,13cm2酶膜对50ml、10ppm苯酚的去除效率60min后可达到70%以上。在500瓦强度的氙灯全谱光照下,不加h2o2,酶膜对苯酚的去除效率60min后为45%以上。
实施例7:hpr@zif-8/paa/ptfe膜对双酚a的去除效率的评价
本实施例中,将依次按照实施例1-3步骤所制备得到的酶膜在h2o2存在条件下降解双酚a,以评价膜对分泌干扰物的去除效率。结果为:在h2o2存在条件下,13cm2酶膜对50ml、10ppm苯酚的去除效率5分钟内达到45%以上,60min后可达到85%以上。
实施例8:高纳米酶负载率的hpr@zif-8/paa/ptfe膜的制备
将图1中所制得的聚四氟乙烯接枝膜在4ml浓度为0.3125mol/l的硝酸锌溶液中浸渍1小时,利用zif-8前躯物中金属离子zn2+与膜表面羧基的配位作用组装至接枝膜表面。向前驱体溶液中加入40ml浓度为1.25mol/l的二甲基咪唑溶液,然后立即加入4ml浓度为7.5mg/l的辣根过氧化物酶液,200rpm下共沉淀1小时后将膜取出。用ph为7,浓度为50mmol/l的磷酸缓冲液冲洗膜表面,以冲洗掉膜表面的未参与反应的单体。将膜放入冻干仪中在-40℃下冻干。
本实施例制备的hpr@zif-8/paa/ptfe膜,表面纳米酶的负载率为43.1%。水接触角由原膜的129.5°下降至54.8°,纯水通量在30分钟后能稳定在149l·m-2·h-1范围内,对1g/l的牛血清蛋白废水具有较高的截留率100%。
- 还没有人留言评论。精彩留言会获得点赞!