一种稳定高表达目标产物的细胞株的构建方法和试剂盒与流程
本发明涉及分子生物学技术领域,特别是涉及一种稳定高表达目标产物的细胞株的构建方法和试剂盒。
背景技术:
随着生物技术的发展,生物制药越来越受欢迎,对医药也越来越重要。越来越多的生物药品在真核细胞中生产,目前,市场上有一半以上的治疗用重组蛋白药物都是通过真核细胞,尤其是哺乳动物细胞表达系统生产的,其中又以中国仓鼠卵巢细胞cho(chinesehamsterovary)、人胚肾细胞hek293等为主要的工业生产重组蛋白细胞株。
为了达到一定的生产效率,满足经济效益,需要筛选出产量高且稳定性强的表达异源蛋白的细胞株。通过随机整合获得稳转细胞株是目前工业生产重组蛋白药物的传统方法,即将包含目的基因的质粒转染入哺乳动物细胞,逐步加药筛选获得产量高的细胞株。但是该方法需要大量的时间和成本,并且无法控制目的基因在哺乳动物细胞基因组中的整合位置,会导致“位置效应”。即使筛选出了产量高的细胞株,随着时间的推移,细胞株的传代,这些高产量的细胞株的表达产率会减少。
因此,如何减少筛选高产量细胞株的所需的时间和成本,以及提高细胞株的稳定性,是当今生物制药领域亟待解决的问题。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种表达目标产物的细胞株及其构建方法、构建试剂盒、应用,实现直接获取产率高、稳定性强的表达目标产物的细胞株。
为实现上述目的及其他相关目的,第一方面,本发明提供了一种表达目标产物的细胞株的构建方法,包括如下步骤:将异源多核苷酸定点整合到宿主细胞的c12orf35位点,获得表达目标产物的细胞株;其中,所述异源多核苷酸包括编码所述目标产物的核苷酸序列。
所述c12orf35位点是位于真核细胞染色体端粒区的一个基因,在不同物种中均存在。所述c12orf35位点的序列为智人(h.sapiens)染色体12开放阅读框35(c12orf35)的可能同源物。在cho细胞中c12orf35位点位于染色体8的端粒区。
在一种可能的实现方式中,所述宿主细胞为真核细胞。优选为哺乳动物细胞,包括中国仓鼠卵巢cho细胞、人胚肾hek293细胞等含有c12orf35基因位点的哺乳动物细胞。
在一种可能的实现方式中,所述细胞为中国仓鼠卵巢cho细胞。
在一种可能的实现方式中,采用基因编辑技术将所述异源多核苷酸定点整合到所述宿主细胞的c12orf35位点。
在一种可能的实现方式中,所述基因编辑技术选自以下技术中的任一种:成簇规律间隔短回文重复crispr技术、锌指核酸酶zfn技术、类转录激活因子效应物核酸酶talen技术、cre-loxp技术、人工染色体技术、基因打靶技术。
在一种可能的实现方式中,当采用crispr技术时,包括以下步骤:将向导rna、编辑元件和供体质粒导入所述宿主细胞;其中,所述编辑元件为crispr相关蛋白cas9和/或可表达cas9的质粒;所述供体质粒包括所述c12orf35位点的5’同源臂、所述异源多核苷酸、所述c12orf35位点的3’同源臂。
在一种可能的实现方式中,所述向导rna的序列包括如seqidno:1所示的序列,seqidno:1所示的序列具体为cccccttacagctgtagata。
在一种可能的实现方式中,所述5’同源臂为cas9断裂位点左侧750bp的序列,所述3’同源臂为cas9断裂位点右侧750bp的序列。
在一种可能的实现方式中,所述5’同源臂的序列如seqidno:2所示,所述3’同源臂的序列如seqidno:3所示。
在一种可能的实现方式中,所述异源多核苷酸的5’端含有启动子序列。
在一种可能的实现方式中,所述启动子为hcmv启动子,所述hcmv启动子的序列如seqidno:4所示。
在一种可能的实现方式中,所述异源多核苷酸的3’端含有polya序列。
在一种可能的实现方式中,所述异源多核苷酸还包括筛选标记基因序列。
在一种可能的实现方式中,所述目标产物选自以下产物中的任一种:抗体、抗体片段、重组蛋白、多肽。
第二方面,本发明提供了一种采用第一方面所述的构建方法构建的细胞株。
第三方面,本发明提供了第一方面所述的构建方法在表达目标产物中的用途。
第四方面,本发明提供了一种表达目标产物的细胞株的构建试剂盒,所述构建试剂盒包括用于将异源多核苷酸定点整合到宿主细胞的c12orf35位点的试剂;其中,所述异源多核苷酸包括编码所述目标产物的核苷酸序列。
在一种可能的实现方式中,所述构建试剂盒包括:感受态细胞、基因编辑技术所需的反应物。
在一种可能的实现方式中,所述基因编辑技术选自以下技术中的任一种:成簇规律间隔短回文重复crispr技术、锌指核酸酶zfn技术、类转录激活因子效应物核酸酶talen技术、cre-loxp技术、人工染色体技术、基因打靶技术。
在一种可能的实现方式中,所述基因编辑技术所需的反应物包括:向导rna、编辑元件、供体空白质粒、所述c12orf35位点的5’同源臂、所述c12orf35位点的3’同源臂;其中,所述编辑元件为crispr相关蛋白cas9和/或可表达cas9的质粒。
在一种可能的实现方式中,所述向导rna的序列包括如seqidno:1所示的序列,seqidno:1所示的序列具体为cccccttacagctgtagata。
在一种可能的实现方式中,所述5’同源臂为cas9断裂位点左侧750bp的序列,所述3’同源臂为cas9断裂位点右侧750bp的序列。
在一种可能的实现方式中,所述5’同源臂的序列如seqidno:2所示,所述3’同源臂的序列如seqidno:3所示。
与现有技术相比,本发明具有如下有益效果:
本发明将表达目标产物的异源多核苷酸定点整合于宿主细胞的c12orf35位点,可以提高该宿主细胞的对目标产物的表达量和稳定性;该宿主细胞的表达量可达到随机整合细胞的表达量的10~48倍。
附图说明
图1为目标产物为mcherry的供体质粒,通过crispr/cas9介导dna双链在特定位点发生断裂,引发同源末端重组的修复途径,在c12orf35的第一个外显子上发生定点整合的流程示意图。
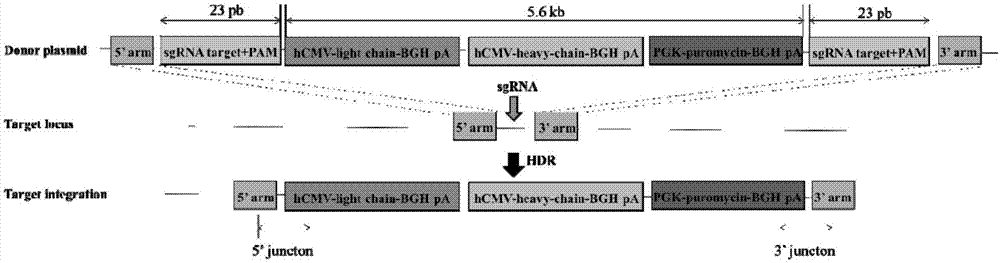
图2为目标产物为anti-pd1抗体的供体质粒,通过crispr/cas9介导dna双链在特定位点发生断裂,引发同源末端重组的修复途径,在c12orf35的第一个外显子上发生定点整合的流程示意图。
图3为使用目标产物为mcherry的供体质粒与cas9编辑质粒转染中国仓鼠卵巢癌细胞,3天后通过荧光倒置显微镜检测mcherry的表达的结果图。在图3中,随机整合对照组为仅转染目标产物为mcherry供体质粒的中国仓鼠卵巢癌细胞池,c12orf35位点定点整合组为共转染目标产物为mcherry的供体质粒与cas9编辑质粒的中国仓鼠卵巢癌细胞池。通过荧光倒置显微镜观察可知,转染3天后,随机整合细胞池与c12orf35定点整合细胞池的mcherry表达水平基本没有差异。
图4为嘌呤霉素加压筛选3周后,通过荧光倒置显微镜比较随机整合细胞池与c12orf35定点整合细胞池在表达mcherry上的差异图。图4表明,加压筛选3周后,c12orf35定点整合细胞池的mcherry表达水平明显高于随机整合细胞池的mcherry表达水平,说明c12orf35位点是中国仓鼠卵巢癌细胞中具有高转录活性的位点。
图5为使用目标产物为anti-pd1抗体的供体质粒与cas9编辑质粒转染中国仓鼠卵巢癌细胞,3天后通过westernblot检测anti-pd1抗体的表达结果图。随机整合对照组为仅转染目标产物为anti-pd1供体质粒的中国仓鼠卵巢癌细胞池,c12orf35位点定点整合组为共转染目标产物为anti-pd1抗体的供体质粒与cas9编辑质粒的中国仓鼠卵巢癌细胞池。westernblot结果表明,细胞转染3天后,随机整合细胞池和c12orf35定点整合细胞池的anti-pd1抗体表达水平基本没有差异。
图6为采用嘌呤霉素作为筛选标记为例,加压筛选3周后,通过westernblot检测随机整合细胞池与c12orf35定点整合细胞池的anti-pd1抗体表达水平结果图。结果表明,加压筛选3周后,c12orf35定点整合细胞池的anti-pd1抗体表达水平明显高于随机整合细胞池,而且加压筛选3周后随机整合细胞池的抗体表达急剧减少,通过westernblot基本检测不到。说明c12orf35位点是中国仓鼠卵巢癌细胞中具有高转录活性的位点。
图7为通过5’/3’junctionpcr鉴定表达mcherry蛋白的定点整合细胞株的结果图。分别提取随机整合细胞和c12orf35定点整合细胞的基因组,以其作为模板,使用特异性的引物进行junctionpcr扩增。结果表明,与随机整合细胞相比,c12orf35定点整合细胞在5’junctionpcr和3’junctionpcr的结果中均有大小为1000bp左右的目的条带。可以初步说明已得到c12orf35位点的定点整合细胞。
图8为表达mcherry蛋白的定点整合细胞株5’/3’junctionpcr的测序结果图。将以c12orf35定点整合细胞的基因组为模板进行junctionpcr扩增得到的1000bp左右的条带进行切胶回收和sanger测序,结果表明,异源多核苷酸正确整合到c12orf35位点的第一个外显子上。
图9为通过5’/3’junctionpcr鉴定表达anti-pd1抗体的定点整合细胞株的结果图。分别提取随机整合细胞和c12orf35定点整合细胞的基因组,以其作为模板,使用特异性的引物进行junctionpcr扩增。结果表明,与随机整合细胞相比,c12orf35定点整合细胞在5’junctionpcr和3’junctionpcr的结果中均有大小为1000bp左右的目的条带。可以初步说明此时已得到c12orf35位点的定点整合细胞。
图10为表达anti-pd1抗体的定点整合细胞株5’/3’junctionpcr的测序结果图。将以c12orf35定点整合细胞的基因组为模板进行junctionpcr扩增得到的1000bp左右的条带进行切胶回收和sanger测序,结果表明,异源多核苷酸正确整合到了c12orf35位点的第一个外显子上。
图11为利用流式细胞仪检测c12orf35定点整合细胞株和随机整合细胞株的mcherry蛋白表达水平的结果图。
图12为使用mabselectsure层析柱纯化c12orf35定点整合细胞株和随机整合细胞株表达的anti-pd1抗体的层析图。用于纯化的anti-pd1抗体来自c12orf35位点定点整合细胞株的细胞培养上清。
图13为使用mabselectsure层析柱纯化c12orf35定点整合细胞株和随机整合细胞株表达的anti-pd1抗体的层析图。用于纯化的anti-pd1抗体来自c12orf35位点定点整合细胞株的细胞培养上清。
图14为使用mabselectsure层析柱纯化c12orf35定点整合细胞株和随机整合细胞株表达的anti-pd1抗体的层析图。用于纯化的anti-pd1抗体来自随机整合细胞株的细胞培养上清。
图15为使用mabselectsure层析柱纯化c12orf35定点整合细胞株和随机整合细胞株表达的anti-pd1抗体的层析图。用于纯化的anti-pd1抗体来自随机整合细胞株的细胞培养上清。
具体实施方式
在发明人通过大量实验发现如果将编码目标产物的异源多核苷酸插入到宿主细胞的c12orf35位点,可以提高宿主细胞对目标产物的表达量,并在此基础下完成本发明。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。
发明的实施例提供了一种表达目标产物的细胞株的构建方法,包括如下步骤:将异源多核苷酸定点整合到宿主细胞的c12orf35位点,获得表达目标产物的细胞株;其中,所述异源多核苷酸包括编码所述目标产物的核苷酸序列。
可采用本领域技术人员所知晓的现有技术将所述异源多核苷酸定点整合到所述宿主细胞的c12orf35位点,并不局限于基因编辑技术,更不局限于实施例中所列举的具体的基因编辑技术。
将异源多核苷酸插入到c12orf35位点可以高产量并且稳定地表达目标产物,与传统的随机整合获得的重组蛋白稳转细胞株的方法相比,避免了“位置效应”的发生,同时也节约了构建重组细胞株的时间和经济成本。
可以采用5’/3’junctionpcr对整合后的细胞进行鉴定,以判断是否得到了该位点插入基金的细胞池。5’/3’junctionpcr的阳性片段可进行测序,测序结果可以用于证明得到了该位点的定点整合细胞株。
5’/3’junctionpcr为阳性结果,westernblot检测目标产物是否正确表达,若结果为阳性,利用有限稀释法铺单克隆;单克隆细胞长出后,再利用5’/3’junctionpcr方法及westernblot方法检测阳性克隆,得到的阳性克隆即为目的细胞株。
在一个示例中,5’/3’junctionpcr所使用的引物序列应覆盖整合的异源基因序列和相邻的基因组序列,引物扩增片段大小以1000bp左右为宜。
在一个示例中,所述细胞为真核细胞,优选为哺乳动物细胞。
在一个示例中,所述细胞为中国仓鼠卵巢cho细胞,人胚肾hek293细胞等含有c12orf35基因位点的哺乳动物细胞。
在一个示例中,采用基因编辑技术将所述异源多核苷酸定点整合到所述宿主细胞的c12orf35位点。
在一个示例中,所述基因编辑技术选自以下技术中的任一种:成簇规律间隔短回文重复crispr技术、锌指核酸酶zfn技术、类转录激活因子效应物核酸酶talen技术、cre-loxp技术、人工染色体技术、基因打靶技术。
在一个示例中,当采用crispr技术时,包括以下步骤:将向导rna、编辑元件和供体质粒导入所述宿主细胞;其中,所述编辑元件为crispr相关蛋白cas9和/或可表达cas9的质粒;所述供体质粒包括所述c12orf35位点的5’同源臂、所述异源多核苷酸、所述c12orf35位点的3’同源臂。
在一个示例中,所述向导rna的序列包括如seqidno:1所示的序列,seqidno:1所示的序列具体为cccccttacagctgtagata;
在一个示例中,所述供体质粒为适用于真核表达系统的质粒。
在一个示例中,所述供体质粒为长度较小的适用于真核表达系统的质粒。
在一个示例中,所述表达质粒为puc19。
在一个示例中,5’同源臂、3’同源臂、编码目标产物的核苷酸序列以及筛选标记基因序列通过同源重组的克隆方法插入到puc19真核表达载体的限制性酶切位点之间。在一个例子中,所述编码目标产物的核苷酸序列插入到puc19真核表达载体的hindiii酶和ecori酶的限制性酶切位点之间。
在一个示例中,将5’同源臂、3’同源臂、编码目标产物的核苷酸序列以及筛选标记基因序列通过同源重组的方法插入puc19真核表达载体,连接产物转化dh5α感受态细胞,筛选正确连接的载体作为构建成功的目标产物表达载体。所述筛选为采用添加有氨苄(amp)的lb培养基选择培养转化了连接产物的感受态细胞,挑取单克隆进行测序分析,验证连接产物正确连入了puc19真核表达载体。
在一个示例中,所使用的嘌呤霉素加压筛选的浓度为8μg/ml,加压筛选时间为3周。
在一个示例中,将向导rna、编辑元件和供体质粒导入所述宿主细胞的方法包括阳离子多聚体转染、脂质体转染、电穿孔转染等。
在一个示例中,所述的电穿孔转染方法的具体条件为:电压1800v,脉冲时程20ms,脉冲个数1个,转染使用细胞培养的6孔板,细胞密度为1×106个/ml,培养基体积为2ml,所需质粒为30μg。
在一个示例中,可表达cas9的质粒可以为px330、px458、px260等。
在一个示例中,所述5’同源臂为cas9断裂位点左侧750bp的序列,所述3’同源臂为cas9断裂位点右侧750bp的序列。
在一个示例中,所述5’同源臂的序列如seqidno:2所示,所述3’同源臂的序列如seqidno:3所示。
在一个示例中,所述异源多核苷酸的5’端含有启动子序列。启动子具体为真核细胞表达所需的启动子。
在一个示例中,所述启动子为hcmv启动子,所述hcmv启动子的序列如seqidno:4所示。
在一个示例中,所述异源多核苷酸的3’端含有polya序列。
当目标产物为抗体时,该抗体的重链和轻链分别带有启动子序列和polya序列。
在一个示例中,所述异源多核苷酸还包括筛选标记基因序列。筛选标记包括抗生素、荧光蛋白等,例如嘌呤霉素,新霉素、绿色荧光蛋白、红色荧光蛋白等。
可以在异源核苷酸进入到细胞72小时后,使用筛选标记富集表达目标产物的克隆;
在一个示例中,所述目标产物选自以下产物中的任一种:抗体、抗体片段、重组蛋白、多肽。
本发明实施例还提供了一种采用第一方面所述的构建方法构建的细胞株。
本发明实施例还提供了第一方面所述的构建方法在表达目标产物中的用途。
本发明实施例还提供了一种表达目标产物的细胞株的构建试剂盒,所述构建试剂盒包括用于将编码所述目标产物的异源多核苷酸整合在宿主细胞的c12orf35位点的试剂。
在一个示例中,所述构建试剂盒包括:感受态细胞、基因编辑技术所需的反应物。
在一个示例中,所述基因编辑技术选自以下技术中的任一种:成簇规律间隔短回文重复crispr技术、锌指核酸酶zfn技术、类转录激活因子效应物核酸酶talen技术、cre-loxp技术、人工染色体技术、基因打靶技术。
在一个示例中,所述基因编辑技术所需的反应物包括:向导rna、编辑元件、供体空白质粒、所述c12orf35位点的5’同源臂、所述c12orf35位点的3’同源臂;其中,所述编辑元件为crispr相关蛋白cas9和/或可表达cas9的质粒。
在一个示例中,所述向导rna的序列包括如seqidno:1所示的序列,seqidno:1所示的序列具体为cccccttacagctgtagata。
在一个示例中,所述5’同源臂为cas9断裂位点左侧750bp的序列,所述3’同源臂为cas9断裂位点右侧750bp的序列。
在一个示例中,所述5’同源臂的序列如seqidno:2所示,所述3’同源臂的序列如seqidno:3所示。
与现有技术相比,本发明具有如下有益效果:
本发明将表达目标产物的异源多核苷酸定点整合于宿主细胞的c12orf35位点,可以提高该宿主细胞的对目标产物的表达量和稳定性;该宿主细胞的表达量可达到随机整合细胞的表达量的10~48倍。
下文以具体实施例1对本发明实施例的技术方案进行更具体地说明。
实施例1在c12orf35位点高效表达mcherry蛋白
(1)构建cas9编辑质粒
设计一对可以靶向中国仓鼠卵巢癌细胞c12orf35位点的具有较高剪切效率的sgrna,其正向序列如seqidno.5所示,具体为:caccgcccccttacagctgtagata(正向序列);其反向序列如seqidno.6所示,具体为aaactatctacagctgtaagggggc(反向序列)。seqidno.5所示序列包括了seqidno.1所示序列(下划线所示部分),seqidno.6所示序列包括了seqidno.1所示序列的反向序列(下划线所示部分)。
将这对sgrna用t4连接酶在37℃连接30min,再95℃孵育5min,之后梯度降温至25℃(6℃/min)。得到的产物与用bbsi酶切过的px458质粒连接。连接产物转化于dh5α感受态,涂于氨苄+lb固体平板,次日挑取单克隆,抽取质粒。最后通过测序验证得到序列正确的cas9编码质粒。
(2)构建供体质粒
供体质粒由5’.同源臂、mcherry编码基因,嘌呤霉素编码基因和3’同源臂串联于puc19质粒上构成,结构如图1所示。5’同源臂的序列如seqidno.2所示,3’同源臂的序列如seqidno.3所示,同源臂片段以中国仓鼠卵巢癌细胞的基因组为模板、利用巢式pcr扩增获得。
扩增5’同源臂的第一轮pcr正向引物序列如seqidno.7所示,具体为:tgccccaaacccaccatatt(第一轮pcr正向引物)。
扩增5’同源臂的第一轮反向引物序列如seqidno.8所示,具体为:tatgcccaggcagtgatagc(第一轮pcr反向引物)。
扩增5’同源臂的第二轮正向引物序列如seqidno.9所示,具体为:atgattacgccaagcttcccccttacagctgtagatatggtttcagctgtctcccaca(第二轮pcr正向引物)。
扩增5’同源臂的第二轮反向引物序列如seqidno.10所示,具体为:caatgtcaacctacagctgtaagggg(第二轮pcr反向引物)。
扩增3’同源臂的第一轮pcr正向引物序列如seqidno.11所示,具体为:tgccccaaacccaccatatt(第一轮pcr正向引物)。
扩增3’同源臂的第一轮pcr反向引物序列如seqidno.12所示,具体为:tatgcccaggcagtgatagc(第一轮pcr反向引物)。
扩增3’同源臂的第二轮pcr正向引物序列如seqidno.13所示,具体为:caaccatagtatatggaagccaacatgtgc(第二轮pcr正向引物)。
扩增3’同源臂的第二轮pcr反向引物序列如seqidno.14所示,具体为:acgacggccagtgaattcccatatctacagctgtaagggggttttccaacagctacatc((第二轮pcr反向引物)。
mcherry编码基因和嘌呤霉素编码基因均带有hcmv启动子和polya序列。构成供体质粒的5个片段通过同源重组试剂盒连接。连接产物转化于dh5α感受态,涂于氨苄+lb固体平板,次日挑取单克隆,抽取质粒。最后通过测序验证得到序列正确的表达mcherry蛋白的供体质粒。
(3)电穿孔转染cas9编码质粒和mcherry供体质粒
本实验使用悬浮型的中国仓鼠卵巢癌细胞,即cho-s细胞株。转染前一天将细胞密度调整为1×106个/ml。第二天使用电穿孔的方法进行转染,条件为电压1800v,脉冲时程20ms,脉冲个数1个,转染使用细胞培养的6孔板,细胞个数为1×106个,培养基体积为2ml,所需质粒为30μg。转染完成后放置于37℃、5%co2的培养箱中培养。其中,加入cas9编码质粒和mcherry供体质粒进行共转染可以得到c12orf35位点定点整合细胞池,只加入mcherry供体质粒转染可以得到表达mcherry的随机整合细胞池。
(4)加压筛选富集稳转细胞
转染3天后,使用荧光倒置显微镜检测随机整合细胞池和定点整合细胞池的mcherry的表达情况,结果如图3。结果表明转染3天后,随机整合细胞池和定点整合细胞池的mcherry表达量基本没有差别。同时,转染3天后开始加入嘌呤霉素进行加压筛选,浓度为8μg/ml,3~4天更换一次细胞培养基,加压筛选需要3周的时间。
(5)5’/3’junctionpcr鉴定定点整合细胞池
加压筛选3周后,提取随机整合细胞池和定点整合细胞池的基因组,以其为模板进行5’/3’juncitonpcr鉴定。
5’junctionpcr的鉴定正向引物序列seqidno.15所示,具体为:tgccccaaacccaccatatt(正向引物)。5’junctionpcr的鉴定反向引物序列seqidno.16所示,具体为:gccatttaccgtcattgacgtc(反向引物)。
3’junctionpcr的鉴定正向引物序列seqidno.17所示,具体为:catgcatcgatgatatcagatccc(正向引物)。3’junctionpcr的鉴定反向引物序列seqidno.18所示,具体为:tatgcccaggcagtgatagc(反向引物)。
junctionpcr结果如图7所示,与随机整合的细胞相比,c12orf35定点整合的细胞在5’junctionpcr和3’junctionpcr的结果中均有大小为1000bp左右的目的条带。可以初步说明此时已得到c12orf35位点的定点整合细胞。将目的条带切胶回收,进行sanger测序,得到结果如图8所示,结果表明目的基因已正确插入到中国仓鼠卵巢癌细胞的c12orf35位点。
(6)荧光倒置显微镜检测稳转细胞池的mcherry蛋白表达
对5’/3’junctionpcr扩增得到的目的片段进行测序,确定得到c12orf35位点的定点整合细胞池后,利用荧光倒置显微镜再次检测mcherry蛋白的表达情况,结果如图4所示,随机整合细胞池的mcherry表达量明显低于c12orf35位点定点整合细胞池的表达量,初步说明位点c12orf35具有较高的转录活性。
(7)有限稀释法获得单克隆细胞株
通过5’/3’junctionpcr及荧光倒置显微镜确定得到了c12orf35位点定点整合细胞池后,通过有限稀释法获得单克隆细胞株,即将鉴定得到的c12orf35位点定点整合细胞池铺于96孔板,细胞密度为1个/孔。细胞生长约1周时,显微镜下观察,标记为单克隆的细胞。细胞生长约5周时,将单克隆细胞吸取一半提取基因组dna,进行5’/3’junctionpcr检测,方法同步骤(5)。将5’/3’junctionpcr得到的阳性细胞株进一步用荧光倒置显微镜观察,检测其mcherry蛋白是否正确表达。
(8)定点整合细胞株mcherry表达量的检测
检测得到的阳性细胞株使用流式细胞仪定量测定mcherry蛋白的表达情况,利用flowjo软件计算mcherry的峰面积,结果如图11所示,kc6和kc15是两株c12orf35定点整合细胞株,c16是随机整合细胞株,kc6,kc15和c16的mcherry峰面积分别为1.06×105,1.58×105,8.08×103,c12orf35定点整合细胞株的mcherry表达量约为随机整合细胞株表达的13~19倍,说明位点c12orf35是中国仓鼠卵巢癌细胞中具有高转录活性的位点。
实施例2在c12orf35位点高效表达anti-pd1单克隆抗体
(1)构建cas9编辑质粒
设计一对可以靶向中国仓鼠卵巢癌细胞c12orf35位点的具有较高剪切效率的sgrna,其正向序列如seqidno.5所示,具体为:caccgcccccttacagctgtagata(正向序列);其反向序列如seqidno.6所示,具体为aaactatctacagctgtaagggggc(反向序列)。seqidno.5所示序列包括了seqidno.1所示序列(下划线所示部分),seqidno.6所示序列包括了seqidno.1所示序列的反向序列(下划线所示部分)。
将这对sgrna用t4连接酶在37℃连接30min,再95℃孵育5min,之后梯度降温至25℃(6℃/min)。得到的产物与用bbsi酶切过的px458质粒连接。连接产物转化于dh5α感受态,涂于氨苄+lb固体平板,次日挑取单克隆,抽取质粒。最后通过测序验证得到序列正确的cas9编码质粒。
(2)构建供体质粒
供体质粒由5’同源臂、anti-pd1单克隆抗体编码基因,嘌呤霉素编码基因和3’同源臂串联于puc19质粒上构成,结构如图2所示。5’同源臂的序列如seqidno.2所示,3’同源臂的序列如seqidno.3所示,同源臂片段以中国仓鼠卵巢癌细胞的基因组为模板、利用巢式pcr扩增获得。
扩增5’同源臂的引物序列如seqidno.10所示,具体为:
tgccccaaacccaccatatt(第一轮pcr正向引物)
tatgcccaggcagtgatagc(第一轮pcr反向引物)
atgattacgccaagcttcccccttacagctgtagatatggtttcagctgtctcccaca(第二轮pcr正向引物)
taatcaatgtcaacttcgaactacagctgtaaggg(第二轮pcr反向引物)。
扩增3’同源臂的引物序列如seqidno.11所示,具体为:
tgccccaaacccaccatatt(第一轮pcr正向引物)
tatgcccaggcagtgatagc(第一轮pcr反向引物)
gctagcgtcgacggcgcgccatatggaagccaacatgtgc(第二轮pcr正向引物)
acgacggccagtgaattcccatatctacagctgtaagggggttttccaacagctacatc((第二轮pcr反向引物)
anti-pd1抗体轻链、重链以及嘌呤霉素的编码基因均分别带有hcmv启动子和polya序列。构成供体质粒的5个片段通过同源重组试剂盒连接。连接产物转化于dh5α感受态,涂于氨苄+lb固体平板,次日挑取单克隆,抽取质粒。最后通过测序验证得到序列正确的表达anti-pd1抗体的供体质粒。
(3)电穿孔转染cas9编码质粒和anti-pd1供体质粒
本实验使用悬浮型的中国仓鼠卵巢癌细胞,即cho-s细胞株。转染前一天将细胞密度调整为1×106个/ml。第二天使用电穿孔的方法进行转染,条件为电压1800v,脉冲时程20ms,脉冲个数1个,转染使用细胞培养的6孔板,细胞个数为1×106个,培养基体积为2ml,所需质粒为30μg。转染完成后放置于37℃、5%co2的培养箱中培养。其中,加入cas9编码质粒和anti-pd1供体质粒进行共转染可以得到c12orf35位点的定点整合细胞池,仅加入anti-pd1供体质粒转染可以得到表达anti-pd1的随机整合细胞池。
(4)加压筛选富集定点整合细胞
转染3天后,使用westernblot检测随机整合细胞池和定点整合细胞池的细胞培养上清液中anti-pd1抗体的表达情况,结果如图5,结果表明转染3天后随机整合细胞池和定点整合细胞池的anti-pd1抗体表达量基本没有差别。同时,转染3天后开始加入嘌呤霉素进行加压筛选,浓度为8μg/ml,3~4天更换一次细胞培养基,加压筛选需要3周的时间。
(5)5’/3’junctionpcr鉴定定点整合细胞池
加压筛选3周后,提取随机整合细胞池和定点整合细胞池的基因组,以其为模板进行5’/3’juncitonpcr鉴定。5’junctionpcr的鉴定正向引物序列seqidno.15所示,具体为:
tgccccaaacccaccatatt(正向引物)
5’junctionpcr的鉴定反向引物序列seqidno.19所示,具体为:caccagctgcacctgggagt(反向引物)。
3’junctionpcr的鉴定正向引物序列为seqidno.17,正向引物序列为seqidno.18。junctionpcr结果如图9所示,与随机整合的细胞相比,c12orf35位点定点整合的细胞在5’junctionpcr和3’junctionpcr的结果中均有大小为1000bp左右的目的条带。可以初步说明此时已经得到了c12orf35位点的定点整合细胞。将目的条带切胶回收,进行sanger测序,得到结果如图10所示,结果表明目的基因序列已经正确整合到c12orf35位点。
(6)westernblot检测定点整合细胞池anti-pd1抗体的表达
对5’/3’junctionpcr扩增得到的目的片段测序,确定得到了c12orf35的定点整合细胞池后,利用westernblot再次检测anti-pd1抗体的表达情况,结果如图6所示,随机整合细胞池在加药筛选3周后通过westernblot基本检测不到anti-pd1抗体的表达,而c12orf35位点定点整合细胞池的anti-pd1抗体表达量较高,初步说明位点c12orf35具有较高的转录活性。
(7)有限稀释法获得单克隆细胞株
通过5’/3’junctionpcr及westernblot确定得到了c12orf35位点定点整合细胞池后,通过有限稀释法获得单克隆细胞株,即将鉴定得到的c12orf35位点定点整合细胞池铺于96孔板,细胞密度为1个/孔。细胞生长约1周时,显微镜下观察,标记为单克隆的细胞。细胞生长约5周时,将单克隆细胞吸取一半提取基因组dna,进行5’/3’junctionpcr检测,方法同步骤(5)。将junctionpcr检测得到阳性细胞株进一步进行westernblot检测,判断anti-pd1抗体是否正确表达。
(8)定点整合细胞株anti-pd1抗体表达量的检测
进一步检测c12orf35位点定点整合的阳性细胞株kp6,kp11和随机整合的抗体表达细胞株p21,p26的抗体表达量。将4个稳转细胞株分别以2×105个/ml的密度接种于250ml的摇瓶,培养体积为30ml,在37℃、8%co2、125rpm条件下培养。当细胞活率下降到50%左右时,收取细胞培养上清液,使用mabselectsure层析柱进行纯化,纯化结果如图12~图15所示。洗脱得到的抗体用pbs进行4℃过夜透析,透析得到的抗体用bca方法检测蛋白浓度。最后计算kp6,kp11,p21和p26稳转细胞株的产量,分别为140.2mg/l,114.8mg/l,10.2mg/l和2.9mg/l。结果表明c12orf35位点定点整合细胞株的anti-pd1抗体表达量约为随机整合细胞株表达量的10~48倍,进一步说明位点c12orf35是中国仓鼠卵巢癌细胞中具有高转录活性的位点。
综上所述,本发明有效克服了现有技术中的种种缺点而具高度产业利用价值。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
序列表
<110>上海交通大学
杰科实验室
杰科(天津)生物医药有限公司
<120>一种稳定高表达目标产物的细胞株的构建方法和试剂盒
<130>173260
<160>19
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna/rna
<213>人工序列(artificialsequence)
<400>1
cccccttacagctgtagata20
<210>2
<211>750
<212>dna/rna
<213>人工序列(artificialsequence)
<400>2
tttcagctgtctcccacataaccaagaagcatgcatatatcccactaattcaaattcagt60
ttcacagccacttctgaacgtcaggagtttcataaatcctccgatctctgtttctaatgt120
gcataataggacagttgtggcctcacagacctcagtagaaagagtcacatatacaaatgt180
taaaggagcccaacaaccaaaccacaatttgcaaacagtgtcttctggagttgtgcaaaa240
tgcctggatgaattcaacaatgaggaattttatgccttctcttacagaggcaaccatatc300
tcataaacctgatggtgggcctagtatgccatatatgcatgcaccacagagtcatcttgt360
cacatcagacacctactctgtgcaactacagatgactccttcaaactctgtaagaggccc420
tgtaacttaccaaggaaattatcaaggaaatccgggacttaaccactcgatggcaggtga480
gcttggctgggtacaatgtgcatccagtgaacttacttatccagattacagaccacctcc540
aaagcaatatccttatttaccacaaagctttgtgcaagacacttctgttcagaaacaaaa600
ctttgtgtcatctacatcattacaagttaaaaataatcagcttccaccttctacacagac660
cttaccatcaaagcgccctgtacctgtgtcgtcatatcagtatgctgcagaaaccagcaa720
aagactccctccccccccttacagctgtag750
<210>3
<211>750
<212>dna/rna
<213>人工序列(artificialsequence)
<400>3
atatggaagccaacatgtgcaaaattctcagtctgtttctagacacttgcctgtggaagt60
tcctcagagttcagaaatgcactcgtctgaaaaaaagaaagatgcttacaaagtctttca120
acagcagtggcagagcactagtaaaaatgtcagtacaataggaaaattctgtgagttgaa180
aattaatacaaaacagtcttacaatgactctgctggctcttctggggatggtgttcatac240
tcttgttcaaaataatcaagaagaaagaaagtattcttataatccaagtacaaatcaaat300
actagacacaaatgtcacaaaagaaaagctggtgagggatattaaatcactagtagaaat360
tagctgggccatggtggcgcacgcctttaatcccagcactcaggaggcagaggcaggtca420
aataggcattctgaattttcagcaaaagaaatgtctgctaaaagggacaatcagtgctcc480
atggaattgctagcaacatgcctttctctttggaaaaaccaacctccaaaaaccacagaa540
gaaaatgtttcaaaacctttagaagaaaaacaatataatgcatcaagaactagtacaaca600
gcggttggcccttcaaatcccatgaatgaagttcatgtgaagaatttttgttcaggtgtt660
agaaattctcagaaaataaccacctcgtcacaaacagtcttgtcagttctcacaccagtt720
tacgattcttcagatgtagctgttggaaaa750
<210>4
<211>588
<212>dna
<213>人工序列(artificialsequence)
<400>4
gttgacattgattattgactagttattaatagtaatcaattacggggtcattagttcata60
gcccatatatggagttccgcgttacataacttacggtaaatggcccgcctggctgaccgc120
ccaacgacccccgcccattgacgtcaataatgacgtatgttcccatagtaacgccaatag180
ggactttccattgacgtcaatgggtggagtatttacggtaaactgcccacttggcagtac240
atcaagtgtatcatatgccaagtacgccccctattgacgtcaatgacggtaaatggcccg300
cctggcattatgcccagtacatgaccttatgggactttcctacttggcagtacatctacg360
tattagtcatcgctattaccatggtgatgcggttttggcagtacatcaatgggcgtggat420
agcggtttgactcacggggatttccaagtctccaccccattgacgtcaatgggagtttgt480
tttggcaccaaaatcaacgggactttccaaaatgtcgtaacaactccgccccattgacgc540
aaatgggcggtaggcgtgtacggtgggaggtctatataagcagagctc588
<210>5
<211>25
<212>dna/rna
<213>人工序列(artificialsequence)
<400>5
caccgcccccttacagctgtagata25
<210>6
<211>25
<212>dna/rna
<213>人工序列(artificialsequence)
<400>6
aaactatctacagctgtaagggggc25
<210>7
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>7
tgccccaaacccaccatatt20
<210>8
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>8
tatgcccaggcagtgatagc20
<210>9
<211>58
<212>dna
<213>人工序列(artificialsequence)
<400>9
atgattacgccaagcttcccccttacagctgtagatatggtttcagctgtctcccaca58
<210>10
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>10
caatgtcaacctacagctgtaagggg26
<210>11
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>11
tgccccaaacccaccatatt20
<210>12
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>12
tatgcccaggcagtgatagc20
<210>13
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>13
caaccatagtatatggaagccaacatgtgc30
<210>14
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>14
acgacggccagtgaattcccatatctacagctgtaagggggttttccaacagctacatc59
<210>15
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>15
tgccccaaacccaccatatt20
<210>16
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>16
gccatttaccgtcattgacgtc22
<210>17
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>17
catgcatcgatgatatcagatccc24
<210>18
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>18
tatgcccaggcagtgatagc20
<210>19
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>19
caccagctgcacctgggagt20
- 还没有人留言评论。精彩留言会获得点赞!