酰基保护的L-LNA-鸟嘌呤核苷单体的制作方法
本发明涉及立体专一的硫代磷酸寡核苷酸和核苷单体及其合成方法。本文公开了酰基保护的l-lna-g单体,其具有改善的溶解性和稳定性特征,因此导致寡核苷酸合成的效率提高。
发明背景
最近,我们发现在lna寡核苷酸中使用立体专一的硫代磷酸酯核苷间键可以优化lna寡核苷酸的药理学特征。与非立体专一的硫代磷酸寡核苷酸相比,目前立体专一的硫代磷酸寡核苷酸的制备相对低效。因此需要提高立体专一的寡核苷酸的合成效率。
wo2014/010250公开了核苷单体,当掺入寡核苷酸时,其在相应的硫代磷酸酯核苷间键合位置提供手性确定的立体中心。虽然考虑了lna单体,但没有进行制备或测试。本发明基于鸟嘌呤单体(称为l-xna-g单体)在许多溶剂中不溶和/或不稳定这一出人意料的观察结果。本发明提供了其中鸟嘌呤残基的环外氮被酰基保护基而不是常规的dmf保护基保护的l-xna-g单体。这些单体在溶液中显著可溶并且稳定。
发明详述
本发明提供了式1、1a或1b的化合物
其中
z是鸟嘌呤核苷,其中鸟嘌呤核碱基基团在鸟嘌呤环外氮基团上包含酰基保护基,其中式i的环外氧与核苷z的3'碳共价连接;r5和r6独立地选自氢、烷基、环烷基、芳基、杂芳基、取代的烷基、取代的环烷基、取代的芳基和取代的杂芳基,或者r5和r6与式1的n原子一起形成包含3-16个碳原子的杂环;
r9是氢;
r1选自氢和c1-3烷基;并且
r选自芳基、杂芳基、取代的芳基、取代的杂芳基、硝基、卤素、氰基、甲硅烷基、取代的甲硅烷基、砜、取代的砜(芳基取代的砜)、芴和取代的芴。
当被取代时,r可被选自下列的基团取代:c1-4烷基、c6-14芳基、c1-4烷氧基、c7-14芳烷基、c1-4烷基c6-14芳基、c1-4烷氧基c6-14芳基或c6-14芳基c1-4烷基。多重取代可以非独立地或独立地选自c1-4烷基、c6-14芳基、c1-4烷氧基、c7-14芳烷基、c1-4烷基c6-14芳基、c1-4烷氧基c6-14芳基或c6-14芳基c1-4烷基。
式1化合物可以是如式1a和式1b所示的两种非对映异构体中的任一种,或者在一些实施方案中,可以是非对映异构体的混合物。
在一些实施方案中,z是
其中b是在鸟嘌呤环外氮基团上包含酰基保护基的鸟嘌呤核碱基基团,并且r2、r3和r4如本文中所述。在一些实施方案中,r4和r2形成二价桥接以形成一个双环核苷(参见下文中的lna)。虚线表示与式1、1a或1b化合物中的非环氧的连接。代表性的核苷基团z如本文公开的式62、63、64、65、66、67、68、69、70、71、72、73和74的核苷中所示,所不同的是3'oh基团被式1、1a和1b中所示的连接于环外氧基团的键替代。
在一些实施方案中,当r是取代的芳基时,r可被卤素例如碘、氟、溴或氯取代。
本发明提供了包含式1化合物和溶剂的溶液(组合物)。本发明提供了包含式1a化合物和溶剂的溶液(组合物)。本发明提供了包含式1b化合物和溶剂的溶液(组合物)。溶液可以是稳定的溶液,即它在室温下稳定至少24小时(例如使用实施例6中提供的测定方法)。应该认识到,在一些实施方案中,稳定的溶液可以在24小时内导致溶液中的本发明化合物的一些降解,但是,在24小时后在溶液中存在例如至少20%(例如至少30%,至少40%,至少50%,至少60%或至少70%,或至少75%)初始量的化合物1。
本发明提供了本发明化合物或组合物在合成或制备寡核苷酸中的用途。
本发明提供了合成式i(1a)化合物的方法,所述方法包括使包含3'-oh基团的鸟嘌呤核苷与式8化合物反应的步骤:
其中x是卤素,例如碘、溴或氯,并且其中鸟嘌呤核苷上的鸟嘌呤核碱基基团在鸟嘌呤环外氮基团上包含酰基保护基,其中r、r1、r9、r5和r6如本发明的化合物中所定义,并且其中鸟嘌呤核苷上的鸟嘌呤核碱基基团在鸟嘌呤环外氮基团上包含酰基保护基。
本发明提供了式1a和1b化合物的混合物。本发明提供了包含式1a化合物的组合物。在一些实施方案中,混合物可以是非对映异构体混合物。如本文所示,本文公开的单体的l和d立体异构体、例如lna单体,在不同溶剂中可显示出显著不同的溶解度和稳定性。
本发明提供了合成立体专一的硫代磷酸寡核苷酸的方法,所述方法包括将本发明化合物(本发明的鸟嘌呤核苷单体)与通过-oh基团连接到固体支持物上的核苷的5'-oh基团偶联的步骤,然后进行硫化步骤。该方法可以进一步包括加帽步骤,该步骤可以在硫化步骤之前或之后进行。随后可在链延长完成后除去酰基保护基团,例如在整体脱保护和将寡核苷酸从固体支持物上裂解的过程中。因此,本发明的单体可以用于亚磷酰胺寡核苷酸合成,以在寡核苷酸内引入立体专一的手性中心。
附图说明
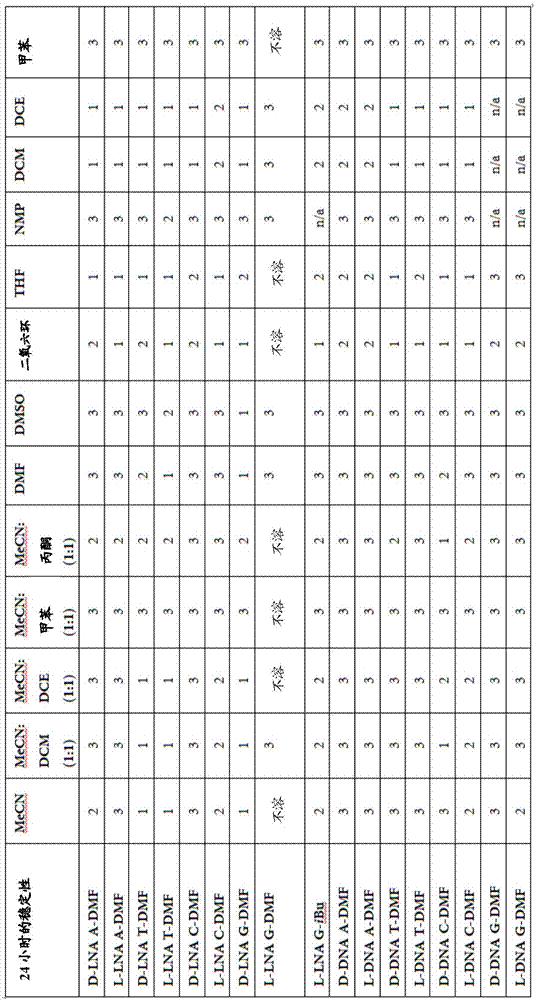
图1:各种l和d核苷单体在选择的溶剂中的溶解度。
图2:各种l和d核苷单体在选择的溶剂中的稳定性。3=相对不稳定,2=中等稳定性,1=相对稳定
图3:在各种溶剂中24小时后测量的l-lna-g-ibu单体(3a)和l-lna-g-dmf单体的稳定性(参见实施例6)。图3a-i-bu-对照是指在t=0h时的起始材料(l-lnag-i-bu)。图3b-dmf-对照是指t=0h时的起始材料(l-lnag-dmf)。
发明详述
本文所用的术语“芳基”是指芳环,其中每一个成环原子均是碳原子。芳基环由五个、六个、七个、八个、九个或九个以上的碳原子形成。芳基是取代或未取代的。在一个方面,芳基是苯基或萘基。取决于结构,芳基可以是单价基团或二价基团(即亚芳基)。在一个方面,芳基是c6-10芳基。在一些实施方案中,芳基是苯基。当被取代时,芳基可以被选自下组的基团取代:c1-4烷基、c6-14芳基、c1-4烷氧基、c7-14芳烷基、c1-4烷基c6-14芳基、c1-4烷氧基c6-14芳基或c6-14芳基c1-4烷基。多重取代可以非独立地或独立地选自:c1-4烷基、c6-14芳基、c1-4烷氧基、c7-14芳烷基、c1-4烷基c6-14芳基、c1-4烷氧基c6-14芳基或c6-14芳基c1-4烷基;或选自卤素的基团,如碘、氟、溴或氯,如被卤素如碘、氟、溴或氯取代的苯基。
“烷基”基团是指脂族烃基。烷基部分可以是饱和烷基(这意味着它不含任何不饱和单元,例如碳-碳双键或碳-碳三键),或者烷基部分可以是不饱和烷基(这意味着它含有至少一个不饱和单元)。无论是饱和的还是不饱和的,烷基部分可以是支链的、直链的或包括环状部分。烷基的连接点位于不是环的一部分的碳原子上。“烷基”部分可具有1至10个碳原子(无论何时在本文中出现,数值范围如“1至10”是指给定范围内的每个整数;例如,“1至10个碳原子”表示烷基基团可以由1个碳原子、2个碳原子、3个碳原子等组成,直至并包括10个碳原子,尽管本发明的定义还包括所出现的未指定数值范围的术语“烷基”)。烷基包括支链和直链烷基。本文所述化合物的烷基可称为“c1-6烷基”或类似的名称。仅举例来说,“c1-6烷基”表示烷基链中存在一个、两个、三个、四个、五个或六个碳原子,即烷基链选自甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基和叔丁基。典型的烷基包括但不限于甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、己基、烯丙基、环丙基甲基、环丁基甲基、环戊基甲基、环己基甲基等。在一个方面,烷基是c1-6或c1-4烷基或c1-3烷基。c1-3烷基是指具有1至3个碳原子的直链或支链烷基。c1-4烷基的实例是甲基、乙基、丙基和异丙基。c1-3烷基是指具有1至4个碳原子的直链或支链烷基。c1-3烷基的实例是甲基、乙基、丙基、异丙基、丁基、异丁基和叔丁基。
“烯基”基团是含有至少一个碳-碳双键的直链、支链和环状烃基。烯基可以被取代。
“炔基”基团是含有至少一个碳-碳三键的直链、支链和环状烃基。炔基可以被取代。
“烷氧基”基团是指与氧连接的烷基,即(烷基)-o-基团,其中烷基如本文所定义。其实例包括甲氧基(-och3)或乙氧基(-och2ch3)。
“烯氧基”基团是指与氧连接的烯基,即(烯基)-o-基团,其中烯基如本文所定义。
“炔氧基”基团是指与氧连接的炔基,即(炔基)-o-基团,其中炔基如本文所定义。
“芳氧基”基团是指与氧连接的芳基,即(芳基)-o-基团,其中芳基如本文所定义。其实例包括苯氧基(-oc6h5)。
“甲硅烷基”是指h3si-。如本文所用的“取代的甲硅烷基”是指有一个或多个甲硅烷基的氢被取代的部分。其实例包括但不限于tbdms(叔丁基二甲基甲硅烷基)、tbdps(叔丁基二苯基甲硅烷基)或tms(三甲基甲硅烷基)基团。
术语“卤素”旨在包括氟、氯、溴和碘。术语“卤化物”包括氟化物、溴化物、碘化物和氯化物。
“酰基保护基”包括酰基–c(=o)-r7,其中r7是末端基团,例如选自烷基-、烷基-、烯基-、炔基-、环烷基-和芳基-基团;或选自未取代的烷基-、未取代的烯基-、未取代的炔基-、未取代的环烷基-或未取代的芳基-基团的基团;或是选自取代的烷基-、取代的烯基-、取代的炔基-、取代的环烷基-或取代的芳基-基团的基团。在一些实施方案中,r7可以选自未取代的c1-6-烷基-、未取代的c2-6-烯基-、未取代的c2-6-炔基-、未取代的c3-7-环烷基-或未取代的苯基-基团或取代的c1-6-烷基-、取代的c2-6-烯基-、取代的c2-6-炔基-、取代的c3-7-环烷基-或取代的苯基-基团;其中当被取代时,取代基可以是单取代或多取代的,例如被一个或多个选自下列的取代基取代:卤素、c1-6-烷基、c2-6-烯基、c2-6-炔基、c1-6-烷氧基、任选取代的芳基氧基或任选取代的芳基。在一些实施方案中,酰基保护基是异丁酰基(-c(o=)ch(ch3)2)(在本文中也称为ibu)。
本发明提供了式1的核苷单体,例如式1a或1b的核苷单体,和包含核苷单体的溶剂组合物(溶液),以及它们在合成寡核苷酸中的用途。
式1a的核苷的r和r1(r/r1)基团提供立体中心(l),当掺入寡核苷酸时,其导致在核苷3'上形成sp立体专一的硫代磷酸酯基团。包含由式1a中所示的r和r1基团产生的立体中心的单体在本文中称为l单体,其导致形成sp立体中心。在一些实施方案中,本发明基于令人惊讶的观察结果,即dmf保护的鸟嘌呤l单体,例如l-lna-g单体,在许多溶剂中难以溶解,并且即使溶解了也非常不稳定,以至于难以在商业规模制备立体专一的寡核苷酸。与糖修饰的核苷(例如双环核苷,例如l-lna-g核苷)相比,l-dna-g单体的问题不太严重。实际上,dmf保护的l-lna-g和d-lna-g(其中式1的立体中心r/r1和r6/r9的立体化学反转,如式1b所示)的溶解度的并列比较显示,尽管dmf保护的d-lna-g在大多数溶剂中是可溶且稳定的,但dmf保护的l-lna-g非常难以溶解并且在溶液中的稳定性小于24小时。
式1b的核苷的r和r1(r/r1)基团提供立体中心(d),当掺入寡核苷酸时,其导致在核苷3'上形成rp立体专一的硫代磷酸酯基团。包含由式1b中所示的r和r1基团产生的立体中心的单体在本文中称为d单体,其导致形成rp立体中心。
非对映异构体的混合物
本发明提供了一种组合物,其包含式1a化合物。在一些实施方案中,所述组合物不包含式1b化合物。在一些实施方案中,该组合物不包含超过1%的式1b化合物(通过式1a化合物的摩尔比测量)。在一些实施方案中,该组合物不包含超过2%的式1b化合物(通过式1a化合物的摩尔比测量)。在一些实施方案中,该组合物不包含超过3%的式1b化合物(通过式1a化合物的摩尔比测量)。在一些实施方案中,该组合物不包含超过4%的式1b化合物(通过式1a化合物的摩尔比测量)。在一些实施方案中,该组合物不包含超过5%的式1b化合物(通过式1a化合物的摩尔比测量)。在一些实施方案中,该组合物不包含超过10%的式1b化合物(通过式1a化合物的摩尔比测量)。在一些实施方案中,该组合物不包含超过20%的式1b化合物(通过式1a化合物的摩尔比测量)。组合物可以是本文所述的溶液(组合物)的形式。
本发明提供了一种组合物,其包含式1b化合物。在一些实施方案中,所述组合物不包含式1a化合物。在一些实施方案中,该组合物不包含超过1%的式1a化合物(通过式1b化合物的摩尔比测量)。在一些实施方案中,该组合物不包含超过2%的式1a化合物(通过式1b化合物的摩尔比测量)。在一些实施方案中,该组合物不包含超过3%的式1a化合物(通过式1b化合物的摩尔比测量)。在一些实施方案中,该组合物不包含超过4%的式1a化合物(通过式1b化合物的摩尔比测量)。在一些实施方案中,该组合物不包含超过5%的式1a化合物(通过式1b化合物的摩尔比测量)。在一些实施方案中,该组合物不包含超过10%的式1a化合物(通过式1b化合物的摩尔比测量)。在一些实施方案中,该组合物不包含超过20%的式1a化合物(通过式1b化合物的摩尔比测量)。组合物可以是本文所述的溶液(组合物)的形式。
l-单体
在一些实施方案中,本发明提供了式1a的化合物
其中
z是鸟嘌呤核苷,其中鸟嘌呤核碱基基团在鸟嘌呤环外氮基团上包含酰基保护基,其中式1a的环外氧与核苷z的3'碳共价连接;r5和r6独立地选自氢、烷基、环烷基、芳基、杂芳基、取代的烷基、取代的环烷基、取代的芳基和取代的杂芳基,或者r5和r6与式1a的n原子一起形成包含3-16个碳原子的杂环;
r9是氢;
r1选自氢和c1-3烷基;并且
r选自芳基、杂芳基、取代的芳基、取代的杂芳基、硝基、卤素、氰基、甲硅烷基、取代的甲硅烷基、砜、取代的砜(芳基取代的砜)、芴和取代的芴。
本文对基团r、r1、r6、r9和r5的描述通常可适用于本文所述的化合物,包括l和d立体异构体。
当被取代时,r可被选自下列的基团取代:c1-4烷基、c6-14芳基、c1-4烷氧基、c7-14芳烷基、c1-4烷基c6-14芳基、c1-4烷氧基c6-14芳基或c6-14芳基c1-4烷基。多重取代可以非独立地或独立地选自c1-4烷基、c6-14芳基、c1-4烷氧基、c7-14芳烷基、c1-4烷基c6-14芳基、c1-4烷氧基c6-14芳基或c6-14芳基c1-4烷基。
在一些实施方案中,r选自芳基、杂芳基、取代的芳基、取代的杂芳基、硝基、卤素、氰基、甲硅烷基、取代的甲硅烷基、砜、取代的砜(芳基取代的砜)、芴和取代的芴。
在一些实施方案中,r选自芳基、杂芳基、取代的芳基和取代的杂芳基。
在一些实施方案中,r是芳基,例如苯基。
在一些实施方案中,当r是取代的芳基时,r可被卤素例如碘、氟、溴或氯取代,例如被卤素例如碘、氟、溴或氯取代的苯基。
在一些实施方案中,r1是氢。在一些实施方案中,r1是c1-3烷基,例如甲基、乙基或丙基。在一些实施方案中,r1是甲基。
在一些实施方案中,r是芳基,例如苯基并且r1是氢。
在一些实施方案中,r是芳基,例如苯基,并且r1是c1-3烷基,例如甲基、乙基或丙基。
在一些实施方案中,r是
其中g31、g32和g33独立地选自c1-4烷基、c6-14芳基c1-4烷氧基、c7-14芳烷基、c1-4烷基c6-14芳基、c1-4烷氧基c6-14芳基和c6-14芳基c1-4烷基。
在一些实施方案中,r是
其中g21、g22和g23独立地是氢、硝基、卤素、氰基或c1-3烷基。
在一些实施方案中,r是
其中g51、g52和g53独立地是氢、硝基、卤素、氰基或c1-3烷基或c1-3烷氧基。
在一些实施方案中,r5和r6一起形成杂环(与式1中所示的环氮一起)。杂环可以包含例如3-16个碳原子,例如4个碳原子。
在一些实施方案中,r5和r6一起形成杂环(与式i中所示的环氮一起),所述杂环包含4个碳原子,使得杂环中总共有5个原子(4个碳和一个式1中所示的氮)。例如,本发明的化合物可以是式2的化合物:
其中r、r1、r9和z如本发明的化合物所述。
在一些实施方案中,r5和r6一起形成杂环(与式i中所示的环氮一起),所述杂环包含4个碳原子,使得杂环中总共有5个原子(4个碳和一个式1中所示的氮),并且r是芳基,例如苯基,r1是氢或甲基。r9是氢。
以上的z基团是核苷,其中核苷的3’氧是式1中所示的环外氧。在一些实施方案中,z基团是lna核苷部分。因此,在一些实施方案中,本发明的化合物可以表示为式3的化合物:
其中,r、r1、r5、r6和r9如本发明的化合物中所定义;
b是在鸟嘌呤环外氮基团上包含酰基保护基的鸟嘌呤核碱基基团;
r3选自ch2odmtr、ch2-烷基-o-dmtr、ch-me-o-dmtr、ch2ommtr、ch2-烷基-o-mmtr、ch(me)-o-mmtr、ch-ra-o-dmtrrb和ch-ra-o-mmtrrb;
r2选自卤素例如–f、氨基、叠氮基、-sh、-cn、-ocn、-cf3、-ocf3、-o(rm)-烷基、-s(rm)-烷基、–n(rm)-烷基、-o(rm)-烯基、-s(rm)-烯基、–n(rm)-烯基;-o(rm)-炔基、-s(rm)-炔基或-n(rm)-炔基;o-亚烷基-o-烷基、炔基、烷芳基、芳烷基、o-烷芳基、o-芳烷基、o(ch2)2sch3、o-(ch2)2-o-n(rm)(rn)或o-ch2c(=o)-n(rm)(rn)、-o-(ch2)2och3和-o-ch3,其中rm和rn各自独立地是h、氨基保护基或取代或未取代的c1-10烷基;
r4选自烷基、环烷基、杂环烷基、o-烷基、s-烷基、nh-烷基和氢;
或者r2和r4一起表示二价的桥接,例如由1、2、3个选自-c(rarb)-、-c(ra)=c(rb)、-c(ra)=n、o、-si(ra)2-、s-、-so2-、-n(ra)-和>c=z的基团/原子组成;
其中ra和rb(当存在时)各种独立地选自氢、任选取代的c1-6-烷基、任选取代的c2-6-烯基、任选取代的c2-6-炔基、羟基、任选取代的c1-6-烷氧基、c2-6-烷氧基烷基、c2-6-烯基氧基、羧基、c1-6-烷氧基羰基、c1-6-烷基羰基、甲酰基、芳基、芳基氧基-羰基、芳基氧基、芳基羰基、杂芳基、杂芳基氧基-羰基、杂芳基氧基、杂芳基羰基、氨基、单-和二-(c1-6-烷基)氨基、氨基甲酰基、单-和二-(c1-6-烷基)-氨基-羰基、氨基-c1-6-烷基-氨基羰基、单-和二-(c1-6-烷基)氨基-c1-6-烷基-氨基羰基、c1-6-烷基-羰基氨基、脲基、c1-6-链烷酰氧基、sulphono、c1-6-烷基磺酰氧基、硝基、叠氮基、硫烷基、c1-6-烷硫基、卤素,其中芳基和杂芳基可被任选取代,并且其中两个偕取代基ra和rb合在一起可以表示任选取代的亚甲基(=ch2),其中对于所有手性中心,不对称基团可以为r或s取向。
在一些实施方案中,当掺入寡核苷酸中时,核苷(z)赋予比同等dna核苷更高的对互补rna靶的结合亲和力。这种核苷被称为高亲和力核苷。高亲和力核苷的实例包括2'-o-moe、2'-氟、2'-o-甲基和lna核苷。在核苷是高亲和力核苷的实施方案中,r3可以是例如ch2-o-dmtr或ch2-o-mmtr。
在一些实施方案中,r2选自氟(–f)、-o-(ch2)2och3和-o-c1-3烷基,例如–o-ch3。在该实施方案中,r4任选地是氢。
在一些实施方案中,核苷是包含2’–4’桥接(二价基团)的lna核苷(也称为双环核苷)。
在一些实施方案中,r2和r4一起表示二价的桥接,其选自桥接–c(rarb)-o-、–c(rarb)c(rarb)-o-、-ch2-o-、-ch2ch2-o-、-ch(ch3)-o-。在一些实施方案中,r2和r4表示二价的桥接-ch2-o-(亚甲基-氧基,也称为氧-lna)或-ch(ch3)-o-(甲基-亚甲基-氧基)。-ch(ch3)-o-桥接在桥接内的碳原子上引入一个手性中心,在一些实施方案中,其位于s位(例如在本领域中称为(s)cet的核苷–参见ep1984381))。在一些实施方案中,r2和r4表示二价的桥接–ch2-o-,其中的桥接位于β-d位(β-d-氧lna)。在一些实施方案中,r2和r4表示二价的桥接–ch2-o-,其中的桥接位于α-l位(α-l-d-氧lna)。在一些实施方案中,r2和r4表示二价的桥接–ch2-s-(硫lna)或–ch2-nh2-(氨基lna)。在其中r2和r4一起表示二价的桥接的实施方案中,r3可以是例如ch2-o-dmtr或ch2-o-mmtr。
在一些其中核苷(z)是双环核苷(lna)例如β-d-氧lna的实施方案中,r是芳基,例如苯基,并且r1是氢或c1-3烷基。在所述实施方案中,r5和r6可以一起形成杂环,例如本文中所述的5元杂环(例如,参见式2)。
本发明的化合物包含酰基保护的鸟嘌呤核苷(z)。
在一些实施方案中,本发明的化合物可以用式10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25的化合物表示:
其中,r、r1、r2、r3、r4、r5、r9和r6如本发明的化合物中所定义,并且-c(=o)-r7是鸟嘌呤碱基环外氮上的酰基保护基,r8(当存在时)是鸟嘌呤环外氧上的保护基。在一些实施方案中,r8是氰基乙基。在一些实施方案中,r9是氢。
在本发明化合物的一些实施方案中,r7选自任选取代的烷基-、烯基-、炔基-、环烷基-或芳基-基团,优选选自任选取代的c1-6-烷基-、c2-6-烯基-、c2-6-炔基-、c3-7-环烷基-或苯基-基团;其中当被取代时,取代基可以是单取代或多取代的,例如被一个或多个选自卤素、c1-6-烷基、c2-6-烯基、c2-6-炔基、c1-6-烷氧基、任选取代的芳基氧基或任选取代的芳基的取代基取代。在一些实施方案中,烷基是支链的烷基,例如c3-10或c3-6支链烷基。
在一些实施方案中,r7是支链烷基,例如取代或未取代的支链烷基,例如异-丙基、异-丁基、仲-丁基和叔丁基。在一些实施方案中,r7是异-丙基。
在一些实施方案中,鸟嘌呤环外氮基团上的酰基保护基(例如–c(=o)-r7)选自异丁酰基(ibu)、乙酰基(ac)、苯氧基乙酰基(pac)、对-异丙基苯氧基乙酰基(iprpac)、苯基乙酰基、异丙基氧基乙酰基、甲氧基乙酰基、苯甲酰基、对-甲氧基苯基乙酰基、二苯基乙酰基、环己基羰基、1,1-二甲基丙酰基和对-叔丁基-苯氧基乙酰基。
在一些实施方案中,鸟嘌呤环外氮基团上的酰基保护基选自异丁酰基(ibu)、乙酰基(ac)、苯氧基乙酰基(pac)和对-异丙基苯氧基乙酰基(iprpac)。
在一些实施方案中,鸟嘌呤环外氮基团上的酰基保护基是异丁酰基(ibu)端基。
在其中r2和r4一起表示二价的桥接的实施方案中,r3可以是ch2-o-dmtr或ch2-o-mmtr,鸟嘌呤环外氮基团上的酰基保护基(例如-c(=o)-r7)是异丁酰基(ibu),r可以是苯基并且r1可以是氢或甲基,r5和r6一起形成5元杂环,例如如式2中所示。
在一些实施方案中,本发明的化合物可以用式50、51、52、53、54、55、56、57、58、59、60或61的化合物表示:
其中r3和r8(当存在时)如本发明的化合物中所定义。在一些实施方案中,r3选自ch2odmtr、ch2-烷基-o-dmtr、ch-me-o-dmtr、ch2ommtr、ch2-烷基-o-mmtr、ch(me)-o-mmtr、ch-ra-o-dmtrrb和ch-ra-o-mmtrrb,并且r8(当存在时)可以是氰基乙基;其中ra和rb如本发明的化合物中所定义。
在一些实施方案中,本发明提供了式75、76和77任意一个的化合物:
n-(9-((1s,3r,4r,6s,7s)-1-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)-6-甲基-7-(((1r,3r,3as)-3-苯基四氢-1h,3h-吡咯并[1,2-c][1,3,2]噁唑磷烷-1-基)氧基)-2,5-二氧杂二环[2.2.1]庚-3-基)-6-氧代-6,9-二氢-1h-嘌呤-2-基)异丁酰胺
n-(9-((1r,3r,4r,7s)-1-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)-7-(((1r,3r,3as)-3-苯基四氢-1h,3h-吡咯并[1,2-c][1,3,2]噁唑磷烷-1-基)氧基)-2,5-二氧杂二环[2.2.1]庚-3-基)-6-氧代-6,9-二氢-1h-嘌呤-2-基)异丁酰胺
n-(9-((2r,3r,4r,5r)-5-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)-3-(2-甲氧基乙氧基)-4-(((1r,3r,3as)-3-苯基四氢-1h,3h-吡咯并[1,2-c][1,3,2]噁唑磷烷-1-基)氧基)四氢呋喃-2-基)-6-氧代-6,9-二氢-1h-嘌呤-2-基)异丁酰胺
可以理解,在一些实施方案中,式75、76和77的化合物可以带有是甲基(而不是氢)的r1基团。
溶剂组合物
本发明提供溶剂组合物,其包含本发明化合物和溶剂,例如极性非质子溶剂。合适地,本发明的化合物可溶于溶剂中。因此,本发明提供了包含本发明化合物的溶液。溶液可以是稳定的溶液。稳定的溶液、即本发明的化合物可溶于溶剂中,并且在室温(例如20℃)下稳定至少24小时。实施例中提供了测定包含本发明化合物的溶液组合物的溶解度和稳定性的方法。
在一些实施方案中,本发明化合物在溶液(例如溶液组合物)中的稳定性为至少约20%,例如至少约30%,例如至少约40%,例如至少约50%,例如至少约60%,例如至少约70%,例如至少约75%,采用实施例6中提供的稳定性测定试验在24小时后测定(通常在室温、例如20-25℃下进行)。这些在24小时后显示稳定性(即,采用实施例6的稳定性测定试验测量的24小时后剩余化合物的量为至少约20%,例如至少约30%,例如至少约40%,例如至少约50%,例如至少约60%,例如至少约70%,例如至少约75%)的包含溶解在溶液中的本发明化合物的溶液在本文中称为稳定溶液。在一些实施方案中,本发明提供稳定的溶液,其包含本发明的化合物和溶剂,例如本文提及的那些。
在一些实施方案中,溶剂是极性溶剂。在一些实施方案中,溶剂是非质子溶剂。
在一些实施方案中,溶剂是或包含选自乙腈、dmf、dmso、二氧六环、四氢呋喃、二氯甲烷和二氯乙烷的溶剂。
在一些实施方案中,溶剂是或包含乙腈或二氧六环。
在一些实施方案中,溶剂包含乙腈和丙酮,例如比例约为1:1。
在一些实施方案中,溶剂是或包含dmso或dmf。
在一些实施方案中,溶剂是或包含四氢呋喃。
在一些实施方案中,溶剂是或包含二氯甲烷或二氯乙烷。
在一些实施方案中,溶剂不是甲苯。在一些实施方案中,溶剂不包含甲苯。
在一些实施方案中,溶剂不是dmso或dmf。在一些实施方案中,溶剂不包含dmso或dmf。
合成本发明化合物的方法
本发明提供了合成本发明化合物的方法,所述方法包括将包含3’–oh基团的鸟嘌呤核苷(z)与式4化合物反应的步骤:
其中x是卤素,例如溴、氯或碘,并且其中r、r1、r5、r6和r9如本发明的化合物所定义;
并且其中鸟嘌呤核苷上的鸟嘌呤核碱基基团在鸟嘌呤环外氮基团上包含酰基保护基,例如酰基保护基-c(=o)-r7。
在一些实施方案中,式4的化合物选自式5、6、7和8:
其中x是卤素,例如氯、溴或碘。
在一些实施方案中,式4或5的x是氯。以下可任选地适用于式4、5、6、7和8的化合物:
在一些实施方案中,r选自芳基、杂芳基、取代的芳基、取代的杂芳基、硝基、卤素、氰基、甲硅烷基、取代的甲硅烷基、砜、取代的砜(芳基取代的砜)、芴和取代的芴。
在一些实施方案中,r选自芳基、杂芳基、取代的芳基和取代的杂芳基。
在一些实施方案中,r是芳基,例如苯基。
在一些实施方案中,当r是取代的芳基时,r可以被卤素取代,例如被碘、氟、溴或氯取代,例如被卤素如碘、氟、溴或氯取代的苯基。
在一些实施方案中,r1是氢。在一些实施方案中,r1是c1-3烷基,例如甲基、乙基或丙基。在一些实施方案中,r1是甲基。
在一些实施方案中,r是芳基,例如苯基,并且r1是氢。
在一些实施方案中,r是芳基,例如苯基,并且r1是c1-3烷基,例如甲基、乙基或丙基。
在一些实施方案中,r是苯基,r1是氢,x是溴并且和r5和r6一起形成5元杂环。在一些实施方案中,r是苯基,r1是甲基,x是溴,并且r5和r6一起形成5元杂环。在一些实施方案中,r是苯基,r1是氢,x是氯,并且r5和r6一起形成5元杂环。在一些实施方案中,r是苯基,r1是甲基,x是氯,并且r5和r6一起形成5元杂环。
式4或式5、6、7或8的化合物是可用于合成本发明化合物的方法的中间体化合物,因此,本发明提供式4、5、6、7或8的化合物及其在合成核苷单体,例如酰基保护的l-xna-g,如酰基保护的l-lna-g单体中的用途。
式4的中间体化合物(例如式5、6、7和8的化合物)可以在事前步骤(步骤a)中通过将式9或式9a的化合物与三卤化磷如pcl3、pbr3或pi3,例如pcl3反应而制备
其中r、r1、r5、r9和r6如本发明的化合物所定义。
式9或9a化合物与三卤化磷之间的反应通常在非亲核性叔碱例如n-甲基吗啉(nmm)、三乙胺、吡啶、n-甲基咪唑或1,4-二氮杂双环[2.2.2]辛烷的存在下进行,并且可以在溶剂例如甲苯、thf、二氧六环、乙醚或苯,例如thf或甲苯中进行。在一些实施方案中,非亲核性叔胺是nmm,溶剂是甲苯或thf。
在式9或9a的一些实施方案中,r是苯基并且r1是氢。在一些实施方案中,r是苯基并且r1是甲基。
本发明提供了合成式4、5、6、7或8的化合物的方法(其在本文中描述的一些实施方案中可称为步骤a)。
所述方法包括将式9或9a的化合物与三卤化磷(制备式4和5*的化合物),例如三氯化磷(制备式6*的化合物)、三碘化磷(制备式7*的化合物)或者三溴化磷(制备式8*的化合物)在溶剂(例如甲苯)中的溶液在低于0℃的温度下反应以生成式4、5、6、7、8或9的化合物的步骤。溶剂可以选自例如甲苯、thf、二氧六环、乙醚或苯,例如thf或甲苯。应认识到,前体9a可用于制备式5、6、7、8或9的中间体,这取决于使用哪种三卤化磷(如式5、6、7和8的*所示)。因此,三卤化磷与式9或9a化合物的反应形成式4、5、6、7或8的中间体化合物。
在一些实施方案中,化合物9(或9a)与三卤化磷的反应在约-45℃至约-65℃的温度下进行,例如在约50℃至约-60℃之间,例如约-55℃。术语“约”包括指定的具体整数值。
在一些实施方案中,所用的三卤化磷例如pcl3的摩尔浓度不大于式9或9a化合物的摩尔浓度。在一些实施方案中,与三卤化磷的摩尔量相比,在步骤a中使用摩尔过量的式9或9a化合物。在一些实施方案中,步骤1中式9或9a的前体化合物与三卤化磷的摩尔比大于约1,例如为1.05以上。在一些实施方案中,步骤1中式9或9a的前体化合物与三卤化磷的摩尔比不大于1.5。
合成之后,可以将式4、5、6、7或8的化合物干燥,例如在真空中干燥,并任选地再溶解于溶剂例如甲苯、thf、二氧六环、乙醚或苯,例如thf或甲苯中以用于随后的合成步骤,其在本文中可称为步骤b。
本发明提供了合成式3化合物的方法(其在本文中描述的一些实施方案中可称为步骤b)。所述方法包括将式4化合物
其中x是卤素,例如溴、碘或氯(例如式5、6、7或8的化合物),并且其中r、r1、r5、r9和r6如本发明化合物所定义,
与式x的核苷反应的步骤
其中r2、r3和r4如本发明的化合物中所定义;
反应在溶剂例如甲苯、thf、二氧六环、乙醚或苯,例如thf或甲苯中;在低于0℃的温度下进行,生成式3的化合物
在一些实施方案中,反应步骤在有机碱例如非亲核性叔胺碱例如n-甲基吗啉和三乙胺的存在下进行。
在一些实施方案中,式4化合物(或式5、6、7或8的化合物)与核苷x的反应在约-60℃至约-80℃的温度下进行,例如在约65℃至约-75℃,例如约-77℃进行。术语“约”包括指定的具体整数值。
在一些实施方案中,步骤b中使用的式4化合物(或式5、6、7或8的化合物)与核苷x的摩尔浓度比为至少2,例如约2和约4,例如约2和约3。在一些实施方案中,与式x化合物相比,式4化合物(或式5、6、7或8的化合物)以摩尔过量使用。
在一些实施方案中,将核苷x的溶液逐渐加入到式4化合物(或式5、6、7或8的化合物)的溶液中,即,不是一次性加入,例如在至少15秒的时间内,例如至少30秒,例如至少1分钟,例如至少90秒,例如至少2分钟,例如5至30分钟,例如10至20分钟,例如约15分钟的时间内加入。
在一些实施方案中,核苷具有下式
其中b、r2、r3、r4如文中所定义。
在一些实施方案中,步骤b中的反应在碱和溶剂的存在下进行。在一些实施方案中,碱是有机碱,例如选自三甲胺、三乙胺和n-甲基吗啉的碱。在一些实施方案中,溶剂是或包含甲苯或四氢呋喃,任选还包含吡啶。在一些实施方案中,溶剂是或包含极性非质子溶剂。在一些实施方案中,溶剂是或包含选自乙腈、dmf、dmso、二氧六环、四氢呋喃、n-甲基-2-吡咯烷酮、二氯甲烷和二氯乙烷的溶剂。在一些实施方案中,溶剂是或包含四氢呋喃(thf)并且碱是三甲胺。在一些实施方案中,步骤b中的反应在低于0℃的温度下进行,例如低于-10℃,例如低于-20℃,例如低于-30℃,例如低于-40℃,例如低于-50℃,例如低于-60℃,例如低于-70℃,例如在-75和-80之间,例如约-77℃。“约”包括提到的确切整数。
在一些实施方案中,式x的化合物选自式62、63、64、65、66、67、68、69、70和71的化合物:
其中r2、r3、r4、r7和r8如本发明的化合物中所定义。
在一些实施方案中,式x的化合物可以是式72、73或74的化合物:
n-(9-((1r,3r,4r,6s,7s)-1-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)-7-羟基-6-甲基-2,5-二氧杂二环[2.2.1]庚-3-基)-6-氧代-6,9-二氢-1h-嘌呤-2-基)异丁酰胺
n-(9-((1r,3r,4r,7s)-1-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)-7-羟基-2,5-二氧杂二环[2.2.1]庚-3-基)-6-氧代-6,9-二氢-1h-嘌呤-2-基)异丁酰胺
n-(9-((2r,3r,4r,5r)-5-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-羟基-3-(2-甲氧基乙氧基)四氢呋喃-2-基)-6-氧代-6,9-二氢-1h-嘌呤-2-基)异丁酰胺
本发明提供了包括随后的步骤a和b的合成式1化合物(例如式3化合物)的方法。步骤a和步骤b的方法的实例显示在以下反应流程中,其中r和r1与本发明化合物相同,px3是卤化磷,x是卤素,如碘、溴或氯,b是本发明的酰基保护的鸟嘌呤核碱基。
寡核苷酸合成
本发明提供了本发明化合物或包含本发明化合物的溶剂组合物在合成寡核苷酸中的用途。
当通过寡核苷酸合成掺入寡核苷酸中时,本发明的核苷单体导致在掺入的核苷3'位产生sp立体专一的硫代磷酸酯核苷间键。
在一些实施方案中,寡核苷酸是lna寡核苷酸。本发明的l-lna-g单体可以通过任何合适的寡核苷酸合成方法、例如亚磷酰胺寡核苷酸合成掺入寡核苷酸中。本发明的l-lna-g单体是亚磷酰胺。在一些实施方案中,l-lna-g单体在亚磷酰胺寡核苷酸合成过程中掺入寡核苷酸中。
在一些实施方案中,通过本发明的方法制备的lna寡核苷酸可包含至少1g单体,例如至少2g单体,例如至少3g单体,例如至少4g单体。许多寡核苷酸的设计是已知的,并且本发明的方法可用于例如制备lnagapmer、混合物、单一体(totalmer)和tinylna。
以下流程显示了氧化、加帽和去保护的重复循环的示意流程,其可用于亚磷酰胺寡核苷酸合成的方法,如下所示:
制备寡核苷酸的方法可以使用任何合适的寡核苷酸合成方法,例如亚磷酰胺寡核苷酸合成。寡核苷酸合成可以在固体支持物上进行,例如unylinker支持物。寡核苷酸合成可以通过偶联、氧化、加帽和去保护的连续步骤进行。一旦合成了寡核苷酸,就可以除去任何剩余的保护基团(例如-c(=o)-r7和r8(当存在时)),并且可以从固体支持物上释放寡核苷酸,例如使用nh4oh在60℃下处理。
立体专一的硫代磷酸寡核苷酸
通常,合成的寡核苷酸硫代磷酸酯是rp和sp硫代磷酸酯键的无规混合物(也称为非对映异构体混合物)。在本发明的方法中,提供了硫代磷酸寡核苷酸,其中,在寡核苷酸样品中存在的至少75%,例如至少80%,或至少85%,或至少90%,或至少95%,或至少97%,例如至少98%,例如至少99%,或(基本上)所有寡核苷酸分子中,寡核苷酸的至少一个硫代磷酸酯键是立体专一的、即是rp或sp。立体专一的寡核苷酸包含至少一个立体专一的硫代磷酸酯键。术语立体专一的可用于将一个或多个硫代磷酸酯核苷间键的专一手性描述为rp或sp,或可用于描述包含一个(或多个)这样的硫代磷酸酯核苷间键的寡核苷酸。已经认识到立体专一的寡核苷酸可以在任何一个位置包含少量的另一种立体异构体,例如,wan等人报道了2014年11月在nar中报道的gapmer的98%立体选择性。
lna寡核苷酸
lna寡核苷酸是包含至少一个lna核苷的寡核苷酸。lna寡核苷酸可以是反义寡核苷酸。
本文使用的术语寡核苷酸定义为本领域技术人员通常所理解的包含两个或更多个共价连接的核苷的分子。为了用作反义寡核苷酸,通常合成长度为7-30个核苷酸的寡核苷酸。
如本文所用的术语“反义寡核苷酸”是指能够通过与靶核酸杂交,特别是与靶核酸上的连续序列杂交来调节靶基因表达的寡核苷酸。反义寡核苷酸也可以通过其与靶核酸互补来定义。反义寡核苷酸是单链的。反义寡核苷酸基本上不是双链的,因此不是sirna。反义寡核苷酸包含与靶核酸互补的连续核苷酸。反义寡核苷酸通常包含一个或多个修饰的核苷间键,并且作为非限制性实例,可以是lnagapmer或混合翼(mixedwing)gapmer的形式。在其他实施方案中,寡核苷酸可以是lna混合物(lna和非lna核苷酸,例如lna和dna(参见例如wo2007/112754,在此引入作为参考),或lna和2'-o-moe核苷酸,或lna、dna和2'o-moe核苷酸),或lna单一体(totalmer)(仅有lna核苷酸-参见例如wo2009/043353,在此引入作为参考)。
术语“修饰的核苷间键”定义为本领域技术人员通常所理解的除磷酸二酯(po)键以外的键,其将两个核苷共价偶联在一起。修饰的核苷间键特别适用于稳定体内应用的寡核苷酸,并且可用于保护免受核酸酶切割。由于核酸酶抗性、有益的药物动力学和易于生产,硫代磷酸酯核苷间键特别有用。在一些实施方案中,寡核苷酸或其连续核苷酸序列中的至少70%,例如至少80%或例如至少90%的核苷间键是硫代磷酸酯。在一些实施方案中,寡核苷酸或其连续核苷酸序列中的所有核苷间键是硫代磷酸酯,其中至少一个硫代磷酸酯核苷间键是立体专一的硫代磷酸酯核苷间键(源自寡核苷酸合成过程中本发明的酰基保护的l-xna-g单体掺入寡核苷酸中)。在wo2009/124238(在此引入作为参考)中公开了其他核苷间连接基。
术语核碱基包括存在于核苷和核苷酸中的嘌呤(例如腺嘌呤和鸟嘌呤)和嘧啶(例如尿嘧啶、胸腺嘧啶和胞嘧啶)部分,其在核酸杂交中形成氢键。在本发明的上下文中,术语核碱基还包括修饰的核碱基,其可以不同于天然存在的核碱基,但在核酸杂交期间是有功能的。在一些实施方案中,通过修饰或替换核碱基来修饰核碱基部分。在本文中,“核碱基”是指天然存在的核碱基,例如腺嘌呤、鸟嘌呤、胞嘧啶、胸苷、尿嘧啶、黄嘌呤和次黄嘌呤,以及非天然存在的变体。这些变体例如描述于hirao等人(2012)accountsofchemicalresearchvol45,2055页和bergstrom(2009)currentprotocolsinnucleicacidchemistrysuppl.371.4.1。
核苷酸是寡核苷酸和多核苷酸的构建单元,并且出于本发明的目的,核苷酸包括天然存在的和非天然存在的核苷酸。在自然界中,核苷酸,例如dna和rna核苷酸包含核糖部分、核碱基部分和一个或多个磷酸基团(其在核苷中不存在)。与等同的dna或rna核苷/核苷酸相比,修饰的核苷和核苷酸通过引入对核糖部分、核碱基部分的修饰,或在修饰的核苷酸的情况下,引入对核苷间键的修饰而被修饰。核苷和核苷酸也可互换地称为“单元”或“单体”。
如本文所用的术语“修饰的核苷”或“核苷修饰”是指与等同的dna或rna核苷相比,通过引入糖部分或(核)碱基部分的一个或多个修饰而修饰的核苷。术语“修饰的核苷”在本文中也可与术语“核苷类似物”或修饰的“单元”或修饰的“单体”互换使用。修饰的核苷的实例在单独的“低聚物修饰”部分及其子部分中描述。
酰基保护的环外氮
鸟嘌呤的环外氮基团如下所示(带圈的)。在本发明的化合物中,该基团被酰基保护。也可任选地保护氧基团。
l-xna-g单体
在一些实施方案中,本发明的化合物包含核苷部分(z),其不是dna或rna,这种单体被称为l-xna-g单体。l-xna-g(和l-lna-g)中的“l”是指式1、2和3中所示的立体中心r/r1(和r9位置的立体中心,如r6/r9位置)的立体化学。另一种立体异构体d-形式在r/r1和r9立体中心处具有相反的立体化学。除dna和rna之外的核苷可称为核苷类似物。核苷可以是高亲和力核苷(高亲和力核苷类似物)。此类单体包括但不限于lna单体(l-lna-g单体),以及2'取代的核苷,例如2'o-moe、2'-氟或2'-甲基。其他2'取代是本领域已知的,并且在本文r2的定义下列出了一些。
lnag单体
术语lna-g是指在呋喃环中包含2'-4'二价基团和鸟嘌呤核碱基的核苷。本发明提供了l-lna-g单体,其中非环氮基团用酰基保护基保护。任选地,g残基的氧原子也被保护。
1.锁核酸核苷(lna)
lna核苷是修饰的核苷,其包含核苷酸的核糖糖环的c2'和c4'之间的连接基团(称为二价基团或桥接)(即其中r2和r4一起表示二价桥接的实施方案)。
这些核苷在文献中也称为桥接核酸或双环核酸(bna)。
在一些实施方案中,本发明的单体为或包含lna核苷,例如,本发明的化合物可以是式i或ii的化合物:
z代表本发明化合物的酰基保护的鸟嘌呤核苷(z)-包括它用于说明目的。b表示酰基保护的鸟嘌呤核碱基;r、r1、r6、r3、r9、r5如本发明化合物所定义。
x表示选自下列的基团:-c(rarb)-、-c(ra)=c(rb)-、-c(ra)=n-、-o-、-si(ra)2-、-s-、-so2-、-n(ra)-和>c=z
在一些实施方案中,x选自:–o-、-s-、nh-、nrarb、-ch2-、crarb、-c(=ch2)-和-c(=crarb)-
在一些实施方案中,x是-o-
y表示选自下列的基团:-c(rarb)-、-c(ra)=c(rb)-、-c(ra)=n-、-o-、-si(ra)2-、-s-、-so2-、-n(ra)-和>c=z
在一些实施方案中,y选自:–ch2-、-c(rarb)-、–ch2ch2-、
-c(rarb)-c(rarb)-、–ch2ch2ch2-、-c(rarb)c(rarb)c(rarb)-、-c(ra)=c(rb)-和-c(ra)=n-
在一些实施方案中,y选自:-ch2-、-chra-、-chch3-、crarb-或者-x-y-一起表示二价连接基团(也称为基),一起表示由1、2或3个选自下列的基团/原子组成的二价连接基团:-c(rarb)-、-c(ra)=c(rb)-、-c(ra)=n-、-o-、-si(ra)2-、-s-、-so2-、-n(ra)-和>c=z,
在一些实施方案中,-x-y-表示选自下列的二价基团:-x-ch2-、-x-crarb-、-x-chra-、-x-c(hch3)-、-o-y-、-o-ch2-、-s-ch2-、-nh-ch2-、-o-chch3-、-ch2-o-ch2、-o-ch(ch3ch3)-、-o-ch2-ch2-、och2-ch2-ch2-、-o-ch2och2-、-o-nch2-、-c(=ch2)-ch2-、-nra-ch2-、n-o-ch2、-s-crarb-和-s-chra-。
在一些实施方案中,–x-y-表示–o-ch2-或–o-ch(ch3)-,并且ra和rb(当存在时)各自独立地选自氢、任选取代的c1-6-烷基、任选取代的c2-6-烯基、任选取代的c2-6-炔基、羟基、任选取代的c1-6-烷氧基、c2-6-烷氧基烷基、c2-6-烯基氧基、羧基、c1-6-烷氧基羰基、c1-6-烷基羰基、甲酰基、芳基、芳基氧基-羰基、芳基氧基、芳基羰基、杂芳基、杂芳基氧基-羰基、杂芳基氧基、杂芳基羰基、氨基、单-和二-(c1-6-烷基)氨基、氨基甲酰基、单-和二-(c1-6-烷基)-氨基-羰基、氨基-c1-6-烷基-氨基羰基、单-和二-(c1-6-烷基)氨基-c1-6-烷基-氨基羰基、c1-6-烷基-羰基氨基、脲基、c1-6-链烷酰氧基、sulphono、c1-6-烷基磺酰氧基、硝基、叠氮基、硫烷基、c1-6-烷硫基、卤素,其中芳基和杂芳基可被任选取代,并且其中两个偕取代基ra和rb合在一起可以表示任选取代的亚甲基(=ch2),其中对于所有手性中心,不对称基团可以为r或s取向。
r10可以是氢,或在一些实施方案中,可以选自任选取代的c1-6-烷基、任选取代的c2-6-烯基、任选取代的c2-6-炔基、羟基、c1-6-烷氧基、c2-6-烷氧基烷基、c2-6-烯基氧基、羧基、c1-6-烷氧基羰基、c1-6-烷基羰基、甲酰基、芳基、芳基氧基-羰基、芳基氧基、芳基羰基、杂芳基、杂芳基氧基-羰基、杂芳基氧基、杂芳基羰基、氨基、单-和二-(c1-6-烷基)氨基、氨基甲酰基、单-和二-(c1-6-烷基)-氨基-羰基、氨基-c1-6-烷基-氨基羰基、单-和二-(c1-6-烷基)氨基-c1-6-烷基-氨基羰基、c1-6-烷基-羰基氨基、脲基、c1-6-链烷酰氧基、sulphono、c1-6-烷基磺酰氧基、硝基、叠氮基、硫烷基、c1-6-烷硫基、卤素,其中芳基和杂芳基可被任选取代,并且其中两个偕取代基合在一起可以表示氧代、硫代、亚氨基或任选取代的亚甲基。
在一些实施方案中,r10选自c1-6烷基,例如甲基和氢。
在一些实施方案中,r10是氢。
在一些实施方案中,ra是氢或甲基。在一些实施方案中,当存在时,rb是氢或甲基。
在一些实施方案中,ra和rb之一或同时是氢。
在一些实施方案中,ra和rb之一是氢并且另一个不是氢。
在一些实施方案中,ra和rb之一是甲基并且另一个是氢。
在一些实施方案中,ra和rb均是甲基。
在一些实施方案中,二价基团–x-y-是–o-ch2-并且r10是氢。在一些实施方案中,二价基团–x-y-是–s-ch2-并且r10是氢。
在一些实施方案中,二价基团–x-y-是–nh-ch2-并且r10是氢。
在一些实施方案中,二价基团–x-y-是–o-ch2-ch2-或–o-ch2-ch2-ch2-并且r10是氢。
在一些实施方案中,二价基团–x-y-是–o-ch2-并且r10是c1-6烷基,例如甲基。
在一些实施方案中,二价基团–x-y-是–o-crarb-,其中ra和rb之一或同时不是氢,例如甲基,并且r10是c1-6烷基,例如甲基。
在一些实施方案中,二价基团–x-y-表示二价连接基团–o-ch(ch2och3)-(2’o-甲氧基乙基双环核酸-seth等人,2010,j.org.chem.,2010,75(5),pp1569–1581)。在一些实施方案中,二价基团–x-y-表示二价连接基团–o-ch(ch2ch3)-(2’o-乙基双环核酸-seth等人,2010,j.org.chem)。在一些实施方案中,二价基团–x-y-是–o-chra-并且r10是氢。
在一些实施方案中,二价基团–x-y-是–o-ch(ch2och3)-并且r10是氢。该lna核苷在本领域也被称为环moes(cmoe)并且公开于wo07090071。
在一些实施方案中,二价基团–x-y-表示r-或s-构型的二价连接基团–o-ch(ch3)-。在一些实施方案中,二价基团–x-y-合在一起表示二价连接基团–o-ch2-o-ch2-(seth等人,2010,j.org.chem)。在一些实施方案中,二价基团–x-y-是–o-ch(ch3)-并且r10是氢。该6’甲基lna核苷在本领域也被称为cet核苷,并且可以是(s)cet或(r)cet立体异构体,其公开于wo07090071(β-d)和wo2010/036698(α-l)。
在一些实施方案中,二价基团–x-y-是–o-crarb-,其中ra或rb均不是氢并且r10是氢。在一些实施方案中,ra和rb均是甲基。
在一些实施方案中,二价基团–x-y-是–s-chra-并且r10是氢。
在一些实施方案中,二价基团–x-y-是–c(=ch2)-c(rarb)-,例如–c(=ch2)-ch2-或–c(=ch2)-ch(ch3)-并且r10是氢。
在一些实施方案中,二价基团–x-y-是–n(-ora)-并且r10是氢。在一些实施方案中,ra是c1-6烷基例如甲基。在一些实施方案中,二价基团–x-y-合在一起表示二价连接基团–o-nra-ch3-(seth等人,2010,j.org.chem)。在一些实施方案中,二价基团–x-y-是–n(ra)-并且r10是氢。在一些实施方案中,ra是c1-6烷基例如甲基。
在一些实施方案中,r10是c1-6烷基例如甲基。在该实施方案中,二价基团–x-y-可以选自–o-ch2-或–o-c(hcra)-,例如–o-c(hch3)-。
在一些实施方案中,二价基团是–crarb-o-crarb-,例如ch2-o-ch2-并且r10是氢。在一些实施方案中,ra是c1-6烷基例如甲基。
在一些实施方案中,二价基团是–o-crarb-o-crarb-,例如o-ch2-o-ch2-并且r10是氢。在一些实施方案中,ra是c1-6烷基例如甲基。
可以理解,除非具体指明,否则lna核苷可以是β-d或α-l立体异构形式。
如实施例中所示,在本发明的一些实施方案中,lna核苷为或包含β-d-氧-lna核苷,例如,其中2’–4’桥接如式i所述并且其中x是氧,y是ch2并且r10是氢。
gapmer
如本文所用的术语gapmer是指反义寡核苷酸,其包含rnaseh募集寡核苷酸区域(缺口),其通过一个或多个亲和力增强修饰的核苷(侧翼)侧接5'和3'。本文描述了各种gapmer设计。头部(headmers)和尾部(tailmers)是其中一个侧翼缺失的能够募集rnaseh的寡核苷酸,即寡核苷酸的末端中仅有一个末端包含亲和力增强修饰的核苷。对于头部,缺失3'侧翼(即5'侧翼包含亲和力增强修饰的核苷),对于尾部,缺失5'侧翼(即3'侧翼包含亲和力增强修饰的核苷)。
lnagapmer
术语lnagapmer是其中至少一种亲和力增强修饰的核苷是lna核苷的gapmer寡核苷酸。
混合翼gapmer
术语混合翼gapmer是指其中侧翼区包含至少一种lna核苷和至少一种非lna修饰核苷、例如至少一种2'取代的修饰核苷,例如2'-o-烷基-rna、2'-o-甲基-rna、2'-烷氧基-rna、2'-o-甲氧基乙基-rna(moe)、2'-氨基-dna、2'-氟-dna、阿糖核酸(ana)、2'-氟-ana和2'-f-ana核苷的lnagapmer。在一些实施方案中,混合翼gapmer的一个侧翼包含lna核苷(例如5'或3'),另一个侧翼(相应的为3'或5')包含2'取代的修饰核苷。
长度
当提及本文提及的核苷酸分子的长度时,长度对应于单体单元即核苷酸的数目,无论这些单体单元是核苷酸还是核苷酸类似物。关于核苷酸,术语单体和单元在本文中可互换使用。
本发明的方法特别适用于纯化短寡核苷酸,例如,由7至30个核苷酸,例如7-10个核苷酸,例如7、8、9、10或10至20个核苷酸,例如12至18个核苷酸,例如12、13、14、15、16、17或18个核苷酸组成的寡核苷酸。
本发明的其他实施方案
1.式1的化合物
其中
z是鸟嘌呤核苷,其中鸟嘌呤核碱基基团在鸟嘌呤环外氮基团上包含酰基保护基,其中式i的环外氧与核苷z的3’碳共价连接;
r5和r6独立地选自氢、烷基、环烷基、芳基、杂芳基、取代的烷基、取代的环烷基、取代的芳基和取代的杂芳基,或r5和r6与式(i)的n原子一起形成包含3-16个碳原子的杂环;
r1选自氢和c1-3烷基;r9是氢;并且r选自芳基、杂芳基、取代的芳基、取代的杂芳基、硝基、卤素、氰基、甲硅烷基、取代的甲硅烷基、砜、取代的砜(芳基取代的砜)、芴和取代的芴。
2.根据实施方案1所述的化合物,其中r选自芳基、杂芳基、取代的芳基和取代的杂芳基。
3.根据实施方案1所述的化合物,其中r是芳基,例如苯基。
4.根据实施方案1-3任意一项所述的化合物,其中r1是氢。
5.根据实施方案1-3任意一项所述的化合物,其中r1是c1-3烷基,例如甲基。
6.根据实施方案1-5任意一项所述的化合物,其中r5和r6与式(i)的n原子一起形成包含3–16(例如4)个碳原子的杂环。
7.根据实施方案1-5任意一项所述的化合物,其中r5和r6与式(i)的n原子一起形成包含4个碳原子的杂环。
8.根据实施方案6或7所述的化合物,其中所述化合物为式2化合物
其中z、r和r1如实施方案1-7任意一项所述。
9.根据实施方案1-8任意一项所述的化合物,其中所述化合物是式3化合物
其中
r、r1、r5、r6和r9如实施方案1-8任意一项所述;
b是在鸟嘌呤环外氮基团上包含酰基保护基的鸟嘌呤核碱基基团;
r3选自ch2odmtr、ch2-烷基-o-dmtr、ch-me-o-dmtr、ch2ommtr、ch2-烷基-o-mmtr、ch(me)-o-mmtr、ch-ra-o-dmtrrb和ch-ra-o-mmtrrb;
r2选自卤素例如–f、氨基、叠氮基、-sh、-cn、-ocn、-cf3、-ocf3、-o(rm)-烷基、-s(rm)-烷基、–n(rm)-烷基、-o(rm)-烯基、-s(rm)-烯基、–n(rm)-烯基;-o(rm)-炔基、-s(rm)-炔基或-n(rm)-炔基;o-亚烷基-o-烷基、炔基、烷芳基、芳烷基、o-烷芳基、o-芳烷基、o(ch2)2sch3、o-(ch2)2-o-n(rm)(rn)或o-ch2c(=o)-n(rm)(rn)、-o-(ch2)2och3和-o-ch3,其中rm和rn各自独立地是h、氨基保护基或取代或未取代的c1-10烷基;
r4选自烷基、环烷基、杂环烷基、o-烷基、s-烷基、nh-烷基和氢;
或者r2和r4一起表示由1、2、3个选自-c(rarb)-、-c(ra)=c(rb)、-c(ra)=n、o、-si(ra)2-、s-、-so2-、-n(ra)-和>c=z的基团/原子组成的二价的桥接;
其中ra和rb(当存在时)各自独立地选自氢、任选取代的c1-6-烷基、任选取代的c2-6-烯基、任选取代的c2-6-炔基、羟基、任选取代的c1-6-烷氧基、c2-6-烷氧基烷基、c2-6-烯基氧基、羧基、c1-6-烷氧基羰基、c1-6-烷基羰基、甲酰基、芳基、芳基氧基-羰基、芳基氧基、芳基羰基、杂芳基、杂芳基氧基-羰基、杂芳基氧基、杂芳基羰基、氨基、单-和二-(c1-6-烷基)氨基、氨基甲酰基、单-和二-(c1-6-烷基)-氨基-羰基、氨基-c1-6-烷基-氨基羰基、单-和二-(c1-6-烷基)氨基-c1-6-烷基-氨基羰基、c1-6-烷基-羰基氨基、脲基、c1-6-链烷酰氧基、sulphono、c1-6-烷基磺酰氧基、硝基、叠氮基、硫烷基、c1-6-烷硫基、卤素,其中芳基和杂芳基可被任选取代,并且其中两个偕取代基ra和rb合在一起可以表示任选取代的亚甲基(=ch2),其中对于所有手性中心,不对称基团可以为r或s取向。
10.根据实施方案1-9任意一项所述的化合物,其中鸟嘌呤环外氮基团上的酰基保护基是-c(=o)-r7,其中r7选自任选取代的烷基-、烯基-、炔基-、环烷基-或芳基-基团,优选选自任选取代的c1-6-烷基-、c2-6-烯基-、c2-6-炔基-、c3-7-环烷基-或苯基-基团;其中当被取代时,取代基可以是单取代或多取代的,例如被一个或多个选自卤素、c1-6-烷基、c2-6-烯基、c2-6-炔基、c1-6-烷氧基、任选取代的芳基氧基或任选取代的芳基的取代基取代。
11.根据实施方案1-9任意一项所述的化合物,其中鸟嘌呤环外氮基团上的酰基保护基选自异丁酰基(ibu)、乙酰基(ac)、苯氧基乙酰基(pac)、对-异丙基苯氧基乙酰基(iprpac)、苯基乙酰基、异丙基氧基乙酰基、甲氧基乙酰基、苯甲酰基、对-甲氧基苯基乙酰基、二苯基乙酰基、环己基羰基、1,1-二甲基丙酰基和对-叔丁基-苯氧基乙酰基。
12.根据实施方案1-9任意一项所述的化合物,其中鸟嘌呤环外氮基团上的酰基保护基选自异丁酰基(ibu)、乙酰基(ac)、苯氧基乙酰基(pac)和对-异丙基苯氧基乙酰基(iprpac)。
13.根据实施方案1-9任意一项所述的化合物,其中鸟嘌呤环外氮基团上的酰基保护基是异丁酰基(ibu)。
14.根据实施方案9-13任意一项所述的式iii化合物,其中r2和r4一起表示二价的桥接,其选自桥接–c(rarb)-o-、–c(rarb)c(rarb)-o-、-ch2-o-、-ch2ch2-o-和-ch(ch3)-o-。
15.根据实施方案9-13任意一项所述的化合物,其中r2和r4表示二价的桥接-ch2-o-(亚甲基-氧基)或-ch(ch3)-o-(甲基-亚甲基-氧基)。
16.根据实施方案1-15任意一项所述的化合物,其中r3是ch2-o-dmtr或ch2-o-mmtr。
17.根据实施方案1-16任意一项所述的化合物,其中所述化合物是式16或17的化合物:
其中r、r1、r9、r3、r7和r8如实施方案1-16任意一项所述。
18.根据实施方案17所述的化合物,其中r是苯基并且r1是氢或甲基。
19.根据实施方案17所述的化合物,其中r是苯基并且r1是氢。
20.根据实施方案17所述的化合物,其中r是苯基并且r1是甲基。
21.根据实施方案17-20任意一项所述的化合物,其中的酰基保护基(-c(=o)-r7)是异丁酰基。
22.包含根据实施方案1-21任意一项所述的化合物和溶剂的溶液。
23.根据实施方案22所述的溶液,其中的溶剂是或包含极性非质子溶剂。
24.根据实施方案22或23所述的溶液,其中的溶剂选自乙腈、dmf、dmso、二氧六环、四氢呋喃、n-甲基-2-吡咯烷酮、二氯甲烷和二氯乙烷。
25.根据实施方案1-21任意一项所述的化合物或根据实施方案22-24任意一项所述的溶液在合成寡核苷酸中的用途。
26.合成实施方案1-21任意一项所述的化合物的方法,所述方法包括将包含3’–oh基团的鸟嘌呤核苷与式4化合物反应的步骤:
其中x是卤素,例如碘、氯或氯,并且其中r、r1、r5、r9和r6如前述实施方案任意一项所述,并且其中鸟嘌呤核苷上的鸟嘌呤核碱基基团在鸟嘌呤环外氮基团上包含酰基保护基,例如实施方案10-13任意一项所述的酰基保护基。
27.根据实施方案26所述的方法,其中式4中的x是氯。
28.根据实施方案26或27所述的方法,其中的式4化合物选自
29.根据实施方案26-28任意一项所述的方法,其中r、r1、r5、r6和r9如实施方案1-25任意一项所定义。
30.根据实施方案26-29任意一项所述的方法,其中的核苷具有下式
其中b、r2、r3、r4如实施方案9-25任意一项所定义。
31.根据实施方案26-30任意一项所述的方法,其中的反应步骤在碱和溶剂的存在下进行。
32.根据实施方案32所述的方法,其中的碱是有机碱,例如非亲核性有机叔碱,例如选自三甲胺、三乙胺和n-甲基吗啉的碱。
33.根据实施方案31或32所述的方法,其中的溶剂选自实施方案22-24任意一项所定义的溶剂。
34.根据实施方案26-33任意一项所述的方法,其中的溶剂是或包含四氢呋喃(thf)或甲苯,其中任选地,溶剂还可包含吡啶。
35.根据实施方案26-34任意一项所述的方法,其中的反应在低于0℃,例如低于-50℃的温度下进行。
实施例
实施例1–一般合成方法:
在-70℃下,在10分钟的时间内,向n-甲基吗啉在甲苯(50ml)中的溶液中加入pcl3(2.93ml33.4mmol)。此后,在30分钟内加入脯氨酸(p5-d或p5-l)辅助剂(6.24g,35.2mmol)的甲苯(50ml)溶液(p5-d和p5-l的合成参见j.am.chem.soc.,2008,130,16031–16037)。将所得混合物在室温下搅拌1.5小时,然后真空除去溶剂和挥发物(40℃,15毫巴)。然后,将剩余的残余物溶于thf(50ml)中,冷却至-70℃后首先加入net3(17.8ml,128mmol),然后在30分钟内加入5'-odmt-dna-核苷(16mmol)的thf(50ml)溶液。将反应混合物在-77℃下搅拌30分钟,然后在室温下搅拌2小时。此后,加入冷etoac(200ml)并将混合物用冷nahco3(150ml)、盐水(150ml)洗涤,干燥(na2so4),过滤并蒸发至干。通过快速柱色谱在氩气下纯化粗产物,洗脱液中包含7%net3以避免在硅胶上降解。
获得的产物为固体,可能含有少量残留溶剂,例如,etoac、thf和net3。
使用上述方法,合成了以下单体:
d-dnaa:31pnmr(160mhz,dmso-d6):δ150.3
l-dnaa:31pnmr(160mhz,dmso-d6):δ148.5
d-dnat:31pnmr(160mhz,dmso-d6):δ151.0
l-dnat:31pnmr(160mhz,dmso-d6):δ149.1
d-dnac:31pnmr(160mhz,dmso-d6):δ151.7
l-dnac:31pnmr(160mhz,dmso-d6):δ149.8
d-dnag-i-bu:31pnmr(160mhz,dmso-d6):δ151.7
l-dnag-dmf:31pnmr(160mhz,dmso-d6):δ150.3
实施例2
d-lna-g-dmf的合成
将5'-odmt-lna-g(3.51g,5.00mmol)与吡啶共蒸发,然后与甲苯共蒸发以除去任何残留的水或其它溶剂。然后将残余物溶于吡啶(10ml)和thf(10ml)中。在-77℃下将该溶液加入到d-噁唑磷烷(3.51g,5.00mmol)、pcl3(0.88ml,10.0mmol)和net3(3.50ml,25.0mmol)的溶液中。然后将所得反应混合物在-77℃下搅拌15分钟,然后在室温下搅拌1.5小时。此后,加入etoac(150ml)并将混合物用冷的nahco3(100ml)和盐水(100ml)洗涤,用na2so4干燥,过滤,最后与甲苯一起蒸发。
通过柱色谱(洗脱剂:thf的etoac溶液,从10%至30%+7%net3)纯化得到的残余物,得到d-lna-g-dmf(3.91g,估计产率84%)。
1hnmr(400mhz,dmso-d6):δ11.42(1h,s),8.56(1h,s),7.95(1h,s),7.49-7.16(14h,m),6.90-6.83(4h,m),5.96(1h,s),5.58(1h,d,j=6.7hz),3.87(1h,d,j=8.1hz),3.72(6h,s),3.62-3.54(1h,m),3.45(2h,s),3.40-3.33(1h,m),3.08(3h,s),2.99(3h,s),2.93-2.84(1h,m),1.53-1.39(2h,m),1.06-0.97(1h,m),0.79-0.63(1h,m)。
31pnmr(160mhz,dmso-d6):δ151.6
lrms(esi)m/z[m+h]+c46h49n7o8p的计算值:858.3。实测值:858.7。
实施例3
l-lna-g-dmf的合成
将5'-odmt-lna-g(4.91g,7.00mmol)与吡啶共蒸发,然后与甲苯共蒸发以除去任何残留的水或其它溶剂。然后将残余物溶于吡啶(10ml)和thf(15ml)中。在-77℃下将该溶液加入到l-噁唑磷烷(2.48g,14.0mmol)、pcl3(1.22ml,14.0mmol)和net3(4.90ml,35.0mmol)的溶液中。然后将所得反应混合物在-77℃下搅拌15分钟,然后在室温下搅拌1.5小时。此后,加入etoac(150ml)并将混合物用冷的nahco3(100ml)和盐水(100ml)洗涤,用na2so4干燥,过滤,最后与甲苯一起蒸发。
通过柱色谱(洗脱剂:thf在etoac/dcm1:1中的溶液,采用15%至25%+7%net3的梯度)纯化得到的残余物,得到d-lna-g-dmf(3.41g,估计产率84%)。如上所述通过柱色谱法纯化产物。
1hnmr(400mhz,dmso-d6):δ12.3-11.9(1h,brs),11.8-11.5(1h,brs),8.05(1h,s),7.45-7.40(2h,m),7.35-7.21(10h,m),7.02-6.97(2h,m),6.92-6.86(4h,m),5.94(1h,s),5.09(1h,d,j=6.5hz),4.88(1h,d,j=7.5hz),4.69(1h,s),3.89-3.81(2h.m),3.74(3h,s),3.73(3h,s),3.71-3.64(1h,m),3.48-3.38(3h,m),2.83-2.73(1h,m),2.71-2.64(1h,m),1.55-1.45(2h,m),1.14-1.05(1h,m),1.08(3h,d,j=6.9hz),1.05(3h,d,j=6.9hz),0.76-0.66(1h,m)。
31pnmr(160mhz,dmso-d6):δ148.7
lrms(esi)m/z[m+h]+c47h50n6o9p的计算值:873.3。实测值:873.7。
实施例4
d-dnag-dmf的合成
在-70℃下,在10分钟的时间内,向n-甲基吗啉的甲苯(50ml)溶液中加入pcl3(2.93ml,33.4mmol)。此后,在30分钟内加入p5-d(6.24g,35.2mmol)的甲苯(50ml)溶液。将得到的反应混合物在室温下搅拌1.5小时,然后真空除去溶剂和挥发物(40℃,15毫巴)。然后,将剩余的残余物溶于thf(50ml)中,冷却至-70℃后首先加入net3(17.8ml,128mmol),然后在30分钟内加入5'-odmt-dna-g(9.99g,16.0mmol)的thf(50ml)溶液。将反应混合物在-77℃下搅拌30分钟,然后在室温下搅拌2小时。此后,加入冷etoac(200ml)并将混合物用冷nahco3(150ml)、盐水(150ml)洗涤,干燥(na2so4),过滤并蒸发至干。通过快速柱色谱在氩气下纯化粗产物(洗脱剂:dcm/etoac=2/1+7%net3)。分离得到白色泡沫状d-dna-g-dmf(10.6g,72%),含有痕量的溶剂杂质(etoac、甲苯和net3)。
1hnmr(400mhz,dmso-d6):δ11.36(1h,s),8.52(1h,s),7.96(1h,s),7.40-7.16(14h,m),6.83-6.77(4h,m),6.27(1h,t,j=6.4hz),5.65(1h,d,j=6.5hz),5.08-5.01(1h,m),4.02-3.98(1h,m),3.91-3.83(1h,m),3.71(6h,s),3.45-3.35(1h,m),3.27-3.18(2h,m),3.07(3h,s),3.00(3h,s),2.97-2.88(2h,m),2.49-2.40(1h,m),1.58-1.48(1h,m),1.47-1.38(1h,m),1.16-1.09(1h,m),0.86-0.76(1h,m)。
31pnmr(160mhz,dmso-d6):δ151.7
lrms(esi)m/z[m-h]-c45h47n7o7p的计算值:828.3。实测值:828.6。
实施例5
l-dnag-dmf的合成
在-55℃下,在5分钟内向n-甲基吗啉的甲苯(25ml)溶液中加入pcl3(1.33ml,15.2mmol),然后在15分钟内下加入p5-l(2.84g,16.00mmol)的甲苯(25ml)溶液。将所得反应混合物在-55-45℃下搅拌10分钟,然后在室温下搅拌1.5小时。然后,真空除去溶剂和其它挥发物(40℃,6毫巴)。然后将剩余的残余物溶于thf(25ml)中并冷却至-77℃。此后,加入net3(8.92ml,64mmol),然后在15分钟内加入5'-odmt-dna-g-dmf(4.5g,7.2mmol)的thf(25ml)溶液。将反应混合物在-77℃下搅拌15分钟,然后在室温下搅拌3小时。此后,加入etoac(150ml)并将混合物用冷的nahco3(100ml)、盐水(50ml)萃取,干燥(na2so4),过滤并蒸发。
通过快速柱色谱在氩气下(洗脱剂:etoac/dcm=1/2+7%net3)分离产物,为白色泡沫(3.77g,63%),含痕量的etoac。
1hnmr(400mhz,dmso-d6):δ11.36(1h,s),8.51(1h,s),7.96(1h,s),7.39-7.11(14h,m),6.80-6.73(4h,m),6.28(1h,t,j=6.5hz),5.72(1h,d,j=6.5hz),5.06-4.96(1h,m),4.02-3.95(1h,m),3.84-3.76(1h,m),3.70(3h,s),3.69(3h,s),3.50-3.39(1h,m),3.27-3.18(2h,m),3.08(3h,s),3.02(3h,s),2.98-2.83(2h.m),2.48-2.39(1h,m),1.58-1.40(2h,m),1.12-1.02(1h,m),0.83-0.71(1h,m)。
31pnmr(160mhz,dmso-d6):δ150.3
lrms(esi)m/z[m+h]+c45h49n7o7p的计算值:830.3。实测值:830.6。
实施例6
l-lna-g-ibu单体的合成
合成5’-oap-lna-g-ibu衍生物的方法
步骤a:在-55℃下,在5分钟内向n-甲基吗啉(1.76ml,16.0mmol)的甲苯(15ml)溶液中加入pcl3(0.66ml,7.6mmol)。此后,在接下来的15分钟内加入(s)-苯基-(r)-吡咯烷-2-基)甲醇(p5-d)(1.42g,8.00mmol)的甲苯(12ml)溶液。然后,将反应混合物在-55至-45℃之间搅拌10分钟,然后在室温下搅拌1.5小时。在40℃和6毫巴下真空除去溶剂和其它挥发性化合物,然后加入thf(13ml)。
步骤b:然后将反应混合物冷却至-77℃,然后加入三乙胺(5.54ml,40mmol),接着在15分钟内加入5'-odmt-lna-g-ibu(2.67g,4mmol)的thf(13ml)溶液。将所得混合物在-77℃下搅拌15分钟,然后在室温下搅拌3小时。此后,加入etoac(75ml)并将混合物用冷的nahco3(50ml)和盐水(50ml)洗涤,用na2so4干燥,过滤并真空蒸发。通过快速柱色谱(etoac:己烷,1:4+7%net3)在氩气下纯化粗产物。得到白色泡沫状产物(1.95g,估计产率55%)。
在dmso中的31p-nmr148.8ppm+1%28.8ppm。
d-lnag-ibu和l-lnag-ibu合成的进一步优化
发现相对于前体(例如p5)略微过量的pcl3导致副产物的形成,其显著降低产物(例如oap-lna-gibu)的产率。因此,最好使用至少摩尔当量的前体和pcl3。在一些实施方案中,步骤1中前体与pcl3的摩尔比大于约1,例如在1.05以上。在一些实施方案中,步骤1中前体与pcl3的摩尔比不大于1.5。
发现在步骤2中使用超过2倍摩尔当量的中间体产生最高产率(参见表,条目3和5)。在一些实施方案中,中间体(例如5'-odmt-g/ibu)与前体和pcl3的摩尔比大于2。
产物的纯度由31p-nmr谱确定。
实施例6
产物稳定性和溶解度的测定
为了研究l-lnag-dmf和l-lnag-i-bu的稳定性和溶解度,遵循以下实验程序:
向1.5ml小瓶中加入0.013mmol亚磷酰胺,然后将固体物质溶于0.13ml溶剂中。此后,将小瓶加盖,涡旋,最后在室温下放置24小时。然后,目测检查溶解的物质的溶解度(图1)。如果溶液看起来混浊或不均匀,则溶解度设定为“否”。如果溶液看起来完全均匀,则将溶解度设定为“是”(24小时后重复检查)。
稳定性测定方法:为了完成分析,使用agilent1100系列hplc-ms研究亚磷酰胺的稳定性,采用如下具体参数:
柱:watersxterra,msc-18,5μm,2.1x100mm
温度:40℃
流速:0.3ml/min
检测:uv,254nm
运行时间:12min
洗脱剂:a:0.1%饱和nh4oh(aq)的h2o溶液b:20%a的ch3cn溶液
时间(min):%b洗脱剂:
0.00:80
0.50:80
3.00:100
7.00:100
8.00:80
12.00:80
在0小时和24小时鉴定母体化合物的质量和uv峰。此后,通过积分uv色谱图(254nm)并将面积对0小时记录的色谱图进行归一化处理,报告了与其它副产物相比的相对稳定性(图2)。
三种单体在合成后0小时和24小时的溶解度数据如图1所示。在各种溶剂中24小时后测得的稳定性数据如图2和图3a(l-lna-g-ibu)和3b(l-lna-g-dmf)所示。
单体l-lnag-dmf在大多数溶剂(mecn、mecn:dce、mecn:甲苯、mecn:丙酮、二氧六环和thf)中不溶。可溶解单体的溶剂(mecn:dcm、dmf、dmso、nmp、dcm、dce和甲苯)显示出极大的不稳定性。最好的溶剂为dcm,其24小时后剩余10%的亚磷酰胺。
单体l-lnag-i-bu可溶于所有研究的溶剂(12种不同的溶剂),最佳的溶剂为mecn、mecn:丙酮、dcm和dce。用于l-lnag-i-bu单体的所有研究的溶剂均显示出溶解度和稳定性的显著改善。
- 还没有人留言评论。精彩留言会获得点赞!