联合嵌合抗原受体、表达载体、慢病毒及T细胞的制作方法
本发明属于生物医学领域,涉及两种与cd19和cd22结合的配体,具体来说是与cd19和cd22有关的联合嵌合抗原受体、表达载体、慢病毒及t细胞。
背景技术:
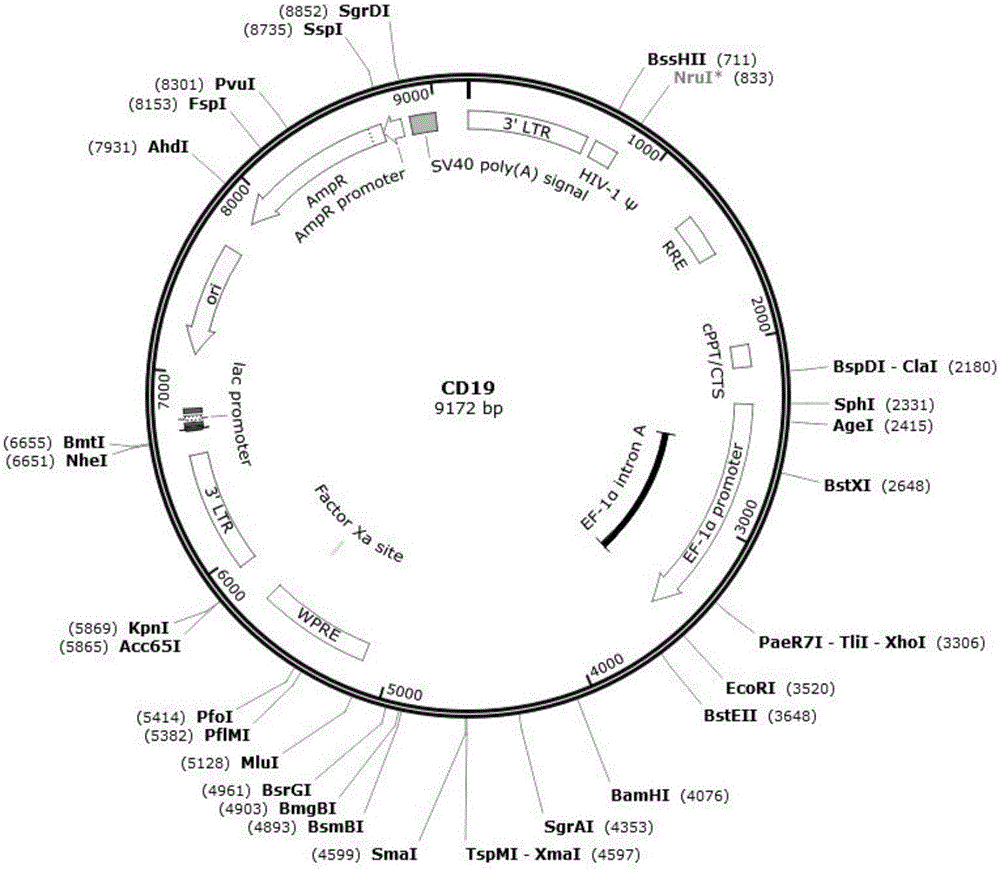
:肿瘤免疫治疗肿瘤免疫治疗的理论基础是免疫系统具有识别肿瘤相关抗原、调控机体攻击肿瘤细胞(高度特异性的细胞溶解)的能力。这个生物过程十分复杂,目前仍处于研究之中。上世纪90年代,多个科研小组已经发现了肿瘤抗原(tumorantigens),t淋巴细胞可以通过主要组织相容性复合体(majorhistocompatibilitycomplex,mhc)依赖性方式识别这些肿瘤抗原。肿瘤免疫治疗通常分为两类,非特异性免疫和特异性免疫。非特异性免疫治疗主要包括白细胞介素-2(interleμkin-2,il-2),干扰素α(interferonα,ifn-α),肿瘤坏死因子(tumornecrosisfactor,tnf-α),卡介苗等细胞因子和毒素,过继性细胞免疫治疗等。特异性免疫治疗主要是肿瘤疫苗。肿瘤非特异性免疫治疗非特异性免疫应答是与生俱来的,它的形成并不需要抗原刺激,能广泛地针对多种抗原,是免疫应答的基础,但特异性不强,对某种特定抗原物质往往不能产生足够强度的反应非特异性的免疫治疗。在进入临床试验的多种细胞因子中,白细胞介素-2和干扰素应用最为广泛[rosenbergsa,lotzemt,mμμllm,etal.aprogressreportonthetreatmentof157patientswithadvancedcancerμsinglymphokine-activatedkillercellsandinterleμkin-2orhigh-doseinterleμkin-2alone[j].nengljmed,1987,316(15):889-897]。肿瘤单克隆抗体的免疫治疗近20多年来单克隆抗体已在肿瘤治疗领域得到广泛应用。抗肿瘤单抗药物一般包括两类:一是抗肿瘤单抗,二是抗肿瘤单抗偶联物,或称免疫偶联物。免疫偶联物分子由单抗与“弹头”药物两部分组成,“弹头”主要包括放射性核素、药物和毒素,与单抗连接后分别构成放射免疫偶联物、化学免疫偶联物和免疫毒素。在1997年11月和1998年10月美国fda分别通过了用于临床肿瘤治疗的两个单抗—ritμximab(ritμxan)和trastμzμmab(herceptin)[dillmanro.magicbμlletsatlast!finally—approvalofamonoclonalantibodyforthetreatmentofcancer[j].cancerbiotherradiopharm,1997,12:223-225.]。目前认为单抗的作用机制有阻断作用、信号传导作用以及靶向作用等三种作用机制,没有直接的杀伤作用。另外还存在药理学方面的问题,主要是到达肿瘤的药量不足。由于偶联物是异体蛋白,会被网状内皮系统摄取,有相当数量将积聚于肝、脾和骨髓。偶联物是大分子物质,通过毛细血管内皮层及穿透肿瘤细胞外间隙均受到限制。肿瘤的过继免疫治疗肿瘤的过继免疫治疗是指将体外激活的自体或异体免疫效应细胞输注给患者,以杀伤患者体内的肿瘤细胞。肿瘤过继性免疫治疗中的一个关键问题是寻找合适的肿瘤杀伤细胞。自上世纪80年代以来,包括lak、细胞因诱导的杀伤细胞(cytokine-indμcedkillers,cik)、til等细胞已先后应用于临床,但由于存在着扩增倍速较低、细胞来源困难、细胞毒力不高等诸多问题,在临床应用上受到限制。如何提高t细胞的肿瘤抗原特异性具有重要的临床意义。t细胞对肿瘤抗原的识别主要是通过t细胞受体(tcellreceptor,tcr)识别肿瘤细胞表面的人类白细胞抗原(hμmanleμkocyteantigen,hla)-肽复合物,因此,t细胞对肿瘤抗原识别的特异性取决于t细胞表面的tcr。利用分子生物学的手段克隆肿瘤特异性t细胞的tcr,并通过构建含tcr的病毒载体,把tcr转入正常的t细胞中,使这些t细胞因携带肿瘤特异性而成为特异性肿瘤杀伤细胞[johnsonla,morganra,dμdleyme,etal.genetherapywithhμmanandmoμset-cellreceptorsmediatescancerregressionandtargetsnormaltissμesexpressingcognateantigen[j].blood,2009,114(3):535-546.]。肿瘤疫苗治疗肿瘤疫苗治疗是通过给患者体内导入肿瘤抗原来激发患者的特异性抗肿瘤免疫反应。由于疫苗治疗具有特异性、在体内免疫效应维持时间长等优点,目前已成为研究热点。近年来多肽疫苗、核酸疫苗、全蛋白疫苗、抗独特性抗体疫苗、重组病毒疫苗、细菌疫苗、基因修饰的肿瘤细胞疫苗、树突状细胞(dendriticcells,dc)疫苗等得到广泛研究和应用[robbinspf,morganra,feldmansa,etal.tμmorregressioninpatientswithmetastaticsynovialcellsarcomaandmelanomaμsinggeneticallyengineeredlymphocytesreactivewithny-eso-1[j].jclinoncol,2011,29(7):917-924.]。肿瘤疫苗治疗的大规模应用还有三个方面的问题亟待解决。首先,肿瘤相关抗原,每个肿瘤、每个亚型、每个肿瘤分期,这些相对抗原表达是不一样的,所以选准抗原,选准病人人群是致关重要的。第二,如何达到肿瘤抗原在树突状细胞中髙效吸收与表达?抗原被树突状细胞吸收是以表面受体为介导的。树突状细胞有十几个受体,如何根据特定的抗原选择相应的受体?第三,针对树突状细胞分化成熟的调控。树突状细胞的分化成熟是一个非常复杂的过程,它既可走向激活t细胞也可以走向抑制t细胞。[靶向dc细胞的治疗型肿瘤疫苗:亮点与挑战并存。http://www.biodiscover.com/news/research/115794.html]。肿瘤car-t治疗car-t,全称是chimericantigenreceptort-cellimmunotherapy,即嵌合抗原受体t细胞免疫疗法。通过将识别肿瘤相关抗原的抗体片段scfv和cd3胞内信号域itam在体外进行基因重组,生成重组质粒,再在体外转染到患者的t细胞,使患者t细胞表达能结合肿瘤抗原的受体。转染后经过纯化和大规模扩增后的t细胞,也即car-t细胞。car-t技术利用病毒载体将car稳定表达在t细胞中,经过活化扩增,进入体内后能选择性识别并杀死肿瘤细胞。完整的car结构包括:抗原结合区(scfv,单链抗体,识别肿瘤相关抗原的抗体片段);跨膜连接区(可选);胞内信号区(t细胞活化基序,cd3胞内信号域itam)。[eleanorj.cheadle,etal.cartcells:drivingtheroadfromthelaboratorytotheclinic.immunologicalreviews2014.vol.257:91–106]。第一代car介导的t细胞激活是通过cd3ζ链或fcerig上的酪氨酸激活基序完成的。cd3ζ链能够提供t细胞激活、裂解靶细胞、调节il-2分泌以及体内发挥抗肿瘤活性所需的信号。但第一代car改造t细胞的抗肿瘤活性在体内受到了限制,t细胞增殖减少最终导致t细胞的凋亡。第二代car在胞内增加了一个新的共刺激信号(跨膜共刺激信号),实验证明,这使得原有的使源自tcr/cd3复合体的“信号1”扩大,许多研究都表明,搭载了“信号2”的第二代car与第一代car相比,抗原特异性不变,t细胞增殖、细胞因子分泌增加,抗细胞凋亡蛋白分泌增加,细胞死亡延迟。常用的共刺激分子为cd28,但之后有研究将cd28用cd137(4-1bb)进行替换,除此之外,一种使用nk细胞受体cd244的思路也被提出来。虽然不同的第二代car究竟孰优孰劣,不同的研究者用不同的肿瘤在体内和体外的研究中得到的结果不尽相同。[深度完整版:car-t的现状和未来.生物谷.2015-051-15]。为了进一步改良car的设计,许多研究组开始着眼于发展第三代car,不仅包括“信号1”、“信号2”,还包括了额外的共刺激信号。不同研究者们用不同的靶点和共刺激信号开展的研究所得到的第二代car和第三代car的比较结果存在一定的差异性。一些研究报道表达第三代car的重组t细胞在抗肿瘤活性、存活周期及细胞因子释放方面均显著提高;wilkie等的研究结果显示靶向mμc1的第二代car与第三代car重组t细胞在抗肿瘤细胞毒性方面并无明显差异,虽然表达第三代car的t细胞能够分泌更大量的ifn-γ(wilkies,piccog,fosterj,etal.retargetingofhμmantcellstotμmorassociatedmμc1:theevolμtionofachimericantigenreceptor.jimmμnol2008;180:4901–4909.)。值得注意的是,上述区别仅仅是体外实验中获得的结论,目前尚未在体内比较第二代和第三代car的报道。这几代car之间的差异可能不止来自于信号传导域,胞外的抗原结合域(scfv)、重组t细胞的转染方法(慢病毒vs逆转录病毒)、重组t细胞的回输方式(静脉回输vs腹膜vs瘤体)等均可能影响car-t细胞的最终抗肿瘤效果。car-t发展到现在已经开发出了第四代技术,包括整合表达免疫因子、整合共刺激因子配体等,甚至可以加入小分子开关等更加精准调控的方式,来用于各种肿瘤的治疗,并在临床试验中取得了显著的疗效。cd19-cart的免疫治疗cart细胞技术目前在临床上应用最成功的是用于治疗血液恶性肿瘤,这可能与其肿瘤相关抗原特异性较强、肿瘤微环境的免疫抑制作用较弱等因素相关。cd19特异性表达于b细胞,在b细胞发育分化的所有阶段和大多数b细胞肿瘤都有表达,而在造血干细胞及其他细胞中无表达,是治疗b细胞肿瘤很有潜力的靶点,也是目前car研究中的热点。国内外正在开展的应用抗cd19car-t细胞治疗血液系统肿瘤的临床试验有20余项,包括慢性淋巴细胞白血病(cll)、非霍奇金淋巴瘤(nhl)、急性b淋巴细胞白血病(all)等。疗效总结:随着cart治疗方案的不断进步,目前cart-19治疗all的几个大型临床试验中报道的有效率已达到较高水平。2014年10月份,up团队报道了30例复发难治性all的cart-19治疗结果,有30例儿童和成人接受了cart-19回输治疗,其中27例(90%)获得了完全缓解(cr),有8例(27%)发生了严重的crs不良反应,给予妥珠单抗治疗后不良反应得到有效控制,不良反应的发生与较重的肿瘤负荷呈正相关,病例中可观测到至少24个月以上的持续缓解。2015年12月,诺华公布了一项cart-19治疗复发/难治性all的ⅱ期临床研究结果,共有59例儿童及年轻成人患者接受cart-19治疗后,cr率达到93%。这是目前已经报道的有关cart-19治疗all的最大临床研究,随访数据显示,12个月时总生存率为79%,6个月时的无复发生存率为76%,其中18例患者在治疗后12个月表现出持续cr反应。27%的患者由于严重crs反应而接受妥珠单抗治疗,治疗后不良反应得到有效控制。据统计,cart-19对all治疗的平均客观反应率为93%左右。cart-19治疗cll的临床研究数量较all少,其有效率也较all低。2013年,mdanderson团队报道了cart-19治疗异基因移植后复发且难治的4例cll患者,1例获得8周部分缓解(pr),1例达15个月以上的疾病稳定(sd),2例pd,此治疗有效率较低可能与未实施有效化疗预处理有关。2015年1月,nci团队报道了cart-19治疗复发/难治性cll的4例患者,在联合氟达拉滨/环磷酰胺预处理方案后,有3例获得cr,1例获得pr,其中1例cr患者表现出至少23个月以上的持续缓解。2015年9月,up团队报道了cart-19治疗复发/难治性cll的ⅰ期临床结果,共有14例患者联合不同预处理方案后接受了0.14×10^8~11×10^8总量的cart-19细胞,总体客观反应率为57%(n=8),其中4例cr,4例pr;体内cart的扩增与临床反应呈正相关,接受治疗4年后,4例cr患者均未出现复发,cart细胞在2例cr患者中仍表现出抗肿瘤活性。据统计,cart-19对cll治疗的平均客观反应率在36%左右。cart-19对于b细胞淋巴瘤也具有较高的临床反应率。2010年mdanderson团队首次利用cart-19治疗了6例非霍奇金淋巴瘤(nhl)患者,在未接受化疗预处理情况下2例获得sd反应,4例获得pr。2012、2013和2015年,nci的rosenberg团队报道了共计19例cart-19治疗b细胞淋巴瘤的案例。2013年报道的文章中患者未接受化疗预处理,2例弥漫大b细胞淋巴瘤(dlbcl)患者中1例pd、1例sd,4例套细胞淋巴瘤(mcl)中有1例pr、3例sd。2011年和2015年的报道中,所有患者在接受cart治疗前均接受化疗预处理,2例脾边缘带淋巴瘤均获得pr,且1例持续反应至少23个月以上;3例可评价的fl均为pr;3例原发纵膈大b淋巴瘤中有2例cr,1例sd;4例dlbcl患者中2例获得cr,2例获得pr;1例低度恶性淋巴瘤获得cr。据统计,cart-19对b细胞淋巴瘤治疗的平均客观反应率为62%左右。存在问题:cd19为靶点的cart疗法效果显著、研究广泛,已成为多数临床研究机构开展基因修饰t细胞治疗研究的模式疗法。然而,cart细胞免疫治疗仍存在很多问题,如复发问题和安全性问题。随着car-t细胞在血液中的衰亡、car丢失或靶抗原突变等原因,许多患者在肿瘤清除后一段时间后出现复发。安全性问题,尤其是crs问题,也是car-t临床应用中不得不面对的一个重要问题。对于b细胞肿瘤的治疗,cd19是一个理想靶点,但cart-19无法满足cd19靶点丢失复发患者和浆细胞肿瘤的患者。技术实现要素:为了解决现有技术中的上述问题,本发明将cd19和cd22联合,基于嵌合抗原受体t细胞免疫技术,提供了以下技术方案:一种联合嵌合抗原受体,包括嵌合蛋白car19和嵌合蛋白car22,所述car19是由至少包括特异性识别cd19的单链抗体和t细胞活化基序两种蛋白的片段偶联而成;所述car22是由至少包括特异性识别cd22的单链抗体和t细胞活化基序两种蛋白的片段偶联而成。cd22在b-all细胞上有高表达,本发明的联合嵌合抗原受体同时靶向cd19和cd22可有效防止靶点丢失型的复发。优选地,上述联合嵌合抗原受体中,所述t细胞活化基序为cd3ζ。优选地,上述联合嵌合抗原受体中,所述car19的结构为:特异性识别cd19的单链抗体、第一跨膜共刺激信号和t细胞活化基序依次偶联而成;所述第一跨膜共刺激信号为cd28,4-1bb,ox40中的一个或几个的组合。优选地,上述联合嵌合抗原受体中,其特征在于,所述car22的结构为:特异性识别cd22的单链抗体、第二跨膜共刺激信号和t细胞活化基序依次偶联而成;所述第二跨膜共刺激信号为cd28,4-1bb,ox40中的一个或几个的组合。本发明还提供了以上任一所述的联合嵌合抗原受体的编码基因,包括car19的编码基因和car22的编码基因。本发明还提供了一种联合表达载体,其包括表达所述car19基因的第一载体和表达所述car22基因的第二载体,或同时表达权利要求1所述car19基因和car22基因的第三载体。优选地,上述联合表达载体中,所述出发载体为重组慢病毒载体plvx-ef1α-ires-puro。本发明还提供了一种联合重组慢病毒,其由上述的联合表达载体同时或分别与慢病毒辅助包装质粒共转染宿主细胞后得到的包装体组合。优选地,上述重组慢病毒中,所述慢病毒辅助包装质粒为gag质粒和vsvg质粒,所述宿主细胞为293t细胞。本发明还提供了转染有上述联合重组慢病毒的t细胞。本发明还提供了一种肿瘤治疗制剂,其含有以上所述的t细胞。所述肿瘤包括但不限于b细胞急性白血病和/或b细胞淋巴瘤。与现有技术相比,本发明具有以下有益效果:本发明提供的联合嵌合抗原受体、联合表达载体,联合慢病毒、联合t细胞,以及肿瘤治疗制剂,均是基于cart技术原理,联合car19t和car22t序贯回输,来有效降低之前car19t高复发的情况,以及防止car19t的重度crs。在以下方面更体现其突出的优越性:1、增加了难治复发b细胞急性白血病和b细胞淋巴瘤的完全缓解率。2、增加了难治复发b细胞急性白血病和b细胞淋巴瘤的长期生存率。3、降低了cart治疗过程中由于细胞因子风暴造成严重副反应的发生率。附图说明图1是重组慢病毒载体pcar19的结构示意图;图2是图1中car19部分结构示意图;图3是图1中包含car19序列的pcar19部分测序对比图,图中下端黑色线条表示标准序列,灰色线条表示测序序列比对结果;图4是重组慢病毒载体pcar22的结构示意图;图5是图4中car22部分结构示意图;图6是4中包含car222的pcar22部分序列测序对比图,图中下端黑色线条表示标准序列,灰色线条表示测序序列比对结果;图7是质粒pcar19的浓度检测结果;图8是质粒pcar22的浓度检测结果;图9是质粒pcar19和质粒pcar22的酶切检测结果;图10是car19t细胞和car22t转导后转导效率检测结果,上面3幅图为car22t,下面为car19t;图11是car19t细胞和car22t细胞杀瘤检测结果;图12是car19t和car22t对肿瘤在小鼠中生长的影响的实验结果,其中右侧色柱从上到下依次为红、黄、绿、青、蓝,对应的小鼠体内显色区域由内到外圈层的颜色也为红、黄、绿、青、蓝,其中cd22和cd19仅显示蓝色。图13是cd19-scfv序列片段结构图;图14是cd22-scfv序列片段结构图。具体实施方式下面结合具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好的理解本发明并能予以实施,但所举实施例不作为对本发明的限定。生物和试剂材料来源:plvx-ef1α-ires-puro:购自clontech。dh5alpha感受态细胞:购自takara。endofreeplasmidmegakit:购自qiagen,包括qiafiltercartridge、buffersp1、buffersp2、buffersp3、bufferfw、bufferer、buffersqbt、bufferqc、bufferqn、endotoxin-freewater、bufferte。gag质粒和vsvg质粒:购自addgene:293t细胞:购自takara。实施实例1、重组慢病毒载体pcar19、pcar22的构建按序列1(car19,参见图13,标记为car19,seqidno.1)和序列2(car22,参见图14,标记为car22,seqidno.2),由南京金斯瑞生物科技公司进行基因合成,合成的序列克隆到t载体上。1、car19序列片段长度1596bp,两端分别设计ecori和mlui酶切位点,克隆到慢病毒骨架质粒plvx-ef1α-ires-puro的多克隆位点完成载体的构建。构建完整图谱参见图1。其中car19部分结构为图2所示,cd19是以cd28和4-1bb为共刺激信号的三代car。car19序列测序对比图如图3所示:图中下端黑色线条表示标准序列,灰色线条表示测序序列比对结果,结果显示序列匹配完全一致。2、car22序列片段长度1443bp,两端分别设计ecori和mlui切位点,克隆到慢病毒骨架质粒plvx-ef1α-ires-puro的多克隆位点完成载体的构建。构建完整图谱如图4所示。其中car22部分结构为图5所示,cd22是以cd28为共刺激信号的二代car。car22序列测序对比图如图6所示:图中下端黑色线条表示标准序列,灰色线条表示测序序列比对结果,结果显示序列匹配完全一致。将慢病毒骨架质粒plvx-ef1α-ires-puro与合成序列使用ecori-hf和mlui限制性内切酶进行双酶切,产物经过1.5%的琼脂糖凝胶电泳,并割胶回收置于eppendorf管内,用qiagen公司的琼脂糖凝胶回收试剂盒回收相应的片段,并测定产物的纯度和浓度。将片段以1:1摩尔比加入eppendorf管加入t4dna连接酶(neb)与t4dna连接酶buffer,22℃反应2小时;将连接液取出8μl加入100μldh5alpha感受态细胞冰浴30min后42℃热激90s,完成后加入500μlsoc培养基37℃、220rpm培养2小时;2小时后将eppendorf管4000g离心1min移除400μl多余液体。将剩余液体涂布在lb平板37℃培养12小时;在平板上挑取单菌落,接种到5mllb液体培养基中37℃、220rpm培养12小时。用qiagen小提试剂盒提取质粒,获得pcar19和pcar22质粒;送南京金斯瑞生物科技公司一代测序验证无误后,进行含pcar19或pcar22质粒的dh5alpha菌株保种。实施实例2、pcar19、pcar22的质粒制备将pcar19或pcar22质粒的dh5alpha菌种接种至250ml含100μg/ml氨苄霉素的lb培养液中,37℃、220rpm培养过夜。培养液在4℃于6000g离心20min,弃上清。取出endofreeplasmidmegakit(qiagen)中的buffersp1,向离心得到的大肠杆菌沉淀中加120ml提前预冷的buffersp1,盖上离心瓶盖,剧烈振荡离心瓶使大肠杆菌沉淀在buffersp1中完全分散。向离心瓶中加120mlbuffersp2,盖上瓶盖放置在滚轴混匀仪上,慢慢提速至50rpm,彻底混匀后室温放置5min。向离心瓶中加120mlbuffersp3,盖上瓶盖放置在滚轴混匀仪上,慢慢提速至滚轴混匀仪最大转速70rpm,彻底混匀直至呈白色不粘稠蓬松的混合液。在4℃于9000g离心15min。向qiafiltercartridge倒入50mlbufferfw,将离心所得上清液倒入qiafiltercartridge中,轻轻地搅拌混匀。将混合液抽滤入已标记好对应的玻璃瓶中。向每个玻璃瓶中加入20mlbufferer,上下颠倒混匀6次,在-20℃孵育30min。将标记好的mega柱放入对应的架子上,向每个mega柱内加入35mlbuffersqbt平衡,重力作用使之流尽。将玻璃瓶中的液体分批全部倒入对应标记的mega柱中,待柱中液体流尽后,向每个mega柱分批加入200mlbufferqc进行清洗。待柱中液体流尽后,将废液收集盘中的废液倒入50ml洁净离心管内。再向每个mega柱内加入40mlbufferqn,使用50ml洁净离心管收集流出液,上下颠倒6次混匀,分装20ml至另一洁净已标记的50ml离心管内。向每个50ml离心管加入14ml异丙醇(常温),上下颠倒6次混匀。在4℃于15000g离心50min。超净工作台内吸尽上清,每管加入3.5mlendotoxin-freewater漂洗,不要将底部沉淀冲散。在4℃于15000g离心30min。将endofreeplasmidmegakit中的bufferte放入烘箱内预热。在超净工作台内吸尽离心后的上清,于超净工作台内吹干(挥发残留的无水乙醇,时间在10min左右)。在烘箱内拿出bufferte,在超净工作台内向每管加入1mlbufferte,用枪吹打10次后放入65℃烘箱,期间不间断地敲击管壁促使沉淀完全溶解。在4℃于4000g离心1min将管壁上的液体甩到管底后吹打混匀。在超净工作台内将液体全部转移至无内毒素无热源无核酸酶对应标记的ep管中。吸出2μl,用微量分光光度计测质粒浓度,并标记在对应的ep管上,获得pcar19或pcar22质粒。质粒检查:1.质粒浓度检查收到样本,取1μl进行浓度测定,使用超微量紫外分光光度计(nanodrop),进入核酸测量模块,设置参数,空白校正后上样进行检测,结果见图7、图8和下表:2.质粒dna(酶切)检查原理:琼脂糖凝胶电泳是用于分离、鉴定和提纯dna片段的标准方法。琼脂糖是从琼脂中提取的一种多糖,具亲水性,但不带电荷,是一种很好的电泳支持物。dna在碱性条件下(ph8.0的缓冲液)带负电荷,在电场中通过凝胶介质向正极移动,不同dna分子片段由于分子和构型不同,在电场中的泳动速率液不同。溴化乙锭(eb)可嵌入dna分子碱基对间形成荧光络合物,经紫外线照射后,可分出不同的区带,达到分离、鉴定分子量,筛选重组子的目的。通过酶切鉴定结果可以初步判断原液中超螺旋质粒含量,超螺旋含量越高,质粒的纯度越好,对后面病毒包装效率越好。方法:分别取200ng样本,用ecori,kpni,mlui三酶切,ecori单酶切,采用0.7%琼脂糖凝胶电泳检测。胶孔上方标注为样品编号,m1:10000kbdnamarker(10000、8000、6000、5000、4000、3500、3000、2000、1500、1200、1000、900、800、700、600、500、400、300、200、100),m2:dl5000dnamarker(5000、3000、2000、1000、750、500、250、100)。样品琼脂糖凝胶电泳图(样品上样约100ng),结果见图9。3.目的基因测序取20μl(500ng)质粒dna,外送测序,根据原始种子序列,检查质粒生产所得产品的目的基因有无发生改变,稳定的工艺下,工作种子在进行发酵培养放大过程中,目的基因不会发生改变,可用于下一环节的生产和正确表达蛋白。实施实例3、重组慢病毒lvcar19、lvcar22的制备在多层细胞培养瓶(hyperflask)(corning)接入130.0~140.0×106数目的293t细胞(takara),共560mldmem完全培养基(50ml胎牛血清、5mlantibiotic-antimycotic(100×)),在37℃含5%co2培养箱中培养24小时。将混有320μg质粒(pcar19或pcar22:gag质粒:vsvg质粒=6:3:2)的dmem完全培养基加入960μgpei管中,漩涡震荡,室温平衡10min。将35mlpei与质粒的混合液与525mldmem完全培养基混匀,换入上述多层细胞培养瓶中。将多层细胞培养瓶置于37℃含5%co2培养箱培养3天后,收集细胞培养上清液。上清液4000rpm(或3000g)离心30min后,向离心后上清中加入cryonase酶(takara)置于4℃。6个小时后,使用0.22μm的滤膜对慢病毒上清液进行抽滤,4℃于30000g离心2.5h。去除上清,加入1mlt细胞培养基重悬沉淀。重悬后,留20μl做滴度活性检测,剩余慢病毒浓缩液分装,标记为lvcar19或lvcar22并置于-80℃保存备用。慢病毒活性滴度检测:原理:protein-l上标记有荧光素,而protein-l能与car中单链抗体轻链的kappa区特异性结合,通过流式细胞仪检测到的荧光信号间接反应了car在293t细胞中的表达情况。方法:在6孔板中接入5.0×105个/孔293t细胞,慢病毒浓缩液每孔分别加入0.1μl、0.5μl、1μl,并设1个阴性对照。置于37℃含5%co2培养箱内培养。三日后,用versene溶液(gibco)收集293t细胞送流式细胞学检测car阳性293t细胞比例,并换算得到lvcar19或lvcar22慢病毒浓缩液活性滴度。目前的慢病毒原液活性滴度在1~10e+05范围,浓缩液活性滴度在1~10e+08范围内,检测分析结果如下:cd22:cd19:实施实例4、car19t和car22t的制备采集健康供者外周血100ml,采用ficoll淋巴细胞分离液分离单个核细胞。计数后,使用适量cd3microbeads,human(美天旎)分选cd3阳性细胞,并以1.0~2.0×106个/ml密度在t细胞完全培养液(optmizertmctstmt-cellexpansionbasalmedium,optmizertmctst-cellexpansionsupplement(invitrogen),500单位的il-2(双鹭药业))中培养,同时按25μl/106个细胞加入dynabeadshumant-activatorcd3/cd28(invitrogen)活化t细胞。24小时后,按moi为3加入lvcar19或lvcar22病毒进行转导,混匀后置于co2培养箱孵育,4小时后补加适量的t细胞完全培养基进行培养。慢病毒转导24小时后将转导后car19t细胞或car22t细胞换入新鲜t细胞完全培养液,并调整活细胞密度为1.0×106/ml,继续培养扩增10~20天,每天进行观察和计数,并根据计得的细胞数量进行补液扩大培养,始终保持细胞培养密度为1.0×106/ml。car-t细胞制剂制备:根据预计细胞用量收集car19t细胞或car22t细胞,重悬于含2%人血白蛋白的100ml生理盐水中,转入细胞回输袋中,热封后制成car19t细胞或car22t细胞制剂成品。car19t,car22t转导效率检测取1.0×106个转导后t细胞,与1ug/mlfitc-protein-l室温孵育30分钟,生理盐水清洗两次后,通过流式细胞仪检测fitc荧光信号,测量fitc阳性细胞比率,反映了cart细胞在总细胞中的比率。检测结果如图10和下表所示。说明成功制备了car19t和car22t细胞。编号转导类型转导效率2017112007car19t51.0%2017112008car22t38.6%实施实例5、car19t和car22t的体外功能检测采用calcein-am对car19t和car22t进行体外杀瘤功能检测。取适量k562靶细胞,在1×106/ml的细胞悬液(pbs,5%胎牛血清)加入calcein-am至终浓度25μm,培养箱中孵育30min。常温,洗两遍后重悬至1.5×105/ml。按不同效靶比加入car19t或car22t细胞,200g离心30秒,37℃孵育2~3小时。孵育完成后取上清,测量其中calcein的荧光强度,并根据自发释放对照和最大释放对照,计算靶细胞裂解百分数。1.杀瘤实验数据对不同批次病毒在回输前需进行细胞系杀瘤等功能性检测,使用钙黄绿素检测法。结果参见图11及下表:阳性靶细胞阴性靶细胞实施实例6、cart19t和car22t在小鼠荷瘤模型中序贯回输为了检测car-t细胞在体内的抗肿瘤效应,我们选择免疫缺陷(nod-scid)小鼠与raji-luc细胞建立肿瘤模型,建模成功后注射car-t细胞,并使用ivis小动物活体成像系统(xenogen,hopkinton,usa)检测实验结果。实验步骤如下:1.建模,给5周龄的nod-scid小鼠皮下注射5×106个raji-luc细胞/只。2.7天后动物成像,以150mg/kg的剂量腹腔注射d-luciferin(molecularimagingproducts,bend,usa),75mg/kg腹腔注射戊巴比妥钠麻醉小鼠,等10分钟后使用ivis小动物活体成像系统(xenogen,hopkinton,usa)收集光信号。3.建模成功后当天注射car-t细胞,分组如下:(1)cd19组,注射car19t细胞5×106个/只;(2)cd22组,注射car22t细胞5×106个/只;(3)cd19+cd22组,先注射car19t细胞5×106个/只,3天后注射car22t细胞5×106个/只。4.注射car-t细胞21天后成像,分析实验结果,参见图12,其中nt:普通t细胞注射组;cd22:car22t注射组;gfp:gfp慢病毒转染t细胞注射组;cd19+cd22:car19t和car22t注射组;cd19:car19t注射组;。结果显示,与普通t细胞注射组和gfp-t注射组相比,car19t和car22t注射组肿瘤负荷均有明显减少,car19t和car22t组肿瘤完全消失。说明双靶点cart序贯回输疗效优于单一靶点回输和不回输组。实施实例7、car19t和car22t的临床应用采用序贯输注抗cd19car-t和抗cd22car-t对59个患有复发/难治/高危急性b淋巴细胞肿瘤进行治疗,其中包括42例b-all患者和17例侵袭性b细胞淋巴瘤患者。入组患者临床背景:关于b-all白血病患者:中位年龄为28岁,男女比例约为3:2。近半数患者复发超过2次或患有原发性难治性疾病。在参加这项试验之前,有7名患者接受了移植,6名接受了car19治疗,但都复发了。来自骨髓的失控的早期b细胞从0到92%不等。6例患者脑脊液中发现失控的早期b细胞。大多数患者发生高危基因畸变,包括bcr/abl易位,t315i突变,17p缺失或tp53突变。也检测到mll重排,主要是mll/af4和亚二倍体。关于侵袭性b细胞淋巴瘤患者:淋巴瘤患者中位年龄为38岁,男女之比约为1:1。所有病理亚型均为高度恶性b细胞淋巴瘤,其中1例为双重淋巴瘤。近65%的患者复发超过两次或有原发性难治性疾病。三名患者曾接受过移植手术,但复发。近半数患者携带myc易位,17p缺失或tp53突变。car-t细胞治疗有效性:对于白血病患者,在回输cart细胞前,40个病人接受了氟达拉滨和环磷酰胺预处理。car19t和car22t的平均剂量分别为2.44±1.11×106/kg和2.19±1.22×106/kg。38/42(90.5%)个病人获得完全缓解(cr或cri),比诺华上市的cd19cart药物kymriah的完全缓解率83%略有提高。33/42(78.6%)个病人获得分子学缓解,通过流式细胞仪检测出mrd阴性。6个月的总体存活率和无事件存活率分别为80.0%和60.8%。12个月时,总体存活率和无事件存活率分别接近60%和40%。随访期间,虽然到目前为止在混合car-t细胞治疗后复发病例中未检测到cd19和cd22的抗原逃逸,但23名患者最终还是复发。对于侵袭性淋巴瘤患者,超过一半的患者达到cr。整体反应率超过80%,高于凯特上市的cd19cart药物yescarta的72%。在6个月时,os和efs分别约为90%和60%。高于yescarta的79%和55%。car-t细胞治疗安全性:对于白血病患者,大多数(88%)患者有crs,但只有20%有严重crs(≥3级)。比诺华上市的cd19cart药物kymriah75%(47/63)的严重crs反应率明显降低。所有侵袭性淋巴瘤患者经历crs,仅10%有严重crs但可逆,比yescarta的13%略有降低,但只有17.6%发生神经毒性,明显低于yescarta的87%。以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本
技术领域:
的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1