一种将二芳基醚转化成N-环己基苯胺类化合物的方法与流程
本发明属于有机合成领域,具体涉及一种将二芳基醚转化成n-环己基苯胺类化合物的方法。
背景技术
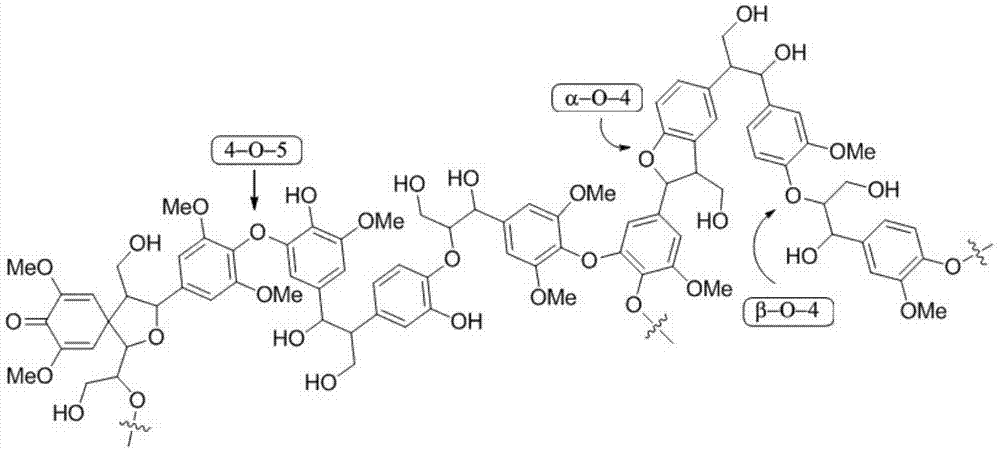
木材是自然界分布最广泛的一种可再生资源。木质素主要存在于木材纤维素纤维之间,在木本植物中木质素含量高达25%,是世界上第二位最丰富的有机物(纤维素是第一位),是一种非常重要的可再生资源。木质素结构片段如附图1所示。它是由氧代苯丙醇结构单元通过醚键和碳碳键相互连接形成的具有三维网状结构的生物高分子。最主要的链连接是β-o-4,α-o-4,4-o-5三种醚键(如附图1所示)以及部分碳碳键,裂解这些芳基醚键可以使其转化成为高价值的精细化学品,因此如何有效地断裂这三种醚键成为木质素降解的关键点,对将高分子聚合物木质素转化成高附加值的小分子有机化合物及其生物精炼具有重要意义。
此外,聚苯醚(polyphenyleneoxide,缩写:ppo)是世界五大通用工程塑料之一,其结构中主要含有二芳基醚骨架。使用完后废弃的聚苯醚塑料由于其中含有大量的二芳基醚键,使得聚苯醚塑料难以降解,长期积累形成污染环境的“白色污染”。因此如何有效地断裂这种醚键成为聚苯醚塑料降解的关键点,对将聚苯醚塑料的降解和再生利用转化成高附加值的小分子有机化合物及其生物精炼具有重要意义。
目前对于木质素降解研究主要以二苯醚、苯基苄基醚和苯基苯乙基醚分别作为4-o-5,α-o-4,β-o-4三种醚键的相应模型底物(如附图2所示)。三种模型底物对应的碳氧键键能相差较大,苯基苄基醚碳氧键的键能为218kj·mol-1,苯基苯乙基醚碳氧键的键能为289kj·mol-1,二苯醚碳氧键的键能为314kj·mol-1。从键能数据可以看出三种碳氧键中的断裂难度最大的是二苯醚。由于二苯基醚键能较高,通常car-o键的氢解需要在高温(>250℃)和较大的氢气压力(>30bar)的非均相催化剂上进行。这些条件导致氢解氢化的化学选择性差,浪费氢气,导致芳烃产物的产率低。直到2011年,hartwig课题组才在二苯基醚碳氧键断裂方面取得突破,将二苯基醚降解成为苯酚和苯(science,2011,332,439;j.am.chem.soc.,2012,134,20226),随后其它小组也成功地将二苯基醚降解成苯酚和苯(angew.chem.,int.ed.,2013,52,12674;angew.chem.,int.ed.,2016,55,1474;catal.commun.2014,52,36;ind.eng.chem.res.2014,53,2633;j.org.chem.2014,79,10189;acscatal.2016,6,55),随后还有其它课题组将二苯基醚降解成为环己醇(j.am.chem.soc.,2012,134,20768)、环己烷(chemcatchem2012,4,64;acscatal.2016,6,7611;chemsuschem2015,8,1761)、二环己基醚(chem.asianj.2007,2,1524;nat.commun.2016,7,11326)、环己醇和环己酮产物(nat.commun.2017,8,14190)。纵观上述研究成果可以看出,他们的工作主要是将二苯醚降解成为了最简单的小分子有机化合物(苯、苯酚、环己烷、环己醇、环己酮、二环己基醚等),其工业价值比较低。从社会可持续发展和绿色化学的角度来看,如何有效地一步将二苯醚转化成为高附加值的化合物(如含氮类化合物)具有很好的经济价值和意义。含氮类化合物是一大类具有重要生物活性的天然产物生物碱的基本骨架,同时含氮类化合物占全部药物的90%以上。
在申请人提交的另一专利申请(201810093386.3)公开了一种将木质素4-o-5模型化合物二芳基醚转化成含氮类化合物的合成方法,反应如下:
技术实现要素:
为了解决以上问题,本发明的目的在于提供一种将二芳基醚转化成n-环己基苯胺类化合物的方法。
本发明是采用以下具体技术方案来实现的:
一种将二芳基醚转化成n-环己基苯胺类化合物的方法,包括:
在催化剂的作用下,二芳基醚与氨水和还原剂混合反应得到n-环己基苯胺类化合物,
所述二芳基醚的结构式为:
所述n-环己基苯胺类化合物的结构式为:
其中,ar为苯环或取代苯环,ar’为苯环、取代苯环、萘环或取代萘环,r为氢或c1-c12的烷基或芳基取代基团;
所述取代苯环为至少带有一个c1-c12的烷基、芳基、烷氧基、芳氧基、卤素、酯基、羟基和/或酰基取代基团的苯环;
所述取代萘环为至少带有一个c1-c12的烷基、芳基、烷氧基、芳氧基、卤素、酯基、羟基和/或酰基取代基团的萘环。
本发明中,ar与ar’可相同或不相同。
本发明中,所述芳基包括但不限于苯基、2-甲基苯基、3-甲基苯基、对甲基苯基、卤代苯基、2-甲氧基苯基、3-甲氧基苯基、对甲氧基苯基、2-羧基苯基、3-羧基苯基、对羧基苯基、苯酚基团、苯酮基团、萘基、呋喃基团、噻吩基团、吡咯基团、四氢呋喃基团、苯并呋喃基团、2,3-二氢苯并呋喃基团、联苯基团等;所述烷氧基包括但不限于甲氧基、乙氧基、丙氧基、正丁氧基、异丁氧基、叔丁氧基、正戊氧基、异戊氧基、正己氧基、正庚氧基、正辛氧基、正十一烷氧基、正十二烷氧基等;所述芳氧基包括但不限于苯氧基、苄氧基、2-甲基苯氧基、3-甲基苯氧基、对甲基苯氧基、卤代苯氧基、2-甲氧基苯氧基、3-甲氧基苯氧基、对甲氧基苯氧基、2-羧基苯氧基、3-羧基苯氧基、对羧基苯氧基、萘氧基等;所述酯基为-coor’、-ono2或-ocor’,r’包括但不限于c1-c12的烷基;所述酰基为-cor”,r”包括但不限于c1-c12的烷基、氨基等。
本发明中,所述c1-c12的烷基包括但不限于甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、异戊基、己基、庚基、辛基、壬基、癸基、正十一烷基、正十二烷基等;所述卤素包括氟、氯、溴、碘。
本发明中,所述催化剂为以单质或化合物形式存在的铁系元素或铂系元素:金属钯、金属钌、金属铑、金属铂、金属镍、金属铁、二(环辛二烯)镍、氯化镍、醋酸镍、氯化钯、醋酸钯、二(三苯基膦)氯化钯、氯化铁、氯化亚铁、氯化铑、氯化钌、氯化铂、氢氧化钯等。上述催化剂也可负载在碳、二氧化硅、三氧化铝、分子筛等载体上,如钯/碳、氢氧化钯/碳、钯/二氧化硅、铑/碳、钌/碳、铂/碳。优选地,所述催化剂是氢氧化钯/碳。其中,所述催化剂的用量为所述二芳基醚的10-30mol%。优选地,所述催化剂的用量为所述二芳基醚的20mol%。
本发明中,所述还原剂是:甲酸钾,甲酸锂,甲酸铯,甲酸铵,甲酸钠,氢化钠,氢化铝锂,硼氢化钠,氢化钙。优选地,所述还原剂是硼氢化钠。其中,所述还原剂的用量为所述二芳基醚的0.5-3倍当量。优选地,所述还原剂的用量为所述二芳基醚的1倍当量。
本发明中,所述反应可选用如下溶剂:甲苯,1,4-二氧六环,氟苯,二甲基亚砜,水,邻二甲苯,间二甲苯,对二甲苯,优选地,所述溶剂是间二甲苯。所述溶剂的用量为使得所述二芳基醚的浓度范围为0.005-1mmol/ml,优选地,所述溶剂的用量为使得二芳基醚的浓度为0.2mmol/ml。
本发明中,所述反应温度为140-160摄氏度,优选地,所述反应温度为150摄氏度。
本发明中,所述反应时间为12-36小时,优选地,所述反应温度为24小时。
本发明中,所述反应在惰性气体的保护下进行,优选地,所述惰性气体为氩气。
本发明中,为提高二芳基醚的转化率,氨水的用量相对于二芳基醚保持过量。
与申请人的另一专利申请(201810093386.3)相比,申请人意外发现用氨水与二芳基醚反应可将二芳基醚转化成附加值更高的n-环己基苯胺类化合物。
附图说明
图1为木质素结构片段;
图2为4-o-5,α-o-4,β-o-4三种醚键的模型底物。
具体实施方式
下面通过具体实施例对本发明的具体技术方案作进一步地详细说明。以下列举的仅是本发明的部分具体实施例子。显然,本发明不限于以下实施例子,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
本发明所用原料可由市场购得或者采用本领域己知方法合成。
实施例1
在干燥的反应管(20毫升)中放入适中的搅拌子,加入氢氧化钯/碳(20mol%)、nabh4(1倍当量),随后将反应管抽真空、充氩气,反复置换三次,在氩气气氛下将溶解在间二甲苯中的二苯醚(0.2mmol)和氨水(1mmol)溶液用注射器缓慢加入反应管,将反应管置于150摄氏度油浴中加热并搅拌反应。24小时后停止反应,将反应管从油浴中拿出,自然冷却到室温,用乙酸乙酯稀释,然后用硅藻土将反应液过滤,气相检测滤液苯的产率为82%。滤液浓缩后用活化好的薄层层析色谱板(淋洗剂:正己烷/乙酸乙酯=30/1)进行分离后得到最终产物3a。产物3a(产率:83%):1hnmr(cdcl3,400mhz)δ:7.17(t,j=8,2h),6.67(t,j=8hz,1h),6.60(d,j=8hz,2h),3.25(tt,j=10.0,3.7hz,1h),2.09-2.04(m,2h),1.79-1.75(m,2h),1.69-1.65(m,1h),1.43-1.27(m,2h),1.18-1.12(m,3h);13cnmr(cdcl3,100mhz)δ:147.3,129.2,116.8,113.1,51.6,33.4,25.9,25.0.
实施例2
在干燥的反应管(20毫升)中放入适中的搅拌子,加入氢氧化钯/碳(20mol%)、nabh4(1倍当量),随后将反应管抽真空、充氩气,反复置换三次,在氩气气氛下将溶解在间二甲苯中的间二甲苯基醚(0.2mmol)和氨水(1mmol)溶液用注射器缓慢加入反应管,将反应管置于150摄氏度油浴中加热并搅拌反应。24小时后停止反应,将反应管从油浴中拿出,自然冷却到室温,用乙酸乙酯稀释,然后用硅藻土将反应液过滤,气相检测滤液甲苯的产率为85%。滤液浓缩后用活化好的薄层层析色谱板(淋洗剂:正己烷/乙酸乙酯=30/1)进行分离后得到最终产物3b。产物3b(产率:79%):cis-isomer1hnmr(400mhz,cdcl3)δ:7.08(dd,j=8,7.2hz,1h),6.51(d,j=8hz,1h),6.43(d,j=8hz,2h),3.74-3.67(m,1h),2.29(s,3h),1.75-1.54(m,7h),1.38-1.27(m,1h),1.09-1.04(m,1h),0.94(d,j=6.5hz,3h).13cnmr(100mhz,cdcl3)δ:147.3,139.0,129.1,117.6,113.7,110.0,47.4,38.8,34.0,30.4,27.1,21.8,21.7,20.6.
trans-isomer1hnmr(400mhz,cdcl3)δ:7.10-7.05(m,1h),6.52(d,j=8hz,1h),6.44(s,2h),3.26(tt,j=12,3.8hz,1h),2.29(s,3h),2.13-2.10(m,2h),1.84-1.78(m,1h),1.73-1.69(m,1h),1.58-1.46(m,1h),1.42-1.33(m,1h),1.04-0.96(m,1h),0.95(d,j=8hz,3h),0.90-0.70(m,2h).13cnmr(100mhz,cdcl3)δ:147.4,139.0,129.1,117.8,113.9,110.2,52.0,42.5,34.6,33.4,32.0,25.0,22.5,21.7.
实施例3
在干燥的反应管(20毫升)中放入适中的搅拌子,加入氢氧化钯/碳(20mol%)、nabh4(1倍当量),随后将反应管抽真空、充氩气,反复置换三次,在氩气气氛下将溶解在间二甲苯中的对二甲苯基醚(0.2mmol)和氨水(1mmol)溶液用注射器缓慢加入反应管,将反应管置于150摄氏度油浴中加热并搅拌反应。24小时后停止反应,将反应管从油浴中拿出,自然冷却到室温,用乙酸乙酯稀释,然后用硅藻土将反应液过滤,气相检测滤液甲苯的产率为88%。滤液浓缩后用活化好的薄层层析色谱板(淋洗剂:正己烷/乙酸乙酯=30/1)进行分离后得到最终产物3c。产物3c(产率:82%):cis-isomer1hnmr(400mhz,cdcl3)δ:6.98(d,j=8.0hz,2h),6.54(d,j=8.0hz,2h),3.53(quint,j=4.5hz,1h),2.24(s,3h),1.77-1.73(m,2h),1.67-1.53(m,5h),1.27-1.23(m,2h),0.94(d,j=8hz,3h).13cnmr(100mhz,cdcl3)δ:145.0,129.7,125.9,113.3,48.3,30.9,29.7,29.2,21.4,20.4.
trans-isomer1hnmr(400mhz,cdcl3)δ:7.00(d,j=8hz,2h),6.54(d,j=8.5hz,2h),3.19-3.09(m,1h),2.24(s,3h),2.13-2.10(m,2h),1.77-1.75(m,2h),1.44-1.41(m,1h),1.16-1.03(m,4h),0.93(d,j=8hz,3h).13cnmr(100mhz,cdcl3)δ:145.1,129.7,126.1,113.5,52.4,34.1,33.5,32.3,22.3,20.3.
实施例4
在干燥的反应管(20毫升)中放入适中的搅拌子,加入氢氧化钯/碳(20mol%)、nabh4(1倍当量),随后将反应管抽真空、充氩气,反复置换三次,在氩气气氛下将溶解在间二甲苯中的对二乙基苯基醚(0.2mmol)和氨水(1mmol)溶液用注射器缓慢加入反应管,将反应管置于150摄氏度油浴中加热并搅拌反应。24小时后停止反应,将反应管从油浴中拿出,自然冷却到室温,用乙酸乙酯稀释,然后用硅藻土将反应液过滤,气相检测滤液乙基苯的产率为80%。滤液浓缩后用活化好的薄层层析色谱板(淋洗剂:正己烷/乙酸乙酯=30/1)进行分离后得到最终产物3d。产物3d(产率:69%):cis-isomer1hnmr(400mhz,cdcl3)δ:7.01(d,j=8hz,2h),6.57(d,j=8.6hz,2h),3.56-3.54(m,1h),2.53(q,j=8hz,2h),1.73-1.59(m,6h),1.38-1.29(m,5h),1.20(t,j=8hz,3h),0.90(t,j=8hz,3h).13cnmr(100mhz,cdcl3)δ:145.3,132.5,128.5,113.2,48.6,37.8,29.4,28.3,27.9,27.4,16.0,11.7.
trans-isomer1hnmr(400mhz,cdcl3)δ:7.00(d,j=8hz,2h),6.56(d,j=8.6hz,2h),3.20-3.13(m,1h),2.53(q,j=8hz,2h),2.16-2.12(m,2h),1.84-1.81(m,2h),1.26-1.15(m,8h),1.08-0.99(m,2h),0.90(t,j=8hz,3h).13cnmr(100mhz,cdcl3)δ:145.4,132.7,128.5,113.3,52.7,39.0,33.6,31.7,29.6,27.9,16.0,11.7.
实施例5
在干燥的反应管(20毫升)中放入适中的搅拌子,加入氢氧化钯/碳(20mol%)、nabh4(1倍当量),随后将反应管抽真空、充氩气,反复置换三次,在氩气气氛下将溶解在间二甲苯中的对二丙基苯基醚(0.2mmol)和氨水(1mmol)溶液用注射器缓慢加入反应管,将反应管置于150摄氏度油浴中加热并搅拌反应。24小时后停止反应,将反应管从油浴中拿出,自然冷却到室温,用乙酸乙酯稀释,然后用硅藻土将反应液过滤,气相检测滤液丙基苯的产率为83%。滤液浓缩后用活化好的薄层层析色谱板(淋洗剂:正己烷/乙酸乙酯=30/1)进行分离后得到最终产物3e。产物3e(产率:71%):cis-isomer1hnmr(400mhz,cdcl3)δ:6.98(d,j=8hz,2h),6.55(d,j=8hz,2h),3.55-3.52(m,1h),2.7(t,j=8.6hz,2h),1.77-1.51(m,8h),1.38-1.19(m,7h),0.90(m,6h).13cnmr(100mhz,cdcl3)δ:145.4,131.2,129.2,113.2,52.7,39.4,37.2,37.0,33.7,32.1,25.0,20.2,14.5,14.0.
trans-isomer1hnmr(400mhz,cdcl3)δ:6.98(d,j=8hz,2h),6.54(d,j=8.6hz,2h),3.19-3.12(m,1h),2.47(t,j=8hz,2h),2.14-2.11(m,2h),1.82-1.79(m,2h),1.61-1.58(m,2h),1.36-1.17(m,5h),1.11-1.03(m,4h),0.90-0.88(m,6h).13cnmr(100mhz,cdcl3)δ:145.3,131.0,129.2,113.1,48.7,37.2(2c),35.7,29.4,27.8,25.0,20.2,14.4,13.9.
实施例6
在干燥的反应管(20毫升)中放入适中的搅拌子,加入氢氧化钯/碳(20mol%)、nabh4(2倍当量),随后将反应管抽真空、充氩气,反复置换三次,在氩气气氛下将溶解在间二甲苯中的双(4-氟苯基)醚(0.2mmol)和氨水(1mmol)溶液用注射器缓慢加入反应管,将反应管置于150摄氏度油浴中加热并搅拌反应。36小时后停止反应,将反应管从油浴中拿出,自然冷却到室温,用乙酸乙酯稀释,然后用硅藻土将反应液过滤,气相检测滤液苯的产率为62%。滤液浓缩后用活化好的薄层层析色谱板(淋洗剂:正己烷/乙酸乙酯=30/1)进行分离后得到最终产物3a。产物3a(产率:48%):1hnmr(cdcl3,400mhz)δ:7.17(t,j=8,2h),6.67(t,j=8hz,1h),6.60(d,j=8hz,2h),3.25(tt,j=10.0,3.7hz,1h),2.09-2.04(m,2h),1.79-1.75(m,2h),1.69-1.65(m,1h),1.43-1.27(m,2h),1.18-1.12(m,3h);13cnmr(cdcl3,100mhz)δ:147.3,129.2,116.8,113.1,51.6,33.4,25.9,25.0.
实施例7
在干燥的反应管(20毫升)中放入适中的搅拌子,加入氢氧化钯/碳(20mol%)、nabh4(1倍当量),随后将反应管抽真空、充氩气,反复置换三次,在氩气气氛下将溶解在间二甲苯中的双(4-甲氧基二苯基)醚(0.2mmol)和氨水(1mmol)溶液用注射器缓慢加入反应管,将反应管置于150摄氏度油浴中加热并搅拌反应。36小时后停止反应,将反应管从油浴中拿出,自然冷却到室温,用乙酸乙酯稀释,然后用硅藻土将反应液过滤,气相检测滤液甲氧基苯的产率为58%。滤液浓缩后用活化好的薄层层析色谱板(淋洗剂:正己烷/乙酸乙酯=30/1)进行分离后得到最终产物3a。产物3a(产率:42%):1hnmr(cdcl3,400mhz)δ:7.17(t,j=8,2h),6.67(t,j=8hz,1h),6.60(d,j=8hz,2h),3.25(tt,j=10.0,3.7hz,1h),2.09-2.04(m,2h),1.79-1.75(m,2h),1.69-1.65(m,1h),1.43-1.27(m,2h),1.18-1.12(m,3h);13cnmr(cdcl3,100mhz)δ:147.3,129.2,116.8,113.1,51.6,33.4,25.9,25.0.
实施例8
在干燥的反应管(20毫升)中放入适中的搅拌子,加入氢氧化钯/碳(20mol%)、nabh4(1倍当量),随后将反应管抽真空、充氩气,反复置换三次,在氩气气氛下将溶解在间二甲苯中的3-甲基二苯基醚(0.2mmol)和氨水(1mmol)溶液用注射器缓慢加入反应管,将反应管置于150摄氏度油浴中加热并搅拌反应。24小时后停止反应,将反应管从油浴中拿出,自然冷却到室温,用乙酸乙酯稀释,然后用硅藻土将反应液过滤,气相检测滤液苯的产率为65%。滤液浓缩后用活化好的薄层层析色谱板(淋洗剂:正己烷/乙酸乙酯=30/1)进行分离后得到最终产物3b。产物3b(产率:74%):cis-isomer1hnmr(400mhz,cdcl3)δ:7.08(dd,j=8,7.2hz,1h),6.51(d,j=8hz,1h),6.43(d,j=8hz,2h),3.74-3.67(m,1h),2.29(s,3h),1.75-1.54(m,7h),1.38-1.27(m,1h),1.09-1.04(m,1h),0.94(d,j=6.5hz,3h).13cnmr(100mhz,cdcl3)δ:147.3,139.0,129.1,117.6,113.7,110.0,47.4,38.8,34.0,30.4,27.1,21.8,21.7,20.6.
trans-isomer1hnmr(400mhz,cdcl3)δ:7.10-7.05(m,1h),6.52(d,j=8hz,1h),6.44(s,2h),3.26(tt,j=12,3.8hz,1h),2.29(s,3h),2.13-2.10(m,2h),1.84-1.78(m,1h),1.73-1.69(m,1h),1.58-1.46(m,1h),1.42-1.33(m,1h),1.04-0.96(m,1h),0.95(d,j=8hz,3h),0.90-0.70(m,2h).13cnmr(100mhz,cdcl3)δ:147.4,139.0,129.1,117.8,113.9,110.2,52.0,42.5,34.6,33.4,32.0,25.0,22.5,21.7.
实施例9
在干燥的反应管(20毫升)中放入适中的搅拌子,加入氢氧化钯/碳(20mol%)、nabh4(1倍当量),随后将反应管抽真空、充氩气,反复置换三次,在氩气气氛下将溶解在间二甲苯中的4-甲基二苯基醚(0.2mmol)和氨水(1mmol)溶液用注射器缓慢加入反应管,将反应管置于150摄氏度油浴中加热并搅拌反应。24小时后停止反应,将反应管从油浴中拿出,自然冷却到室温,用乙酸乙酯稀释,然后用硅藻土将反应液过滤,气相检测滤液苯的产率为73%。滤液浓缩后用活化好的薄层层析色谱板(淋洗剂:正己烷/乙酸乙酯=30/1)进行分离后得到最终产物3c。产物3c(产率:82%):cis-isomer1hnmr(400mhz,cdcl3)δ:6.98(d,j=8.0hz,2h),6.54(d,j=8.0hz,2h),3.53(quint,j=4.5hz,1h),2.24(s,3h),1.77-1.73(m,2h),1.67-1.53(m,5h),1.27-1.23(m,2h),0.94(d,j=8hz,3h).13cnmr(100mhz,cdcl3)δ:145.0,129.7,125.9,113.3,48.3,30.9,29.7,29.2,21.4,20.4.
trans-isomer1hnmr(400mhz,cdcl3)δ:7.00(d,j=8hz,2h),6.54(d,j=8.5hz,2h),3.19-3.09(m,1h),2.24(s,3h),2.13-2.10(m,2h),1.77-1.75(m,2h),1.44-1.41(m,1h),1.16-1.03(m,4h),0.93(d,j=8hz,3h).13cnmr(100mhz,cdcl3)δ:145.1,129.7,126.1,113.5,52.4,34.1,33.5,32.3,22.3,20.3.
实施例10
在干燥的反应管(20毫升)中放入适中的搅拌子,加入氢氧化钯/碳(20mol%)、nabh4(1倍当量),随后将反应管抽真空、充氩气,反复置换三次,在氩气气氛下将溶解在间二甲苯中的4-苯氧基联苯(0.2mmol)和氨水(1mmol)溶液用注射器缓慢加入反应管,将反应管置于150摄氏度油浴中加热并搅拌反应。24小时后停止反应,将反应管从油浴中拿出,自然冷却到室温,用乙酸乙酯稀释,然后用硅藻土将反应液过滤。滤液浓缩后用活化好的薄层层析色谱板(淋洗剂:正己烷/乙酸乙酯=30/1)进行分离后得到最终产物3a、联苯(11%)和环己基苯(82%)。产物3a(产率:76%):1hnmr(cdcl3,400mhz)δ:7.17(t,j=8,2h),6.67(t,j=8hz,1h),6.60(d,j=8hz,2h),3.25(tt,j=10.0,3.7hz,1h),2.09-2.04(m,2h),1.79-1.75(m,2h),1.69-1.65(m,1h),1.43-1.27(m,2h),1.18-1.12(m,3h);13cnmr(cdcl3,100mhz)δ:147.3,129.2,116.8,113.1,51.6,33.4,25.9,25.0.
实施例11
在干燥的反应管(20毫升)中放入适中的搅拌子,加入氢氧化钯/碳(20mol%)、nabh4(1倍当量),随后将反应管抽真空、充氩气,反复置换三次,在氩气气氛下将溶解在间二甲苯中的2-苯氧基萘(0.2mmol)和氨水(1mmol)溶液用注射器缓慢加入反应管,将反应管置于150摄氏度油浴中加热并搅拌反应。24小时后停止反应,将反应管从油浴中拿出,自然冷却到室温,用乙酸乙酯稀释,然后用硅藻土将反应液过滤。滤液浓缩后用活化好的薄层层析色谱板(淋洗剂:正己烷/乙酸乙酯=30/1)进行分离后得到最终产物3a、萘(17%)和1,2,3,4-四氢萘(74%)。产物3a(产率:73%):1hnmr(cdcl3,400mhz)δ:7.17(t,j=8,2h),6.67(t,j=8hz,1h),6.60(d,j=8hz,2h),3.25(tt,j=10.0,3.7hz,1h),2.09-2.04(m,2h),1.79-1.75(m,2h),1.69-1.65(m,1h),1.43-1.27(m,2h),1.18-1.12(m,3h);13cnmr(cdcl3,100mhz)δ:147.3,129.2,116.8,113.1,51.6,33.4,25.9,25.0.
实施例12
在干燥的反应管(20毫升)中放入适中的搅拌子,加入氢氧化钯/碳(20mol%)、nabh4(1倍当量),随后将反应管抽真空、充氩气,反复置换三次,在氩气气氛下将溶解在间二甲苯中的2-对甲苯氧基萘(0.2mmol)和氨水(1mmol)溶液用注射器缓慢加入反应管,将反应管置于150摄氏度油浴中加热并搅拌反应。24小时后停止反应,将反应管从油浴中拿出,自然冷却到室温,用乙酸乙酯稀释,然后用硅藻土将反应液过滤。滤液浓缩后用活化好的薄层层析色谱板(淋洗剂:正己烷/乙酸乙酯=30/1)进行分离后得到最终产物3a、萘(14%)和1,2,3,4-四氢萘(76%)。产物3c(产率:77%):cis-isomer1hnmr(400mhz,cdcl3)δ:6.98(d,j=8.0hz,2h),6.54(d,j=8.0hz,2h),3.53(quint,j=4.5hz,1h),2.24(s,3h),1.77-1.73(m,2h),1.67-1.53(m,5h),1.27-1.23(m,2h),0.94(d,j=8hz,3h).13cnmr(100mhz,cdcl3)δ:145.0,129.7,125.9,113.3,48.3,30.9,29.7,29.2,21.4,20.4.
trans-isomer1hnmr(400mhz,cdcl3)δ:7.00(d,j=8hz,2h),6.54(d,j=8.5hz,2h),3.19-3.09(m,1h),2.24(s,3h),2.13-2.10(m,2h),1.77-1.75(m,2h),1.44-1.41(m,1h),1.16-1.03(m,4h),0.93(d,j=8hz,3h).13cnmr(100mhz,cdcl3)δ:145.1,129.7,126.1,113.5,52.4,34.1,33.5,32.3,22.3,20.3.
实施例13
在干燥的反应管(20毫升)中放入适中的搅拌子,加入氢氧化钯/碳(20mol%)、nabh4(1倍当量),随后将反应管抽真空、充氩气,反复置换三次,在氩气气氛下将溶解在间二甲苯中的4-对甲苯氧基联苯(0.2mmol)和氨水(1mmol)溶液用注射器缓慢加入反应管,将反应管置于150摄氏度油浴中加热并搅拌反应。24小时后停止反应,将反应管从油浴中拿出,自然冷却到室温,用乙酸乙酯稀释,然后用硅藻土将反应液过滤。滤液浓缩后用活化好的薄层层析色谱板(淋洗剂:正己烷/乙酸乙酯=30/1)进行分离后得到最终产物3a、联苯(11%)和环己基苯(81%)。产物3c(产率:82%):cis-isomer1hnmr(400mhz,cdcl3)δ:6.98(d,j=8.0hz,2h),6.54(d,j=8.0hz,2h),3.53(quint,j=4.5hz,1h),2.24(s,3h),1.77-1.73(m,2h),1.67-1.53(m,5h),1.27-1.23(m,2h),0.94(d,j=8hz,3h).13cnmr(100mhz,cdcl3)δ:145.0,129.7,125.9,113.3,48.3,30.9,29.7,29.2,21.4,20.4.
trans-isomer1hnmr(400mhz,cdcl3)δ:7.00(d,j=8hz,2h),6.54(d,j=8.5hz,2h),3.19-3.09(m,1h),2.24(s,3h),2.13-2.10(m,2h),1.77-1.75(m,2h),1.44-1.41(m,1h),1.16-1.03(m,4h),0.93(d,j=8hz,3h).13cnmr(100mhz,cdcl3)δ:145.1,129.7,126.1,113.5,52.4,34.1,33.5,32.3,22.3,20.3.
实施例14
在干燥的反应管(20毫升)中放入适中的搅拌子,加入氢氧化钯/碳(20mol%)、nabh4(2倍当量),随后将反应管抽真空、充氩气,反复置换三次,在氩气气氛下将溶解在间二甲苯中的1,4-二苯氧基苯(0.2mmol)和氨水(1mmol)溶液用注射器缓慢加入反应管,将反应管置于150摄氏度油浴中加热并搅拌反应。24小时后停止反应,将反应管从油浴中拿出,自然冷却到室温,用乙酸乙酯稀释,然后用硅藻土将反应液过滤,气相检测滤液苯的产率为84%。滤液浓缩后用活化好的薄层层析色谱板(淋洗剂:正己烷/乙酸乙酯=30/1)进行分离后得到最终产物3a。产物3a(产率:123%):1hnmr(cdcl3,400mhz)δ:7.17(t,j=8,2h),6.67(t,j=8hz,1h),6.60(d,j=8hz,2h),3.25(tt,j=10.0,3.7hz,1h),2.09-2.04(m,2h),1.79-1.75(m,2h),1.69-1.65(m,1h),1.43-1.27(m,2h),1.18-1.12(m,3h);13cnmr(cdcl3,100mhz)δ:147.3,129.2,116.8,113.1,51.6,33.4,25.9,25.0.
实施例15
在干燥的反应管(20毫升)中放入适中的搅拌子,加入氢氧化钯/碳(20mol%)、nabh4(2倍当量),随后将反应管抽真空、充氩气,反复置换三次,在氩气气氛下将溶解在间二甲苯中的1,3-二苯氧基苯(0.2mmol)和氨水(1mmol)溶液用注射器缓慢加入反应管,将反应管置于150摄氏度油浴中加热并搅拌反应。24小时后停止反应,将反应管从油浴中拿出,自然冷却到室温,用乙酸乙酯稀释,然后用硅藻土将反应液过滤,气相检测滤液苯的产率为82%。滤液浓缩后用活化好的薄层层析色谱板(淋洗剂:正己烷/乙酸乙酯=30/1)进行分离后得到最终产物3a。产物3a(产率:112%):1hnmr(cdcl3,400mhz)δ:7.17(t,j=8,2h),6.67(t,j=8hz,1h),6.60(d,j=8hz,2h),3.25(tt,j=10.0,3.7hz,1h),2.09-2.04(m,2h),1.79-1.75(m,2h),1.69-1.65(m,1h),1.43-1.27(m,2h),1.18-1.12(m,3h);13cnmr(cdcl3,100mhz)δ:147.3,129.2,116.8,113.1,51.6,33.4,25.9,25.0。
- 还没有人留言评论。精彩留言会获得点赞!