1,2,3-三氮唑类微管蛋白聚合抑制剂其合成方法和应用与流程
本发明涉及抗肿瘤药物化学领域,具体涉及一类新型1,2,3-三氮唑类化合物、它们的制备方法及其作为一类新的抗肿瘤药物先导化合物的应用。
背景技术:
微管是大多数真核生物细胞骨架的重要组分,在维持细胞形态、保持细胞内部结构的有序性中起重要作用,而且与细胞内的物质运输、细胞运动、细胞的分化发育以及细胞分裂繁殖等生命活动密切相关。微管蛋白(tubulin)的重要生理作用使得其在肿瘤领域中成为重要的靶点。秋水仙碱作为微管蛋白聚合抑制剂可抑制细胞的有丝分裂,有抗肿瘤作用,但毒性大,现已少用。
技术实现要素:
本发明目的在于提供一类抗肿瘤活性强于秋水仙碱的新型1,2,3-三氮唑类化合物。
本发明的另一个目的在于提供一种简单高效,绿色环保的合成新型1,2,3-三氮唑类化合物的方法。
本发明的再一个目的在于探寻所述化合物的抗肿瘤靶点,证明化合物为微管蛋白聚合抑制剂。
本发明所述一类新型1,2,3-三氮唑类化合物具有如下通式:
具体为6a~6l所示化合物:
本发明所述新型1,2,3-三氮唑类化合物主要通过下列步骤制得:
(1)化合物(4)的制备方法:
溶剂中,将3,4,5-三甲氧基苯胺(1),4-甲氧基苄氯在碱性条件下搅拌反应,加入氯乙酰氯反应得到化合物(4),所用的碱性化合物是氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、磷酸钠、十二水磷酸钠、磷酸钾、碳酸氢钾、碳酸氢钠中的一种;所用的溶剂为乙醇、甲醇、n,n-二甲基甲酰胺、二甲基亚砜、四氢呋喃、二氧六环、二氯甲烷中之一或其中任意两种的混合物;反应在0-80℃之间进行。
(2)化合物(5)的制备方法:
溶剂中,化合物(4)和叠氮钠在碱性条件下搅拌反应,得到化合物(5);所用的碱性化合物是氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、磷酸钠、十二水磷酸钠、磷酸钾、碳酸氢钾、碳酸氢钠中的一种;所用的溶剂为乙醇、甲醇、n,n-二甲基甲酰胺、二甲基亚砜、四氢呋喃、二氧六环、二氯甲烷中之一或其中任意两种的混合物;反应在60-120℃之间进行。
(3)通式(6a~6l)的制备方法:
溶剂中,化合物(5)与取代炔基化合物在五水硫酸铜及抗坏血酸钠存在下反应,所用的溶剂为丙酮、乙腈、乙醇、甲醇、异丙醇、四氢呋喃、蒸馏水中之一或其中任意两种或三种的混合物;反应在25-80℃之间进行。
本发明优点:1、该类化合物体外抗癌活性试验表明对多种肿瘤细胞pc3、hepg2、mgc803等均具有一定的抑制作用,同时对微管蛋白的聚合有显著的抑制作用。尤其是化合物(6c)对pc3、hepg2、mgc803三种癌细胞的活性优于抗肿瘤药物秋水仙碱及抗肿瘤药物5-氟尿嘧啶,化合物(6a,6b,6c,6g,6j)对pc3、hepg2、mgc803三种癌细胞的活性优于抗肿瘤药物5-氟尿嘧啶,可作为进一步开发的候选或者先导化合物,应用于制备抗肿瘤药物。2、合成方法简单高效,绿色环保,收率高,达80%以上。
附图说明
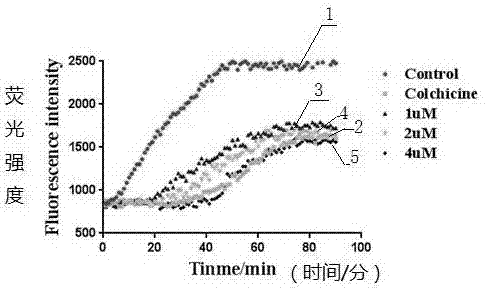
图1为不同浓度的化合物6c对tubulin聚合抑制活性图,其中,1-空白对照,2-秋水仙碱,3-1um化合物6c,4-2um化合物6c,5-4um化合物6c。
具体实施方式
为对本发明进行更好地说明,举实施例如下:
实施例1通式(6a~6l)的制备(1)制备化合物(4):
(1)室温下,乙醇溶剂中,加入3,4,5-三甲氧基苯胺(1)、4-甲氧基苄氯、碳酸钠搅拌反应,然后加入氯乙酰氯反应得到化合物(4);
(2)制备化合物(5):
乙醇溶剂中,加入磷酸钾、化合物(4)和叠氮钠,60℃搅拌反应,得到化合物(5);
(3)制备化合物(6a~6l):将化合物(5)(1.93g,5mmol)和不同炔基化合物(6mmol)加入10ml丙酮/水(5ml/5ml)溶解,最后加入五水硫酸铜(1mmol)和抗坏血酸钠(0.5mmol),室温搅拌过夜。tlc监测反应进程,待反应结束后,向体系中加入蒸馏水,然后用二氯乙烷萃取6次,再用饱和食盐水反萃二氯乙烷相3次,每次10ml,最后有机相用无水硫酸镁干燥,滤除硫酸镁,滤液减压蒸馏除去二氯乙烷。所得粗产品用硅胶柱柱层析分离纯化,石油醚/乙酸乙酯=8:1洗脱,分别得化合物(6a~6l)。
化合物(6a):1hnmr(400mhz,dmso-d6)δ8.3(s,1h),7.7(d,1h),7.7(d,1h),7.4(d,1h),7.4(t,1h),7.2(d,2h),6.9(d,2h),6.6(s,2h),6.2(s,1h),5.5(s,2h),5.2(s,2h),4.8(s,2h),3.7(s,9h),3.7(s,3h).收率81%。
化合物(6b):1hnmr(400mhz,dmso-d6)δ8.2(s,1h),8.0(d,1h),7.7(d,1h),7.2(dd,3h),7.0(dd,1h),6.9(d,2h),6.6(s,2h),6.3(d,1h),5.3(s,2h),5.2(s,2h),4.8(s,2h),3.7(s,9h),3.7(s,3h).收率86%。
化合物(6c):1hnmr(400mhz,dmso-d6)δ8.2(s,1h),7.7(d,1h),7.2(dd,3h),7.1(dd,1h),6.9(d,2h),6.6(s,2h),6.2(d,1h),5.30(s,2h),5.2(s,2h),4.8(s,2h),3.7(s,9h),3.7(s,3h),2.4(d,3h).收率85%。
化合物(6d):1hnmr(400mhz,dmso-d6)δ8.1(s,1h),7.3(dd,2h),7.2(d,2h),7.1(d,2h),7.0(t,1h),6.9(d,2h),6.6(s,2h),5.2(d,4h),4.8(s,2h),3.7(s,9h),3.7(s,3h).收率83%。
化合物(6e):1hnmr(400mhz,dmso-d6)δ8.0(d,2h),7.9(d,1h),7.6–7.3(m,2h),7.1(d,2h),6.9(d,2h),6.6(s,2h),5.1(s,2h),4.8(s,2h),4.7(s,2h),3.7(d,9h),3.7(s,3h).收率89%。
化合物(6f):1hnmr(400mhz,dmso-d6)δ7.9(s,1h),7.2(d,2h),6.8(d,2h),6.6(s,2h),5.1(s,2h),4.8(s,2h),4.4(s,2h),4.2(t,2h),3.7(s,9h),3.7(s,3h),3.5(t,2h).收率90%。
化合物(6g):1hnmr(400mhz,dmso-d6)δ8.1(s,1h),7.8–7.6(m,2h),7.5–7.2(m,2h),7.1(d,2h),6.9(d,2h),6.6(s,2h),5.1(s,2h),4.8(s,2h),4.7(s,2h),3.7(d,9h),3.7(s,3h).收率92%。
化合物(6h):1hnmr(400mhz,dmso-d6)δ7.99(s,1h),7.6–7.3(m,10h),7.1(d,2h),6.9(d,2h),6.6(s,2h),5.1(s,2h),4.8(s,2h),4.9(s,2h),3.7(d,9h),3.7(s,3h).收率93%。
化合物(6i):1hnmr(400mhz,dmso-d6)δ9.6(s,1h),8.0(s,1h),7.1(d,2h),6.9(d,2h),6.6(s,2h),5.1(s,2h),4.8(s,2h),4.7(s,2h),3.7(d,9h),3.7(s,3h).收率80%。
化合物(6j):1hnmr(400mhz,dmso-d6)δ8.0(s,1h),7.1(d,2h),6.9(d,2h),6.6(s,2h),5.1(s,2h),4.8(s,2h),4.6(s,2h),3.9(s,3h),3.7(d,9h),3.7(s,3h).收率86%。
化合物(6k):1hnmr(400mhz,dmso-d6)δ7.9(s,1h),7.6(dd,2h),7.4(d,1h),7.1(t,3h),7.0(t,1h),6.8(d,2h),6.6(s,2h),6.4(d,1h),5.5(s,2h),5.1(s,2h),4.8(s,2h),3.7(s,3h),3.7(s,6h),3.6(s,3h).收率80%。
化合物(6l):1hnmr(400mhz,dmso-d6)δ8.1(t,1h),7.8(s,1h),7.7(d,2h),7.4(d,2h),7.1(d,2h),6.9(d,2h),6.6(s,2h),5.1(s,2h),4.8(s,2h),4.0(d,2h),3.7(s,9h),3.7(s,3h),2.4(s,3h).收率96%。
实施例2上述化合物的抗肿瘤活性测定:
筛选所用化合物均是由本发明合成、纯化而得;样品储备液:称取1-2mg样品置于2mlep管中,然后用dmso配制成溶液,4℃保存放置,实验时根据所需浓度利用培养基稀释。取对数生长期的细胞,消化计数后,用培养基调整细胞密度,以4000-5000个cell/孔接种至96孔板中,每孔150μl,培养24h后,弃去培养基,加入用培养基稀释好的药物(50μg/ml、100μg/ml),每个浓度设6个复孔,另设空白对照组及阴性对照组。药物作用72h后,每孔加入20μlmtt,继续培养4h后,吸去液体,加入150ml的dmso,振荡均匀,酶标仪490nm处检测吸光度值,计算抑制率,计算公式如下:抑制率(%)=(1-给药组吸光度值/空白组吸光度值)×100%,50μg/ml时抑制率大于50%的样品,重新设置浓度进行细筛。试验结果采用spss软件计算ic50值和相关系数。实验结果见表1。
表1化合物抑制瘤细胞株的ic50值
a每个数值用平均值±标准偏差(mean±sd)表示,方差分析:p<0.05,5-fu:5-氟尿嘧啶,colchicine:秋水仙碱
实施例3化合物6c的tubulin聚合抑制活性测定:
将提取的微管蛋白重悬于冰冷的g-pem缓冲液中(80mmpipesph5.9,5mmmgcl2,1mmegta,1mmatp,5%(v/v)glycerol),取100ul加至包含100ul化合物6c的96孔板内,微管蛋白终浓度为5.6g/l,药物浓度设置0um,1um,2um,4um四个梯度,样品充分混匀,分光光度计检测微管蛋白的聚合,间隔5min,总计60min,ic50值在30分钟使用graphpad软件计算得到。化合物6c的微管蛋白聚合抑制活性的ic50值为2.17μm,说明化合物6c确实能够结合微管蛋白,抑制其聚合,结果见图1。
- 还没有人留言评论。精彩留言会获得点赞!