靶向丝/苏氨酸激酶抑制剂的晶型的制作方法
本公开涉及一种靶向cdk4/6激酶抑制剂的晶型及其制备方法,还涉及包含所述晶型的药物组合物,以及这些晶型化合物及其组合物在治疗和/或预防由cdk4/6激酶介导的疾病中的应用。
背景技术:
式(i)所示的化合物的化学名称为5-((4-乙基哌嗪-1-基)甲基)-n-(5-氟-4-(4-氟-1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)吡啶-2-基)嘧啶-2-胺(以下简称为“式(i)化合物”,在专利申请pct/cn2014/095615中已有描述),其为靶向周期蛋白依赖性激酶4/6(cyclin-dependentkinase4/6,cdk4/6)激酶抑制剂。研究表明,在参与细胞周期的cdk亚型中,cdk4/6发挥着不可替代的作用。与癌症有关的细胞周期突变主要存在于g1期和g1/s期转化过程中,cdk4/6与cyclind形成的复合物使抑癌基因rb磷酸化为prb,释放被结合的转录因子e2f,导致与s期启动有关的基因转录,促使细胞通过检验点,并从g1期向s期转移。大约80%的人类肿瘤中有cyclind-cdk4/6-ink4-rb通路的异常。这条通路的改变,加速了g1期进程,使得肿瘤细胞增殖加快而获得生存优势。因此,对该通路的干预成为一种治疗策略,cdk4/6成为一种新的抗肿瘤靶点。
cdk4/6作为抗肿瘤靶点的优势在于以下两个方面:(1)大多数增殖的细胞依赖cdk2或者cdk4/6增殖,但cdk4/6的抑制剂不表现出“pan-cdk抑制剂”的细胞毒性,如骨髓抑制和肠道反应。(2)临床前实验表明,如果细胞cyclind水平升高或者p16ink4a失活,能够增加细胞对药物的敏感性,由于肿瘤细胞相对于正常细胞存在上述现象,所以一定程度上增加了药物的靶向性。
晶型的研究在药物研发过程中发挥着重要的作用,同一药物的不同晶型在溶解度、稳定性、生物利用度等方面存在着显著的差异,为了更好地控制药物的质量,满足制剂、生产、运输、存储等情况的要求,我们对式(i)化合物的晶型进行了研究,以期发现具有良好性质的晶型。
技术实现要素:
本公开涉及式(i)所示的靶向cdk4/6激酶抑制剂5-((4-乙基哌嗪-1-基)甲基)-n-(5-氟-4-(4-氟-1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)吡啶-2-基)嘧啶-2-胺的马来酸盐晶型i(简称晶型i)。本公开还涉及晶型i的制备方法,包含晶型i的药物组合物,以及这些化合物在降低或抑制细胞中的cdk4/6激酶的活性,治疗和/或预防由cdk4/6激酶介导的癌症相关疾病中的应用。
在某些实施方案中,本公开提供了一种式(i)所示化合物的马来酸盐晶型i,
在某些实施方案中,所述化合物的马来酸盐晶型i,其特征在于,式(i)化合物与马来酸的摩尔比为1:3-1:1,优选约1:2。
在某些实施方案中,所述晶型i为式(i)化合物的二马来酸盐晶型。
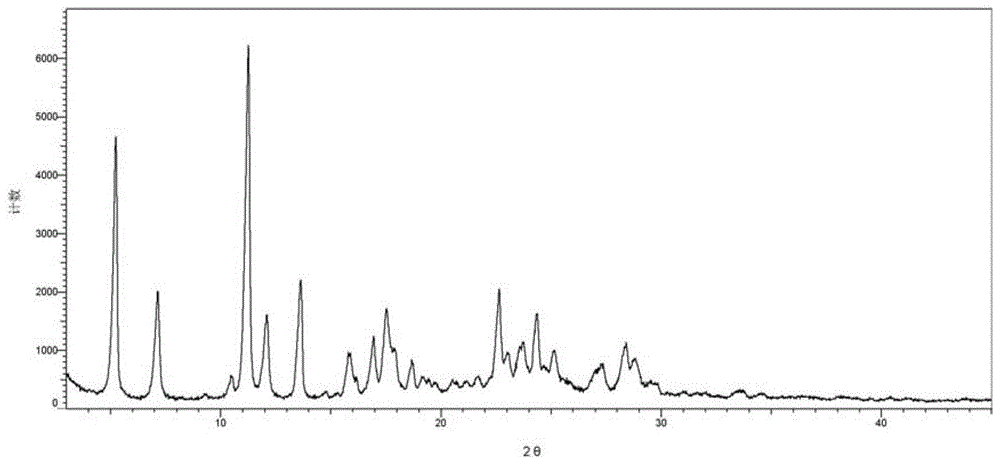
在某些实施方案中,所述的马来酸盐晶型i,使用cu-kα辐射,以2θ角度表示x-射线粉末衍射图谱在5.2±0.2°、7.1±0.2°、11.2±0.2°、12.1±0.2°、13.6±0.2°处有特征峰。
在某些实施方案中,所述的马来酸盐晶型i,其在使用cu-kα辐射,以2θ角度表示x-射线粉末衍射图在5.2±0.2°、7.1±0.2°、10.5±0.2°、11.2±0.2°、12.1±0.2°、13.6±0.2°、15.9±0.2°、16.9±0.2°、17.5±0.2°、18.7±0.2°、22.6±0.2°、24.3±0.2°处有特征峰。
在某些实施方案中,所述的马来酸盐晶型i,其在使用cu-kα辐射,以2θ角度表示x-射线粉末衍射图在5.2±0.2°、7.1±0.2°、10.5±0.2°、11.2±0.2°、12.1±0.2°、13.6±0.2°、15.9±0.2°、16.9±0.2°、17.5±0.2°、18.7±0.2°、22.6±0.2°、23.7±0.2°、24.3±0.2°、25.1±0.2°、28.4±0.2°处有特征峰。
在某些实施方案中,所述的马来酸盐晶型i,其具有基本上如图1所示的使用cu-kα辐射获得的x-射线粉末衍射图。
在某些实施方案中,所述的马来酸盐晶型i,其特征在于,其差示扫描量热(dsc)分析图在165℃至220℃范围内具有吸热峰。
在某些优选的实施方案中,所述的马来酸盐晶型i的差示扫描量热(dsc)分析图在211.06±5℃存在最大吸热转变温度。
在某些优选的实施方案中,所述的马来酸盐晶型i具有基本上如图2所示的差示扫描量热曲线。
在某些优选的实施方案中,所述的马来酸盐晶型i具有基本上如图3所示的热重分析(tga)曲线。
在某些实施方案中,所述的式(i)化合物的马来酸盐晶型i,其特征在于,具有基本如图4所示的1h-nmr图谱。
在某些实施方案中,所述的式(i)化合物的马来酸盐晶型i,其特征在于,其晶体结构为基本纯净的形式。
本公开还提供了一种马来酸盐晶型i的制备方法,包括以下操作:
将式(i)化合物溶于有机溶剂中,室温或加热至一定温度后,加入一定当量的马来酸或马来酸溶液反应得晶型i。
在某些优选的实施方案中,所述的马来酸盐晶型i的制备方法中,所述的有机溶剂选自下列溶剂中的一种或者两种以上溶剂之间的任一组合:
(1)醇类溶剂,选自脂肪醇、脂环醇及芳香醇类溶剂,所述脂肪醇类溶剂选自甲醇、乙醇、丙醇、异丙醇、正丁醇、异丁醇、叔丁醇、仲丁醇、正戊醇、正己醇、乙二醇、丙二醇或丙三醇;所述的脂环醇类溶剂选自环戊醇、环戊甲醇、环己醇、环己甲醇或环己乙醇;所述芳香醇类溶剂选自苯甲醇、苯乙醇或苯丙醇;
(2)酮类溶剂,选自脂肪酮类及环酮类溶剂,所述的脂肪酮类溶剂选自甲乙酮、甲基异丙基酮、丙酮、甲基丁酮或甲基异丁酮;所述的环酮类溶剂选自环丙酮、环己酮、异佛尔酮或n-甲基吡咯烷酮;
(3)腈类溶剂,选自乙腈或丙腈;
(4)醚类溶剂,选自脂肪醚类及环醚类溶剂,所述脂肪醚类溶剂选自乙醚、二丙醚、二异丙醚、甲基叔丁基醚、乙基丁基醚、乙基叔丁基醚、二丁醚或二戊醚,环醚类溶剂选自环氧乙烷、1,2-环氧丙烷、四氢呋喃、2-甲基呋喃、二氧戊环或1,4-二氧六环;
在某些优选的实施方案中,所述的马来酸盐晶型i的制备方法中,所述的有机溶剂选自:乙醇、乙腈、丙酮。
在某些优选的实施方案中,所述的马来酸盐晶型i的制备方法中,所述的一定温度选自40℃-80℃,优选50℃-70℃。
优选的加热温度为至样品溶解并变得清澈时的温度。
在某些优选的实施方案中,所述的马来酸盐晶型i的制备方法中,所述的一定当量选自0.9-1.5当量,优选1.0-1.2当量,更优选1.0当量。
在某些优选的实施方案中,所述的马来酸盐晶型i的制备方法中,所述的马来酸溶液是指马来酸溶于有机溶剂中形成的溶液,所述的有机溶剂与反应体系所用的有机溶剂相同或互溶。在某些优选的实施方案中,所述的晶型i的制备方法,其特征在于,反应结束后,经过析晶、分离、干燥得晶型i。
在某些优选的实施方案中,所述的析晶选自室温析晶或降温析晶。
在某些优选的实施方案中,所述的室温析晶选自室温搅拌析晶、室温放置析晶;所述的降温析晶选自自然冷却降温析晶、冰浴冷却降温析晶、制冷设备降温析晶;所述的分离选自常压过滤或减压抽滤。
在某些优选的实施方案中,所述的马来酸盐晶型i的制备方法中,所述制备过程可任选的在搅拌条件下进行,其中所述的搅拌,其搅拌方式选自机械搅拌、磁力搅拌;所述的制备过程包括加料过程、原料溶解过程、升温过程、反应发生过程、析晶过程。
在某些优选的实施方案中,所述的马来酸盐晶型i的制备方法中,所述的干燥选自室温下自然晾干、红外灯干燥、烘箱烘干、真空干燥器干燥,优选在真空条件下干燥;优选的干燥温度为30℃-100℃,优选30℃-80℃,优选35℃-70℃,优选40℃-65℃,优选35℃-50℃;干燥过程中可以任选的在不同温度进行多次干燥;优选的干燥时间为5h~48h,10h~36h,15h~24h。
本公开还提供了一种式(i)所示化合物的丙二酸盐晶型ii(简称晶型ii),其特征在于,其在使用cu-kα辐射,以2θ角度表示x-射线粉末衍射图在7.1±0.2°、11.8±0.2°、13.8±0.2°、14.6±0.2°、14.9±0.2°、16.0±0.2°、16.8±0.2°、17.9±0.2°、20.2±0.2°、22.8±0.2°、24.4±0.2°处有特征峰,
在某些实施方案中,所述的丙二酸盐晶型ii,其具有基本上如图5所示的使用cu-kα辐射获得的x-射线粉末衍射图。
在某些实施方案中,本公开还提供了一种药物组合物,其含有本公开所述的式(i)化合物的晶型i或晶型ii,以及任选的一种或多种药用载体和/或稀释剂。在某些实施方案中,本公开所述的药物组合物可以为药学上可接受的任一剂型,例如溶液剂、片剂、胶囊或注射剂,这些药物组合物可以通过注射途径给药或口服给药。在某些实施方案中,本公开所述的式(i)化合物的马来酸盐晶型i、丙二酸盐晶型ii或其药物组合物优选通过口服给药。
在某些实施方案中,本公开所述的含有式(i)化合物的马来酸盐晶型(例如马来酸盐晶型i)或丙二酸盐晶型(例如晶型ii)与任选的一种或多种药用载体和/或稀释剂的药物组合物可以为药学上可接受的任一剂型。以口服、肠胃外、直肠或经肺给药等方式施用于需要其的患者。用于口服给药时,可制成常规的固体制剂,如片剂、胶囊剂、丸剂、颗粒剂等;也可制成口服液体制剂,如口服溶液剂、口服混悬剂、糖浆剂等。制成口服制剂时,可以加入适宜的填充剂、粘合剂、崩解剂、润滑剂等。用于肠胃外给药时,可制成注射剂,包括注射液、注射用无菌粉末与注射用浓溶液。制成注射剂时,可采用现有制药领域中的常规方法生产,配制注射剂时,可以不加入添加剂,也可根据药物的性质加入适宜的添加剂。用于直肠给药时,可制成栓剂等。用于经肺给药时,可制成吸入剂或喷雾剂等。
在某些实施方案中,本公开所述的药物组合物还可以包含一种或多种额外的抗肿瘤剂和/或免疫抑制剂。所述额外的抗肿瘤剂和/或免疫抑制剂,选自下述中的一种或多种:甲氨蝶呤、卡培他滨、吉西他滨、去氧氟尿苷、培美曲塞二钠、帕唑帕尼、伊马替尼、埃罗替尼、拉帕替尼、吉非替尼、凡德他尼、赫赛汀、贝伐单抗、利妥昔单抗、曲妥珠单抗、紫杉醇、长春瑞滨、多西他赛、多柔比星、羟基喜树碱、丝裂霉素、表柔比星、吡柔比星、博来霉素、来曲唑、他莫西芬、氟维司群、曲谱瑞林、氟他胺、亮丙瑞林、阿那曲唑、异环磷酰胺、白消安、环磷酰胺、卡莫司汀、尼莫司汀、司莫司汀、氮芥、马法兰、瘤可宁、卡铂、顺铂、奥沙利铂、络铂、拓扑特肯、喜树碱、拓扑替康、依维莫司、西罗莫斯、特癌适、6-巯基嘌呤、6-硫鸟嘌呤、硫唑嘌呤、菌素d、柔红霉素、阿霉素、米托蒽醌、争光霉素、普卡霉素和氨鲁米特。
在某些实施方案中,本公开还提供了本公开式(i)化合物的马来酸盐晶型(例如晶型i)或者含马来酸盐晶型i的药物组合物在制备用于治疗和/或预防受试者中由cdk4/6激酶介导的癌症相关疾病的药物中的用途。
在某些实施方案中,本公开还提供了本公开式(i)化合物的丙二酸盐晶型(例如晶型ii)或者含晶型ii的药物组合物在制备用于治疗和/或预防受试者中由cdk4/6激酶介导的癌症相关疾病的药物中的用途。
在某些实施方案中,本公开还提供一种在有需要的哺乳动物中治疗和/或预防由cdk4/6激酶介导的癌症相关疾病的方法,该方法包括给有需要的哺乳动物施用治疗和/或预防有效量的本公开所述的式(i)化合物的马来酸盐晶型i或所述的含晶型i的药物组合物。
在某些实施方案中,本公开还提供一种在有需要的哺乳动物中治疗和/或预防由cdk4/6激酶介导的癌症相关疾病的方法,该方法包括给有需要的哺乳动物施用治疗和/或预防有效量的本公开所述的式(i)化合物的丙二酸盐晶型ii或所述的含有晶型ii的药物组合物。
在某些实施方案中,本公开还提供了所述的式(i)化合物的马来酸盐晶型i,其用于治疗和/或预防由cdk4/6激酶介导的癌症相关疾病的药物。
在某些实施方案中,本公开还提供了所述的式(i)化合物的丙二酸盐晶型ii,其用于治疗和/或预防由cdk4/6激酶介导的癌症相关疾病的药物。
本公开中,所述cdk4/6激酶介导的癌症相关疾病选自:脑瘤、肺癌、鳞状上皮细胞癌、膀胱癌、胃癌、卵巢癌、腹膜癌、胰腺癌、乳腺癌、头颈癌、子宫颈癌、子宫内膜癌、直肠癌、肝癌、肾癌、食管腺癌、食管鳞状细胞癌、前列腺癌、雌性生殖道癌、原位癌、淋巴瘤、神经纤维瘤、甲状腺癌、骨癌、皮肤癌、脑癌、结肠癌、睾丸癌、胃肠道间质瘤、前列腺肿瘤、肥大细胞肿瘤、多发性骨髓瘤、黑色素瘤、胶质瘤、肉瘤。
本公开所用的术语“约”,例如在用于修饰某一数值或数值范围时,是指包括该数值或数值范围以及该数值或数值范围的本领域技术人员可接受的误差范围,例如该误差范围为±10%、±5%、±4%、±3%、±2%、±1%、±0.5%等。
本公开所述的有机溶剂中“两种以上溶剂之间的任一组合”是指有机溶剂中同一种类或不同种类的溶剂按照一定比例混合形成的溶剂。同一种类溶剂形成的混合溶剂,包括但不限于以下具体实例:甲醇/乙醇、甲醇/异丙醇、甲醇/乙醇/异丙醇、甲醇/叔丁醇、甲醇/环戊醇、甲醇/苯甲醇、乙醇/异丙醇、乙醇/叔丁醇、乙醚/四氢呋喃等。所述的不同种类溶剂形成的混合溶剂,包括但不限于以下混合溶剂体系:醇类/酮类、醇类/醚类、醇类/酯类、酮类/酯类等。
当用于上述治疗和/或预防或其他治疗和/或预防时,治疗和/或预防有效量的本公开式(i)化合物的马来酸盐晶型i或丙二酸盐晶型ii,可以以纯形式应用。或者以含有式(i)化合物的马来酸盐晶型i与一种或多种药物可接受赋形剂的药物组合物给药;或者以含有式(i)化合物的丙二酸盐晶型ii与一种或多种药物可接受赋形剂的药物组合物给药。词语“治疗和/或预防有效量”的本公开所述式(i)化合物的马来酸盐晶型i或丙二酸盐晶型ii指以适用于任何医学治疗和/或预防的合理效果/风险比治疗障碍的足够量的化合物。但应认识到,本公开所述式(i)化合物的马来酸盐晶型i、丙二酸盐晶型ii和药物组合物的总日用量须由主诊医师在可靠的医学判断范围内作出决定。对于任何具体的患者,具体的治疗有效剂量水平须根据多种因素而定,所述因素包括所治疗的障碍和该障碍的严重程度;所采用的具体化合物或其结晶型的活性;所采用的具体组合物;患者的年龄、体重、一般健康状况、性别和饮食;所采用的具体化合物或其结晶型的给药时间、给药途径和排泄率;治疗持续时间;与所采用的具体化合物或其结晶型组合使用或同时使用的药物;及医疗领域公知的类似因素。例如,本领域的做法是,化合物或其结晶型的剂量从低于为得到所需治疗效果而要求的水平开始,逐渐增加剂量,直到得到所需的效果。
本公开所述式(i)化合物的马来酸盐晶型i或丙二酸盐晶型ii可以单独或以药物组合物的形式给药。本公开所述的药物组合物可根据给药途径配成各种适宜的剂型。使用一种或多种生理学上可接受的载体,包含赋形剂和助剂,它们有利于将活性化合物或其结晶型加工成可以在药学上使用的制剂。适当的制剂形式取决于所选择的给药途径,可以按照本领域熟知的常识进行制造。
本公开式(i)化合物的晶型i、晶型ii的主要优点包括:
(1)制备方法操作简便,适合工业化生产;
(2)具有良好的性状、流动性、可压性、崩解和溶出性质,便于生产、检测、制剂制备、运输和储藏;
(3)纯度高、残留溶剂少,溶解度较高,稳定性好,质量易控;
(4)对cdk4/6酶具有良好的抑制活性,在体内具有良好暴露量和/或生物利用度;
(5)具有良好的体内外药效,可用于治疗和/或预防cdk4/6激酶介导的癌症相关疾病。
附图说明
此处所说明的附图用来提供对本公开的进一步理解,构成本申请的一部分,本公开的示意性实施例及其说明用于解释本公开,并不构成对本公开的不当限定。在附图中:
图1是式(i)化合物晶型i的x-射线粉末衍射(xrpd)图谱,纵坐标表示衍射强度(intensity),横坐标表示衍射角度(2θ)。
图2是式(i)化合物的晶型i的dsc分析图,纵坐标表示热流(w/g),横坐标表示温度t(℃)。
图3是式(i)化合物的晶型i的tga分析图,纵坐标表示重量(%),横坐标表示温度t(℃)。
图4是式(i)化合物晶型i的1h-nmr图谱。
图5是式(i)化合物的丙二酸盐晶型ii的x-射线粉末衍射(xrpd)图谱,纵坐标表示衍射强度(intensity),横坐标表示衍射角度(2θ)。
图6是式(i)化合物的丙二酸盐晶型ii的1h-nmr图谱。
具体实施方式
下面结合本公开的具体实施例来进一步说明本公开的实质性内容,应理解,以下实施例仅用于说明本公开,但并不以此来限定本公开的保护范围。下面实施例中未注明具体条件者,按照常规条件或制造商建议的进行。所用药品或试剂未注明生产厂商者,均为可以通过市购获得的常规产品。
虽然以下实施例中所使用的许多材料和操作方法是本领域公知的,但是本公开仍然在此作尽可能详细描述。本领域技术人员清楚,如果未特别说明,下面实施例中所用的材料和操作方法是本领域公知的。
以下实施例或实验例中所用到的式(i)化合物按照专利申请pct/cn2014/095615中公开的制备方法制备获得。
制备实施例:
式(i)化合物的马来酸盐晶型i的制备方法
制备方法一:取式(i)化合物(150mg),溶清于乙醇(1ml)中,加入马来酸(34.4mg,1eq),析出固体,继续搅拌15h,抽滤,所得固体经50℃真空干燥16h,所得固体经xrpd测试,为晶型i,1hnmr显示无溶剂残留。
制备方法二:取式(i)化合物(300mg),加入乙醇(6ml),升温至70℃,0.5h内溶清。马来酸(68.8mg,1eq)室温下溶清于乙醇(2ml),然后一次性加入到式(i)化合物的乙醇溶液中,搅拌3.0h后自然降至室温,抽滤,所得固体经50℃真空干燥15h,经xrpd、1h-nmr分析,所得固体为晶型i。
式(i)化合物的丙二酸盐晶型ii的制备方法
取式(i)化合物(150mg),溶清于乙醇(1ml)中,搅拌1.0h,加入丙二酸(31mg,1eq),析出白色固体,搅拌5.0h后抽滤,所得固体经50℃真空干燥16h,所得固体经xrpd、1h-nmr分析,为晶型ii。
xrpd测试
仪器名称:x射线粉末衍射仪;型号:d2;厂家:bruker。
x射线反射参数:cu,kα;入射狭缝:0.6mm;发散狭缝:1mm;扫描模式:连续;扫描范围:3.0~45.0度;取样步长:0.02度;每步扫描时间:0.3s;探测器角度:2.0度。
式(i)化合物的马来酸盐晶型i的x-射线粉末衍射图示于图1中,该晶型在以下衍射2θ角度处有峰:5.2±0.2°、7.1±0.2°、10.5±0.2°、11.2±0.2°、12.1±0.2°、13.6±0.2°、15.9±0.2°、16.9±0.2°、17.5±0.2°、18.7±0.2°、22.6±0.2°、23.7±0.2°、24.3±0.2°、25.1±0.2°、28.4±0.2°。
差示扫描量热法
通过差示扫描量热法(dsc)研究式(i)化合物的晶型i的固态热性能。
仪器名称:差示扫描量热仪;型号:q2000;厂家:ta。
测定条件:用氮气以50毫升/分钟吹扫,在25℃至250℃之间以10℃/分钟加热速率收集数据,在吸热峰朝下的情况下绘图。
测定结果:式(i)化合物的晶型i在165℃至220℃范围内出现吸热峰,其差示扫描量热分析图如图2所示。
热重分析
仪器名称:热重分析仪;型号:q50;厂家:ta。
测试条件:用氮气以60毫升/分钟吹扫,在室温至350℃之间以10℃/分钟加热速率收集数据。
测定结果:式(i)化合物的马来酸盐晶型i的tga曲线如图3所示。
核磁分析(1h-nmr)
仪器:brukeradvanceiii400;溶剂:氘代dmso。
测定结果:式(i)化合物的马来酸盐晶型i的1h-nmr如图4所示。
性质测试试验例:
实验例1晶型i的性质考察
1)晶型i的稳定性试验
供试品:式(i)化合物的马来酸盐晶型i,按照上述制备方法一或二制备。
实验方法:将供试品在高湿(25℃/rh92.5%或40℃/rh75%)开口条件下,60℃-闭口和紫外光照(4500lx±500lx)开口条件下放置10天,分别于第5、10天取样测定纯度、有关物质及xrpd,与0天的样品进行比较。
纯度及有关物质测定:按照《中国药典》2010年版二部附录vd高效液相色谱法测定。
xrpd测定:按照《中国药典》2010年版二部附录ixfx射线粉末衍射法测定。
式(i)化合物的马来酸盐晶型i的稳定性实验结果如表1所示。
表1式(i)化合物的马来酸盐晶型i稳定性考察结果
2)式(i)化合物无定型及马来酸盐晶型i的引湿性试验
供试品:
式(i)化合物,按照专利pct/cn2014/095615中说明书实施例1的制备方法制备。
式(i)化合物的马来酸盐晶型i,按照上述制备方法一或二制备。
测定方法:依据中国药典2015年版四部通则9103药物引湿性试验指导原则测定。
引湿性实验结果见表2。
表2引湿性检测结果
实验例2式(i)化合物无定型的稳定性考察
供试品:式(i)化合物(即无定型),按照专利pct/cn2014/095615中说明书公开的制备方法制备。
实验方法:
将供试品在25℃/rh92.5%条件下或60℃条件下放置10天,分别于第5、10天取样;将供试品在光照(4500lx±500lx)开口条件下或40℃/rh75%条件下放置10天,于第10天取样,测定有关物质及xrpd,与0天的样品进行比较。
有关物质:按照《中国药典》2015年版二部附录vd高效液相色谱法测定。
xrpd测定:《中国药典》2015年版四部0451x射线衍射法。
式(i)化合物无定型的稳定性实验结果见表3。
表3无定型的稳定性考察结果
实验结论:
在稳定性测试条件下,马来酸盐晶型i的性状、有关物质、xrpd等性质均无明显变化;而无定型在光照条件下,有关物质增长迅速,高达10.54%。
上述结果表明,与式(i)化合物(即无定型)相比,本公开的马来酸盐晶型i显示出更好的稳定性和低吸湿性特点,更加便于药品的生产、制剂的制备、运输和储藏,更有利于保证药物使用的稳定性和安全性。
实验例3本发明化合物的比格犬体内药代动力学实验
供试品:式(i)化合物的马来酸盐晶型i,按照上述制备方法一或二制备。
受试动物:雄性比格犬,3只,体重9-12kg/只。
供试品给药药液的制备:
溶解方案:
po(口服)给药:枸橼酸与磷酸氢二钠溶液配制成ph4.0的缓冲液。
空白溶媒的配制:
ph4.0缓冲液的配制方法:甲液:称取枸橼酸(21g),加入纯化水溶解成1000ml溶液。乙液:称取磷酸氢二钠(28.652g),加入纯化水溶解成400ml溶液。取甲液614.5ml,乙液385.5ml,搅拌均匀即得。
给药药液的配制:
取供试品(569.55mg),加入195.051ml上述溶媒,加热超声溶解,搅拌均匀,即得浓度为2mg/ml的给药混悬液,作为比格犬po给药药液。
实验方法
给药方法:
供试品给药剂量为10mg/kg,给药浓度为2mg/ml,给药体积为5ml/kg。
采血时间点:
给药后0.167h、0.5h、1h、2h、4h、6h、8h、24h、30h、48h、54h
每个时间点通过前肢静脉采集200μl左右的全血,放置到含有edta-k2抗凝剂的抗凝管中,全血样品在4℃条件下8000转/分钟离心6分钟得到血浆样品,置于-80℃冰箱冻存。
血浆样品分析:
采用蛋白沉淀法:取血浆30μl,加入内标(含西地那非25ng/ml的乙腈溶液)200μl,涡旋10分钟后,4000转/分钟离心20分钟,取上清液100μl,再加入100μl纯净水,涡旋混匀3分钟后,lc-ms/ms分析。
实验结果
表4比格犬pk评价结果(po)
auc0-t代表药时曲线下面积0→t(最后一个时间点54h);auc0-∞代表药时曲线下面积0→∞;代表药时曲线下面积0→54h;tmax代表血药浓度达峰时间;cmax代表血药浓度达峰浓度;t1/2代表消除半衰期。
实验结论
由表4的实验结果可知,本发明式(i)化合物的马来酸盐晶型i的药代动力学性质良好,在测试动物体内,半衰期长,暴露量高。
最后应当说明的是:以上实施例仅用以说明本公开的技术方案而非对其限制;尽管参照较佳实施例对本公开进行了详细的说明,所属领域的普通技术人员应当理解:依然可以对本公开的具体实施方式进行修改或者对部分技术特征进行等同替换;而不脱离本公开技术方案的精神,其均应涵盖在本公开请求保护的技术方案范围当中。
- 还没有人留言评论。精彩留言会获得点赞!
- 抑制EGFR基因表达的siRNA及其应用
- 新型表皮生长因子受体抑制剂及其应用
- 作为t790变异抑制剂的嘧啶衍生物的制作方法
- 作为egfr-t790m激酶抑制剂的取代的嘧啶类化合物的制作方法
- 一种含酪氨酸激酶抑制剂的药物组合物及其在制备抗肿瘤转移药物中的应用
- 一种含egfr酪氨酸激酶的低剂量药物组合物及其在制备预防肿瘤转移药物中的应用
- 一种Eph激酶多肽抑制剂及其应用
- 酪氨酸激酶抑制剂类靶向用药指导抗体芯片和检测方法
- 一种作用于EGFR敏感突变激酶EGFR<sup>L858R</sup>,EGFR<sup>(d746-750)</sup>的6-取代氨基嘌呤类化合物及 ...的制作方法
- 一种制备布鲁顿酪氨酸激酶(btk)激酶抑制剂的制备方法