具有酪氨酸激酶抑制活性的1,2,3-噻二唑类药物分子及其制备方法和应用与流程
本发明属于抑制剂类药物合成技术领域,具体涉及一种具有酪氨酸激酶抑制活性的1,2,3-噻二唑类药物分子及其制备方法和应用。
背景技术:
杂环化合物数量特别多,广泛分布在在自然界中,在生物的发展、成长等过程中起重大的作用。十九世纪初期,杂环化合物的获得多为天然产物的提取,但是由此得到的化合物产量很低,纯度不高,而且价格昂贵;随着有机合成技术的发展,为了充分利用杂环类化合物,化学工作者开始进行了大规模人工合成杂环类化合物,使其得到了广泛的应用,其中包括生物医药、储能材料、生物模拟材料,高性能染料等。其中含氮杂环化合物作为重要的杂环化合物,由于其具有独特的结构从而具有广谱的生物活性及药理活性,例如含氮杂环类化合物具有杀菌、抗病毒、抗肿瘤等生物活性,可以作为很多药物的先导化合物骨架在,医药创制领域有着重要的作用。
几十年来,杂环化合物如嘧啶、吡咯、噻唑和咪唑等及其衍生物因具有较高的生物活性,而被广泛应用于医药、农业及材料等领域,逐渐引起化学家们的关注。噻二唑是众多唑类杂环化合物中的重要一员,具有较多的生物和药理活性。噻二唑是含有n、s杂原子的五元杂环化合物,目前噻二唑及其衍生物广泛用于生物、医药等领域,尤其在抗菌、抗肿瘤、抗癌等方面的研究已取得重大突破;例如1,3,4-噻二唑类衍生物是含有氮和硫杂原子的五元化合物,具有杀菌、杀虫、抗癌、除草、抗病毒等广泛的生物活性;此外,1,3,4-噻二唑类衍生物还具有抗结核、抗惊厥、植物生长调节等活性,可作为止痛药、抗传染药、抑制增生的药物等。1,3,4-噻二唑类化合物在农药方面也被广泛应用,例如,杀菌剂中防治水稻自叶枯病的叶青双;除草剂中,如丁硫咪唑酮、拜尔公司研究开发的fluthiamidep、诺华公司开发的fluthiacetmethy,尤其后者,苗后4~15g/ha的施用量,能完全控制玉米和马铃薯中的阔叶杂草;在杀虫剂方面如用于防治卫生害虫的几噻唑,2.5ppm浓度下,7d内100%杀死亚热带粘虫的幼虫。2009年,xiao等设计合成了2-氨基-5-(2,4-二氯苯氧基)甲基-1,3,4-噻二唑酰胺类化合物,抑菌活性测试表明:部分目标化合物有一定的抑菌活性,其中化合物1、2对麦类黑变病菌的抑制率分别为88%、71%;化合物3、4对炭疽菌抑制率分别为68.70%、66.94%。
同样,1,2,3-噻二唑也是一种重要的、具有广泛生物活性的噻二唑类化合物,由于其化学结构中s原子直接与n原子相连,化学制备方法稳定性较差,合成工艺比较困难,目前关于1,2,3-噻二唑类化合物的研究报道比较少,但是由于1,2,3-噻二唑结构的特殊性以及优越的生物活性,对其进行研究有重要意义。
技术实现要素:
本发明解决的技术问题是提供了一种具有酪氨酸激酶抑制活性的1,2,3-噻二唑类药物分子及其制备方法和应用
本发明为解决上述技术问题采用如下技术方案,一种具有酪氨酸激酶抑制活性的1,2,3-噻二唑类药物分子的结构为:
本发明为解决上述技术问题采用如下技术方案,一种具有酪氨酸激酶抑制活性的1,2,3-噻二唑类药物分子的制备方法,其特征在于具体包括以下步骤:
(1)4-甲氧基苯乙醛与水合肼和碳酸二甲酯经缩合反应得到4-甲氧基苯亚乙基肼基甲酸甲酯;
(2)4-甲氧基苯亚乙基肼基甲酸甲酯与硫试剂发生成环反应得到4-甲氧基苯基-1,2-3-噻二唑;
(3)4-甲氧基苯基-1,2-3-噻二唑经有机锂试剂拔氢后与3-氯丙酰氯反应得到4-(4-甲氧基苯基)-5-氯丙酮基-1,2-3-噻二唑;
(4)4-(4-甲氧基苯基)-5-氯丙酮基-1,2-3-噻二唑与3,4-二甲氧基苯胺发生取代反应后在催化剂作用下经过亚胺的亲核加成反应得到目标化合物。
步骤(1)为:在带有分水器的多口反应瓶中,把一定量的含量为80%的水合肼和碳酸二甲酯加入甲苯,搅拌均匀后缓慢升温至回流,通过分水器分出反应体系带有及产生的水分,通过观察回流反应过程中分水器中不在出现水分,冷却至室温,向反应体系中加入一定量的碱性化合物和4-甲氧基苯乙醛,然后在氮气保护下,继续升温至回流,通过分水器及时除去反应过程中生成的水分,反应结束后趁热过滤反应液,滤液倒入冰水中,通过冰乙酸调节反应液ph为7~8,然后用乙酸乙酯萃取反应液多次,合并有机相后经无水硫酸镁干燥后浓缩得到4-甲氧基苯亚乙基肼基甲酸甲酯;所述的4-甲氧基苯乙醛与水合肼和碳酸二甲酯的投料量摩尔比为1:2:1~1.2;所述的碱性化合物为无水氢氧化钡、氢氧化钠或甲醇钠;所述的4-甲氧基苯乙醛与碱性化合物的投料量摩尔比为1:0.5~1;
步骤(2)为采用以下两种方法中的一种:
a、在多口反应瓶中,把一定量的4-甲氧基苯亚乙基肼基甲酸甲酯和1,8-二氮杂二环十一碳-7-烯和单质硫加入到二氯甲烷中,搅拌均匀后,在一定反应温度下和氮气保护下,向反应液滴加氯化亚砜,滴加完后,缓慢升至室温,在室温条件下搅拌反应一段时间,通过流动氮气排出反应体系所生成的气体,控制反应温度在室温左右,反应结束后向反应液中倒入冰水,搅拌均匀后分出有机相,水箱再用二氯甲烷萃取多次,合并有机相,再经无水硫酸镁干燥后浓缩经硅胶柱层析分离得到4-甲氧基苯基-1,2-3-噻二唑;所述的反应温度为0℃;所述的4-甲氧基苯亚乙基肼基甲酸甲酯与1,8-二氮杂二环十一碳-7-烯和单质硫与氯化亚砜的投料量摩尔比为1:1~1.1:2~2.1:2~2.1
b、在密闭的反应器中,把无水醋酸铜和有机酸加入到二甲基亚砜中,搅拌均匀后,再加入4-甲氧基苯亚乙基肼基甲酸甲酯和硫代硫酸钾,真空除去反应器中的空气,通入氧气,使反应器中的压力达到一定数值再缓慢加热到一定温度,反应结束后缓慢降至室温,减压整除未反应完的有机酸,然后向反应液中加入一定量的水,然后用乙酸乙酯萃取反应液多次,合并有机相,再用氯化钠溶液洗涤有机相,浓缩后经硅胶柱层析分离得到4-甲氧基苯基-1,2-3-噻二唑;所述的4-甲氧基苯亚乙基肼基甲酸甲酯与无水醋酸铜与硫代硫酸钾的投料量摩尔比为1:0.5:1;所述的有机酸为甲酸或乙酸;所述的反应压力为0.1~0.2mpa;所述的反应温度为100~120℃。
步骤(3)为:在多口反应瓶中,在-40℃条件下,氮气保护下,把一定量的4-甲氧基苯基-1,2-3-噻二唑加入到无水四氢呋喃中,搅拌均匀后向反应液中缓慢滴加溶有一定量有机锂试剂的四氢呋喃溶液,滴加完后在-40℃条件下搅拌一段时间,在升温至-20℃搅拌反应一段时间,在该温度条件下加入溶有3-氯丙酰氯的四氢呋喃溶液,滴加完后升温至0℃,继续搅拌一段时间,然后向反应液中加入水淬灭反应,向反应液中加入二氯甲烷,搅拌均匀后分出有机相,谁想用稀盐酸调节ph为中性后,再用二氯甲烷萃取多次,合并有机相,用无水硫酸镁干燥后浓缩得到4-(4-甲氧基苯基)-5-氯丙酮基-1,2-3-噻二唑;所述的有机锂试剂为甲基锂或正丁基锂;所述的4-甲氧基苯基-1,2-3-噻二唑与有机锂试剂与3-氯丙酰氯的投料量摩尔比为1:1.5:1。
步骤(4)为:把一定量的4-(4-甲氧基苯基)-5-氯丙酮基-1,2-3-噻二唑和3,4-二甲氧基苯胺和三乙胺加入二氯甲烷中,在室温条件下搅拌均匀后加热至70℃搅拌反应一段时间,然后向过滤反应液,分出有机相,水相用二氯甲烷萃取多次,合并有机相,再经无水硫酸镁干燥后浓缩后加入二氯甲烷和1,4-二氧六环的混合溶液中,搅拌均匀后再加入一定量的催化剂和催化辅助剂,反应温度升至80℃,反应结束后冷却至室温,向反应液中加入水,然后过滤反应液,在真空条件下蒸除溶剂二氯甲烷和1,4-二氧六环,再用二氯甲烷萃取反应液多次,合并有机相,经无水硫酸镁干燥后浓缩后经硅胶柱层析分离得到目标化合物;所述的4-(4-甲氧基苯基)-5-氯丙酮基-1,2-3-噻二唑与催化剂和催化辅助剂的投料量摩尔比为1:0.1:0.2;所述的4-(4-甲氧基苯基)-5-氯丙酮基-1,2-3-噻二唑与3,4-二甲氧基苯胺与三乙胺的投料量摩尔比为1:1:1;所述的催化剂为三氟甲磺酸铜,六水合高氯酸镍,高氯酸镁或六水合高氯酸锌;所述的催化辅助剂为碳酸铜。
本发明具有的有益效果:本发明通过新方法合成了一种结构新颖的1,2,3-噻二唑类药物分子,并通过抗肿瘤活性测试以及酪氨酸激酶抑制活性测试,发现目标化合物对肝癌smmc7721细胞有一定抑制作用,并且对野生性egfr激酶具有一定抑制作用。
附图说明
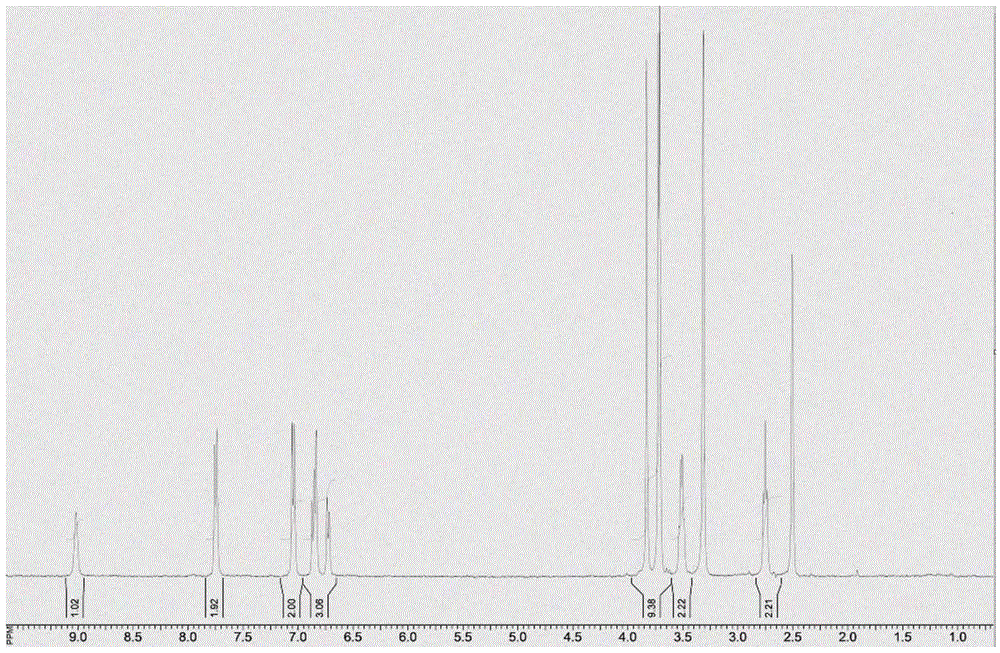
图1是目标化合物的核磁氢谱图。
具体实施方式
以下通过实施例对本发明的上述内容做进一步详细说明,但不应该将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容实现的技术均属于本发明的范围。
实施例1
在带有分水器的多口反应瓶中,把含量为80%的水合肼13g和碳酸二甲酯9g加入甲苯200ml,搅拌均匀后缓慢升温至回流,通过分水器分出反应体系带有及产生的水分,通过观察大约回流反应3h,分水器中不在出现水分,冷却至室温,向反应体系中加入无水氢氧化钡9.5g和4-甲氧基苯乙醛15g,然后在氮气保护下,继续升温至回流,通过分水器及时除去反应过程中生成的水分,大约回流反应5h,,然后趁热过滤反应液,滤液倒入冰水中,通过冰乙酸调节反应液ph为7~8,然后用乙酸乙酯萃取反应液多次,合并有机相后经无水硫酸镁干燥后浓缩得到4-甲氧基苯亚乙基肼基甲酸甲酯17.3g;1hnmr(400mhz,dmso-d6):δ9.67(s,1h),8.05(d,j=4.0hz,1h),7.69(d,j=8.0hz,2h),7.35(d,j=8.0hz,2h),3.76(s,3h),3.42(s,3h),2.93(t,j1=8.0hz,j2=8.0hz,2h),ms(esi)m/z:223.8(m+h+)。
实施例2
在带有分水器的多口反应瓶中,把含量为80%的水合肼13g和碳酸二甲酯9g加入甲苯200ml,搅拌均匀后缓慢升温至回流,通过分水器分出反应体系带有及产生的水分,通过观察大约回流反应3h,分水器中不在出现水分,冷却至室温,向反应体系中加入甲醇钠5.5g和4-甲氧基苯乙醛15g,然后在氮气保护下,继续升温至回流,通过分水器及时除去反应过程中生成的水分,大约回流反应5h,tlc监控4-甲氧基苯乙醛反应完全,然后趁热过滤反应液,滤液倒入冰水中,通过冰乙酸调节反应液ph为7~8,然后用乙酸乙酯萃取反应液多次,合并有机相后经无水硫酸镁干燥后浓缩得到4-甲氧基苯亚乙基肼基甲酸甲酯19.6g;1hnmr(400mhz,dmso-d6):δ9.67(s,1h),8.05(d,j=4.0hz,1h),7.69(d,j=8.0hz,2h),7.35(d,j=8.0hz,2h),3.76(s,3h),3.42(s,3h),2.93(t,j1=8.0hz,j2=8.0hz,2h),ms(esi)m/z:223.8(m+h+)。
实施例3
在带有分水器的多口反应瓶中,把含量为80%的水合肼13g和碳酸二甲酯9g加入甲苯200ml,搅拌均匀后缓慢升温至回流,通过分水器分出反应体系带有及产生的水分,通过观察大约回流反应3h,分水器中不在出现水分,冷却至室温,向反应体系中加入氢氧化钠4g和4-甲氧基苯乙醛15g,然后在氮气保护下,继续升温至回流,通过分水器及时除去反应过程中生成的水分,大约回流反应5h,然后趁热过滤反应液,滤液倒入冰水中,通过冰乙酸调节反应液ph为7~8,然后用乙酸乙酯萃取反应液多次,合并有机相后经无水硫酸镁干燥后浓缩得到4-甲氧基苯亚乙基肼基甲酸甲酯15.9g;1hnmr(400mhz,dmso-d6):δ9.67(s,1h),8.05(d,j=4.0hz,1h),7.69(d,j=8.0hz,2h),7.35(d,j=8.0hz,2h),3.76(s,3h),3.42(s,3h),2.93(t,j1=8.0hz,j2=8.0hz,2h),ms(esi)m/z:223.8(m+h+)。
实施例4
在多口反应瓶中,把4-甲氧基苯亚乙基肼基甲酸甲酯22g和1,8-二氮杂二环十一碳-7-烯15g和单质硫6.5g加入到二氯甲烷中,搅拌均匀后,在0℃条件下和在氮气保护下,向反应液滴加氯化亚砜24g,滴加完后,缓慢升至室温,在室温条件下搅拌反应1h,通过流动氮气排出反应体系所生成的气体,控制反应温度在室温左右,tlc监控原料反应完全后,向反应液中倒入冰水50ml,搅拌10min,分出有机相,水相再用二氯甲烷萃取多次,合并有机相,再用活性炭脱色,再经无水硫酸镁干燥后浓缩经硅胶柱层析分离得到4-甲氧基苯基-1,2-3-噻二唑14.5g;1hnmr(400mhz,dmso-d6):δ8.41(s,1h),7.62(d,j=8.0hz,2h),7.27(d,j=8.0hz,2h),3.71(s,3h),ms(esi)m/z:193.5(m+h+)。
实施例5
在密闭的反应器中,把无水醋酸铜9g和乙酸30ml加入到二甲基亚砜200ml中,搅拌均匀后,再加入4-甲氧基苯亚乙基肼基甲酸甲酯22g和硫代硫酸钾19g,真空除去反应器中的空气,通入氧气,使反应器中的压力达到0.2mpa,缓慢加热到120℃,搅拌反应4h,hplc监控4-甲氧基苯亚乙基肼基甲酸甲酯在反应体系中的剩余量小于2%,缓慢降至室温,减压整除未反应完的乙酸,然后向反应液中加入水300ml,然后用乙酸乙酯100ml萃取反应液多次,合并有机相,再用氯化钠溶液洗涤有机相,浓缩后经硅胶柱层析分离得到4-甲氧基苯基-1,2-3-噻二唑17.7g;1hnmr(400mhz,dmso-d6):δ8.41(s,1h),7.62(d,j=8.0hz,2h),7.27(d,j=8.0hz,2h),3.71(s,3h),ms(esi)m/z:193.5(m+h+)。
实施例6
在密闭的反应器中,把无水醋酸铜18g和乙酸30ml加入到二甲基亚砜200ml中,搅拌均匀后,再加入4-甲氧基苯亚乙基肼基甲酸甲酯22g和硫代硫酸钾19g(0.1mol),真空除去反应器中的空气,通入氧气,使反应器中的压力达到0.2mpa,缓慢加热到120℃,搅拌反应4h,缓慢降至室温,减压整除未反应完的乙酸,然后向反应液中加入水300ml,然后用乙酸乙酯100ml萃取反应液多次,合并有机相,再用氯化钠溶液洗涤有机相,浓缩后经硅胶柱层析分离得到4-甲氧基苯基-1,2-3-噻二唑15.2g;1hnmr(400mhz,dmso-d6):δ8.41(s,1h),7.62(d,j=8.0hz,2h),7.27(d,j=8.0hz,2h),3.71(s,3h),ms(esi)m/z:193.5(m+h+)
实施例7
在密闭的反应器中,把无水醋酸铜9g和甲酸30ml加入到二甲基亚砜200ml中,搅拌均匀后,再加入4-甲氧基苯亚乙基肼基甲酸甲酯22g和硫代硫酸钾19g,真空除去反应器中的空气,通入氧气,使反应器中的压力达到0.2mpa,缓慢加热到120℃,搅拌反应4h,缓慢降至室温,减压整除未反应完的甲酸,然后向反应液中加入水300ml,然后用乙酸乙酯100ml萃取反应液多次,合并有机相,再用氯化钠溶液洗涤有机相,浓缩后经硅胶柱层析分离得到4-甲氧基苯基-1,2-3-噻二唑12.8g;1hnmr(400mhz,dmso-d6):δ8.41(s,1h),7.62(d,j=8.0hz,2h),7.27(d,j=8.0hz,2h),3.71(s,3h),ms(esi)m/z:193.5(m+h+)。
实施例8
在多口反应瓶中,在-40℃条件下,氮气保护下,把4-甲氧基苯基-1,2-3-噻二唑20g加入到无水四氢呋喃150ml中,搅拌均匀后向反应液中缓慢滴加溶有甲基锂33g的四氢呋喃溶液150ml,滴加完后在-40℃条件下搅拌1.5h,在升温至-20℃搅拌反应1h,在该温度条件下加入溶有3-氯丙酰氯13g的四氢呋喃溶液100ml,大约2h滴加完全,滴加完后升温至0℃,继续搅拌30min,然后向反应液中加入水50min,淬灭反应,向反应液中加入二氯甲烷200ml,搅拌均匀后分出有机相,谁想用稀盐酸调节ph为中性后,再用二氯甲烷萃取多次,合并有机相,用无水硫酸镁干燥后浓缩得到4-(4-甲氧基苯基)-5-氯丙酮基-1,2-3-噻二唑23g;ms(esi)m/z:283.9(m+h+);元素分析计算值[c12h11cln2o2s]:c,50.97;h,3.92;n,9.91;实测值:c,50.65;h,3.99;n,9.84。
实施例9
在多口反应瓶中,在-40℃条件下,氮气保护下,把4-甲氧基苯基-1,2-3-噻二唑20g加入到无水四氢呋喃150ml中,搅拌均匀后向反应液中缓慢滴加溶有正丁基锂13g的四氢呋喃溶液150ml,滴加完后在-40℃条件下搅拌1.5h,在升温至-20℃搅拌反应1h,在该温度条件下加入溶有3-氯丙酰氯13g的四氢呋喃溶液100ml,大约2h滴加完全,滴加完后升温至0℃,继续搅拌30min,然后向反应液中加入水50min,淬灭反应,向反应液中加入二氯甲烷200ml,搅拌均匀后分出有机相,谁想用稀盐酸调节ph为中性后,再用二氯甲烷萃取多次,合并有机相,用无水硫酸镁干燥后浓缩得到4-(4-甲氧基苯基)-5-氯丙酮基-1,2-3-噻二唑18.1g;ms(esi)m/z:283.9(m+h+);元素分析计算值[c12h11cln2o2s]:c,50.97;h,3.92;n,9.91;实测值:c,50.65;h,3.99;n,9.84
实施例10
在多口反应瓶中,把4-(4-甲氧基苯基)-5-氯丙酮基-1,2-3-噻二唑28g和3,4-二甲氧基苯胺15g和三乙胺10g加入二氯甲烷300ml中,在室温条件下搅拌30min,加热至70℃搅拌反应50min,然后向过滤反应液,分出有机相,水相用二氯甲烷30ml萃取多次,合并有机相,再经无水硫酸镁干燥后浓缩后加入二氯甲烷200ml和1,4-二氧六环200ml的混合溶液中,搅拌均匀后再加入三氟甲磺酸铜3.6g和碳酸铜2.5g,反应温度升至80℃,反应3h后冷却至室温,向反应液中加入水50ml,然后过滤反应液,在真空条件下蒸除溶剂二氯甲烷和1,4-二氧六环,再用二氯甲烷萃取反应液多次,合并有机相,经无水硫酸镁干燥后浓缩后经硅胶柱层析分离得到目标化合物27.3g;1hnmr(400mhz,dmso-d6):9.03(s,1h,nh-1h),7.74(d,j=8.0hz,2h,ar-2h),7.04(d,j=8.0hz,2h,ar-2h),6.88-6.69(m,3h)[“6.85(t,j1=4.0hz,j2=4.0hz,2h,ar-2h),6.71(d,j=8.0hz,1h,ar-1h)”],3.84(s,3h,och3-3h),3.72(d,j=4.0hz,6h,2och3-6h),3.51(d,j=4.0hz,2h,ch2-2h),2.72(t,j1=4.0hz,j2=4.0hz,2h,ch2-2h);元素分析计算值[c20h21n3o4s]:c,60.13;h,5.30;n,10.52;实测值:c,60.47;h,5.25;n,10.39。
实施例11
在多口反应瓶中,把4-(4-甲氧基苯基)-5-氯丙酮基-1,2-3-噻二唑28g和3,4-二甲氧基苯胺15g和三乙胺10g加入二氯甲烷300ml中,在室温条件下搅拌30min,加热至70℃搅拌反应50min,然后向过滤反应液,分出有机相,水相用二氯甲烷30ml萃取多次,合并有机相,再经无水硫酸镁干燥后浓缩后加入二氯甲烷200ml和1,4-二氧六环200ml的混合溶液中,搅拌均匀后再加入六水合高氯酸镍3.6g和碳酸铜2.5g,反应温度升至80℃,反应3h后冷却至室温,向反应液中加入水50ml,然后过滤反应液,在真空条件下蒸除溶剂二氯甲烷和1,4-二氧六环,再用二氯甲烷萃取反应液多次,合并有机相,经无水硫酸镁干燥后浓缩经硅胶柱层析分离得到目标化合物22.9g;1hnmr(400mhz,dmso-d6):9.03(s,1h,nh-1h),7.74(d,j=8.0hz,2h,ar-2h),7.04(d,j=8.0hz,2h,ar-2h),6.88-6.69(m,3h)[“6.85(t,j1=4.0hz,j2=4.0hz,2h,ar-2h),6.71(d,j=8.0hz,1h,ar-1h)”],3.84(s,3h,och3-3h),3.72(d,j=4.0hz,6h,2och3-6h),3.51(d,j=4.0hz,2h,ch2-2h),2.72(t,j1=4.0hz,j2=4.0hz,2h,ch2-2h);元素分析计算值[c20h21n3o4s]:c,60.13;h,5.30;n,10.52;实测值:c,60.47;h,5.25;n,10.39。
实施例12
在多口反应瓶中,把4-(4-甲氧基苯基)-5-氯丙酮基-1,2-3-噻二唑28g和3,4-二甲氧基苯胺15g和三乙胺10g加入二氯甲烷300ml中,在室温条件下搅拌30min,加热至70℃搅拌反应50min,然后向过滤反应液,分出有机相,水相用二氯甲烷30ml萃取多次,合并有机相,再经无水硫酸镁干燥后浓缩后加入二氯甲烷200ml和1,4-二氧六环200ml的混合溶液中,搅拌均匀后再加入高氯酸镁2.5g和碳酸铜2.5g,反应温度升至80℃,反应3h后冷却至室温,向反应液中加入水50ml,然后过滤反应液,在真空条件下蒸除溶剂二氯甲烷和1,4-二氧六环,再用二氯甲烷萃取反应液多次,合并有机相,经无水硫酸镁干燥后浓缩得到目标化合物35.2g;1hnmr(400mhz,dmso-d6):9.03(s,1h,nh-1h),7.74(d,j=8.0hz,2h,ar-2h),7.04(d,j=8.0hz,2h,ar-2h),6.88-6.69(m,3h)[“6.85(t,j1=4.0hz,j2=4.0hz,2h,ar-2h),6.71(d,j=8.0hz,1h,ar-1h)”],3.84(s,3h,och3-3h),3.72(d,j=4.0hz,6h,2och3-6h),3.51(d,j=4.0hz,2h,ch2-2h),2.72(t,j1=4.0hz,j2=4.0hz,2h,ch2-2h);元素分析计算值[c20h21n3o4s]:c,60.13;h,5.30;n,10.52;实测值:c,60.47;h,5.25;n,10.39。
实施例13
在多口反应瓶中,把4-(4-甲氧基苯基)-5-氯丙酮基-1,2-3-噻二唑28g和3,4-二甲氧基苯胺15g和三乙胺10g加入二氯甲烷300ml中,在室温条件下搅拌30min,加热至70℃搅拌反应50min,然后向过滤反应液,分出有机相,水相用二氯甲烷30ml萃取多次,合并有机相,再经无水硫酸镁干燥后浓缩后加入二氯甲烷200ml和1,4-二氧六环200ml的混合溶液中,搅拌均匀后再加入六水合高氯酸锌3.7g和碳酸铜2.5g,反应温度升至80℃,反应3h后冷却至室温,向反应液中加入水50ml,然后过滤反应液,在真空条件下蒸除溶剂二氯甲烷和1,4-二氧六环,再用二氯甲烷萃取反应液多次,合并有机相,经无水硫酸镁干燥后浓缩得到32.8g;1hnmr(400mhz,dmso-d6):9.03(s,1h,nh-1h),7.74(d,j=8.0hz,2h,ar-2h),7.04(d,j=8.0hz,2h,ar-2h),6.88-6.69(m,3h)[“6.85(t,j1=4.0hz,j2=4.0hz,2h,ar-2h),6.71(d,j=8.0hz,1h,ar-1h)”],3.84(s,3h,och3-3h),3.72(d,j=4.0hz,6h,2och3-6h),3.51(d,j=4.0hz,2h,ch2-2h),2.72(t,j1=4.0hz,j2=4.0hz,2h,ch2-2h);元素分析计算值[c20h21n3o4s]:c,60.13;h,5.30;n,10.52;实测值:c,60.47;h,5.25;n,10.39。
实施例14
从co2培养箱中取出肝癌smmc7721细胞培养瓶,分别进行如下操作:旋开瓶盖,倒出培养液于废液缸中,在酒精灯旁进行无菌操作,用2ml的pbs洗培养瓶中的培养液两次,用0.25%的胰蛋白酶进行消化,待观察发现出现细胞间隙增大、细胞变成小圆圈形状时终止消化,使用移液枪吹打培养瓶底部使细胞脱落,将所得的细胞悬浮液转移至无菌离心管中,设置离心机为800r/min,3min,进行离心,然后缓慢倾倒离心管中的上清液,加入2~5ml的培养液,于倒置显微镜下进行细胞计数。根据计数结果,用相应的培养液将其配制成5×104cells/ml的单细胞悬液,然后接种于96孔板中,且每孔100μl。将96孔板放入37℃,5%co2培养箱中培养24h。
将目标化合物配制至所需浓度:0.16μmol/l,0.8μmol/l,4.0μmol/l,20.0μmol/l,100μmol/l。从co2培养箱中取出96孔板,每孔加入100μl的含药培养基,每种浓度的药物同时设3个复孔。作为空白实验的孔,加入等体积的相应培养液。将其置于37℃、5%co2培养箱中培养72h。该实验用多西他赛作为阳性对照,每一种药物都用同一批次不同代数的细胞进行三次实验。72小时后,在避光条件下,每孔加入5mg/ml的mtt溶液20μl,继续放入co2培养箱中培养4h,用移液枪吸取上清液,每孔加入150μldmso,放置摇床5min使其混合均匀,用酶标仪在562nm波长处测定其吸光度od值,其细胞增殖抑制率计算方法如下:细胞增殖抑制率=[od对照-od实验]/od对照×100%;经检测目标化合物对肝癌smmc7721的抑制率ic50分别达到4.73μmol/l,具有一定的抑制效果。
实施例15
将目标化合物配制至所需浓度:0.16μmol/l,0.8μmol/l,4.0μmol/l,20.0μmol/l,100μmol/l。在室温条件下与特定浓度的野生型egfr激酶溶液共同孵育5分钟,之后加入适量的酶反应底物、atp以及启动酶反应过程,30分钟后,向酶反应体系中加入适量的反应终止液和检测液,孵育1个小时后,在多孔板酶标显色仪上,测定特定化合物不同浓度下的酶活力,并计算不同浓度的化合物对酶活力的抑制活性,之后根据四参数方程,对不同浓度化合物下酶活力的抑制活性进行拟合,计算出目标化合物对野生型egfr激酶的ic50值为1.92μmol.
以上实施例描述了本发明的基本原理、主要特征及优点,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入本发明保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!