二氢吡啶类降压药物原料药微粉化的新方法与流程
本申请涉及生物药物制剂技术领域,具体而言,涉及一种二氢吡啶类降压药物原料药微粉化的新方法。
背景技术:
非洛地平(felodipine)是当前应用最广的二氢吡啶类降压药物之一,临床上最为常用的是其口服缓、控释制剂。非洛地平的生物药剂学分类为bcsii类,属于低溶解高渗透药物,而提高该难溶药物在制剂中的溶解性以保障体内的药物吸收,是非洛地平缓控释制剂必须解决的问题。在诸多的难溶药物增溶解决方案中,药物微粉化是最常用且便捷、有效的手段。
现有技术中,最常见的是利用气流粉碎法对药物原料药进行微粉化处理,但是气流粉碎法粉碎后的粒径偏大,常需要作两次乃至多次粉碎后才能符合所需粒径要求,但难以达到10um以下的微粒粒径。而且收率较低,过程能耗也大。
技术实现要素:
本发明目的在于提供一种二氢吡啶类降压药物原料药微粉化新方法,其能够得到粒度更细的二氢吡啶类降压药物粉体,且收率较高,因而能够进一步提高二氢吡啶类降压药物缓释制剂的体内生物利用度。
第一方面,本申请实施例提供了一种二氢吡啶类降压药物原料药微粉化的新方法,包括:将二氢吡啶类降压药物原料药溶解于第一溶剂,将溶解有二氢吡啶类降压药物原料药的第一溶剂加入到第二溶剂中进行反溶剂重结晶;第一溶剂包括低级脂肪醇或脂肪族酮类;第二溶剂包括水、含有电解质的水溶液或含有阴离子表面活性剂的水溶液。
在上述实现过程中,将二氢吡啶类降压药物先溶解于第一溶剂,然后以第二溶剂作为反溶剂,因为二氢吡啶类降压药物在第二溶剂中不溶或几乎不溶,由于去溶剂化作用能形成很高的过饱和度,使得二氢吡啶类降压药物能在瞬间析出,并使得析出的二氢吡啶类降压药物粉体粒径显著变小,进而达到二氢吡啶类降压药物微粉化的目的。实验证明,本申请的二氢吡啶类降压药物微粉化后,较气流粉碎处理后的二氢吡啶类降压药物粒度更细,分布范围更窄,且收率明显提高。其中,第一溶剂包括能与水混溶的低级脂肪醇或脂肪族酮类有机溶剂,而二氢吡啶类降压药物易溶于这类极性溶剂中。并且,水、含有电解质的水溶液或含有阴离子表面活性剂的水溶液均能够与这两类溶剂互溶,以使得溶解有二氢吡啶类降压药物的第一溶剂与第二溶剂混合后时,能够实现反溶剂重结晶。而且只需一次微粉化过程,故产品损失少,收率高。在此过程中,无须经历高温过程,不会导致微粉化后产品中易氧化物含量升高。
在一种可能的实施方案中,低级脂肪醇包括乙醇、甲醇和异丙醇中的至少一种;或者,脂肪族酮类化合物包括丙酮。
在上述实现过程中,二氢吡啶类降压药物易溶于乙醇、甲醇、异丙醇和丙酮中。
在一种可能的实施方案中,电解质为药学上可接受的无机盐;可选地,电解质包括氯化钠和硫酸钠中的至少一种;可选地,含有电解质的水溶液中的电解质的质量百分浓度为0.1~1%;可选地,含有电解质的水溶液中的电解质的质量百分浓度为0.2~0.6%。
在上述实现过程中,由于二氢吡啶类降压药物一般是用于药物制剂的,电解质的选择应是药学上可接受的无机盐,使得二氢吡啶类降压药物微粉化后的产物能够用于生产该药物制剂。其中,氯化钠和硫酸钠均是药学上可接受的物质,而且含有上述电解质的水溶液与乙醇、甲醇、异丙醇和丙酮均能够互溶。既可以达到与纯水溶剂相同的微粉化技术效果,又要确保微粉化药物原料药中炽灼残渣含量不超标,且含有电解质的水溶液可以提高微粉化收率。
在一种可能的实施方案中,表面活性剂为药学上可接受的阴离子表面活性剂,阴离子表面活性剂可选地为十二烷基硫酸钠。
在上述实现过程中,由于二氢吡啶类降压药物一般是用于药物制剂的,表面活性剂选择药学上可接受的物质,使得二氢吡啶类降压药物微粉化后的产物能够用于生产药物。其中,十二烷基硫酸钠为药学上可接受的物质,而且,含有十二烷基硫酸钠的水溶液与乙醇、甲醇、异丙醇和丙酮均能够互溶。
在一种可能的实施方案中,含有表面活性剂的水溶液中的表面活性剂的质量百分浓度为0.05~0.5%;可选地,含有表面活性剂的水溶液中的表面活性剂的质量百分浓度为0.08~0.3%。
在上述实现过程中,当溶液中表面活性剂的浓度合适时,微粉化后既可以获得所希望的微粉粒径,还可以适度提高微粉化收率。
在一种可能的实施方案中,二氢吡啶类降压药物原料药与第一溶剂的重量体积比为1:(1.5~5.5)g/ml;可选地,二氢吡啶类降压药物原料药与第一溶剂的重量体积比为1:(2~4)g/ml;
和/或,将二氢吡啶类降压药物原料药在温度大于等于25℃且小于第一溶剂的沸点温度的条件下溶解于第一溶剂。
在上述实现过程中,上述重量体积比的二氢吡啶类降压药物原料药与第一溶剂,既能保证二氢吡啶类降压药物原料药在第一溶剂中充分地溶解,又不至于因第一溶剂用量过多而使第二溶剂用量增加更多。示例性地,当二氢吡啶类降压药物原料药与第一溶剂的重量体积比大于1:5.5g/ml时,必然会明显增加第二溶剂的用量,无疑会降低生产产能。当二氢吡啶类降压药物原料药与第一溶剂的重量体积比小于1:1.5g/ml时,不利于生产操作。
另外,在溶解温度大于等于25℃且小于第一溶剂的沸点温度的条件下,二氢吡啶类降压药物能够更好地充分溶解于第一溶剂中。
在一种可能的实施方案中,反溶剂重结晶的温度为-5~5℃。
在反溶剂重结晶过程中,设置-5~5℃的温度条件,有利于获得粒径较小的二氢吡啶类降压药物微粉粉体。当温度大于5℃时,难以获得粒径合适的二氢吡啶类降压药物微粉粒径。当温度小于-5℃时,不仅对降低微粒粒径的幅度有限,还会额外地增加能耗。
在一种可能的实施方案中,第一溶剂和第二溶剂的体积比为1:(15~55);可选地,第一溶剂和第二溶剂的体积比为1:(20~40)。
在上述实现过程中,上述体积比的第一溶剂和第二溶剂,既可以保证微粉化粒径符合指标要求,又不至于明显制约未来生产上的设备产能。在第一溶剂和第二溶剂的体积比为1:(15~55)的范围内,当第一溶剂和第二溶剂的体积比大于1:40时,二氢吡啶类降压药物微粉化后的粒径在预设的粒径范围内呈减小的趋势;当第一溶剂和第二溶剂的体积比小于1:20,二氢吡啶类降压药物微粉化后的粒径在预设的范围内呈增大的趋势。
在一种可能的实施方案中,将溶解有二氢吡啶类降压药物原料药的第一溶剂加入到第二溶剂中的方式包括:采用滴加法将溶解有二氢吡啶类降压药物原料药的第一溶剂滴加到第二溶剂中;或采用喷雾法将溶解有二氢吡啶类降压药物原料药的第一溶剂喷雾到第二溶剂中。
在上述实现过程中,基于对目标产品不同的粉体粒度的不同要求,可以在上述第一溶剂和第二溶剂的配比、搅拌速度和结晶温度的基础上,可选择地采用滴加法或喷雾法作反溶剂重结晶,可以达到预期目的。经试验验证,喷雾法可获得比滴加法更小的微粉粒径。
在一种可能的实施方案中,滴加法的滴加速度为0.5-6.0ml/min;可选地,滴加法的滴加速度为1.5-4.0ml/min;
或者,喷雾法的喷雾速度为0.5-3.5ml/min,喷雾压力为20~50kpa;可选地,喷雾法的喷雾速度为2.0-2.5ml/min;可选地,喷雾法的喷雾压力为25~45kpa。
在上述实现过程中,上述滴加速度能够使溶解有二氢吡啶类降压药物的第一溶剂在瞬息间被第二溶剂所充分分散,并迅速自混合溶剂中析出所希望得到的微尺度粉体。另外,在0.5-6.0ml/min的滴加速度范围内,滴加速度大于4.0ml/min,得到的二氢吡啶类降压药物粒径增大,当滴加速度小于1.5ml/min时,虽然微粉粒径会继续降低,但降低幅度有限,相反,还会影响收率和生产效率。
同理,当喷雾速度大于3.5ml/min时,微粉化的二氢吡啶类降压药物粒径呈增大的趋势,当喷雾速度小于0.5ml/min时,虽有利于降低粒径,但降低幅度有限,且会降低收率和生产效率。当喷雾压力大于50kpa时,虽然微粉粒径降低明显,但收率呈降低的趋势,当喷雾压力小于20kpa时,会使微粉粒径增大,但收率上升幅度有限。
在一种可能的实施方案中,在将溶解有二氢吡啶类降压药物原料药的第一溶剂加入到第二溶剂的过程中始终处于搅拌状态下,搅拌速率为500-1200r/min;可选地,搅拌速率为600-1000r/min。
在上述实现过程中,合适的喷雾压力和搅拌速率能够保证含有二氢吡啶类降压药物原料药的第一溶剂在第二溶剂中能够在瞬息间充分分散。需要说明的是,在第一溶剂加入到第二溶剂的全过程中都伴随搅拌,当搅拌速率大于1200r/min时,降低粒径的作用降低,反而会降低微粉化收率,并不必要地增加动力消耗,当搅拌速率小于500r/min时,二氢吡啶类降压药物微粉化后的粒径呈增大的趋势。
在一种可能的实施方案中,二氢吡啶类降压药物选自非洛地平、硝苯地平、西尼地平、尼群地平、尼莫地平以及苯磺酸氨氯地平中的任一种。
在上述实现过程中,非洛地平、硝苯地平、西尼地平、尼群地平、尼莫地平以及苯磺酸氨氯地平均适用于上述的原料药微粉化的新方法。
附图说明
为了更清楚地说明本申请实施例的技术方案,下面将对本申请实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅显示出了本申请的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
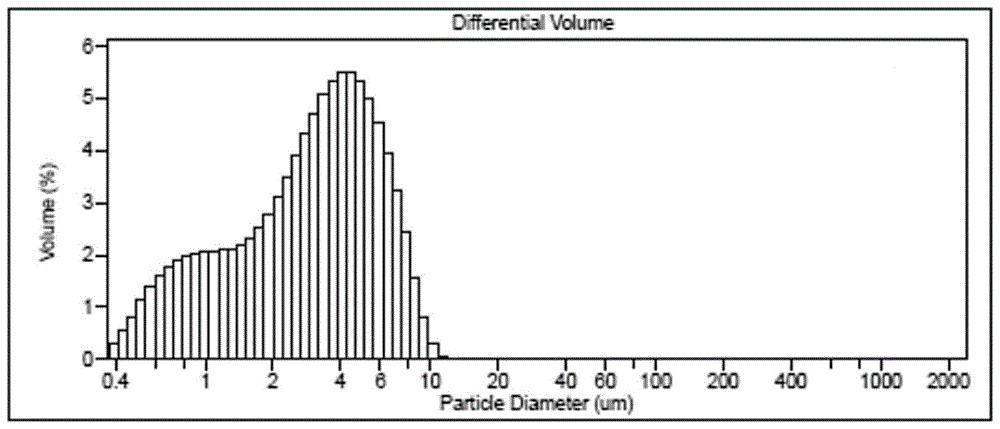
图1为本申请实施例1提供的非洛地平微粉化后的粒径检测谱图;
图2为本申请实施例3提供的非洛地平微粉化后的粒径检测谱图;
图3为本申请实施例25提供的非洛地平微粉化后的粒径检测谱图;
图4为本申请实施例26提供的非洛地平微粉化后的粒径检测谱图;
图5为本申请对比例1提供的非洛地平微气流粉碎后的粒径检测谱图;
图6为本申请对比例2提供的非洛地平微气流粉碎后的粒径检测谱图。
具体实施方式
为使本申请实施例的目的、技术方案和优点更加清楚,下面将对本申请实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
需要说明的是,本申请中的“和/或”,如“方案a和/或方案b”,均是指可以单独地为方案a、单独地为方案b、方案a加方案b,该三种方式。
下面将对本申请实施方式中的二氢吡啶类降压药物原料药微粉化的新方法进行描述。
本申请实施方式提供一种二氢吡啶类降压药物原料药微粉化的新方法,包括:
s1:将二氢吡啶类降压药物原料药溶解于第一溶剂中,第一溶剂包括低级脂肪醇或脂肪族酮类化合物。
示例性地,二氢吡啶类降压药物选自非洛地平、硝苯地平、西尼地平、尼群地平、尼莫地平以及苯磺酸氨氯地平中的任一种。
在一些可能的实施方案中,低级脂肪醇包括乙醇、甲醇和异丙醇中的至少一种。也即是说,当第一溶剂选择低级脂肪醇时,第一溶剂可以是甲醇、乙醇、异丙醇中的任一种,也可以是三者中的两者的混合物,或者是三者的混合物。其中,乙醇可选地为药用乙醇。
在一种可能的实施方案中,脂肪族酮类化合物包括丙酮。也即是说,当第一溶剂选择脂肪族酮类化合物时,第一溶剂可以选择丙酮。可以理解的是或脂肪族酮类化合物除了丙酮,也可以是能与水混溶的、且药学上可接受的其他其他低级脂族酮溶剂。
在一种可能的实施方案中,二氢吡啶类降压药物与第一溶剂的重量体积比为1:1.5~5.5g/ml,或1:2~4g/ml。例如但不限于1:1.5g/ml、1:2g/ml、1:2.5g/ml、1:3g/ml、1:4g/ml、1:5g/ml中的任一点值或任意两者间的范围值。
在一些可能的实施方案中,将二氢吡啶类降压药物原料药在温度大于等于25℃且小于第一溶剂的沸点温度的条件下溶解于第一溶剂。
需要说明的是,二氢吡啶类降压药物的溶解温度范围设置为25℃~第一溶剂的沸点温度,溶剂溶解温度的选择区间根据所选择的第一溶剂的种类以及溶质与溶剂的配比率不同而不同。
s2:将溶解有二氢吡啶类降压药物原料药的第一溶剂加入到第二溶剂中,使之实现二氢吡啶类降压药物反溶剂重结晶,第二溶剂包括水或含有电解质或表面活性剂的水溶液。
当第二溶剂选择水或含有电解质或表面活性剂的水溶液时,也即是说,第二溶剂可以是纯碎的水、含有电解质的水溶液或含有表面活性剂的水溶液。示例性地,水可以选择纯化水。需要说明的是:1)非洛地平及其他二氢吡啶类降压药物原料药在第二溶剂中不溶或几乎不溶或仅微溶;2)低级脂肪醇或低级脂肪酮类必须与水或含有电解质或表面活性剂水溶液的第二溶剂能够任意比例地互溶。
示例性地,在一种可能的实施方案中,反溶剂重结晶的温度为-5~5℃。当第二溶剂为含有电解质或表面活性剂的水溶液时,水的冰点会降至零摄氏度以下,从而在-5~5℃温度范围内能够较好地实现二氢吡啶类降压药物及其他种二氢吡啶类降压药物原料药的反溶剂重结晶。
在一种可能的实施方案中,电解质为药学上可接受的无机盐。可选地,电解质包括氯化钠和硫酸钠中的任意一种。示例性地,电解质可以是氯化钠或硫酸钠。
示例性地,含有电解质的水溶液中的电解质的质量百分浓度为0.1~1%,或0.2~0.6%,例如但不限于0.1%、0.2%、0.4%、0.5%、0.6%、0.8%、1%中的任一点值或任意两者间的范围值。
在一种可能的实施方案中,表面活性剂为药学上可接受的阴离子表面活性剂。
可选地,表面活性剂为十二烷基硫酸钠。示例性地,含有表面活性剂的水溶液中的表面活性剂的质量百分浓度为0.05~0.5%,或0.08~0.3%。例如但不限于0.05%、0.08%、0.1%、0.15%、0.2%、0.25%、0.3%、0.4%、0.5%中的任一点值或任意两者间的范围值。
在一种可能的实施方案中,第一溶剂和第二溶剂的体积比为1:15~55,或1:20~40,例如但不限于1:15、1:18、1:20、1:25、1:30、1:35、1:40、1:45、1:50中的任一点值或任意两者间的范围值。
在一种可能的实施方案中,将溶解有二氢吡啶类降压药物原料药的第一溶剂加入到第二溶剂中的方式是采用滴加法将溶解有二氢吡啶类降压药物的第一溶剂滴加到第二溶剂,或者采用喷雾法将溶解有二氢吡啶类降压药物的第一溶剂喷雾到第二溶剂。
当采用滴加法时,示例性地,滴加法的滴加速度为0.5-6.0ml/min,或1.5-4.0ml/min,例如但不限于0.5ml/min、1ml/min、1.5ml/min、2ml/min、3ml/min、4ml/min、5ml/min、6ml/min中的任一点值或任意两者间的范围值。
当采用喷雾法时,示例性地,喷雾法的喷雾速度为0.5-3.5ml/min,或1.0-3.0ml/min,例如但不限于0.5ml/min、1ml/min、1.5ml/min、2ml/min、3ml/min、3.5ml/min中的任一点值或任意两者间的范围值。
示例性地,喷雾法的喷雾压力为20~50kpa,或25~45kpa,例如但不限于20kpa、25kpa、30kpa、40kpa、45kpa中的任一点值或任意两者间的范围值。
在一种可能的实施方案中,在将溶解有二氢吡啶类降压药物原料药的第一溶剂加入到第二溶剂的过程中始终于搅拌状态下,搅拌速率为500-1200r/min,或600-1000r/min。例如但不限于500r/min、600r/min、800r/min、1000r/min、1200r/min中的任一点值或任意两者间的范围值。可选地,搅拌时间为1~15min,或5~10min,例如但不限于1min、2min、4min、5min、8min、10min、12min、15min中的任一点值或任意两者间的范围值。
在一种可能的实施方案中,在二氢吡啶类降压药物反溶剂重结晶的滴加或喷雾操作结束后,将重结晶物料静止陈化。示例性地,静止陈化的时间为10~60min,或15~45min,例如但不限于10min、15min、20min、25min、30min、40min、45min、50min、60min中的任一点值或任意两者间的范围值。
在一种可能的实施方案中,静止陈化后,对陈化后的物料进行过滤得到滤饼。可选地,过滤可采用真空过滤或离心过滤。可选地,经过滤得到的滤饼经水反复洗涤至残留溶剂和无机盐达标为止。其中,残留物可能是无机盐和/或其第一溶剂残留。
洗涤后,对滤饼进行干燥。示例性地,干燥方式可选择真空干燥,真空度范围为600-760mmhg。干燥温度可选为45~65℃或50~60℃,例如但不限于45℃、50℃、55℃、60℃中的任一点值或任意两者间的范围值。
以下结合实施例对本申请的特征和性能作进一步的详细描述。
实施例1
取符合《中国药典》2015版质量标准的非洛地平原料药粉(d90为76μm)10.0g,置于配置有冷凝器的50ml圆底烧瓶中,加入浓度为95%的乙醇(第一溶剂)30.0ml,然后在电磁搅拌下于60℃水浴上解热至全溶后继续保温搅拌5min,然后撤除热水浴,将溶解液自然放冷至室温后备用。
将配置好的溶解有非洛地平原料药粉的乙醇(第一溶剂)溶液倒入预热的滴液漏斗中备用。
将配置有电动搅拌器、温度计的1500ml的反应瓶置于冰盐水锅中,然后向该圆底烧瓶中加入900ml纯化水(第二溶剂),加毕,开启电动搅拌使降温。
当圆底瓶内水温降至3.5℃时,将搅拌转速调至650r/min,并以3.5ml/min的滴加速度将上述浓度和体积的非洛地平的乙醇溶液均匀地滴加到预冷至3.5℃的第二溶剂中。在滴加过程中搅拌速度、滴加速度和水温维持不变,直至滴尽。
滴加完毕,于上述搅拌转速和温度条件下继续搅拌5min,然后自冰水浴中取出反应瓶,室温环境下静止陈化30min。
陈化结束后,将反溶剂重结晶物料倒入干净的布氏漏斗中作真空过滤。滤尽母液后将滤饼全部转入干净的50ml烧杯中,用25ml纯化水搅洗后再过滤,如此重复操作2次,得到非洛地平微粉化湿滤饼。将过滤所得的非洛地平微粉滤饼置于洁净的不锈钢真空干燥箱中,于真空度≥650mmhg,内温≤60℃条件下减压干燥至干,得到干燥的非洛地平微粉,净重9.63g。
实施例2~实施例22
实施例2~22的主要工艺参数记载在表1中,其他未记载在表1中的参数请参见实施例1的内容。其中,实施例2~20的第二溶剂均为水,实施例21的第二溶剂为浓度为1.0%的氯化钠水溶液,实施例22的第二溶剂为浓度0.4%的十二烷基硫酸钠水溶液。
实施例23
取符合《中国药典》2015版质量标准规定的非洛地平原料药粉(d90为76μm)10g,置于圆底烧瓶中,再加入配置好的乙醇(第一溶剂)30ml,并在60℃水浴上加热至全溶后继续保温搅拌5min,然后撤除热水浴,将溶解液自然放冷至室温后备用。
将配置好的溶解有非洛地平原料药粉的乙醇溶液倒入事先预热的喷枪中备用。
将配置有电动搅拌器和温度计的1500ml的圆底烧瓶置于冰盐浴锅中,然后向该圆底烧瓶中加入900ml纯化水(第二溶剂),加毕,开启电动搅拌使降温。
当圆底烧瓶内水温降至约1℃时,将搅拌转速调至650r/min,然后将喷枪压力调节到在35kpa,并以35kpa喷雾压力、1.5ml/min的喷雾速度将上述浓度和体积的非洛地平的乙醇溶液均匀地喷雾到预冷至1℃、并始终处于搅拌状态下的第二溶剂中。在喷雾过程中,喷雾压力、速度、搅拌速度和水温维持不变,直至全部料液喷雾至尽。
喷雾完毕,在上述各参数不变条件下继续搅拌5min,然后自冰水浴中取出圆底烧瓶,室温环境下静止陈化30min。
陈化结束后将反溶剂重结晶物料倒入干净的布氏漏斗中作真空过滤。滤尽母液后将滤饼全部转入干净的50ml烧杯中,用25ml纯化水搅洗后再过滤,如此重复操作2次,得到非洛地平微粉化湿滤饼。将过滤所得的非洛地平微粉滤饼置于洁净的不锈钢真空干燥箱中,于真空度≥650mmhg,内温≤60℃条件下减压干燥至干,得到干燥的非洛地平微粉9.60g。
实施例24~实施例38
实施例24~38的主要工艺参数记载在表2中,其他未记载在表2中的参数请参见实施例23的内容。其中,实施例24~34的第二溶剂均为水,实施例35~36的第二溶剂为浓度为0.5%的氯化钠水溶液,实施例37~38的第二溶剂为浓度0.2%的十二烷基硫酸钠水溶液。
实施例39~实施例42
实施例39~42的原料药粉为硝苯地平,其微粉化过程与实施例1的非洛地平微粉化过程共有的固定技术条件不变,实施例39~42的一部分工艺参数记载在表3中,其他未记载在表3中的参数请参见实施例1的内容。其中,实施例39~40的第二溶剂均为水,实施例41的第二溶剂为浓度为0.5%的氯化钠水溶液,实施例42的第二溶剂为浓度0.2%的十二烷基硫酸钠水溶液。
实施例43~实施例44
实施例43~44的原料药粉为尼西地平,其微粉化过程与实施例1的非洛地平微粉化过程共有的固定技术条件不变,实施例43~44的主要工艺参数记载在表3中,其他未记载在表3中的参数请参见实施例1的内容。其中,实施例43~44的第二溶剂均为水。
实施例45
实施例45的原料药粉为尼群地平,其微粉化过程与实施例1的非洛地平微粉化过程共有的固定技术条件不变,实施例45的主要工艺参数记载在表3中,其他未记载在表3中的参数请参见实施例1的内容。其中,实施例45的第二溶剂均为水。
实施例46
实施例46的原料药粉为尼莫地平,其微粉化过程与实施例1的非洛地平微粉化过程共有的固定技术条件不变,实施例46的主要工艺参数记载在表3中,其他未记载在表3中的参数请参见实施例1的内容。其中,实施例46的第二溶剂均为水。
实施例47
实施例47的原料药粉为苯磺酸氨氯地平,其微粉化过程与实施例1的非洛地平微粉化过程共有的固定技术条件不变,实施例47的主要工艺参数记载在表3中,其他未记载在表3中的参数请参见实施例1的内容。其中,实施例47的第二溶剂均为水。
实施例48~实施例51
实施例48~51的原料药粉为硝苯地平,其微粉化过程与实施例23的非洛地平微粉化过程共有的固定技术条件不变,实施例48~51的主要工艺参数记载在表4中,其他未记载在表4中的参数请参见实施例23的内容。其中,实施例48~49的第二溶剂均为水。实施例50的第二溶剂为浓度为0.5%的氯化钠水溶液,实施例51的第二溶剂为浓度0.2%的十二烷基硫酸钠水溶液。
实施例52~实施例53
实施例52~53的原料药粉为尼西地平,其微粉化过程与实施例23的非洛地平微粉化过程共有的固定技术条件不变,实施例52~53的主要工艺参数记载在表4中,其他未记载在表4中的参数请参见实施例23的内容。其中,实施例52~53的第二溶剂均为水。
实施例54
实施例54的原料药粉为尼群地平,其微粉化过程与实施例23的非洛地平微粉化过程共有的固定技术条件不变,实施例54的主要工艺参数记载在表4中,其他未记载在表4中的参数请参见实施例23的内容。其中,实施例54的第二溶剂均为水。
实施例55
实施例55的原料药粉为尼莫地平,其微粉化过程与实施例23的非洛地平微粉化过程共有的固定技术条件不变,实施例55的主要工艺参数记载在表4中,其他未记载在表4中的参数请参见实施例23的内容。其中,实施例55的第二溶剂均为水。
实施例56
实施例56的原料药粉为苯磺酸氨氯地平,其微粉化过程与实施例23的非洛地平微粉化过程共有的固定技术条件不变,实施例56的主要工艺参数记载在表4中,其他未记载在表4中的参数请参见实施例23的内容。其中,实施例56的第二溶剂均为水。
对比例1
取符合《中国药典》2015版质量标准规定的非洛地平原料药粉(d90为76μm)10g在加料压力为0.45mpa、粉碎压力为0.7mpa以及粉碎速度为1g/min的条件下对非洛地平原料药粉进行粉碎两次得到非洛地平粉末。
对比例2
取符合《中国药典》2015版质量标准规定的非洛地平原料药粉(d90为76μm)20g在加料压力为0.50mpa、粉碎压力为0.8mpa以及粉碎速度为1.2g/min的条件下对非洛地平原料药粉进行粉碎两次得到非洛地平粉末。
试验例1
供试样的粒径检测:准确称取0.5g各实施例的微粉化后的非洛地平和其他种二氢吡啶类降压药物的原料药微粉化样品,加入到0.5g颗粒分散剂溶液中,摇匀,再加入50ml纯化水,搅拌并超声处理30秒,即得供试样溶液。在型号为ls13320激光粒度分析仪上对供试样溶液作粒径检测,其检测结果分别记录在表1-表4中。其中,实施例1、3、25、26以及对比例1~2的检测图谱请参见图1~图6。需要说明的是,实施例1~38的非洛地平原料药的微粉化前的平均粒径(d90)均为76.0um。实施例39~56中的硝苯地平、西尼地平、尼群地平、尼莫地平以及苯磺酸氨氯地平的原料药在微粉化前的平均粒径(d90)分别为67.0、70.0、78.0、69.0和74.0um。
表1.滴加方式下的实施例1~22的非洛地平微粉化过程的部分工艺参数
表2.喷雾方式下的实施例23~38的非洛地平微粉化过程的部分工艺参数
从表1和表2记载的结果可以得知,通过本申请实施例1~38的非洛地平原料药微粉化的方法制得的非洛地平粉末90%的粒径在3~8μm范围。而且,在本申请的喷雾法反溶剂重结晶条件下,可以获得平均粒径(d90)小于3.5mu的非洛地平微粉。同时,从图1-图4中的结果可以看出,本申请实施例的非洛地平原料药微粉化的方法制得的非洛地平粉末分布范围狭窄。
表3.滴加方式下实施例39~47的原料药微粉化过程的部分工艺参数
表4.喷雾方式下实施例48~56的原料药微粉化过程的部分工艺参数
试验例2
将对比例1和对比例2粉碎后得到的非洛地平粉末送样作微粉粒径测定。其测定结果记载在表5中。同时,对比例1和2的粒径检测谱图请参照图5和图6。
表5.对比例1与对比例2的非洛地平粉末的粒径测试结果
将表5与表1(滴加方式)的结果进行对比后发现,采用气流粉碎方法的对比例1和对比例2最后得到的非洛地平粉末的平均粒径均明显大于本申请实施例1~22微粉化后得到的非洛地平粉末的粒径。说明了本申请实施例的非洛地平粉末微粉化的方法较气流粉碎的效果更好。其中,实施例23-38的喷雾法所得平均粒径与现有气流粉碎法比较,则差距更大。
另外,非洛地平原料药利用本申请的原料药微粉化的方法的平均粉碎收率(≥96%)比现有气流粉碎法的平均粉碎收率提高15%以上。且利用气流粉碎法需要连续粉碎2~3次才能达到表5的对比例1和对比例2的粒径水平。
现有的气流粉碎法的设备清洁不易,不仅费时、耗能,且难以真正达到药品生产gmp规范标准。而本申请的二氢吡啶类降压药物原料药微粉化的新方法若用于生产,设备清洁容易。不仅省时,省力,动力成本更低。
以上所述仅为本发明的优选实施方式而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!