一种高纯种超微藻的分离和鉴定方法与流程
本发明属于环境科学、生态学领域的藻类分离培养技术领域,具体涉及一种快速分离纯种超微藻的方法。
背景技术:
超微藻群体庞大,生境广泛,普遍分布于各大海洋和湖泊生态系统中,其个体小、比表面积大的优势使其能高效的获取、利用资源进行生长繁殖,因而对湖泊初级生产力有重要的贡献,其全年平均贡献率随着湖泊营养盐水平的上升而下降,相关研究表面在抚仙湖、鄱阳湖和巢湖其贡献率分别达到65%,60%和23%。超微藻作为微食物环的一个初始的关键环节,可被一些异养鞭毛虫和纤毛虫摄食,进而成为大型浮游生物的间接食物,由此进入经典食物网,最终影响水产渔业的产量。研究表明超微藻对水体的碳代谢平衡也具有重要影响,在推动水生态系统的物质循环及能量流动中意义重大。也因超微藻个体微小,缺乏显著的形态学分类标准,光学显微镜甚至电子显微镜也很难进行种类鉴定,以至于超微藻纲鲜少有新物种被报道,大大降低了人们对超微藻的认知,从而忽略了这一组成繁多而又不容小觑的生物资源。因此若有一种能快速分离培养和鉴定超微藻的方法,能大大提高对超微藻的认知,从而了解超微藻在生态系统中的作用,为进一步探索我国自然资源奠定了基础。
技术实现要素:
发明目的:针对上述现有存在的问题和不足,本发明的目的是提供了一种高纯种超微藻的分离和鉴定方法,将流式细胞仪以及分子生物学技术集成协同运用,高效快速地分离培养出纯种超微藻,为湖泊、海洋等水体超微藻的分离培养提供了成套技术,大大提高人们对超微藻的认知,从而了解超微藻在生态系统中的作用,为进一步探索我国自然资源奠定了基础。
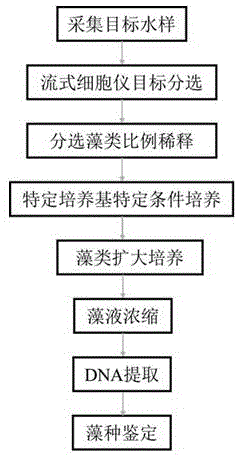
技术方案:为实现上述发明目的,本发明采用以下技术方案:一种高纯种超微藻的分离和鉴定方法,包括以下步骤:
(1)首先,在目标水体多次采集水样并进行混合,并用300目的筛绢进行预过滤;
(2)然后,选择激发波长分别为488nm和640nm的荧光作为叶绿素荧光,并在200-300个细胞/秒的进样流速下,通过流式细胞仪对水样的目标藻细胞数进行分选,分选过程中设置侧向散射光,以3.1μm的nile小球圈定3μm以内区域,收集适量目标超微藻细胞的藻样;
(3)接着,采用过滤后的湖水对分选得到的目标超微藻细胞的藻样进行稀释至1cell·100μl-1;
(4)经过稀释后的藻细胞稀释溶液与20%的gb11培养液混合分装于孔板中,置于培养箱进行培养;
(5)将步骤(4)中发生变色的藻细胞液取出,转移至含有bg11培养液的无菌瓶中进行扩大培养数日;扩大培养成功的藻液通过离心弃上清液后收集至ep收集管内;
(6)对步骤(5)收集的藻样提取dna,并通过分子生物学技术进行藻种鉴定。
进一步的,步骤(1)中水样是通过采集目标水体水面以下0.5m内的表层水、中层水和离湖底0.5m以内的湖底水的三层水混合而得。
进一步的,步骤(3)中用于稀释的湖水通过0.2μm聚碳酸脂滤膜进行过滤。
进一步的,步骤(4)的培养条件:每日光照周期为16小时光照与8小时黑暗,培养温度为25±1℃,且每3日补充一次过滤后的湖水至原体积。
进一步的,步骤(6)中的藻样通过dneasyblood&tissuekit试剂盒提取dna;
采用18srrna通用引物ns1(5’-gtagtcatatgcttgtctc-3’)和18l(5’-cacctacggaaaccttgttacgactt-3’)扩增目标藻样18s序列,再利用sanger法进行双向测序,对双向测序成功的样品进行正反列拼接,正向或反向测序成功的样品提取正向序列,进行分子鉴定;最后通过silva(silva_132_ssuref_tax_silva.fasta)数据库的本地blast比对,基于分子生物学手段判断目标藻样品的种水平分类学信息。
有益效果:与现有技术相比,本发明将流式细胞仪以及分子生物学技术集成协同运用,可以高效、快速地分离培养出纯种超微藻,为湖泊水体超微藻的分离培养提供了成套技术,从而为我国藻种库的扩种提供了一部分的理论技术支持。
附图说明
图1为本发明所述高纯种超微藻的分离和鉴定方法的流程示意图;
图2为本发明实施例中流式细胞仪检测到的超微藻类群的示意图;
图3为本发明实施例中超微藻dna电泳图。
具体实施方式
下面结合附图和具体实施例,进一步阐明本发明,应理解这些实施例仅用于说明本发明而不用于限制本发明的范围,在阅读了本发明之后,本领域技术人员对本发明的各种等价形式的修改均落于本申请所附权利要求所限定的范围。
本实施例基于鄱阳湖超微藻时空分布特征,选择目标藻种(真核绿藻麦可属)丰度高的点位采集混合水样。所述采集目标混合水样的方式为,使用机玻璃采水器采集表层(水面以下0.5m)、中层和底层(离湖底0.5m)目标水体的水样,将3层水样均匀混合后置于4℃保温箱暂时保存,立即送回实验室进行下一步处理。预先利用0.2μm的聚碳酸脂滤膜过滤湖水。
如图1-3所示,利用流式细胞仪对水样进行分选得到含有2000个真核藻细胞的藻样。具体过程:预先采用75%的乙醇冲洗流式细胞仪的管道,然后采用pbs冲洗半小时,并作为分选鞘液。流式细胞仪的工作台达到无菌状态,准备好接收所分选超微藻的无菌bg11培养基,根据目标超微藻具有的自发叶绿素荧光差异,选择荧光fl3和fl5通道(激发波长为488nm和640nm)叶绿素荧光;然后根据超微藻细胞大小一般在3μm以下,设定侧向散射光(fsc,依据bd公司3.1μm的nile小球,圈定3μm以内区域,将待处理的湖泊水体先用300目的筛绢预过滤,而后以低速率200-300个细胞/秒进样。根据所圈定的范围(图2),收集得到含有根据目标超微藻具有的自发叶绿素荧光差异,选择荧光fl3和fl5通道(激发波长为488nm和640nm)叶绿素荧光;根据超微藻细胞大小一般在3μm以下,设定侧向散射光(fsc,依据bd公司3.1μm的nile小球,圈定3μm以内区域,将待处理的湖泊水体先用300目的筛绢预过滤,而后以低速率200-300个细胞/秒进样。根据所圈定的范围(图2),收集适量目标超微藻细胞。采用过滤后的湖水将分选的真核藻细胞溶液稀释至1cell·100μl-1,利用无菌水配置20%bg11溶液,将100μl藻细胞稀释溶液和900μlbg11培养液转移到48孔培养基中培养。一共接种七板48孔培养基,共336孔。将48孔培养基置于光照培养箱进行培养,光照周期为16小时(光照):8小时(黑暗),培养温度为25℃。当多孔培养基颜色变化后,转移100μl藻液到含有100mlbg11培养液的锥形瓶中,在光照培养箱中扩大培养。共有85个孔颜色发生变化,49个孔的藻液扩大培养成功。藻液通过多次离心弃上清收集至1.5mlep管,使用dneasyblood&tissuekit试剂盒(qiagen)提取dna(图3)。然后利用18srrna通用引物ns1(5’-gtagtcatatgcttgtctc-3’)和18l(5’-cacctacggaaaccttgttacgactt-3’)扩增目标藻样18s序列。再利用sanger法进行双向测序,对双向测序成功的样品进行正反列拼接,正向或反向测序成功的样品提取正向序列,进行分子鉴定,通过最新版silva(silva_132_ssuref_tax_silva.fasta)数据库的本地blast比对,通过分子生物学手段判断目标藻样品的种水平分类学信息。其中,11个样品扩增失败,10个样品出现重复峰,最终成功鉴定28个藻样品。
如图3所示为本实施例超微藻样品dna电泳图,从左至右泳道依次为markerdl2000,样品1(mychonasteshomosphaera),样品2(无扩增条带),样品3(mychonasteshomosphaera),样品4空白,样品5(allovahlkampfiasp.strainso/1p),样品6(tetrastrumstaurogeniaeforme),样品7(desmodesmusintermedius)。
- 还没有人留言评论。精彩留言会获得点赞!